-
摘要: 能谱CT可产生不同X射线能量下的基材料图像,所产生的基材料图像可用于组织成分和造影剂分布的定性与定量评价,且对成像物质分离、鉴别的能力明显优于传统单能CT。能谱CT中双能谱技术是最常用的模式之一,在临床应用中发挥了重大作用。本文就双能谱CT图像域基材料分解的两物质分解、多物质分解方法进行总结,最后展望未来可能的发展方向。Abstract: Spectral CT can produce basis materials with different X-ray energies. Subsequently, the generated basis materials can be used for qualitative and quantitative evaluation of tissue components and contrast agent distribution. This approach presents a superior ability to separate and identify imaging materials compared to traditional single-energy CT. Dual-energy spectrum technology is one of the most commonly used modes in spectrum CT, which plays an important role in clinical application. In this study, the decomposition methods of a basis material in the image domain of dual-energy spectrum CT were classified into two categories: two-material decomposition and multi-material decomposition. Finally, these methods are summarized and trend of future development is addressed.
-
Keywords:
- spectral CT /
- dual-energy CT /
- image domain /
- basis material decomposition
-
食管癌(esophageal cancer,EC)是一种侵袭性较高的癌症,居于癌症相关死因的第6位[1]。目前EC患者的预后较差,5年生存率仅约为21%[2],因此对EC患者治疗方案的疗效评价和预后评估显得至关重要。目前,CT作为EC的常规检查手段,能够呈现肿瘤的位置、大小、体积以及与周围结构的关系等解剖学信息,在一定程度上反映了组织病理学特征以及预后信息[3]。然而,这些影像学结果通常受到影像科医师主观评价的影响,且传统的CT扫描无法显示出肿瘤微环境和肿瘤异质性等相关信息。
近年来,影像组学作为一种新兴的技术,不仅能够揭示同一类型肿瘤的个体差异,提供关于肿瘤微环境的额外信息,还能够反映肿瘤更丰富更全面的异质性信息[4],它不依赖于影像科医师的主观评价,有望用于提高各类型癌症的疗效和预后预测。影像组学通过对医学图像进行量化,形成与预测目标相关的高维数据,并通过算法进行模型构建,从而对研究目的进行定量预测或评估[5]。在预测EC患者的治疗反应和预后方面,影像组学具备很高的潜力。多项研究证实了基于CT的影像组学在预测EC患者的生存期、淋巴结转移、远处转移以及经不同治疗方案后患者预后等方面的应用价值[6-10]。影像组学可以动态监测患者的治疗反应,对患者的临床个性化治疗提供一定的指导作用。
本文综述CT影像组学在EC预后及疗效评价中的作用,旨在为临床实现更为精准的治疗提供新思路。
1. CT影像组学预测EC预后
EC患者的预后受多种因素影响,包括遗传易感因素、肿瘤TMN分期、病理类型及转移复发情况等。然而,这些因素往往是定性的,难以直观地评估患者的预后情况。
CT影像组学运用算法将EC患者的预后情况可视化,并对患者进行分层,根据患者的影像数据和临床信息,制定个体化治疗方案,从而提高治疗效果和患者的生存率。
1.1 预测生存期
目前,CT影像组学对EC患者生存期的预测主要涵盖了总生存期(overall survival,OS)、无进展生存期(progression free survival, PFS)和无病生存期(disease free survival,DFS)。莫笑开等[10]从肿瘤的最大层面勾画肿瘤感兴趣区(region of interest,ROI)提取影像组学特征,与病理N分期等临床风险因素结合构建了影像组学-临床综合模型用于预测根治术后食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者的DFS,表现出良好的识别能力(C指数:0.74),能有效辨识高风险肿瘤进展患者,为临床提供了一种可靠的精准诊疗的工具。
上述研究在ROI勾画上选择了肿瘤单层面,而Peng等[9]则分别勾画了单层面、三层面及全体积ROI提取影像组学特征,结果表明全体积ROI特征计算的影像组学评分(rad-score)是预测术后ESCC患者OS和PFS的独立预测因子。该研究将全体积rad-score和临床风险因素(TNM分期、淋巴血管侵犯、神经周围侵犯)结合构建了影像组学列线图,实现了模型的可视化和预测术后EC患者预后精度的计算。全体积ROI考虑了完整的三维空间数据,能够更全面地反映组织结构和特征,更好的预测预后。相比之下,单层面的ROI可能无法捕获整体的结构信息。
此外Cao等[6]整合了肿瘤和淋巴结的影像组学特征构建模型预测术后EC患者的OS,研究评估了淋巴结影像组学特征在OS预测中的附加价值。联合影像组学特征构建的模型显示出优于临床TNM(cTNM)分期模型的性能,并与病理TNM(pTNM)分期模型相媲美。研究最后将影像组学特征和性别、术前血清钠浓度、pTNM分期结合建立了综合列线图模型,预测患者OS的能力最优。该研究建立的列线图将肿瘤和淋巴结的影像组学特征结合起来,以填补EC患者分期系统中的空白,进而帮助临床医生更精准地做出治疗决策和预测患者的生存期。
以上几位的研究对象均为术后ES患者。与此不同,Cui等[7]的研究侧重于预测非手术治疗ESCC患者的PFS和OS,构建的列线图模型结合了临床变量和增强CT图像的影像特征。基于所得的C指数(PFS:0.81,OS:0.72)和曲线下面积(area under the curve,AUC)(PFS:0.85,OS:0.74),列线图模型展现出明显优势,相较于单一的影像组学模型或临床模型具有更优异的性能表现。
列线图模型是一种综合预测模型,能够结合临床因素和影像组学信息,并通过可视化方法将这些信息呈现出来。列线图将患者的临床数据和影像数据进行整合表示为一条条直线,直线的形态和位置反映了不同的信息以及它们与生存期之间的关系,从而实现对患者生存期的评估。这种可视化方法不仅能够提高临床医生对患者情况的认识和理解,还能够帮助医生更准确地评估患者的预后。
1.2 预测复发
复发是EC患者预后不良的主要原因之一,癌症患者一旦复发,预后通常都较差,因此建立肿瘤复发风险评估对于改善预后十分有益。有研究[11]使用CT影像组学预测ESCC患者的局部无复发生存期(recurrence free survival,RFS)对患者进行复发风险评估。该研究将影像组学特征、深度学习特征和临床因素相结合构建了列线图,其在训练集(C指数:0.82)、内部验证集(C指数:0.78)和外部验证集(C指数:0.76)均展现出优秀的预测性能,且研究引入深度学习进一步提高了模型的准确性和可靠性。
预测局部复发有助于医生对不同风险的患者进行精准医疗,对复发风险高的患者可以及早施行合适的治疗策略。Tang等[12]基于增强CT图像构建了3种不同治疗模式(新辅助治疗、放疗及手术)下预测ESCC患者2年内复发情况的模型,其联合预测模型(AUC:0.879)的表现优于单独影像组学模型(AUC:0.754)和临床模型(AUC:0.679);此外针对局部晚期ESCC患者同步放化疗后1年内复发的预后,同样发现联合模型(AUC:0.821)获得了最优的预测结果。
而Qiu等[13]研究侧重于预测新辅助治疗后获得病理完全应答(pathological complete response,pCR)状态的ESCC患者的RFS,建立的包含影像组学和临床特征的列线图在训练集(C指数:0.74)和验证集(C指数:0.72)获得了最佳性能。
这些研究显示CT影像组学可作为评估EC患者复发的有力工具,能够将患者复发风险划分为高、低危组,为预后分层提供有益信息,以期寻找更为有效的治疗方案。
1.3 预测远处转移
据报道,近一半接受治愈性治疗的EC患者在5年内会出现远处转移[14],转移性EC患者的5年生存率不足5%[15],远处转移往往预示着不良预后。
Zhu等[8]采用机器学习算法,将临床病理预测因素和CT影像组学有效地结合,通过监督学习建立了可靠且准确的预测模型,实现对EC远处转移的精准预测,旨在为EC的防治提供新视角。研究中分别采用支持向量机、K-近邻、随机森林和Logistic回归建立组学模型,评估影像组学预测EC远处转移的最大效率,并选择最佳算法拟合影像特征。研究结果表明Logistic回归模型(AUC:0.827)的判别能力优于其他算法模型,可作为预测EC远处转移的最佳模型。此模型有助于早期鉴别EC远处转移高危患者,进而进行有效干预,从而改善患者预后。CT影像组学可作为EC远处转移预测的重要工具。
目前有关基于CT影像组学特征构建模型预测EC远处转移的研究报道相对有限。因此,未来需要进一步探索CT影像组学在该领域的价值,完善和补充现有的研究成果,并为临床实践提供更加准确和有效的EC远处转移预测方法。
1.4 预测淋巴结转移
淋巴结转移对EC的预后影响巨大,转移淋巴结数量的增加意味着疾病的恶化[16-17]。准确预测术前的EC淋巴结转移对肿瘤分期、制定个体化治疗计划及预后评估等均具有重要的临床价值。
近年来影像组学的发展为无创预测患者淋巴结转移提供了契机。Shen等[18]结合基于CT图像的影像组学特征、CT报告可疑淋巴结数和肿瘤位置3个要素构建了术前预测EC淋巴结转移模型。研究发现综合预测模型(AUC:0.8)对EC淋巴结转移的预测较常规CT(AUC:0.6)更为可靠。Tan等[19]开发并验证了一个列线图模型用于术前诊断可切除ESCC患者的淋巴结转移情况。该研究的列线图首次将增强CT的影像组学特征和CT报告的淋巴结大小标准(测量淋巴结的最大短径)相结合。
影像组学列线图有助于弥合仅依赖大小标准和病理确诊淋巴结转移之间的差距,是改进和优化临床治疗的有用工具,为临床医生评估个人淋巴结转移风险和为患者精准治疗提供新的思路。
以上研究均采用增强CT图像进行影像组学研究,而Peng等[20]在Tan等[19]研究的基础上首次运用不同时相的CT图像进行定量分析预测EC淋巴结转移。分别从平扫期和增强期图像中提取肿瘤的定量图像信息建立模型,发现两种模型在经过Delong检验计算后无统计学差异。研究高度表明平扫期图像也包含了丰富的肿瘤生物学信息。基于CT影像组学特征的模型能准确预测ESCC淋巴结转移,其预测效率优于基于大小标准的临床模型。非对比增强的CT图像可能包含丰富的肿瘤异质性信息,也可作为预测EC淋巴结转移的合理选择。
2. CT影像组学对EC的疗效评估
EC的治疗方式主要取决于诊断时的肿瘤分期、患者的年龄及身体状况等因素,在治疗EC的过程中,如果单纯使用手术切除的方法,效果可能并不尽人意。除手术治疗外,放化疗、新辅助治疗及免疫治疗等在EC治疗中也具有重要的价值[21]。
及时准确的评价治疗疗效对调整辅助临床治疗策略是至关重要的。目前CT影像组学在该方面具有较好的预测潜能。
2.1 对EC手术治疗的疗效评估
手术仍然是可切除EC的主要治疗方式。Peng等[9]研究从肿瘤全体积增强CT动脉期图像中提取影像组学特征构建影像组学模型,来预测接受根治性食管切除术后ESCC患者3年预后。该研究将影像组学和临床风险因素结合构建了组合模型列线图,实现了组合模型的可视化和预测术后预后精度的计算,构建的组合预测模型比单一的TNM分期模型提供了更多的个性化信息,可以更好地进行手术治疗的预后评估。部分手术治疗的患者术后仍需要进一步的辅助治疗,但并非所有患者都能从辅助治疗中获益。
影像组学可以进一步探讨能从辅助治疗获益的患者群体。莫笑开等[10]构建了用于预测ESCC患者DFS的影像组学模型,研究基于治疗前的CT图像及病理N分期的临床风险因素构建了影像组学-临床综合模型,该模型有效识别术后肿瘤进展高风险人群,模型在训练集(C指数:0.744)及验证集(C指数:0.774)中均能良好地区分高低风险患者,为临床提供了一种可靠的精准诊疗的工具。
2.2 对EC新辅助治疗的疗效评估
术前新辅助治疗是新的治疗思路,通过手术联合新辅助放化疗,相较于单纯手术,可以提高可切除进展期EC患者的生存率[22-24]。Larue等[25]针对接受新辅助治疗后ESCC患者,采用基于CT图像的纹理特征来构建预测3年OS的预后模型,发现结合CT特征的预测模型能为患者的风险分层带来益处。有一项基于CT图像的研究[26]通过结合血液炎症指标构建影像组学列线图可以对ESCC患者新辅助化疗的疗效进行评价。研究发现CT纹理参数区域熵可以评估患者新辅助治疗的疗效。区域熵反映了肿瘤的异质性,此纹理参数的值与治疗效果呈正相关,说明愈加混乱的肿瘤微环境更有助于化疗药物作用于肿瘤细胞。
上述的影像特征主要集中在肿瘤病灶区域,而对肿瘤周围影像特征的作用甚少注意。Hu等[27]利用瘤内和瘤周的影像组学特征建立预测模型来预测接受新辅助治疗的ESCC患者的pCR。研究证明了瘤内和瘤周特征的结合提高了预测精度(AUC:0.906),证实了瘤周影像特征的额外预测价值,主要因为周围区域可以提供肿瘤异质性的补充信息。瘤周区域的影像特征可以反映肿瘤周围组织的状态,如瘤周炎症、瘤周纤维化、瘤周血管生成水肿和坏死等,这些影像特征可以为肿瘤的预后评估提供额外的信息。
因此,利用瘤周影像特征进行肿瘤预后评估可以更全面地反映肿瘤异质性,提高预测模型的准确性和稳定性。基于CT影像组学预测模型可以在治疗前较好地预测EC患者新辅助治疗的疗效,为患者制订个性化治疗方案提供参考。
2.3 对EC根治性放化疗的疗效评估
对于无法手术或存在手术禁忌症的EC患者,根治性放化疗是主要的治疗方法[21,28]。Luo等[29]建立了结合临床分期和基于CT图像的影像组学特征的列线图模型,以预测接受根治性放化疗的EC患者的临床完全反应(complete response,CR)状态,模型在训练集(AUC:0.844)和验证集(AUC:0.807)上均具有较高的预测能力。CR状态的预测模型有助于在治疗前对患者的放射敏感性进行分类,并制定更精准的治疗方案。
Jin等[30]利用机器学习将影像组学特征和剂量学参数结合建立综合模型对接受根治性放化疗的EC患者进行疗效评估。在这项研究中,联合模型(AUC:0.708)在预测接受根治性放化疗患者的治疗反应方面优于单纯影像组学特征模型(AUC:0.689)。并且研究发现影像组学特征中Globalmean x.333.1、Correlation、Coarseness和Skewness与患者的治疗反应有关,CT的纹理特征可以评估EC患者的肿瘤异质性,可以区分放化疗治疗的EC患者的疾病稳定和部分反应状态。以上两项研究结果表明影像组学模型在预测EC根治性放化疗的疗效方面有很高的应用价值。
2.4 对EC免疫治疗的疗效评估
近几年免疫治疗在晚期EC一线或二线治疗中取得了较好的疗效[31],然而如何筛选出受益的患者并制定个性化的诊疗计划仍是一个很大的挑战。
Zhu等[32]对接受免疫检查点抑制剂联合化疗治疗的晚期ESCC患者建立了一种基于2D影像组学模型的列线图预测其疗效。此研究比较了2D和3D模型发现易于操作和省时的2D模型获得了最优性能(AUC:0.818)。研究建立的2D影像组学列线图可以对接受抗程序性死亡受体1(programmed cell death 1,PD1)抗体联合化疗治疗的晚期EC患者进行无创筛选,在治疗前识别出免疫治疗的潜在应答者,提高其疗效。因此基于CT影像组学构建的预后模型可以作为预测性生物标志物,有助于筛选出免疫治疗获益的患者,对于预后大有助益。
3. 小结与展望
影像组学从定量图像分析中构建成像生物标志物在推进精准医学和提高肿瘤生物学知识方面具有巨大的潜力。CT影像组学可以将EC患者的临床资料和病理信息以及反应肿瘤异质性的影像特征整合到一个模型中,可以全面反映肿瘤的病理生理信息及时间空间异质性,为实现精准医疗和个性化医疗提供有力的支撑。当下,大多数研究都采用将临床数据与影像组学相结合来构建联合模型,因此未来的趋势必然是跨学科的,预计会更侧重于将影像组学数据与基因组学、蛋白质组学等其他组学相结合和分析上,以提供更丰富、更有价值的信息,从而推动个体化医疗的发展。
随着更多成像数据和更先进的算法技术的出现,以及其他成像技术的可用性,影像组学的研究仍有很大的改进空间。未来的研究应更加详细地报告建模工作的具体细节,采用更可靠的模型构建方法,并对最终模型进行独立的外部验证。这些改进将有助于提高影像组学在医学领域中的可靠性和准确性,从而更好地指导临床治疗策略的制定和调整。
-
表 1 两种解决方案的主要研究
Table 1 Main research of two solutions
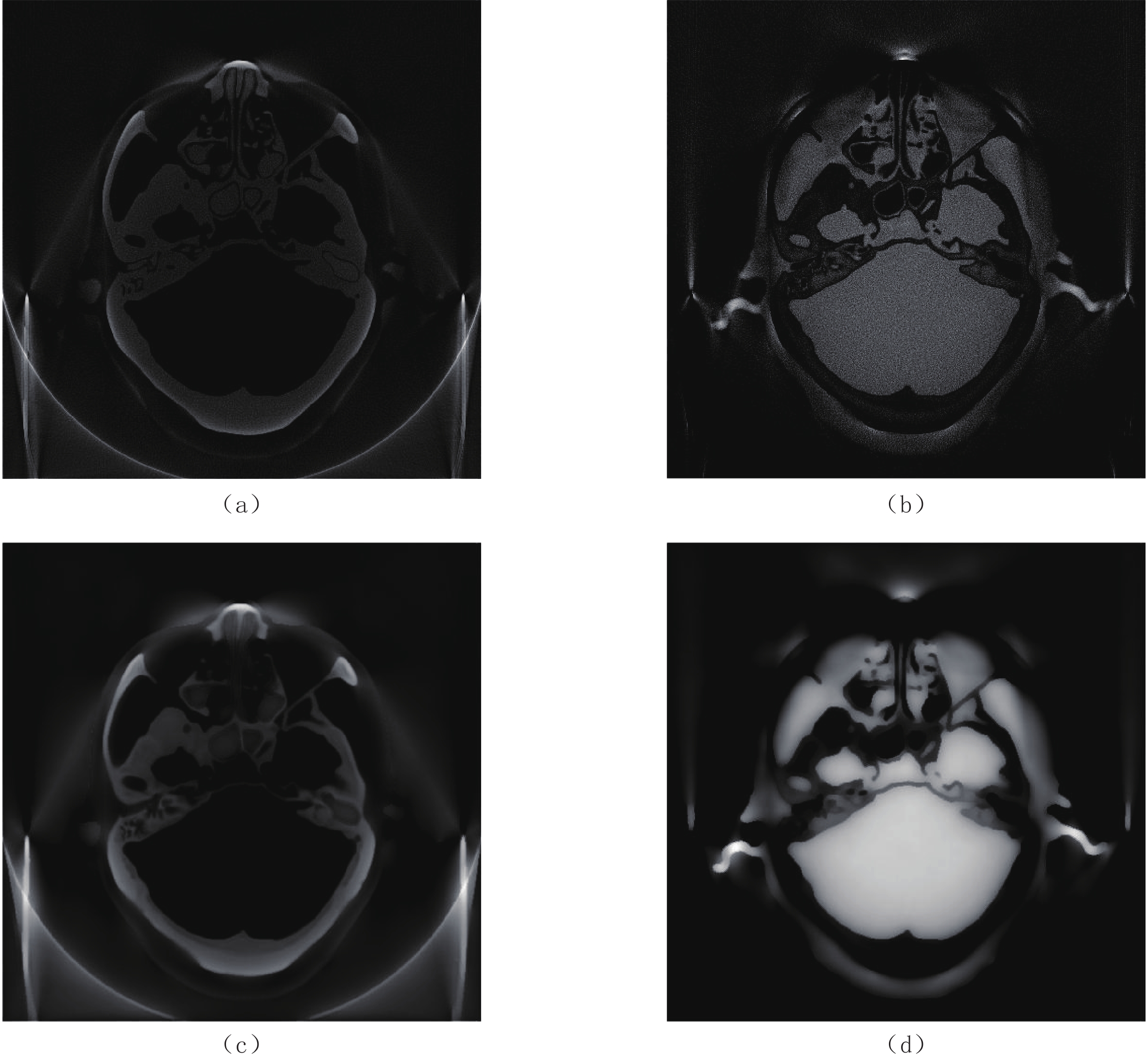
方法 文献 时间 优点 缺点 分解后去噪 [13] 1976 方法实现简单,计算效率高 由于图像分辨率损失很大,效果有限 [14] 1984 实现简便 效果有限 [15] 1985 实现简单 效果有限 [16] 1988 缓解了空间分辨率损失的问题 有边缘伪影 [17] 1995 算法可以在不考虑噪声相关性的情况下实现
噪声抑制分解后的图像中高频噪声被过度抑制,导致图像纹理的改变 [18] 2003 算法利用CT或分解图像的冗余结构或统计信
息进行噪声抑制,可以更好地抑制噪声没有完全描述DECT图像和分解图像之间的映射关系 分解前去噪 [19] 2014 使重建的两幅CT图像噪声变得强烈相关,进
而使得分解图像的噪声得到显著抑制CT重建和图像分解的结合增加了计算的复杂性,并且算法需要大量迭代才能收敛 [20] 2015 可以在保留定量测量和高频边缘信息的同
时显著降低噪声在心肌成像中仍会存在边缘效应 [21] 2018 在抑制噪声的同时可以保持图像边缘细节 没有考虑分解过程的噪声对图像的影响 [22] 2019 可获得高质量的重建CT图像以便后续分解 没有考虑分解过程的噪声对图像的影响 表 2 基于深度学习方法分解图像的主要研究
Table 2 Main research of image decomposition based on deep learning method
-
[1] 高海英. 能谱CT成像关键参数检测技术研究[D]. 广州: 南方医科大学, 2015. GAO H Y. Study on testing techniques of spectral CT imaging key parameters[D]. Guangzhou: Southern Medical University, 2015. (in Chinese).
[2] 韩文艳. CT能谱成像的基本原理与临床应用优势[J]. 中国医疗设备, 2015,30(12): 90−91. doi: 10.3969/j.issn.1674-1633.2015.12.025 HAN W Y. Basic principle and advantages of clinical application of CT energy spectrum imaging[J]. China Medical Devices, 2015, 30(12): 90−91. (in Chinese). doi: 10.3969/j.issn.1674-1633.2015.12.025
[3] ALVAREZ R E, MACOVSKI A. Energy-selective reconstructions in X-ray computerized tomography[J]. Physics in Medicine & Biology, 1976, 21(5): 733−744.
[4] 王丽新, 孙丰荣, 仲海, 等. 双能CT成像的数值仿真[J]. 航天医学与医学工程, 2015,28(5): 350−357. WANG L X, SUN F R, ZHONG H, et al. Numerical simulation of dual-energy CT imaging[J]. Space Medicine & Medical Engineering, 2015, 28(5): 350−357. (in Chinese).
[5] MAASS C, BAER M, KACHELRIESS M. Image-based dual energy CT using optimized precorrection functions: A practical new approach of material decomposition in image domain[J]. Medical Physics, 2009, 36(8): 3818−3829. doi: 10.1118/1.3157235
[6] 贺芳芳. 能谱CT基物质分解技术应用研究[D]. 济南: 山东大学, 2020. HE F F. Application research on basis material decomposition of spectral CT[D]. Jinan: Shandong University, 2020. (in Chinese).
[7] MENDONÇA P R S, BHOTIKA R, MADDAH M, et al. Multi-material decomposition of spectral CT images[C]//Medical Imaging 2010: Physics of Medical Imaging. SPIE, 2010, 7622: 633-641.
[8] 周正东, 章栩苓, 辛润超, 等. 基于MAP-EM算法的双能CT直接迭代基材料分解方法[J]. 东南大学学报(自然科学版), 2020,50(5): 935−941. doi: 10.3969/j.issn.1001-0505.2020.05.020 ZHOU Z D, ZHANG X L, XIN R C, et al. Direct iterative basis material decomposition method for dual-energy CT based on MAP-EM algorithm[J]. Journal of Southeast University (Natural Science Edition), 2020, 50(5): 935−941. (in Chinese). doi: 10.3969/j.issn.1001-0505.2020.05.020
[9] 孙英博, 孔慧华, 张雁霞. 基于投影域分解的多能谱CT造影剂物质识别研究[J]. 中北大学学报 (自然科学版), 2019,40(2): 167−172. SUN Y B, KONG H H, ZHANG Y X. Multi-energy spectral CT contrast agent material recognition based on projection domain decomposition[J]. Journal of North University of China (Natural Science Edition), 2019, 40(2): 167−172. (in Chinese).
[10] LI Z, RAVISHANKAR S, LONG Y, et al. Learned mixed material models for efficient clustering based dual-energy CT image decomposition[C]//2018 IEEE Global Conference on Signal and Information Processing (GlobalSIP). IEEE, 2018: 529-533.
[11] 李磊. 双能CT图像重建算法研究[D]. 郑州: 解放军信息工程大学, 2016. LI L. Research on image reconstruction algorithms of dual energy computed tomography[D]. Zhengzhou: Information Engineering University, 2016. (in Chinese).
[12] MCCOLLOUGH C H, SCHMIDT B, LIU X, et al. Dual-energy algorithms and postprocessing techniques[M]//Dual energy CT in clinical practice. Springer, Berlin, Heidelberg, 2011: 43-51.
[13] RUTHERFORD R, PULLAN B, ISHERWOOD I. X-ray energies for effective atomic number determination[J]. Neuroradiology, 1976, 11(1): 23−28. doi: 10.1007/BF00327254
[14] NISHIMURA D G, MACOVSKI A, BRODY W R. Noise reduction methods for hybrid subtraction[J]. Medical Physics, 1984, 11(3): 259−265. doi: 10.1118/1.595501
[15] JOHNS P C, YAFFE M J. Theoretical optimization of dual-energy X-ray imaging with application to mammography[J]. Medical Physics, 1985, 12(3): 289−296. doi: 10.1118/1.595766
[16] KALENDER W A, KLOTZ E, KOSTARIDOU L. An algorithm for noise suppression in dual energy CT material density images[J]. IEEE Transactions on Medical Imaging, 1988, 7(3): 218−224. doi: 10.1109/42.7785
[17] HINSHAW D A, DOBBINS III J T. Recent progress in noise reduction and scatter correction in dual-energy imaging[C]//Medical Imaging 1995: Physics of Medical Imaging, SPIE, 1995, 2432: 134-142.
[18] WARP R J, DOBBINS J T. Quantitative evaluation of noise reduction strategies in dual-energy imaging[J]. Medical Physics, 2003, 30(2): 190−198. doi: 10.1118/1.1538232
[19] DONG X, NIU T, ZHU L. Combined iterative reconstruction and image-domain decomposition for dual energy CT using total-variation regularization[J]. Medical Physics, 2014, 41(5): 051909(1-9).
[20] ZHAO W, NIU T, XING L, et al. Using edge-preserving algorithm with non-local mean for significantly improved image-domain material decomposition in dual-energy CT[J]. Physics in Medicine & Biology, 2016, 61(3): 1332−1351.
[21] 陈佩君, 冯鹏, 伍伟文, 等. 基于图像总变分和张量字典的多能谱CT材料识别研究[J]. 光学学报, 2018, 38(11): 1111002(1-8). CHEN P J, FENG P, WU W W, et al. Material discrimination by multi-spectral CT based on lmage total variation and tensor dictionary[J]. Acta Optica Sinica 2018, 38(11): 1111002(1-8). (in Chinese).
[22] DENG G, CHEN M, HE P, et al. The experimental study on geometric calibration and material discrimination for in Vivo dual-energy CT imaging[J]. Biomedical Research International, 2019, 2019: 7614589.
[23] NIU T, DONG X, PETRONGOLO M, et al. Iterative image-domain decomposition for dual-energy CT[J]. Medical Physics, 2014, 41(4): 041901(1−10).
[24] TANG S, YANG M, HU X, et al. Multiscale penalized weighted least-squares image-domain decomposition for dual-energy CT[C]//2015 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC). IEEE, 2015: 1-6.
[25] LI Z, RAVISHANKAR S, LONG Y, et al. DECT-MULTRA: Dual-energy CT image decomposition with learned mixed material models and efficient clustering[J]. IEEE Transactions on Medical Imaging, 2020, 39(4): 1223−1234. doi: 10.1109/TMI.2019.2946177
[26] 王冲旭, 陈平, 潘晋孝, 等. 基于迭代残差网络的双能CT图像材料分解研究[J]. CT理论与应用研究, 2022,31(1): 47−54. DOI: 10.15953/j.1004-4140.2022.31.01.05. WANG C X, CHEN P, PAN J X, et al. Research on material decomposition of dual-energy CT image based on iterative residual network[J]. CT Theory and Applications, 2022, 31(1): 47−54. DOI: 10.15953/j.1004-4140.2022.31.01.05. (in Chinese).
[27] XU Y, YAN B, ZHANG J, et al. Image decomposition algorithm for dual-energy computed tomography via fully convolutional network[J]. Computational and Mathematical Methods in Medicine, 2018, 2018(1): 2527516.
[28] 朱冬亮, 文奕, 陶欣. 深度学习在生物医学领域的应用进展述评[J]. 世界科技研究与发展, 2020,42(5): 510−519. ZHU D L, WEN Y, TAO X. A Review of the application progress of deep learning in biomedical field[J]. World Sci-Tech R & D, 2020, 42(5): 510−519. (in Chinese).
[29] KAWAHARA D, SAITO A, OZAWA S, et al. Image synthesis with deep convolutional generative adversarial networks for material decomposition in dual-energy CT from a kilovoltage CT[J]. Computers in Biology and Medicine, 2021, 128: 104111. doi: 10.1016/j.compbiomed.2020.104111
[30] LYU T, ZHAO W, ZHU Y, et al. Estimating dual-energy CT imaging from single-energy CT data with material decomposition convolutional neural network[J]. Medical Image Analysis, 2021, 70: 102001. doi: 10.1016/j.media.2021.102001
[31] CLARK D P, HOLBROOK M, BADEA C T. Multi-energy CT decomposition using convolutional neural networks[C]//Medical Imaging 2018: Physics of Medical Imaging. International Society for Optics and Photonics, 2018, 10573: 415-423.
[32] ZHANG W, ZHANG H, WANG L, et al. Image domain dual material decomposition for dual-energy CT using butterfly network[J]. Medical Physics, 2019, 46(5): 2037−2051. doi: 10.1002/mp.13489
[33] SHI Z, LI H, CAO Q, et al. A material decomposition method for dual-energy CT via dual interactive Wasserstein generative adversarial networks[J]. Medical Physics, 2021, 48(6): 2891−2905. doi: 10.1002/mp.14828
[34] 郭志鹏. Micro-CT重建图像质量增强的方法研究[D]. 西安: 西安电子科技大学, 2017. GUO Z P. Research on image quality enhancement method in micro-CT reconstruction[D]. Xi'an: Xidian University, 2017. (in Chinese).
[35] LIU X, YU L, PRIMAK A N, et al. Quantitative imaging of element composition and mass fraction using dual-energy CT: Three-material decomposition[J]. Medical Physics, 2009, 36(5): 1602−1609. doi: 10.1118/1.3097632
[36] MENDONÇA P R, LAMB P, SAHANI D V. A flexible method for multi-material decomposition of dual-energy CT images[J]. IEEE Transactions on Medical Imaging, 2014, 33(1): 99−116. doi: 10.1109/TMI.2013.2281719
[37] JIANG Y, XUE Y, LYU Q, et al. Noise suppression in image-domain multi-material decomposition for dual-energy CT[J]. IEEE Transactions on Biomedical Engineering, 2020, 67(2): 523−535. doi: 10.1109/TBME.2019.2916907
[38] LEE H, KIM H J, LEE D, et al. Improvement with the multi-material decomposition framework in dual-energy computed tomography: A phantom study[J]. Journal of the Korean Physical Society, 2020, 77(6): 515−523. doi: 10.3938/jkps.77.515
[39] 降俊汝, 余海军, 龚长城, 等. 基于双能CT图像域的DL-RTV多材料分解研究[J]. 光学学报, 2020,40(21): 2111004(1−12). JIANG J R, YU H J, GONG C C, et al. Image-domain multimaterial decomposition for dual-energy CT based on dictionary learning and relative total variation[J]. Acta Optica Sinica, 2020, 40(21): 2111004(1−12). (in Chinese).
[40] LONG Y, FESSLER J A. Multi-material decomposition using statistical image reconstruction for spectral CT[J]. IEEE Transactions on Medical Imaging, 2014, 33(8): 1614−1626. doi: 10.1109/TMI.2014.2320284
[41] XUE Y, RUAN R, HU X, et al. Statistical image-domain multimaterial decomposition for dual-energy CT[J]. Medical Physics, 2017, 44(3): 886−901. doi: 10.1002/mp.12096
[42] DING Q, NIU T, ZHANG X, et al. Image-domain multimaterial decomposition for dual-energy CT based on prior information of material images[J]. Medical Physics, 2018, 45(8): 3614−3626. doi: 10.1002/mp.13001
[43] PATINO M, PROCHOWSKI A, AGRAWAL M D, et al. Material separation using dual-energy CT: Current and emerging applications[J]. Radiographics, 2016, 36(4): 1087−1105. doi: 10.1148/rg.2016150220
-
期刊类型引用(1)
1. 秦慧琳,欧静,苟月芹,王悦苏,罗慧,张小明,付茂勇,陈天武. CT影像组学术前预测可切除性食管胃结合部腺癌区域淋巴结转移的研究. CT理论与应用研究(中英文). 2025(03): 427-438 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载:
