Evaluation of the Diagnostic Value of Pulmonary Nodules Based on Two AI Software
-
摘要: 目的:探讨两种AI软件在≥5 mm肺结节中的临床应用价值。方法:选取2021年6月至2021年10月延安大学附属医院体检肺结节患者92例(共483个结节)。AI软件检测到的结节由影像学医师进行评估并记录其个数及结节类型;人工阅片由两名高年资影像学医师进行视觉评估,并以此作为识别结节的金标准。计算两个软件的检出率、假阳性率和假阴性率,评价两种AI软件的结节诊断价值;卡方检验和Fisher精确检验来比较不同软件与金标准之间的差异;最后,评价两种AI软件联合对肺结节的诊断价值。结果:软件A和软件B结节检出率为92.1% 和87.0%;软件A与人工阅片的吻合度一般(Kappa=0.213),软件B与人工阅片的吻合度较弱(Kappa=0.150);软件A相比人工阅片对实性结节和钙化结节的检出有统计学差异;软件B相比人工阅片纯磨玻璃结节的检出有统计学差异;联合两种AI软件结节的检出率为97.1%,两种软件的联合与人工阅片比,结节类型的检出没有统计学差异。两种AI软件联合与人工阅片的吻合度较好(Kappa=0.439)。结论:两种AI软件联合会提高结节诊断及分类分析的能力;推荐联合诊断的方法用于临床,也为进一步提升AI软件数据集的同质化管理提供佐证。Abstract: Objective: To explore the clinical value of two kinds of AI detection software in ≥5 mm pulmonary nodules. Methods: A total of 92 patients with pulmonary nodules (483 nodules) were selected from the affiliated Hospital of Yan'an University between June and October 2021. The nodules detected by AI software were evaluated and the number and type of nodules were recorded by two senior radiologists. Two senior imaging doctors then evaluated the manual film reading, which was used as the gold standard for nodule recognition. Subsequently, the detection rate and false positive and negative rates of the two software were calculated, and the nodule detection value of the two AI software was evaluated. Additionally, the chi-square and Fisher precision tests were used to compare the differences between the different software and the gold standard. Finally, the diagnostic value of the combination of the two kinds of AI software for pulmonary nodules was calculated. Results: The detection rates of software A and software B nodules were 92.1% and 87.0%, respectively. Moreover, the coincidence degree between software A and manual reading was general (Kappa=0.213), while that between software B and manual reading was weak (Kappa=0.150). There was also a significant difference in the detection of solid nodules and calcified nodules between software A and manual reading, as well as between software B and pure ground glass nodules. The detection rate of nodules with the combined two kinds of AI software was 97.1%. However, compared with manual reading, there was no significant difference in the detection of nodule types. The combination of the two AI software had a good agreement with manual reading (Kappa=0.439). Conclusion: The combination of two kinds of AI software improved the ability of nodule detection and classification analysis. Furthermore, the method of joint diagnosis is recommended for clinical use and it provides evidence for further improving the homogenization management of AI data sets.
-
Keywords:
- artificial intelligence /
- CT /
- pulmonary nodules /
- detection
-
自2019年12月,由严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)导致的新型冠状病毒感染(coronavirus disease 2019,COVID-19,以下简称新冠肺炎)开始成为受到全球关注的流行病。根据世界卫生组织(World Health Organization,WHO)公布的数据,截止到2023年2月10日,全球已经有超过7.5亿新冠确诊病例,其中包括超过680万死亡病例[1]。新型冠状病毒核酸检测阳性为新冠肺炎确诊的首要标准[2-3]。
胸部CT平扫是COVID-19早期发现、诊断及协助疾病分期的有效手段[4-5],且研究表明胸部CT中病变累及范围、体积、形态和密度与COVID-19的进展和预后密切相关[5-6]。在COVID-19流行期间,我国门诊及住院患者中产生了大量胸部CT资料。这些胸部CT资料除提供呼吸系统相关信息外,也涵盖了大量包括甲状腺、心血管、肝脏、脾脏、胰腺、骨骼及肌肉等脏器在内的信息,通过胸部CT平扫影像,无需额外检查,即可获取多系统信息。但目前国内针对COVID-19的研究,仍以呼吸系统研究占绝大多数。因此,基于影像多模式与多维度协同的多要素关联诊断理念[7],胸部CT图像提取的肺外改变与COVID-19预后的关系值得进一步探索。
COVID-19虽以肺部表现为主,但SARS-CoV-2病毒除累及呼吸系统外,还可累及免疫、神经、循环、骨肌、内分泌等多个系统[2,8-10]。其中,尤以对骨肌系统影响的研究较为缺乏。部分国外研究指出,骨密度和体质成分都受到COVID-19的影响。一方面,在COVID-19流行期间,隔离和居家时间延长导致户外阳光照射时间减少,进而导致维生素D和钙的获取减少,从而影响骨密度[11]。此外,居家时间延长也导致体育活动和锻炼缺乏、久坐时间延长、零食摄入及酒精摄入量增加,进一步导致体重和身体质量指数(body mass index,BMI)增加[12]。这些都是COVID-19流行导致的与肌肉骨骼健康密切相关的因素。但有关国人COVID-19患者骨肌特征的研究尚处于空白阶段。因此,骨肌系统特征与COVID-19的关系值得关注。
利用定量CT(quantitative computed tomography,QCT),基于COVID-19患者胸部CT平扫图像,可获取包括胸腰椎骨密度(bone mineral density,BMD)、腹部皮下脂肪(subcutaneous adipose tissue,SAT)面积、腹腔内脂肪(visceral adipose tissue,VAT)面积、腹部总脂肪(total adipose tissue,TAT)面积及骨骼肌横断面面积等多项COVID-19患者骨肌系统指标,为进一步探索该群体骨肌系统变化及预后特征提供了新思路。
本研究旨在通过对COVID-19患者出入院及出院1年后随访的骨及体质成分特征(包括BMD、腹部脂肪在内)进行分析,探索COVID-19对骨肌系统的影响,并进一步分析不同临床分型COVID-19患者临床及骨肌特征的差异。
1. 研究对象及方法
1.1 研究对象
本研究回顾性分析2020年1月至2021年2月期间,在首都医科大学附属北京地坛医院住院的528例COVID-19确诊病例,所有患者入院前均接受咽拭子检测且新型冠状病毒核酸检测为阳性。纳入标准:需同时具备入院前后7 d内胸部CT平扫图像且有出院时、出院1年及以上胸部CT平扫资料。排除标准:①存在胸腰椎椎体骨折或畸形;②存在胸腰椎感染、肿瘤或手术史;③既往存在长期激素应用史;④胸部 CT图像质量不佳。对每位入组患者,通过医院信息系统收集包括人口学信息、COVID-19诊疗信息及胸部CT平扫数据。最终从上述528例COVID-19确诊病例数据库中筛选出33例符合上述纳排标准的患者。
本研究经首都医科大学附属北京友谊医院伦理委员会批准(2022-P2-216-01)。
1.2 胸部CT扫描方案
本研究所有胸部CT平扫检查均由同一台CT设备(Emotion16,西门子)扫描。胸部CT平扫及QCT体模质控扫描方案如下:床高120 cm,管电压120 kV,管电流130 mA,层厚1.0 mm,层间隔1.0 mm,FOV 50 cm×50 cm,标准重建。
1.3 BMD及腹部脂肪测量
所有胸椎BMD及腹部脂肪数据测量分析均采用同一QCT软件(QCT PRO,version 4.2,Mindways Software,Inc.),QCT质控采用Mindways Model 4 CT体模进行。应用QCT软件分别测量胸1~胸12(T1~T12)椎体体积骨密度,单位mg/cm3。腹部脂肪测量层面选择胸12~腰1(T12~L1)椎间隙层面[13],分别测量该层面VAT、SAT、TAT面积,单位均为cm2。
1.4 统计学分析
本研究描述性统计采用(平均值±标准差)表述,定性资料采用例数及百分比表示。采用单因素重复测量方差分析对比入院、出院及出院1年后随访BMD及腹部脂肪差异。采用独立样本t检验和卡方检验对比无症状感染者及轻型组、普通型及重型组两组之间的临床及骨肌特征差异。以P<0.05为差异具有统计学意义。
2. 研究结果
2.1 入院临床特征
本研究共纳入33例COVID-19患者,人口学特征、住院及随访时长详见表1。本研究入组患者平均年龄(47.1±15.0)岁,年龄范围22~72岁,其中男性22人,占66.7%;女性11人,占33.3%。平均BMI为(25.5±3.7)kg/m2。
表 1 入组患者入院临床特征、住院及随访时长Table 1. Clinical characteristics, length of hospital stay, and duration to follow-up of patients with COVID-19项目 特征值 年龄/岁 47.1±15.0 性别/例(%) 男 22(66.7) 女 11(33.3) 身高/cm 169.0±7.9 体重/kg 72.9±13.4 BMI/(kg/m2) 25.5±3.7 临床分型/例(%) 无症状 2(6.1) 轻型 8(24.2) 普通型 19(57.6) 重型 4(12.1) 危重型 0(0.0) 住院时长/d 29.5±9.6 随访时间/d 423.0±53.6 按照2020年1月至2021年2月期间我国新冠肺炎诊疗指南,入组患者中,无症状感染者2人,占6.1%;轻型、普通型、重型患者各8、19和4人,分别占24.2%、57.6% 和12.2%,未见危重型患者。入组患者住院时长跨度10~48 d,平均住院时长为(29.5±9.6)d。出院后平均随访时间为(423.0±53.6)d。
2.2 入院、出院及1年后随访骨密度特征
本研究入组患者入院、出院、1年后随访3个时间点的T1~T12平均BMD值、不同分段平均BMD值详见表2。入院、出院、1年后随访T1~T12平均BMD分别为(165.6±34.6)mg/cm3、(165.3±35.2)mg/cm3、(165.2±35.4)mg/cm3,三者之间未见明显统计学差异。
表 2 入院、出院及1年后随访T1~T12椎体平均BMD及不同分段平均BMDTable 2. The mean BMD of T1~T12 and mean BMD of different vertebral segments at admission, discharge, and one year follow-up of patients with COVID-19椎体或分段 BMD/(mg/cm3) P 入院 出院 1年后随访 T1~T4(上1/3段) 179.3±33.6 178.0±33.1 177.6±33.5 0.586 T5~T8(中1/3段) 164.7±36.9 165.3±36.0 165.5±37.4 0.749 T9~T12(下1/3段) 152.8±36.7 152.5±39.4 152.4±39.0 0.903 T1~T6(上段) 176.6±33.9 175.8±33.9 175.6±34.0 0.679 T7~T12(下段) 154.6±36.7 154.7±37.8 154.7±38.4 0.993 T1~T12平均 165.6±34.6 165.3±35.2 165.2±35.4 0.865 注:BMD为骨密度。 将胸椎划分为上1/3段(T1~T4)、中1/3段(T5~T8)及下1/3段(T9~T12)。上1/3段胸椎入院、出院及1年后随访平均BMD分别为(179.3±33.6)mg/cm3、(178.0±33.1)mg/cm3、(177.6±33.5)mg/cm3;中1/3段胸椎入院、出院、1年后随访平均BMD分别为(164.7±36.9)mg/cm3、(165.3±36.0)mg/cm3、(165.5±37.4)mg/cm3;下1/3段胸椎入院、出院及1年后随访平均BMD分别为(152.8±36.7)mg/cm3、(152.5±39.4)mg/cm3、(152.4±39.0)mg/cm3。上1/3段、中1/3段、下1/3段胸椎入出院及1年后随访3次BMD值之间均未见明显统计学差异。将胸椎划分为上段胸椎(T1~T6)、下段胸椎(T7~T12),上段胸椎入院、出院、1年后随访平均BMD分别为(176.6±33.9)mg/cm3、(175.8±33.9)mg/cm3、(175.6±34.0)mg/cm3,3次BMD之间无统计学差异,下段胸椎入院、出院、1年后随访平均BMD分别为(154.6±36.7)mg/cm3、(154.7±37.8)mg/cm3、(154.7±38.4)mg/cm3,3次BMD之间亦未见统计学差异(表2)。
2.3 入院、出院及1年后随访腹部脂肪特征
本研究入组患者入院、出院、1年后随访3个时间点的T12~L1椎间隙层面SAT、VAT、TAT详见表3。入院、出院、1年后随访平均SAT分别为(99.9±51.2)cm2、(102.2±52.6)cm2和(103.7±52.7)cm2,三者之间未见明显统计学差异。平均VAT分别为(122.4±58.7)cm2、(128.0±64.4)cm2和(130.9±66.7)cm2,三者之间无统计学差异。入院、出院、1年后随访平均TAT分别为(222.3±91.5)cm2、(230.1±96.1)cm2、(234.6±100.1)cm2,3次TAT之间亦无统计学差异(表3)。
表 3 入院、出院及1年后随访腹部脂肪面积Table 3. The abdominal adipose tissue area of patients with COVID-19 at admission, discharge, and one year follow-up腹部脂肪 面积/cm2 P 入院 出院 1年后随访 SAT 99.9±51.2 102.2±52.6 103.7±52.7 0.086 VAT 122.4±58.7 128.0±64.4 130.9±66.7 0.374 TAT 222.3±91.5 230.1±96.1 234.6±100.1 0.186 注:SAT为腹部皮下脂肪,VAT为腹腔内脂肪,TAT为腹部总脂肪。 2.4 不同临床分型之间临床特征、骨密度及腹部脂肪特征比较
根据新冠肺炎临床分型,将入组患者划分为两组:无症状感染者及轻型组、普通型及重型组。无症状感染者及轻型组患者共10例,占30.3%,普通型及重型组患者共23例,占69.7%,详见表4。两组之间,性别分布及BMI均未见统计学差异。无症状感染者及轻型组入院平均年龄为(37.0±12.8)岁,普通型及重型组平均年龄为(51.4±13.9)岁,后组入院年龄明显高于前组。无症状感染者及轻型组入院T1~T12平均BMD(173.9±33.6)mg/cm3高于普通型及重型组(162.0±35.2)mg/cm3,前组1年后随访T1~T12平均BMD(173.5±34.4)mg/cm3亦高于后组(161.5±36.0)mg/cm3。两组之间入院SAT((99.7±71.1)cm2 vs.(99.9±41.7)cm2)及1年后随访SAT((100.5±73.2)cm2 vs.105.1±42.9)cm2),均未见明显统计学差异,但普通型及重型组入院VAT((130.8±51.8)cm2 vs. (102.9±71.2)cm2)及1年后随访VAT((141.1±64.0)cm2 vs. (107.5±70.1)cm2)大于无症状感染者及轻型组。对于入院TAT((230.8±71.0)cm2 vs.(202.6±129.7)cm2)及1年后随访TAT((246.2±81.2)cm2 vs.(208.0±135.7)cm2),普通型及重型组亦大于无症状感染者及轻型组(表4)。
表 4 无症状感染者及轻型组、普通型及重型组之间临床特征、骨密度及腹部脂肪特征比较Table 4. The comparison of clinical features, BMD, and abdominal adipose tissue area of patients with COVID-19 between the asymptomatic and mild group and the common and severe group项目 组别 P 无症状感染者及轻型组 普通型及重型组 病例 10 23 年龄/岁 37.0±12.8 51.4±13.9 0.009 性别 男 7 15 0.788 女 3 8 BMI/(kg/m2) 25.4±5.4 25.5±2.8 0.946 入院T1~T12平均BMD/(mg/cm3) 173.9±33.6 162.0±35.2 0.037 1年后随访T1~T12平均BMD/(mg/cm3) 173.5±34.4 161.5±36.0 0.037 入院T12~L1层面SAT面积/cm2 99.7±71.1 99.9±41.7 0.989 1年后随访T12~L1层面SAT面积/cm2 100.5±73.2 105.1±42.9 0.821 入院T12~L1层面VAT面积/cm2 102.9±71.2 130.8±51.8 0.021 1年后随访T12~L1层面VAT面积/cm2 107.5±70.1 141.1±64.0 0.018 入院T12~L1层面TAT面积/cm2 202.6±129.7 230.8±71.0 0.042 1年后随访T12~L1层面TAT面积/cm2 208.0±135.7 246.2±81.2 0.032 注:BMD为骨密度,SAT为腹部皮下脂肪,VAT为腹腔内脂肪,TAT为腹部总脂肪。 3. 讨论
COVID-19累及了以呼吸系统为主的多系统多脏器,但目前尚缺乏有关COVID-19对骨肌系统影响的研究。其次,COVID-19患者胸部CT平扫图像除体现肺部受累程度外,还包含大量其他系统的信息,基于多要素关联诊断理论,如何充分挖掘利用胸部CT影像信息亟待探索。
本研究首次通过胸部CT影像数据,应用QCT软件,对我国COVID-19患者的骨密度及腹部脂肪特征进行阐述和对比,并对该人群骨肌特征进行随访。
3.1 COVID-19对骨密度的影响
有关骨密度与COVID-19的研究,以往有国外研究指出,COVID-19患者在随访(81±48)d后,平均BMD下降8.6%±10.5%,但该研究纳入的58例患者中,有50例(87.7%)接受糖皮质激素治疗,其中有13例(22.8%)患者接受大剂量糖皮质激素治疗[14]。本研究指出,我国COVID-19患者治愈1年后,其胸椎骨密度并未发生明显变化,提示在1年随访过程中,COVID-19并未影响胸椎骨密度。上述研究差异可从多方面进行分析,一方面可能由于本研究纳入患者中,无危重型分型,且治疗过程中未应用糖皮质激素。另一方面,本研究患者平均年龄为(47.1±15.0)岁,其中65岁以上老年人在本研究中占12.1%,基本符合我国COVID-19患者年龄分布特点[5]。上述国外研究平均年龄为63.2岁,65岁以上患者占48.3%。65岁以上老年人是骨密度易受损伤、脆性骨折高发的群体[15],糖皮质激素应用是导致骨损伤的另一重要因素[16],因此,上述国外研究中无法明确COVID-19对患者随访过程中出现BMD下降的影响程度。诚然,本研究中骨密度未变化也可能由于随访时间较短或样本量不足,导致骨密度变化暂未体现。
此外,在对比无症状感染者及轻型组、普通型及重型组两组胸椎BMD后,本研究提示临床分型较重的COVID-19患者BMD明显低于临床分型较轻的患者。但由于普通型及重型组患者平均年龄明显高于无症状感染者及轻型组,考虑到年龄对骨密度的影响,暂无法明确本研究两组的BMD差异是否由COVID-19感染导致。针对老年或重症/危重症COVID-19患者的骨密度研究或许能揭示COVID-19与骨密度的更多相关性。此外,受限于胸部CT扫描范围,本研究仅测量了胸椎BMD,无法测量腰椎BMD,因此,COVID-19对腰椎BMD的影响尚需要进一步探索。
3.2 COVID-19对体质成分的影响
本研究中COVID-19患者在治愈1年后,其T12~L1层面的VAT、SAT及TAT均未见明显增多或减少。腹部脂肪作为体质成分的重要指标之一,与冠心病、脑血管病等多种疾病的发生密切相关,且不同部位脂肪对健康的影响不同[17-19],因此评估腹部脂肪对研究疾病预后具有重要意义。而基于单层CT图像测量的腹部脂肪面积与腹部脂肪总量具有较高的相关性,且易于评价,可为腹部体质成分评估提供重要价值[20]。既往研究指出,住院COVID-19患者腰3层面的VAT高于门诊患者,且住院患者中,收入ICU的COVID-19患者腰3层面的VAT高于非ICU患者[21]。
本研究在对比无症状感染者及轻型组、普通型及重型组两组腹部脂肪特征后,提示临床分型较重的COVID-19患者,其VAT较高。另有研究指出,腹部脂肪指标与COVID-19预后密切相关,VAT面积增加与重症COVID-19比例增加密切相关[22]。我们前期有关体质成分与COVID-19患者预后相关性的研究指出,VAT面积与COVID-19患者住院时长相关,VAT面积越大,住院时长越长。
3.3 局限性
本文存在以下局限性。首先,本研究为单中心、回顾性研究。其次,我国虽有众多COVID-19感染者,但由于转阴后随访患者例数较少,尤其是转阴后1年后进行随访的患者例数更为稀少。因此,本研究的样本量较小,随访时长仅1年。本研究虽仅纳入了33例患者,但可初步反映COVID-19对骨密度及体质成分的影响。本研究结果还需要多中心、大样本、前瞻性研究以进一步明确。
总之,本研究首次基于真实世界COVID-19患者胸部CT影像数据,应用QCT软件,对我国COVID-19患者的骨密度及体质成分特征进行了阐述和对比,并首次描述了该群体一年随访骨密度及腹部脂肪变化情况,以期助力探索COVID-19对骨肌系统的影响。
致谢
感谢首都医科大学附属北京地坛医院放射科陈步东、郭明楠为本研究提供的帮助。
-
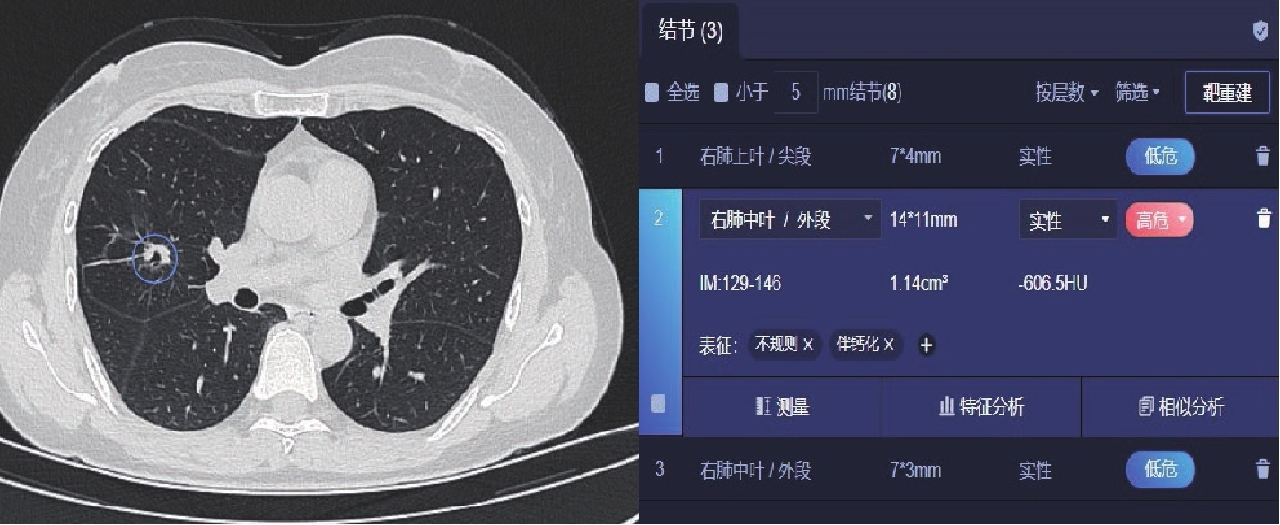
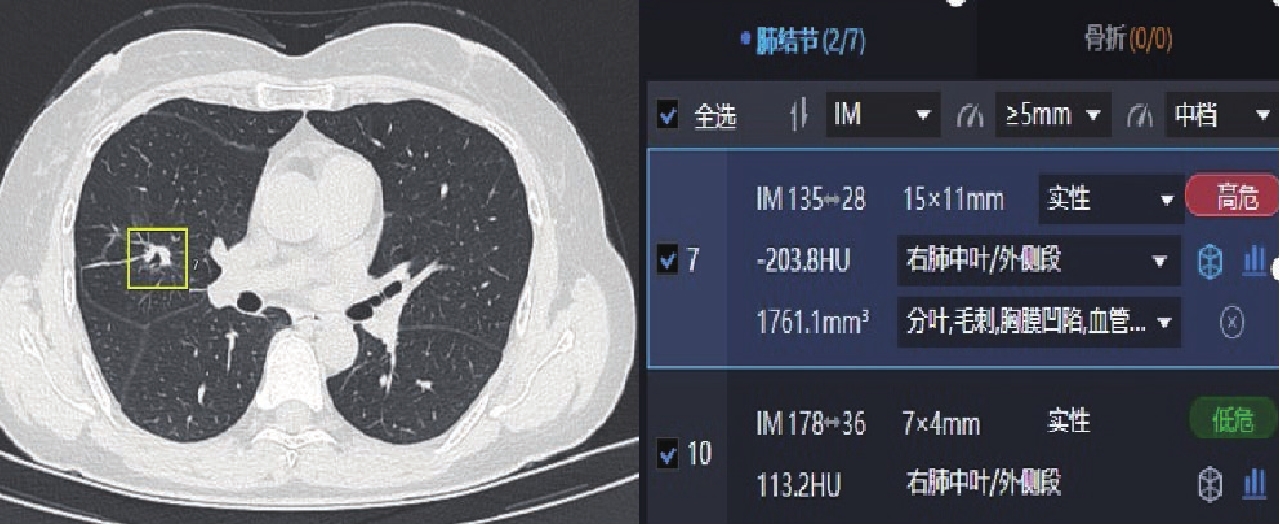
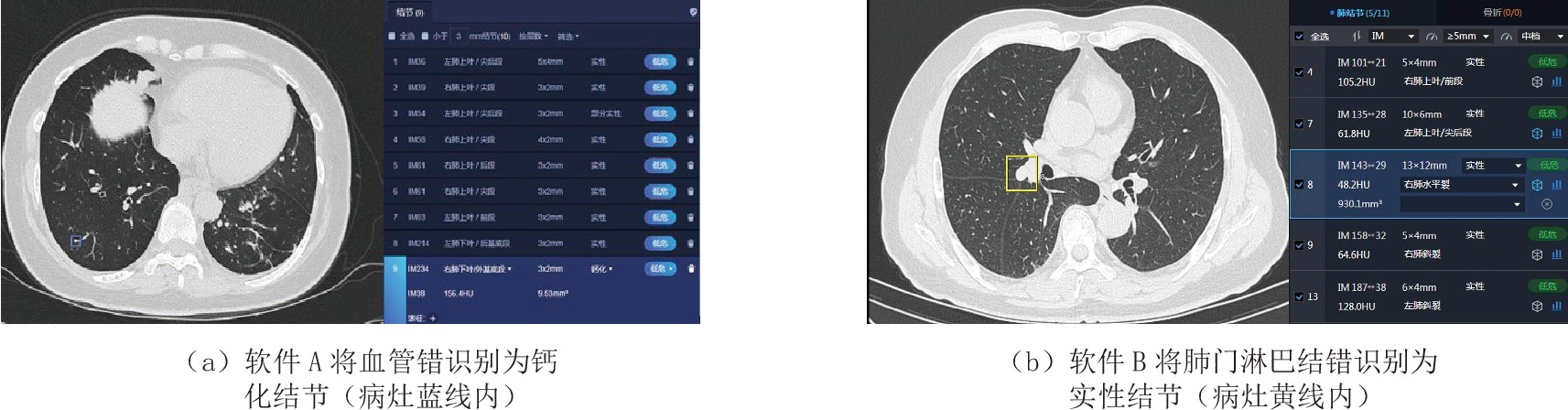
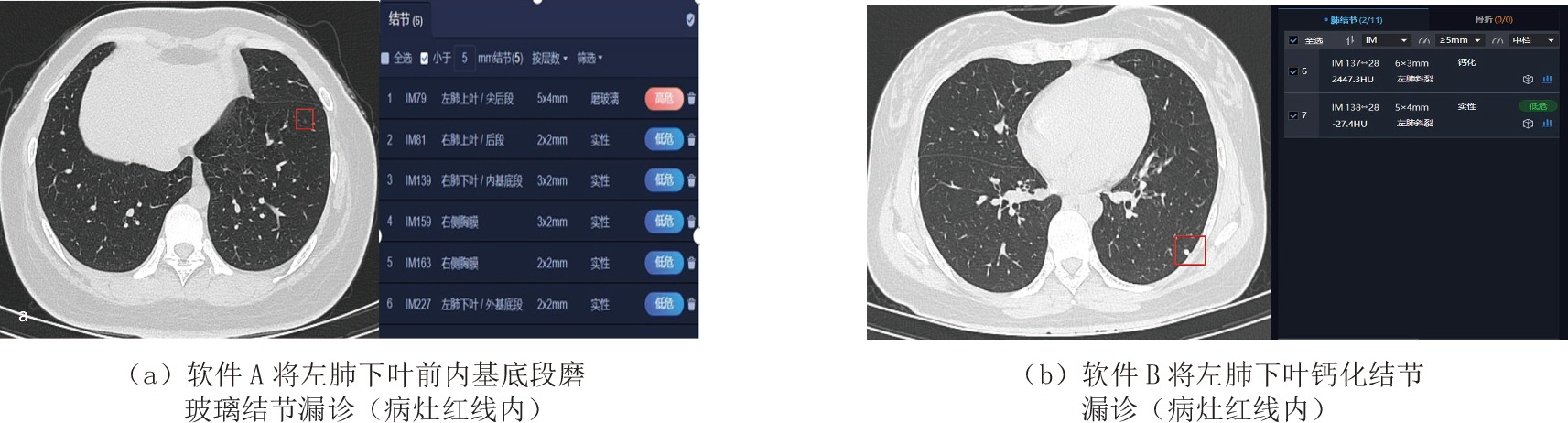
表 1 两种软件及两种软件联合对肺结节的检出情况
Table 1 The detection of pulmonary nodules by two separate kinds of software and their combined effect
阅片方法 检出情况 检出率/% 假阳性率/% 假阴性率/% 软件A 92.1 3.52 7.87 软件B 87.0 2.69 13.0 软件A联合软件B 97.1 1.04 2.91 表 2 两种AI软件及两种AI软件的联合对结节检出率的差异
Table 2 The differences in nodule detection rate between the two artificial intelligence software and their combined effect
软件 N(%) 统计检验 $\chi^2 $ P Kappa 软件A-人工阅片 445(92.1) 25.519 0.000 0.213 软件B-人工阅片 420(87.0) 16.472 0.000 0.150 软件A联合软件B-人工阅片 469(97.1) 102.697 0.000 0.439 表 3 两种AI软件对不同类型结节的检出情况
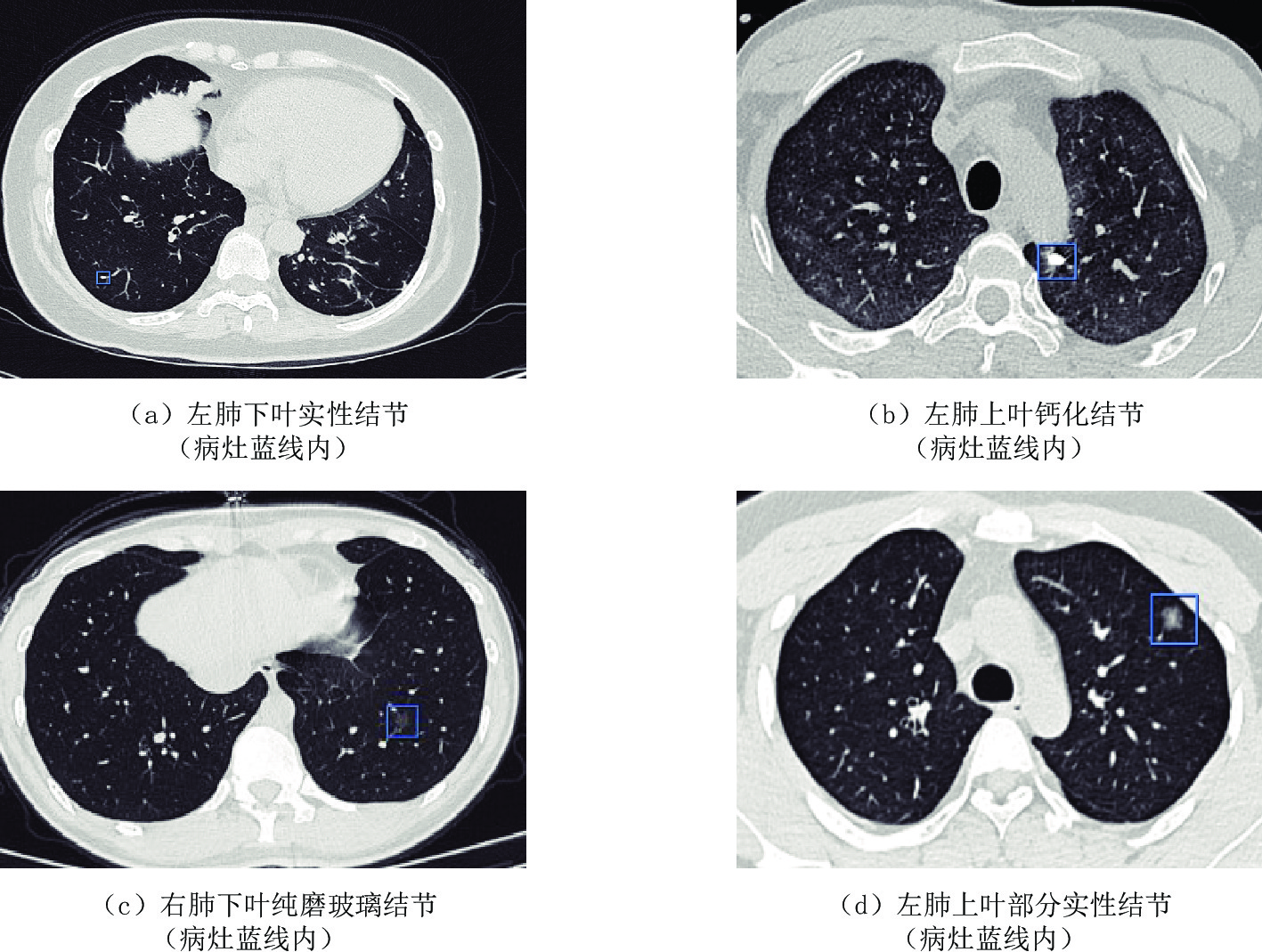
Table 3 The detection of different types of nodules by the two artificial intelligence software
变量 N 结节检测软件 P 软件A(%) 软件B(%) 实性结节 295 279(94.6) 254(86.1) 0.030 部分实性结节 6 6(100.0) 3(50.0) 0.000 纯磨玻璃结节 68 56(82.4) 63(92.6) 0.079 钙化结节 114 104(91.2) 100(87.7) 0.098 表 4 两种AI软件及两种AI软件联合识别不同类型结节的差异
Table 4 The differences between the two artificial intelligence software and their combined effect in identifying different types of nodules
变量 实性结节 部分实性结节 纯磨玻璃结节 钙化结节 $\chi^2 $ P $\chi^2 $ P $\chi^2 $ P $\chi^2 $ P 软件A-人工阅片 10.693 0.001 - 0.538 0.030 0.862 14.809 0.000 软件B-人工阅片 0.800 0.371 - 0.182 6.741 0.009 0.556 0.456 软件A联合软件B-人工阅片 0.381 0.537 - 0.464 0.271 0.603 0.000 1.000 注:-为Fisher确切概率法没有相应的统计量。 -
[1] 中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J]. 中华医学杂志, 2021,101(23): 1725−1757. doi: 10.3760/cma.j.cn112137-20210207-00377 [2] LEIGH J, COLLABORATION G B O D C. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life years for 29 cancer groups, 1990 to 2017[J]. JAMA Oncology, 2019, 5(12): 1749−1768. DOI: 10.1001/jamaoncol.2019.2996.
[3] YUAN S, WEI Y, ZHAO D. Computer-aided lung nodule recognition by SVM classifier based on combination of random undersampling and SMOTE[J]. Computational and Mathematical Methods in Medicine, 2015: 1−13. DOI: 10.1155/2015/368674.
[4] AZUMA M, NAKADA H, TAKEI M, et al. Detection of acute rib fractures on CT images with convolutional neural networks: Effect of location and type of fracture and reader's experience[J]. Emergency Radiology, 2022, 29(2): 317−328. DOI: 10.1007/s10140-021-02000-6.
[5] MASSALHA S, CLARKIN O, THORNHILL R, et al. Decision support tools, systems, and artificial intelligence in cardiac imaging[J]. Canadian Journal of Cardiology, 2018, 34(7): 827−838. DOI: 10.1016/j.cjca.2018.04.032.
[6] SHAFFIE A, SOLIMAN A, FRAIWAN L, et al. A generalized deep learning-based diagnostic system for early diagnosis of various types of pulmonary nodules[J]. Technology in Cancer Research & Treatment, 2018, 17: 1533033818798800.
[7] 中华医学会放射学分会, 中国食品药品检定研究院, 国家卫生健康委能力建设与继续教育中心, 等. 胸部CT肺结节数据集构建及质量控制专家共识[J]. 中华放射学杂志, 2021,55(2): 104−110. DOI: 10.3760/cma.j.cn112149-20200713-00915. Chinese Society of Radiology Chinese Medical Association, National Institutes for Food and Drug Control, National Health Commission Capacity Building and Continuing Education Center, et al. Expert consensus on the construction and quality control of thoracic CT datasets for pulmonary nodules[J]. Chinese Journal of Radiology, 2021, 55(2): 104−110. DOI: 10.3760/cma.j.cn112149-20200713-00915. (in Chinese).
[8] HASSANZADEH T, ESSAM D, SARKER R. Evolutionary deep attention convolutional neural networks for 2D and 3D medical image segmentation[J]. Journal of Digital Imaging, 2021, 34(6): 1387−1404. DOI: 10.1007/s10278-021-00526-2.
[9] 张正华, 蔡雅倩, 韩丹, 等. 人工智能与不同级别医师对肺结节检出效能的对照研究[J]. 中国医学影像学杂志, 2020,28(9): 662−665. DOI: 10.3969/j.issn.1005-5185.2020.09.005. ZHANG Z H, CAI Y Q, HAN D, et al. Artificial intelligence and various levels of physicians in detection of pulmonary nodules: A comparative study[J]. Chinese Journal of Medical Imaging, 2020, 28(9): 662−665. DOI: 10.3969/j.issn.1005-5185.2020.09.005. (in Chinese).
[10] TSUTANI Y, MIYATA Y, NAKAYAMA H, et al. Prognostic significance of using solid versus whole tumor size on high-resolution computed tomography for predicting pathologic malignant grade of tumors in clinical stage IA lung adenocarcinoma: A multicenter study[J]. The Journal of Thoracic and Cardiovascular Surgery, 2012, 143(3): 607−612. DOI: 10.1016/j.jtcvs.2011.10.037.
[11] LEE H J, GOO J M, LEE C H, et al. Nodular ground-glass opacities on thin-section CT: Size change during follow-up and pathological results[J]. Korean Journal of Radiology, 2007, 8(1): 22−31. DOI: 10.3348/kjr.2007.8.1.22.
[12] KANG G X, LIU K, HOU B B, et al. 3D multi-view convolutional neural networks for lung nodule classification[J]. Plos One, 2017, 12(11): e0188290. DOI: 10.1371/journal.pone.0188290.
[13] SHIGEFUKU S, SHIMADA Y, HAGIWARA M, et al. Prognostic significance of ground-glass opacity components in 5-year survivors with resected lung adenocarcinoma[J]. Annals of Surgical Oncology, 2021, 28(1): 148−156. DOI: 10.1245/s10434-020-09125-x.
[14] MENG Y, LIU C L, CAI Q, et al. Contrast analysis of the relationship between the HRCT sign and new pathologic classification in small ground glass nodule-like lung adenocarcinoma[J]. Radiology Medical, 2019, 124(1): 8−13. DOI: 10.1007/s11547-018-0936-x.
[15] 刘凯, 张荣国, 涂文婷, 等. 深度学习技术对胸部X线平片亚实性结节的检测效能初探[J]. 中华放射学杂志, 2017,51(12): 918−921. DOI: 10.3760/cma.j.issn.1005-1201.2017.12.006. LIU K, ZHANG R G, TU W T, et al. A preliminary investigation on pulmonary subsolid nodule detection using deep learninb gmethods from chest X-rays[J]. Chinese Journal of Radiology, 2017, 51(12): 918−921. DOI: 10.3760/cma.j.issn.1005-1201.2017.12.006. (in Chinese).
[16] 李欣菱, 郭芳芳, 周振, 等. 基于深度学习的人工智能胸部CT肺结节检测效能评估[J]. 中国肺癌杂志, 2019,22(6): 336−340. DOI: 10.3779/j.issn.1009-3419.2019.06.02. LI X L, GUO F F, ZHOU Z, et al. Performance of deep-learning-based artificial intelligence on detection of pulmonary nodules in chest CT[J]. Chinese Journal of Lung Cancer, 2019, 22(6): 336−340. DOI: 10.3779/j.issn.1009-3419.2019.06.02. (in Chinese).
[17] 刘娜, 赵正凯, 邹佳瑜, 等. 基于人工智能的胸部CT肺结节检出及良恶性诊断效能评估[J]. CT理论与应用研究, 2021,30(6): 709−715. DOI: 10.15953/j.1004-4140.2021.30.06.06. LIU N, ZHAO Z K, ZOU J Y, et al. Evaluation of detection and diagnostic efficiency of pulmonary nodules by chest CT based on artificial intelligence[J]. CT Theory and Applications, 2021, 30(6): 709−715. DOI: 10.15953/j.1004-4140.2021.30.06.06. (in Chinese).
[18] 王祥, 李清楚, 邵影, 等. 基于三维卷积神经网络肺结节深度学习算法模临床效能初步评估[J]. 放射学实践, 2019,34(9): 942−946. DOI: 10.13609/j.cnki.1000-0313.2019.09.002. WANG X, LI Q C, SHAO Y, et al. A preliminary clinical evaluation of a 3D convolutional neural network based deep learning system[J]. Radiologic Practice, 2019, 34(9): 942−946. DOI: 10.13609/j.cnki.1000-0313.2019.09.002. (in Chinese).
[19] 左玲子, 黄艳. 人工智能在体检肺CT中检出的假阳性结节研究[J]. 中国医疗设备, 2021,36(10): 177−180. DOI: 10.3969/j.issn.1674-1633.2021.10.041. ZUO L Z, HUANG Y. Study of false positive nodules detected by artificial intelligence in lung CT examination[J]. China Medical Devices, 2021, 36(10): 177−180. DOI: 10.3969/j.issn.1674-1633.2021.10.041. (in Chinese).



 下载:
下载: