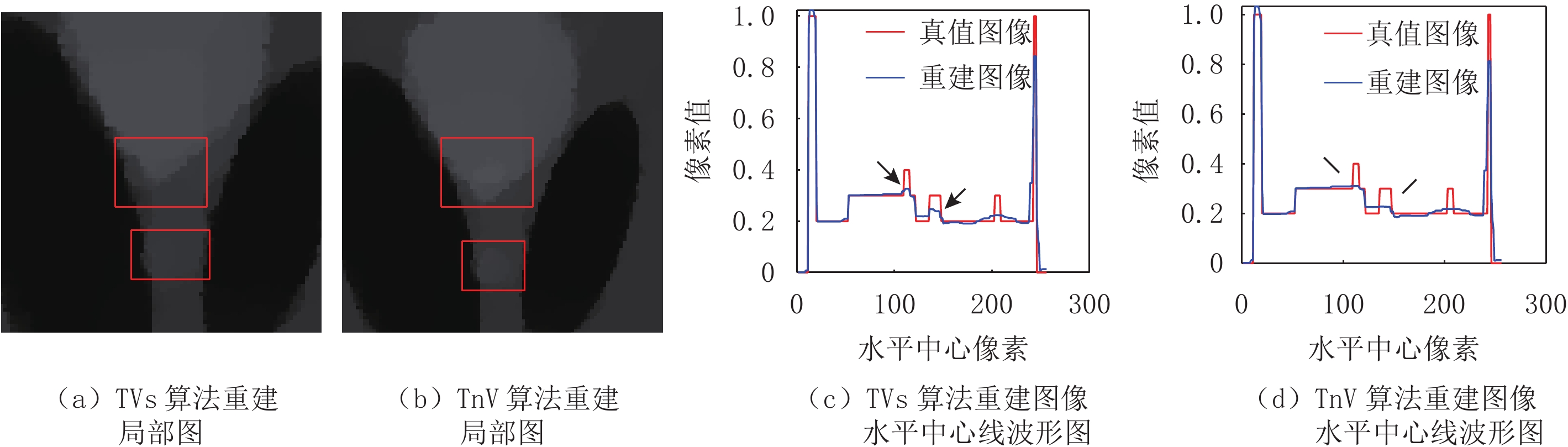
Nuclear TV Multi-channel Image Reconstruction Algorithm Based on Chambolle-pock Framework
-
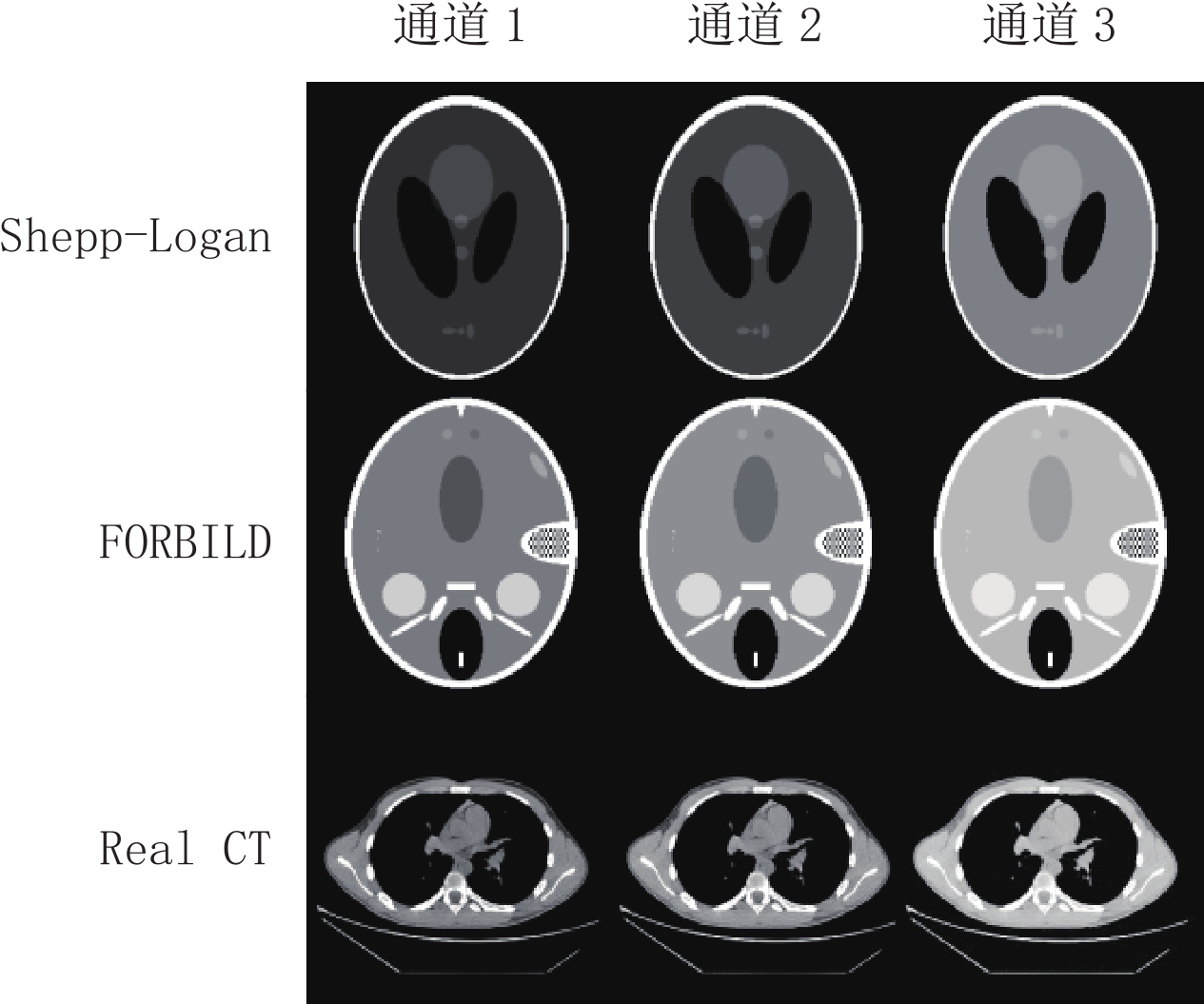
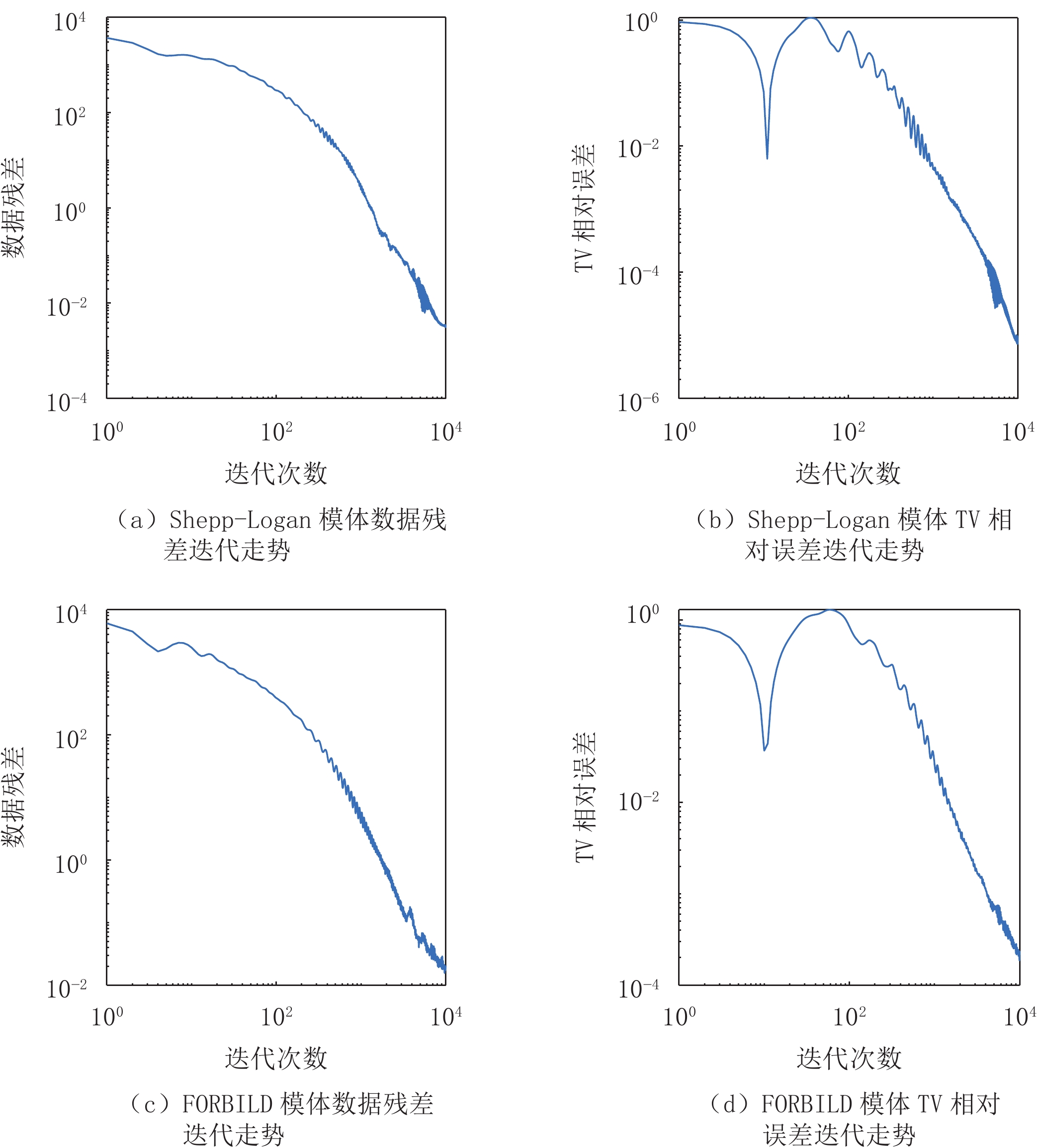
摘要: 总变差最小化算法是一种基于压缩感知理论的图像重建算法,能够从稀疏投影或含噪投影数据中高精度地重建图像,已经被广泛应用于计算机断层成像、磁共振成像、电子顺磁共振成像。能谱CT、T1或T2加权的MRI及EPRI均属于多通道成像。逐通道TV算法可以实现较高精度的图像重建,然而忽略了各通道图像之间的相似性。核TV算法是一种考虑了通道间图像相似性的TV类算法,可以实现高精度图像重建。面向多通道图像重建,以CT重建为研究范例,本文提出一种Chambolle-Pock算法框架下的核TV多通道图像重建算法。通过仿真模体和真实CT图像模体的重建实验,验证算法的正确性,分析算法的收敛性,探索算法参数对收敛速率的影响,评估算法的稀疏重建能力及含噪投影重建能力。结果表明,相对于逐通道TV算法,所提算法可以取得更高的重建精度。核TV算法是一种高精度的多通道图像重建算法,可以应用于各种成像模态的多通道重建场合。Abstract: Total variation (TV) minimum algorithm is an image reconstruction algorithm based on compressed sensing theory, which can realize the reconstruction of images with high accuracy from sparse projection or noisy projection data and has been widely used in computed tomography (CT), magnetic resonance imaging (MRI) and electronic paramagnetic resonance imaging (EPRI). Energy spectrum CT, T1 or T2 weighted MRI and EPRI both belong to multi-channel imaging. The channel-by-channel TV algorithm can achieve high-precision image reconstruction, but it ignores the similarity among the images of each channel while Nuclear TV algorithm is a TV algorithm that considers the image similarity among channels, and can realize high-precision image reconstruction. For multi-channel image reconstruction, taking CT reconstruction as an example, this paper proposes a nuclear TV multi-channel image reconstruction algorithm based on the framework of Chambolle-pock algorithm. Through the reconstruction experiments of simulated phantom and real CT image phantom, the accuracy of the algorithm is verified, the convergence of the algorithm is analyzed, the influence of algorithm parameters on the convergence rate is explored, and the sparse reconstruction ability and noisy projection reconstruction ability of the algorithm are evaluated. The experimental results show that the proposed algorithm can achieve higher reconstruction accuracy than the channel-by-channel TV algorithm. Nuclear TV algorithm is a high-precision multi-channel image reconstruction algorithm, which can be applied to multi-channel reconstruction of various imaging modes.
-
骨质疏松症(osteoporosis,OP)是一种以骨量低下、骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病[1]。OP按病因可分为原发性和继发性两大类,常见于绝经后女性和老年男性。我国是全球老年人口最多的国家,目前我国骨质疏松症患者数约为9千万,其中女性约7千万[2]。骨质疏松症的严重后果是容易引发骨质疏松性骨折(或称脆性骨折),严重影响生活质量。骨密度(bone mineral density,BMD)可通过骨密度测量技术客观、如实的反映骨量在程度上的变化,对OP的临床诊断、疗效评估及防治具有重要作用。
本研究通过应用定量CT(quantitative CT,QCT)对佛山市健康成年居民椎体BMD进行检测,分析骨量变化与性别和年龄的关系,探讨佛山地区成年居民骨密度数据参考值范围。
1. 资料与方法
1.1 一般资料
2021年10月至2023年3月期间在佛山市中医院健康管理中心进行胸部CT/低剂量胸部CT平扫行肺结节筛查联合QCT骨密度测量检查者共3819例,根据健康管理中心数据库录入资料,所选符合条件的健康成年人1065例。纳入标准:①20周岁以上的健康体检者;②佛山市常住人口,居住时间至少10年以上(含10年)。排除标准:①患有系统性代谢性疾病,椎体骨肿瘤或陈旧性骨折的病患;②上腹部扫描范围内有金属植入物的病患。其中男性648例,女性417例,年龄20~89岁。
按性别、年龄分组,每10岁为1个年龄段:20~29岁62例(男41例,女21例);30~39岁157例(男93例,女64例);40~49岁265例(男168例,女97例);50~59岁338例(男211例,女127例);60~69岁146例(男79例,女67例);70~79岁65例(男40例,女25例);80~89岁32例(男16例,女16例)。
1.2 检测方法
(1)质量控制:在数据采集前和项目进行中采用校准体模(Model 4)对CT机进行质控分析校准。体模扫描范围包括体模上端1 cm处至下端1 cm处;图像重建的参数是120 kV,1 mm层厚;标准重建算法,50 cm SFOV。
(2)QCT扫描规范:按常规/低剂量胸部CT扫描摆位,严格执行辐射防护要求做好体检者辐射防护。扫描范围包含肺尖至第1腰椎下缘,患者仰面躺卧,双手交叉上举,于吸气末单次屏气扫描。
(3)QCT结果分析与测量:图像上传QCT工作站,通过Mindways QCT Pro 6.1v软件行椎体骨密度测量,测量时选择第12胸椎和第1腰椎椎体的正中层面的骨松质区域,注意避开骨皮质、骨岛和椎体后静脉区(图1),测量结果保存在工作站数据库。如果发现第12胸椎或第1腰椎椎体有明显骨折或其他病理改变(如骨肿瘤、骨水泥等),则不宜进行骨密度测量,需要做好标记。
1.3 诊断依据
按《中国定量CT(QCT)骨质疏松症诊断指南(2018)》及《骨质疏松的影像学与骨密度诊断专家共识(2020)》所定标准进行诊断[3-4]。BMD>120 mg/cm3为骨密度正常,BMD=80~120 mg/cm3范围内为低骨量,BMD<80 mg/cm3为骨质疏松,BMD<80 mg/cm3且伴一处或多处的脆性骨折,为严重骨质疏松。
1.4 统计学方法
数据进行初步整理后,采用SPSS 22.0及Graph Pad 8.0.1软件,计数资料进行卡方检验,计量资料进行正态性检验,正态性分布的计量资料采用“平均值±标准差”
$(\bar x \pm s)$ 的形式表示,采用方差分析方法对多组间均值进行比较,采用LSD法进行组间两两比较,采用$\chi^2 $ 检验统计发病率的比较,采用Spearman法对等级资料进行相关分析,检验水准α=0.05。2. 结果
2.1 男女间各年龄段体检者的BMD比较
20~29岁、30~39岁、40~49岁3个年龄段男女之间BMD存在显著性差异,女性BMD显著高于男性,60~69岁;70~79岁两个年龄段男女之间BMD存在显著性差异,男性BMD显著高于女性。在40~49岁、50~59岁、60~69岁、70~79岁男性组及30~39岁、40~49岁、50~59岁、60~69岁女性组中,同一性别不同年龄段间的BMD比较差异也有统计学意义,且随年龄的增长呈下降趋势(表1)。
表 1 1065例健康成年人胸部CT体检者椎体BMD分析($\bar x \pm s $ ,mg/cm3)Table 1. Analysis of vertebral BMD in 1065 healthy adults undergoing chest CT examination年龄组/岁 男性 女性 t P 人数/例 BMD 人数/例 BMD 20~29 41 163.31±26.28 21 188.38±28.79 -3.442 0.001 30~39 93 160.62±26.86 64 172.42±29.21b -2.610 0.010 40~49 168 145.47±29.67a 97 158.05±32.50b -3.211 0.001 50~59 211 127.1±28.72a 127 127.95±38.05b -0.215 0.830 60~69 79 107.54±29.85a 67 92.36±25.64b 3.263 0.001 70~79 40 96.11±23.60a 25 84.43±18.11 2.114 0.038 80~89 16 91.51±26.78 16 77.38±17.21 1.775 0.086 F 56.893 74.37 P <0.001 <0.001 注:a表示在男性组中,该年龄段与前一年龄段比较P<0.05;b表示在女性组中,该年龄段与前一年龄段比较P<0.05。 2.2 各年龄段BMD正常、低骨量、骨质疏松及严重骨质疏松发病率比较
在男性组和女性组中,不同年龄段之间的OP发病率差异均有统计学意义,(表2)。采用Spearman法对等级资料进行相关分析,发现男女性年龄与OP发病率均呈正相关(r男=0.517,r女=0.636)。
表 2 1065例健康成年人胸部CT体检者骨质疏松筛查结果(例(%))Table 2. Screening results of osteoporosis in 1065 healthy adults undergoing chest CT examination年龄组/岁 男性 女性 正常 低骨量 OP 严重OP 正常 低骨量 OP 严重OP 20~29 38(92.68) 3(7.32) 0(0.00) 0(0.00) 21(100.00) 0(0.00) 0(0.00) 0(0.00) 30~39 90(96.77) 3(3.23) 0(0.00) 0(0.00) 61(95.31) 3(4.69) 0(0.00) 0(0.00) 40~49 137(81.55) 29(17.26) 1(0.60) 1(0.60) 85(87.63) 11(11.34) 0(0.00) 1(1.03) 50~59 125(59.24) 68(32.23) 13(6.16) 5(2.37) 68(53.54) 41(32.28) 12(9.45) 6(4.72) 60~69 25(31.65) 39(49.37) 13(16.46) 2(2.53) 8(11.94) 35(52.24) 22(32.84) 2(2.99) 70~79 4(10.00) 23(57.50) 11(27.50) 2(5.00) 1(4.00) 11(44.00) 10(40.00) 3(12.00) 80~89 2(12.50) 7(43.75) 4(25.00) 3(18.75) 0(0.00) 4(25.00) 10(62.50) 2(12.50) $\chi^2 $ 225.201 235.748 P <0.001 <0.001 3. 讨论
3.1 BMD测量的必要性及意义
随着我国社会人口老龄化加剧,OP作为一种中老年人最常见的全身性慢性骨骼疾病,越来越加重社会和医疗负担,已成为现阶段重要的公共卫生健康问题。OP患病率高危害大,但知晓率、诊断率、治疗率低(“一高三低”)是我国社会OP的防治现状[2,5];不同地区间及城乡间对OP诊疗水平更是存在着较大的差异[6-7]。原发性OP的基本病理改变是由于骨量不断减少而引起的一种全身慢性进行性骨结构退行性病变,包括绝经后OP(Ⅰ型)、老年OP(Ⅱ型)和特发性OP(包括青少年型),其发病机制复杂,近年来,国内外学者取得的研究新进展大大丰富了原发性OP发病机制[2,8]。
骨质疏松性骨折(又称脆性骨折),是指受到轻微外伤(接近站立高度或更低的高度跌倒)时,甚至在没有明显外伤的情况下即发生的骨折,是OP的严重临床后果。骨质疏松性骨折发生后,再骨折的风险显著增高,导致较高的致死率与致残率[9]。骨质疏松性骨折的好发部位包括脊柱椎体、腕部、股骨近端、肱骨近端等[10-11]。
骨密度(BMD)是指单位面积或单位体积所含的骨量。BMD测量技术是一种无创性定量测量人体骨矿含量、骨密度和体质成份的方法。椎体BMD测量能敏感、客观反映骨量变化,并作为诊断、防治OP的主要依据。当椎体局部BMD增高,或远超过该年龄段BMD或邻近正常椎体BMD,提示椎体骨挫伤、压缩骨折或成骨性病变;当椎体局部BMD降低,则提示骨质疏松或骨质破坏等椎体病变。椎体BMD对脊柱病变术前指导及术后疗效评估亦有重要的临床意义[12]。目前我国已经将骨密度检测项目纳入40岁以上人群常规体检内容[2]。
3.2 BMD的测量方法
双能X线(dual X-ray absorptiometry,DXA)BMD测量是目前认知度、认可度及临床应用最高的骨密度测量方法,DXA测量的是面积骨密度(area bone mineraldensity,aBMD),单位为g/cm2。目前国内外公认的OP诊断标准是以DXA测量的结果为依据[4]。DXA通常在椎体、股骨近端或桡骨远端等部位进行测量。DXA对骨密度水平的判断采用的是T值,须根据同种族同性别的正常参考值范围进行计算。
使用DXA诊断骨质疏松的标准由世界卫生组织(World Health Organization,WHO)专家组制定,T值≥-1.0 SD为正常,-2.5<T值<-1.0 SD为低骨量,T值≤-2.5 SD为骨质疏松,T值≤-2.5 SD且伴脆性骨折为严重骨质疏松;我国的骨质疏松学术组织基于2018年我国疾病控制中心组织的大范围多中心流行病学调查或大样本健康人群数据[13-15],也推荐该标准适用于中国绝经后女性和老年男性。对于儿童、青少年、绝经前女性以及50岁以下男性等人群,则采用中国人群数据库计算出的Z值对骨密度水平进行判断,Z值≤-2.0 SD(标准差)可诊断为“低于同年龄段预期范围”或低骨量[4,16-17]。由于受被检者的人种、年龄、性别、区域及检测方法等多种因素影响,以及采用不同的数据库,用DXA诊断骨质疏松症时,国内外报道OP发病率为14%~60%[18-19],会出现比较大的差距。而且,由于DXA是平面投影成像,其所测出的aBMD易受身高体重、脊柱侧弯、脊柱退变和血管钙化等因素影响,BMD测量的准确性降低,导致假阳性出现[20]。
定量CT(QCT)是一种经体模校准后,利用CT容积数据进行精准测量和定量分析的方法,可应用于骨密度、肝脏脂肪、体部脂肪及肌肉的测量,目前主要用于骨密度测量。QCT可以按需测量不同部位的骨密度,其中椎体和股骨上端最为常用。对于椎体,QCT测量的是椎体中央骨松质的体积骨密度,其测量的是真正的体积骨密度(volumetric bone mineraldensity,vBMD),单位为g/cm3,可敏感反映早期松质骨的丢失状况,且其测量结果不受身高体重、脊柱侧弯、退变和血管钙化等因素的影响[3]。近年来,随着QCT的技术优势和CT技术的快速发展,利用QCT开展骨密度领域研究和临床应用越来越受到关注。
目前的QCT诊断标准是国际临床骨密度学会(International Society for Clinical Densitometry,ISCD)和美国放射学院(American College of Radiology,ACR)分别于2007年和2018年提出,根据美国 Mindways QCT系统,采用120 kV管电压测量椎体骨密度结果数据制定的[21-22]。vBMD>120 mg/cm3为正常,80 mg/cm3≤vBMD≤120 mg/cm3为低骨量,vBMD<80 mg/cm3为骨质疏松,vBMD<80 mg/cm3且伴脆性骨折为严重骨质疏松。我国学者对QCT进行了积极探索、论证,建立了中国人群脊柱QCT正常参考值范围数据库,并认为此ISCD及ACR标准同样适用于中国人群骨质疏松症的诊断[23-24]。QCT如果单独使用,其辐射剂量高于DXA,研究证明低剂量胸部CT扫描与QCT相结合同样可以精准测量椎体骨密度[25-26],在健康管理中有较高的应用价值,因而建议在临床使用过程中,QCT扫描应尽量与临床CT扫描同步联合进行,而且推荐使用低剂量扫描技术[27-30]。
本研究通过对佛山市健康成年居民体检行常规/低剂量胸部CT平扫,应用QCT对胸12、腰1椎体BMD进行定量分析,探讨地区性BMD参考值范围。
3.3 BMD、OP与年龄、性别的关系
(1)表1显示,男女性BMD均随年龄的增长呈下降趋势,且女性下降总体幅度大于男性。在40~49岁、50~59岁、60~69岁、70~79岁男性组及30~39岁、40~49岁、50~59岁、60~69岁女性组中,同性别不同年龄段的BMD比较差异有统计学意义,说明女性骨量流失速度比男性提前10年,此与陈文清等[31]研究相符,考虑与女性怀孕哺乳期导致体内骨钙流失等有关。在70~79岁,女性骨量流失较男性有所减缓。在女性70~79岁年龄段及男性80~89岁年龄段,男女性BMD分别与各自前一年龄段比较均无明显区别,且均已接近OP临界值,亦说明女性BMD降低到病理临界值较男性提前10年。而80~89岁年龄段,男女性之间BMD及与各自前1年龄段比较均无明显区别。
(2)男女性BMD均在20~29岁达到峰值,在20~29岁、30~39岁、40~49岁年龄段男女性均随年龄增加BMD下降,女性的下降速度及幅度大于同年龄段男性,但女性的BMD仍高于同年龄组男性,考虑与此年龄段的女性为即将到来的生育、哺乳打下良好的基础作出充分准备有关。年龄低于40岁的男女性均未发现OP或严重OP。
(3)表1与表2显示,50~59岁年龄段男、女性BMD分别为127.1及127.95,此年龄段为女性绝经期前后,男、女性BMD数字相近,差异无统计学意义。在此年龄段后,男、女性BMD均出现下降,女性BMD下降更为明显,导致同年龄段的女性的BMD均低于男性。从40~49岁年龄段开始,随年龄增长,OP及严重OP在男、女性各年龄段均开始出现且发病率逐步上升。从50~59岁年龄段开始,女性OP及严重OP发病率均高于同年龄组男性。在60~69岁年龄段,男、女BMD分别为107.54及92.36,均达到低骨量诊断标准;此年龄段男、女OP发生率分别为16.46% 及32.84%,女性约是男性的两倍,且分别较同性别上一年龄段大幅增长。在80~89岁年龄段,女性BMD低于80,已全部达到OP;而男性的BMD仍在低骨量范围,但亦接近OP的诊断标准。
本研究采用的是Mindways公司的校准体模(Model 4)及QCT Pro 6.1v骨质密度测量软件,能够如实精准的反映BMD。研究显示,随年龄的增长,受试者的BMD逐渐下降,低骨量、OP及严重OP的发病率也逐渐上升,此结果与大多数文献报道的年龄与骨密度呈负相关、年龄与OP发病率呈正相关结论相符[32-33]。
4. 小结
本研究旨在初步探讨佛山地区成年居民骨密度数据参考值范围。研究发现本地区成年居民骨密度及骨质疏松发病率与全国水平相当。研究结果提示,对于40岁以上的人群,尤其是无症状人群,可以通过将QCT与胸部CT体检结合起来,进行骨密度测量,及时发现骨量减低的程度,以利于临床针对骨质疏松发展的不同阶段采取相应的预防和治疗措施,降低因骨质疏松引起的脆性骨折等潜在风险。
本研究不足之处:①未将20岁以下及90岁以上成年居民纳入样本,此年龄段人群参与胸部CT健康体检的样本量极少故未纳入;②未开展多中心研究,样本量相对局限。后续将继续针对不足之处进一步研究,为完善及建立本地区人群骨密度数据库提供更为可靠的理论支持。
-
表 1 TnV-CP算法伪代码
Table 1 The TnV-CP algorithm pseudocode
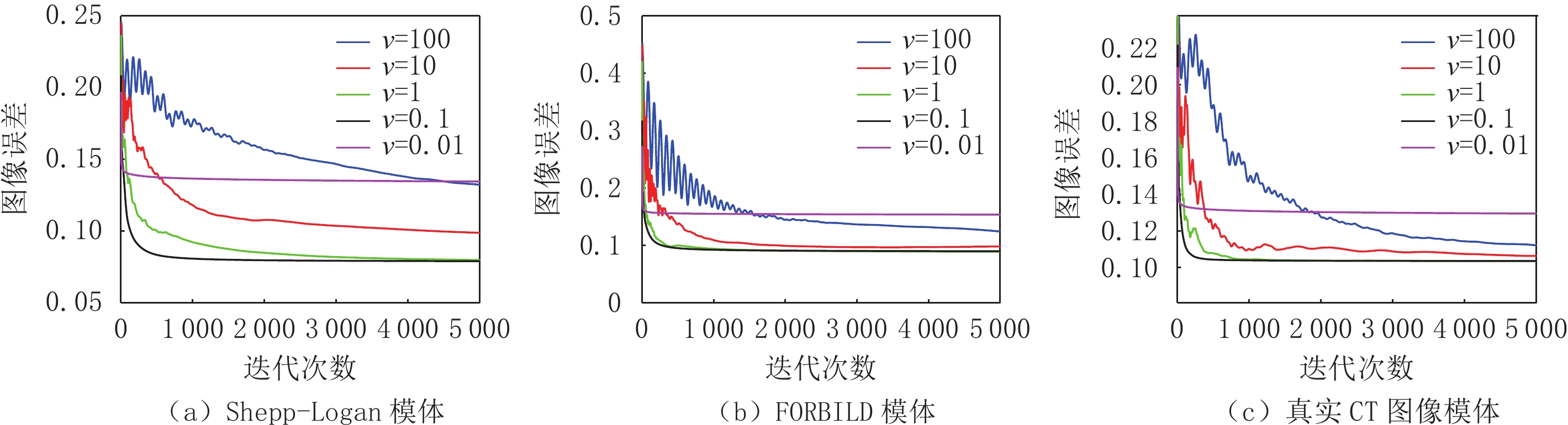
输入: $ \boldsymbol{g},\boldsymbol{A},\boldsymbol{D},\epsilon ;\mathrm{\nu } $ 1) $L={\parallel \frac{\boldsymbol{A} }{\mathrm{\nu }\boldsymbol{D} }\parallel }_{\mathrm{S}\mathrm{V} },\;\sigma =\frac{1}{L},\;\tau =\frac{1}{L},\;\theta =1,\;n=0$ 2) ${\boldsymbol{u} }_{0}=0,\;{\stackrel{-}{\boldsymbol{u} } }_{0}=0,\;{\boldsymbol{p} }_{0}=0$ 3) $ \mathrm{r}\mathrm{e}\mathrm{p}\mathrm{e}\mathrm{a}\mathrm{t} $ 4) $ {\boldsymbol{p}}_{n+1}=\mathrm{max}(\left|\right|{\boldsymbol{p}}_{n}+\sigma (\boldsymbol{A}\overline{\boldsymbol{u}}-\boldsymbol{g})|{|}_{2}-\sigma \epsilon ,0)\cdot ({\boldsymbol{p}}_{n}+\sigma (\boldsymbol{A}\overline{\boldsymbol{u}}-\boldsymbol{g}\left)\right)/\left|\right|{\boldsymbol{p}}_{n}+\sigma (\boldsymbol{A}\overline{\boldsymbol{u}}-\boldsymbol{g})|{|}_{2} $ 5) $ {\mathbf{z}(\mathrm{i},\mathrm{j})}_{\mathrm{n}+1}=\boldsymbol{U}{\sum }_{\mathrm{P}}{\boldsymbol{V}}^{\mathrm{T}} $ 6) $\theta =\sqrt{\mathrm{\nu }/(\mathrm{\nu }+2\tau )},\;\tau =\theta *\tau ,\;\sigma =\sigma /\theta$ 7) $ {\boldsymbol{u}}_{n+1}={\boldsymbol{u}}_{n}-\tau {\boldsymbol{A}}^{\mathrm{T}}{\boldsymbol{p}}_{n+1}-\tau \mathrm{\upsilon }{\boldsymbol{D}}^{\mathrm{T}}{\boldsymbol{z}}_{n+1} $ 8) $ {\stackrel{-}{\boldsymbol{u}}}_{n+1}={\boldsymbol{u}}_{n+1}+\theta ({\boldsymbol{u}}_{n+1}-{\boldsymbol{u}}_{n}) $ 9) $ n=n+1 $ 10) $\mathrm{u}\mathrm{n}\mathrm{t}\mathrm{i}\mathrm{l}\;n\ge N$ 表 2 两种算法重建Shepp-Logan模体在不同稀疏角度下评估参数的比较
Table 2 Comparison of evaluation parameters of Shepp-Logan phantom reconstructed by two algorithms under different sparsity angles
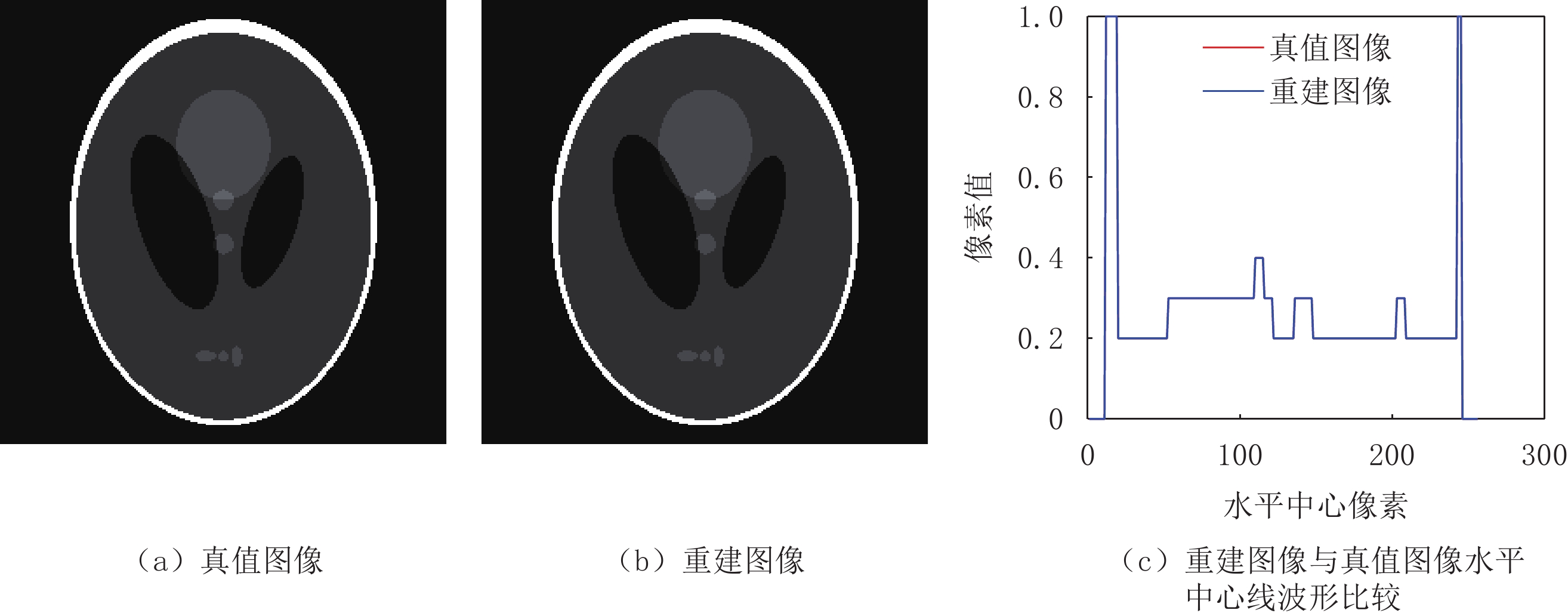
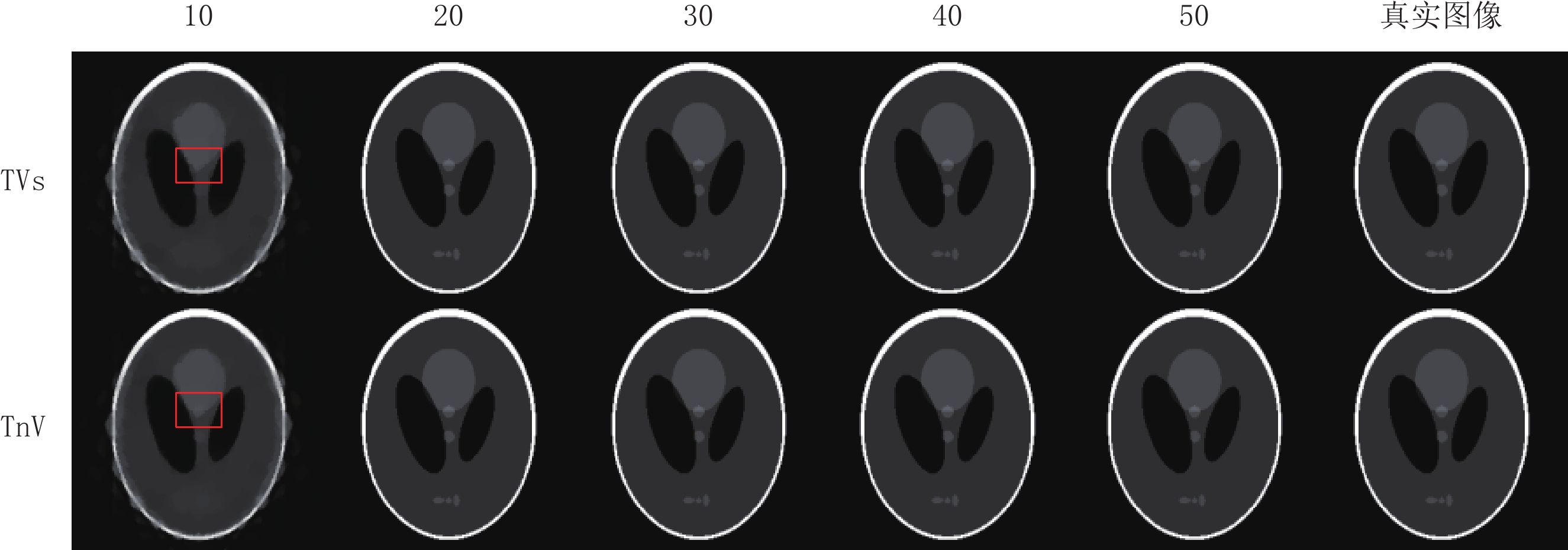
评估参数 算法 投影个数 10 20 30 40 50 RMSE TVs 0.079 0.002 6.626×10-7 4.881×10-7 4.764×10-7 TnV 0.067 1.214×10-6 6.584×10-7 4.651×10-7 4.585×10-7 SSIM TVs 0.798 0.999 1.000 1.000 1.000 TnV 0.831 1.000 1.000 1.000 1.000 表 3 两种算法重建FORBILD模体在不同稀疏角度下评估参数的比较
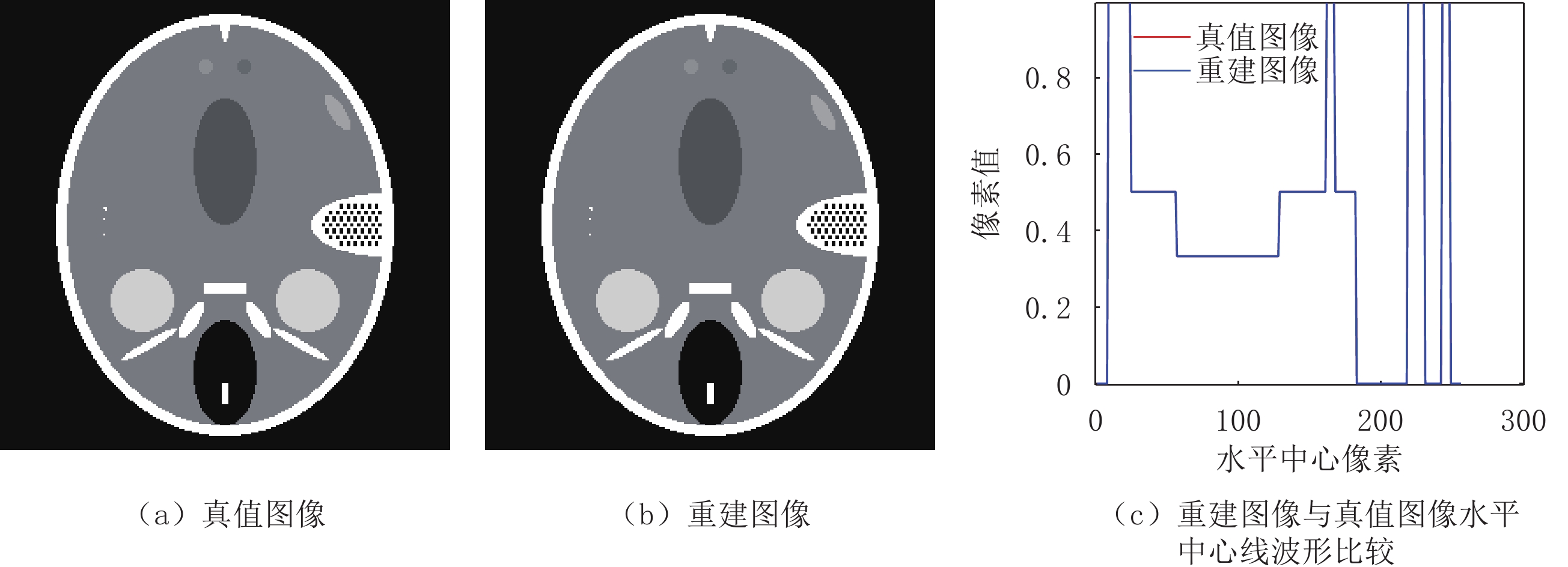
Table 3 Comparison of evaluation parameters between two algorithms in reconstructing FORBILD motifs under different sparse angles
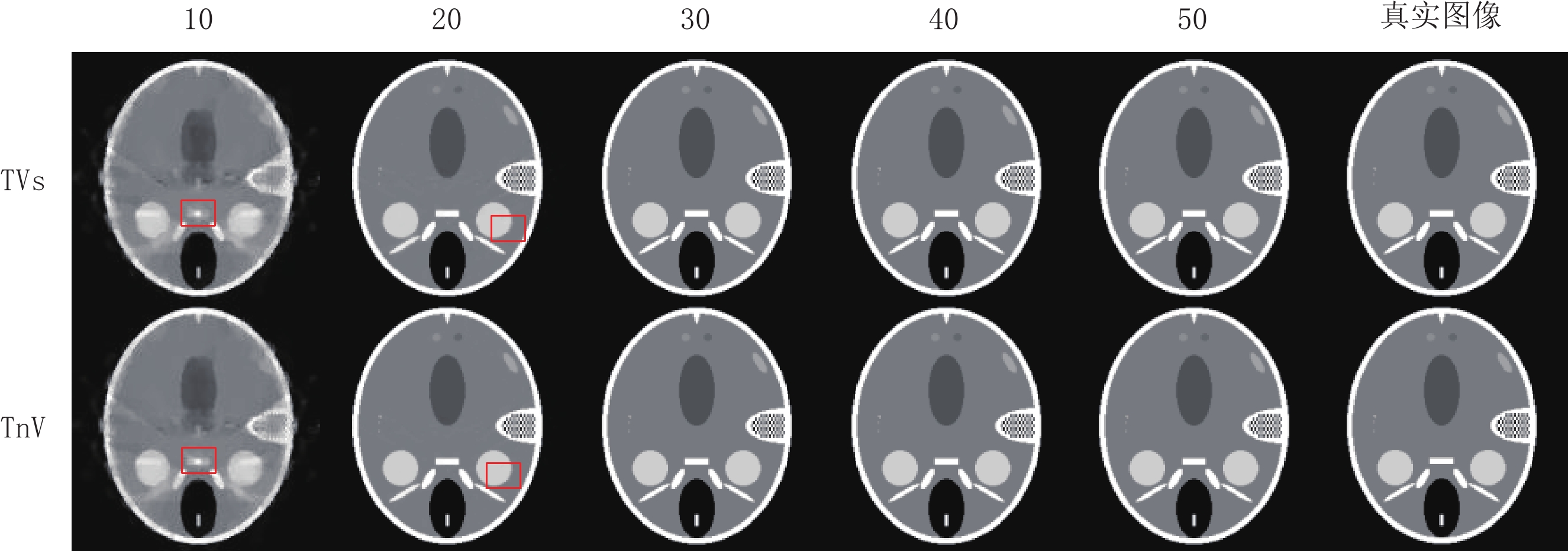
评估参数 算法 投影个数 10 20 30 40 50 RMSE TVs 0.101 0.022 2.022×10-6 1.311×10-6 1.129×10-6 TnV 0.090 0.014 1.484×10-6 1.256×10-6 1.034×10-6 SSIM TVs 0.700 0.981 1.000 1.000 1.000 TnV 0.736 0.992 1.000 1.000 1.000 表 4 两种算法重建真实CT模体在不同稀疏角度下评估参数的比较
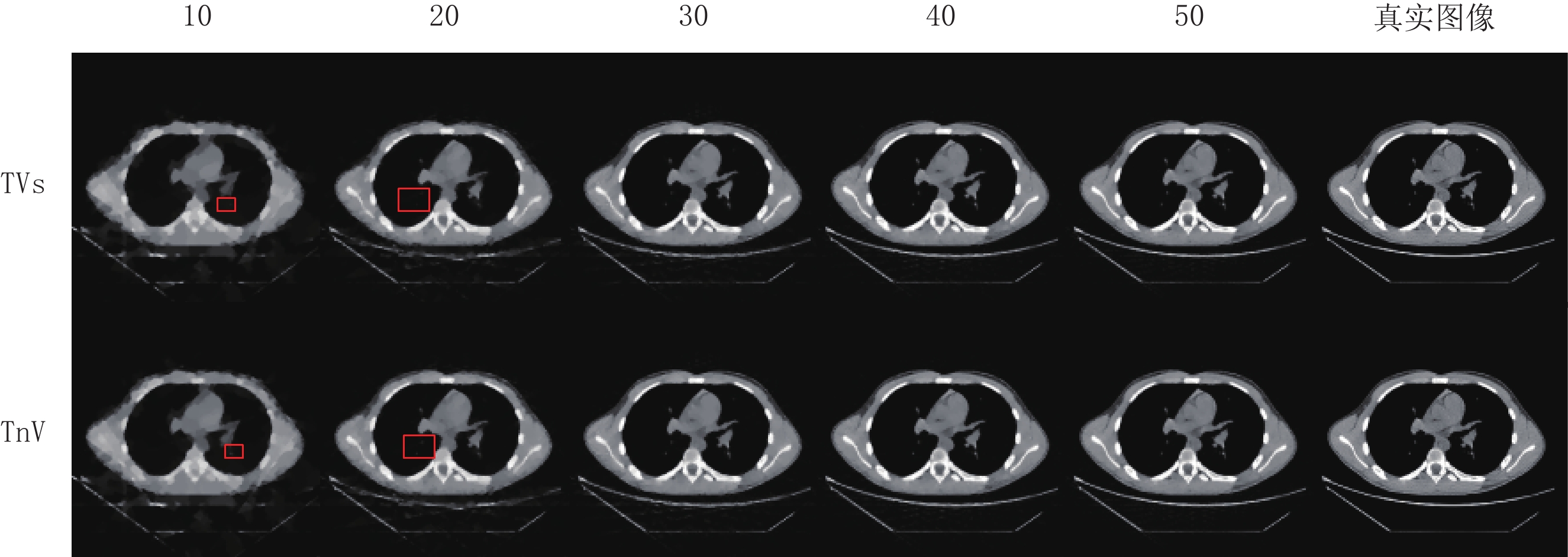
Table 4 Comparison of evaluation parameters between two algorithms in reconstructing real CT phantom under different sparsity angles
评估参数 算法 投影个数 10 20 30 40 50 RMSE TVs 0.104 0.072 0.054 0.043 0.035 TnV 0.099 0.069 0.052 0.041 0.034 SSIM TVs 0.593 0.748 0.840 0.894 0.923 TnV 0.617 0.764 0.850 0.901 0.927 表 5 两种算法重建Shepp-Logan模体在不同噪声强度下评估参数的比较
Table 5 Comparison of evaluation parameters of Shepp Logan phantom reconstructed by two algorithms under different noise intensity
评估参数 算法 噪声等级 30 dB 35 dB 40 dB 45 dB 50 dB RMSE TVs 0.035 0.025 0.018 0.012 0.008 TnV 0.032 0.023 0.017 0.011 0.007 SSIM TVs 0.958 0.980 0.989 0.994 0.997 TnV 0.967 0.982 0.990 0.995 0.998 PSNR TVs 29.090 31.910 34.840 38.460 42.270 TnV 29.930 32.590 35.470 39.110 42.920 表 6 两种算法重建FORBILD模体在不同噪声强度下评估参数的比较
Table 6 Comparison of evaluation parameters between two algorithms in reconstructing FORBILD phantom under different noise intensity
评估参数 算法 噪声等级 30 dB 35 dB 40 dB 45 dB 50 dB RMSE TVs 0.073 0.060 0.043 0.030 0.019 TnV 0.069 0.056 0.038 0.026 0.017 SSIM TVs 0.875 0.913 0.947 0.974 0.988 TnV 0.878 0.916 0.954 0.978 0.990 PSNR TVs 22.700 24.390 27.330 30.570 34.230 TnV 23.260 25.080 28.400 31.610 35.160 表 7 两种算法重建真实CT模体在不同噪声强度下评估参数的比较
Table 7 Comparison of evaluation parameters between two algorithms in reconstructing real CT phantom under different noise intensity
评估参数 算法 噪声等级 30 dB 35 dB 40 dB 45 dB 50 dB RMSE TVs 0.056 0.046 0.039 0.034 0.031 TnV 0.052 0.044 0.037 0.033 0.030 SSIM TVs 0.842 0.884 0.915 0.935 0.943 TnV 0.854 0.896 0.923 0.938 0.947 PSNR TVs 25.010 26.760 28.280 29.510 30.260 TnV 25.610 27.100 28.630 29.690 30.520 -
[1] PAN X C, SIDKY E Y, VANNIER M. Why do commercial CT scanners still employ traditional, filtered back-projection for image reconstruction?[J]. Inverse Problems, 2008, 25(12): 1230009.
[2] YU L, YU Z, SIDKY E Y, et al. Region of interest reconstruction from truncated data in circular cone-beam CT[J]. IEEE Transactions on Medical Imaging, 2006, 25(7): 869−881. doi: 10.1109/TMI.2006.872329
[3] CANDES E J, ROMBERG J, TAO T. Robust uncertainty principles: Exact signal reconstruction from highly incomplete frequency information[J]. IEEE Transactions on Information Theory, 2006, 52(2): 489−509. doi: 10.1109/TIT.2005.862083
[4] SIDKE E Y, KAO C M, PAN X C. Accurate image reconstruction from few-views and limited-angle data in divergent-beam CT[J]. Journal of X-ray Science & Technology, 2006, 14: 119−139.
[5] PAPAFITSOROS K, SCHOENLIEB C B, SENGUL B. Combined first and second order total variation inpainting using split bregman[J]. Image Processing on Line, 2013, 3: 112−136. doi: 10.5201/ipol.2013.40
[6] XI Y R, QIAO Z W, WANG W J, et al. Study of CT image reconstruction algorithm based on high order total variation - ScienceDirect[J]. Optik, 2020, 204: 163814−163814. doi: 10.1016/j.ijleo.2019.163814
[7] 闫慧文, 乔志伟. 基于ASD-POCS框架的高阶TpV图像重建算法[J]. CT理论与应用研究, 2021,30(3): 279−289. DOI: 10.15953/j.1004-4140.2021.30.03.01. YAN H W, QIAO Z W. High order TPV image reconstruction algorithm based on ASD-POCS framework[J]. CT Theory and Applications, 2021, 30(3): 279−289. DOI: 10.15953/j.1004-4140.2021.30.03.01. (in Chinese).
[8] NING F L, HE B J, WEI J. An algorithm for image reconstruction based on lp norm[J]. Acta Physica Sinica, 2013, 62: 174212−174212. doi: 10.7498/aps.62.174212
[9] 张海娇, 孔慧华, 孙永刚. 基于结构先验的加权NLTV能谱CT重建算法[J]. 光学学报, 2018,38(8): 334−342. ZHANG H J, KONG H H, SUN Y G. Weighted NLTV energy spectrum CT reconstruction algorithm based on structure prior[J]. Acta Optica Sinica, 2018, 38(8): 334−342. (in Chinese).
[10] DURAN J, MOELLER M, SBERT C, et al. Collaborative total variation: A general framework for vectorial TV models[J]. SIAM Journal on Imaging Sciences, 2015, 9(1): 116−151.
[11] RIGIE D S, RIVIèRE P J L. Joint reconstruction of multi-channel, spectral CT data via constrained total nuclear variation minimization[J]. Physics in Medicine & Biology, 2015, 60(5): 1741−1762.
[12] RIGIE D S, SANCHEZ A A, RIVIèRE P J L. Assessment of vectorial total variation penalties on realistic dual-energy CT data[J]. Physics in Medicine & Biology, 2017, 62(8): 3284−3298.
[13] QIAO Z W. A simple and fast ASD-POCS algorithm for image reconstruction[J]. Journal of X-ray Science and Technology, 2021, 29(3): 1−16.
[14] SIDKY E Y, PAN X C. Image reconstruction in circular cone-beam computed tomography by constrained, total-variation minimization[J]. Physics in Medicine & Biology, 2008, 53(17): 4777−4807.
[15] CHAMBOLLE A, POCK T. A first-order primal-dual algorithm for convex problems with applications to imaging[J]. Journal of Mathematical Imaging and Vision, 2011, 40(1): 120−145. doi: 10.1007/s10851-010-0251-1
[16] SIDKY E Y, J∅RGENSEN J H, PAN X C. Convex optimization problem prototyping for image reconstruction in computed tomography with the Chambolle-Pock algorithm[J]. Physics in Medicine & Biology, 2011, 57(10): 3065−3091.
[17] QIAO Z W, REDLER G, EPEL B, et al. A balanced total-variation-Chambolle-Pock algorithm for EPR imaging[J]. Journal of Magnetic Resonance, 2021, 328: 107009. doi: 10.1016/j.jmr.2021.107009
[18] CAI J, CAND E J, SHEN Z. A singular value thresholding algorithm for matrix completion[J]. SIAM Journal on Optimization, 2010.
[19] DUAN Y H, WEN R P, XIAO Y. A singular value thresholding with diagonal-update algorithm for low-rank matrix completion[J]. Mathematical Problems in Engineering, 2020: 2020.
[20] LI W, HU J, CHEN C. On accelerated singular value thresholding algorithm for matrix completion[J]. Applied Mathematics, 2014, 5(21): 3445−3451. doi: 10.4236/am.2014.521322
[21] QIAO Z W, ZHANG Z, PAN X C, et al. Optimization-based image reconstruction from sparsely sampled data in electron paramagnetic resonance imaging[J]. Journal of Magnetic Resonance, 2018, 294: 24−34. doi: 10.1016/j.jmr.2018.06.015
[22] QIAO Z W, ZHU Y N, REDLER G, et al. The integrated acceleration of the Chambolle-Pock algorithm applied to constrained TV minimization in CT image reconstruction[J]. Inverse Problems in Science and Engineering, 2019.
[23] 乔志伟. 总变差约束的数据分离最小图像重建模型及其Chambolle-Pock求解算法[J]. 物理学报, 2018,67(19): 198701. DOI: 10.7498/aps.67.20180839. QIAO Z W. Total variation constrained data separation minimum image reconstruction model and its Chambolle-Pock algorithm[J]. Acta Physica Sinica, 2018, 67(19): 198701. DOI: 10.7498/aps.67.20180839. (in Chinese).
[24] QIAO Z W, REDLER G, GUI Z G, et al. Three novel accurate pixel-driven projection methods for 2D CT and 3D EPR imaging[J]. Journal of X-ray Science and Technology, 2018, 26(1): 83−102. doi: 10.3233/XST-17284
[25] QIAO Z W, REDLER G, EPEL B, et al. A doubly constrained TV algorithm for image reconstruction[J]. Mathematical Problems in Engineering, 2020, (2): 1−15.
[26] QIAO Z W, REDLER G, TANG S J, et al. Comparison of TVcDM and DDcTV algorithms in image reconstruction[J]. Inverse Problems in Science and Engineering, 2020, 28(6): 839−858. doi: 10.1080/17415977.2019.1667343
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载: