The Diagnosis of Cronkhite-Canada Syndrome with CT Enterography: A Clinical Case Analysis
-
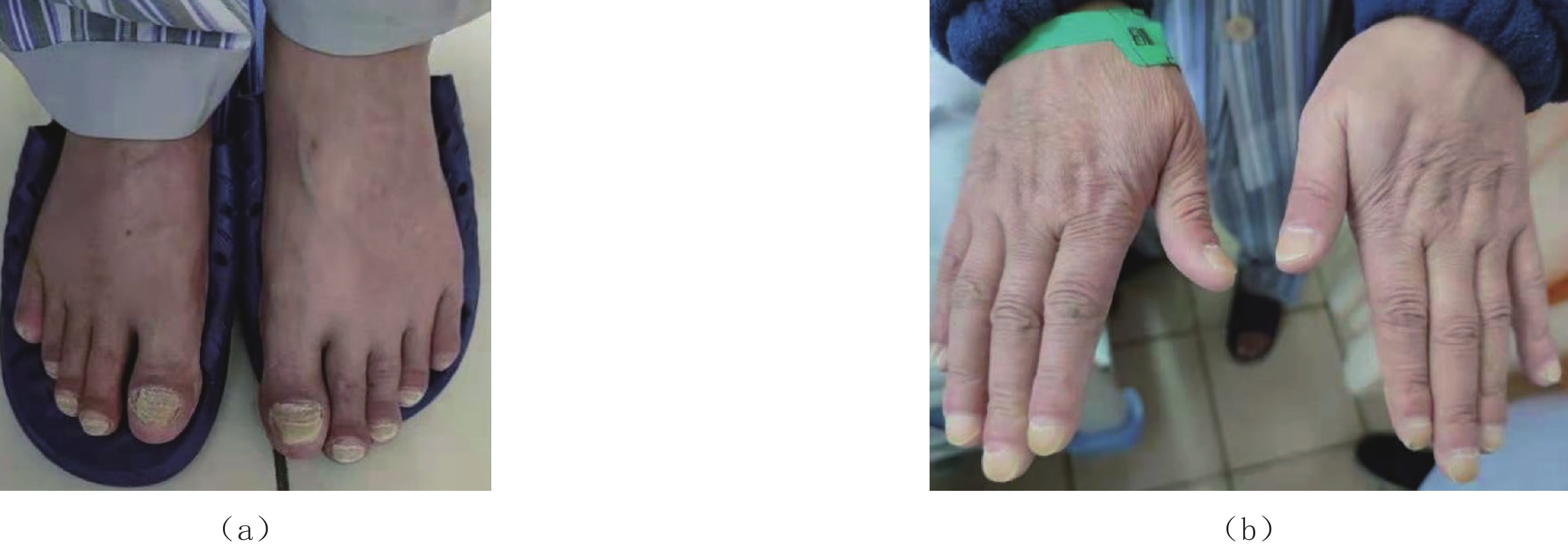
摘要: Cronkhite-Canada综合征(CCS)是一组以胃肠道弥漫性息肉和外胚层变化为特征的综合征,其临床表现主要为慢性腹泻和吸收不良,由于发病率罕见,早期发现和诊断对医生来说是一个挑战。本文报告1例CCS病例,58岁男性,临床表现为慢性水样腹泻、便血、体重减轻和皮肤变化,包括指甲营养不良和色素沉着;实验室检查结果提示贫血和低蛋白血症;CT小肠造影检查发现全消化道黏膜息肉样增生,高度怀疑CCS,随后行内镜检查证实了该诊断。患者经治疗后,症状明显好转,在近1年的随访中,CT小肠造影和内镜检查均提示明显缓解。本文对该疾病进行文献综述,旨在总结其CT小肠造影表现,以提高临床医生对本病的认识,为CCS的早期诊断提供一定的思路。
-
关键词:
- CT小肠造影 /
- 息肉-色素沉着-脱发-指(趾)甲营养不良综合征 /
- 诊断
Abstract: Cronkhite-Canada syndrome (CCS) is a rare cause of chronic diarrhea and malabsorption where patients develop multiple polyps throughout the gastrointestinal (GI) tract, accompanied by ectodermal changes. Due to its rarity, its early detection and diagnosis can be challenging for physicians. This case report described a 58-year-old male patient with CCS who presented with chronic watery diarrhea, hematochezia, weight loss, and skin changes including nail dystrophy and hyperpigmen-tation. Laboratory results showed anemia and hypoalbuminemia. He underwent CT enterography (CTE) which identified diffuse edematous polyposis in the GI tract. The CTE results were highly suspicious of CCS and a subsequent endoscopic examination confirmed the diagnosis. The patient received supportive treatment which improved his symptoms. Based on CTE and endoscopy at 1-year follow-up, the patient was deemed to be in remission. We included a literature review of CCS. The case report aimed to improve the understanding of CCS and explored the key CTE features relevant to its early diagnosis.-
Keywords:
- CT enterography /
- Cronkhite-Canada syndrome /
- diagnosis
-
间质性肺异常(interstitial lung anomaly,ILA)是在轻度症状或轻微肺功能损害患者中偶然发现的,提示早期间质性肺疾病(interstitial lung disease,ILD)[1]。Fleischner协会提出,ILA是在无疑似ILD患者中发现与ILD相符的特异性CT表现,并建议对其进行评估[2]。研究表明,ILA很常见[3],且与死亡率增加、肺癌风险和癌症治疗相关并发症显著相关[4-5]。Cedars-Sinai等[6]通过对类风湿关节炎(rheumatoid arthritis,RA)患者进行纵向随访,发现基线时存在ILA的患者1年后出现影像学进展。因此,有必要对ILA进行早期诊断和适当管理。
ILD是结缔组织病(connective tissue disease,CTD)最常见的肺部并发症[7],通常与不良结局和早期死亡率有关[8]。结缔组织疾病相关间质性肺疾病(connective tissue disease-associated interstitial lung disease,CTD-ILD)常表现为咳嗽等非特异性症状[9],通常在病程晚期被诊断[10],且与其他疾病重叠,导致ILD诊断常被延迟和低估[11],使患者预后恶化[12]。而抗纤维化治疗已被证明可降低ILD患者的死亡率和急性加重的风险[13],延缓肺纤维化进展[14]。因此,保持对ILD的高度怀疑,并尽早识别和治疗有助于改善患者的临床结局[15-16]。
目前,高分辨率计算机断层扫描(high-resolution CT,HRCT)是诊断ILD的金标准[17],也是筛查ILA的重要工具[2]。然而,肉眼识别肺区5%异常具有挑战性[18],且早期ILA影像表现与其他肺部病变(如重力依赖型肺不张、局灶胸椎旁纤维化等[19])相似。而定量CT可克服这些局限性,在ILA评估中发挥着重要作用[20]。该技术不仅能量化不同影像表现(如磨玻璃影、纤维化等)的占比,还能评估肺部整体损伤(如平均肺密度等)情况,并能早期发现病变,为疾病评估和早期诊断提供重要依据。
然而,目前针对CTD患者的ILA的研究仍较少。本研究纳入CTD-ILA及CTD-ILD患者,通过定量CT评估患者肺损伤情况,探讨定量CT指标对于CTD-ILA、CTD-ILD的预测作用及诊断效能,建立基于定量CT的CTD患者筛查方法,为早期诊断与个性化管理提供参考依据。
1. 资料与方法
1.1 一般资料
选取延安大学附属医院2018年1月至2024年11月CTD-ILA患者33例、CTD-ILD患者140例,对照组109例。
CTD-ILA/ILD纳入标准:类风湿关节炎(RA)、系统性硬化症(systemic sclerosis,SSc)、皮肌炎(dermatomyositis,DM)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关血管炎的诊断分别符合2010年[21]、2013年[22]、2017年[23]、2019年[24]、2022年[25]美国风湿病学会指南,干燥综合征(sjögren’s syndrome,SS)、弥漫性结缔组织病(mixed connective tissue disease,MCTD)诊断符合2016年[26]、2019年[27]美欧共识小组指南,ILA的定义符合2020年Fleischner协会指南[2],ILD的定义符合2013年英国胸科协会指南[28]。ILA和ILD示例图如图1所示。
CTD-ILA/ILD排除标准:无薄层高分辨率CT;胸部CT存在伪影;3D slicer无法分割;存在胸部肿瘤、感染[29-30]、肺气肿、胸腔积液;胸部手术史。对照组的纳入标准:符合CTD诊断但未患ILD的人群,其排除标准与CTD-ILD/ILD患者排除标准一致。
1.2 HRCT检查及定量分析
使用128层螺旋CT扫描仪(上海联影UCT-760)进行检查,受试者取仰卧位,于深吸气末扫描,扫描范围为肺尖至肺底膈面。扫描参数:管电压120 kV、管电流自动调节,扫描层厚5 mm,使用1 mm标准算法重建。
由两名经验丰富的放射科主任医生判断患者胸部CT质量并对其进行影像分型。定量CT指标使用3D-Slicer(5.6.2版本,http://www.slicer.org)获得。使用密度直方图和密度阈值法获得定量CT指标。具体步骤如图2所示。
密度阈值法的阈值设置:全肺像素阈值设定为 −
1024 HU至 − 200 HU,进一步细分为正常肺区(− 950 HU至 − 700 HU)、磨玻璃密度区(− 700 HU至 − 500 HU)和纤维化区(− 500 HU至 − 200 HU)。计算这些区域像素与全肺像素比例,得到正常肺区域(normal lung,NL)、磨玻璃密度区域(ground-glass opacity,GGO)和纤维化区域(fibrosis,F)百分比,以及异常病变区域(abnormal area,AA)的百分比(AA%为GGO%与F%之和),定量分割结果如图3所示。密度直方图法通过统计不同密度值出现的频率生成灰度直方图,得到高衰减区(high attenuation area,HAA)、平均肺密度(mean lung density,MLD)、标准差(standard deviation,SD)、峰度(Kurtosis)和偏度(Skewness)参数。
1.3 统计学方法
采用Shapiro-Wilk W进行正态检验。正态资料以(均数±标准差)表示,非正态资料以中位数(四分位数间距)表示,分类变量以频率(百分比(%))表示。组间差异用单因素方差分析或Kruskal-Wallis H检验分析,采用Bonferroni法进行事后比较。
应用受试者操作特征曲线(receiver operator characteristic curve,ROC)评估肺定量CT指标在区分对照组与CTD-ILA、对照组与CTD-ILD、CTD-ILA与CTD-ILD的诊断效能,使用多元逐步Logistic回归筛选预测CTD-ILA及CTD-ILD的定量CT指标。
使用SPSS 25.0进行统计分析,以P<0.05为差异具有统计学意义。
2. 结果
2.1 患者基线特征
本研究共纳入282名患者,包括对照组109例,CTD-ILD组140例,CTD-ILA组33例。3组患者在性别、年龄和CTD类型方面存在差异,而病程、BMI以及CT分型方面无显著差异(表1)。
表 1 患者临床资料表Table 1. Demographic and clinical characteristics of study participants项目 组别 统计检验 对照组(n=109) CTD-ILA(n=33) CTD-ILD(n=140) F/H P 性别(%) 14.52 0.001 男 19(17.3) 14(42.4) 53(37.9) 女 90(81.8) 19(57.6) 87(62.1) 年龄/岁 40(19) 64(11) 62.5(14) 104.52 <0.001 BMI/(kg/m2) 22.54(2.81) 21.89(3.08) 22.34(4.39) 0.29 0.864 病程 3(7) 5(11.25) 4(10.75) 3.25 0.187 CTD类型(%) 9.66 0.008 类风湿关节炎 63(57.3) 22(66.7) 67(47.9) 系统性红斑狼疮 24(21.8) 5(15.2) 10(7.1) 系统性硬化症 2(1.8) 2(6.1) 15(10.7) 干燥综合症 9(8.2) 2(6.1) 16(11.4) 皮肌炎 − 2(6.1) 8(5.7) 弥漫性结缔组织病 7(6.4) − 15(10.7) ANCA相关血管炎 4(3.6) 2(6.1) 9(6.4) CT分型(%) 1.12 0.291 普通型间质性肺炎 − 7(21.2) 41(29.3) 非特异性间质性肺炎 − 18(54.5) 71(50.7) 淋巴细胞性间质性肺炎 − 4(12.1) 22(15.7) 机化性肺炎 − 4(12.1) 6(4.3) 2.2 各组间定量指标差异
定量CT指标分析显示(表2),组间定量CT指标均存在统计学差异(P<0.05)。在密度阈值法中,从无ILD、ILA到ILD,NL%逐渐下降,而GGO%、F%、AA% 则逐渐上升。
表 2 各组间定量CT指标差异Table 2. Intergroup differences in quantitative CT metrics among controls, CTD-ILA, and CTD-ILD cohorts项目 组别 统计检验 对照组(n=109) CTD-ILA(n=33) CTD-ILD(n=140) F/H P NL% 74(7) 68.0(7.5)* 65.5(9)* 89.82 <0.001 GGO% 5.7(3.7) 11.3(8.75)* 12.65(9.1)* 76.00 <0.001 F% 2.9(1.25) 5.2(3.4)* 6.6(4.98)* 113.72 <0.001 AA% 8.8(4.9) 16.40(11.80)* 19.35(12.67)* 89.51 <0.001 HAA 4.04(2.18) 9.25±5.26* 9.44(6.92)* 114.05 <0.001 MLD −830.16(49.19) −777.08(59.02)* −768.19(93.69)* 70.18 <0.001 SD 179.94(16.38) 205.52(25.83)* 220.19(41.43)* 139.60 <0.001 Kurtosis 13.62±4.20 6.77(4.91)* 5.28(5.64)* 122.59 <0.001 Skewness 3.27(0.71) 2.34(0.74)* 2.19±0.60* 115.41 <0.001 注:*表示与对照组相比P<0.05。NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差;Kurtosis为峰值;Skewness为偏度。 密度直方图法中,MLD、HAA、SD呈上升趋势,而Kurtosis和Skewness则逐渐减小。
2.3 定量CT指标区分ILA与ILD ROC曲线
ROC曲线分析结果显示,SD、HAA、Kurtosis和F%在区分对照组与CTD-ILA(表3和图4)、对照组与CTD-ILD(表4和图5)方面表现优异。其中,SD的曲线下面积(AUC)最大,在区分对照组与CTD-ILA(AUC=0.862)和对照组与CTD-ILD(AUC=0.923)时均表现出较高的诊断效能。在密度阈值法中,F%区分两者AUC值最大。
表 3 定量CT指标区分对照组与CTD-ILA的ROC曲线分析结果Table 3. ROC curve analysis of quantitative CT metrics for discriminating control groups from CTD-ILA patients项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.770 <0.001 < 71.50 0.758 0.743 0.501 GGO% 0.774 <0.001 > 8.000 0.788 0.734 0.522 F% 0.814 <0.001 > 4.050 0.758 0.807 0.565 AA% 0.785 <0.001 > 12.20 0.788 0.762 0.549 HAA 0.830 <0.001 > 6.121 0.788 0.835 0.623 MLD 0.763 <0.001 > −800.9 0.697 0.798 0.495 SD 0.862 <0.001 > 191.2 0.849 0.817 0.665 Kurtosis 0.821 <0.001 < 9.615 0.727 0.844 0.571 Skewness 0.816 <0.001 < 2.795 0.788 0.817 0.604 注:NL% 为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 在区分CTD-ILA与CTD-ILD的ROC曲线分析(表5和图6),SD的诊断价值最佳(AUC=0.649),其次为Kurtosis(AUC=0.638),密度阈值法中F%的AUC最大为0.617。
表 4 定量CT指标区分对照组与CTD-ILD的ROC曲线分析结果Table 4. ROC curve analysis of quantitative CT metrics for differentiating control groups from CTD-ILD patients项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.844 <0.001 < 71.50 0.829 0.743 0.572 GGO% 0.815 < 0.001 > 8.350 0.771 0.752 0.524 F% 0.886 < 0.001 > 4.050 0.727 0.807 0.535 AA% 0.843 < 0.001 > 11.30 0.857 0.716 0.573 HAA 0.885 < 0.001 > 6.205 0.727 0.844 0.571 MLD 0.801 < 0.001 > −798.2 0.636 0.826 0.462 SD 0.923 < 0.001 > 191.2 0.864 0.817 0.680 Kurtosis 0.896 < 0.001 < 11.74 0.818 0.706 0.525 Skewness 0.889 < 0.001 < 2.795 0.727 0.817 0.544 注:NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 表 5 定量CT指标区分CTD-ILA与CTD-ILD的ROC曲线分析结果Table 5. ROC curve analysis of quantitative CT metrics for differentiating CTD-ILA from CTD-ILD项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.600 0.074 < 63.50 0.379 0.788 0.167 GGO% 0.544 0.435 > 12.10 0.536 0.576 0.112 F% 0.617 0.037 > 5.450 0.650 0.576 0.226 AA% 0.574 0.187 > 16.85 0.600 0.576 0.176 HAA 0.585 0.128 > 10.06 0.486 0.727 0.213 MLD 0.568 0.224 > −758.5 0.429 0.758 0.186 SD 0.649 0.008 > 219.1 0.529 0.758 0.286 Kurtosis 0.638 0.014 < 5.095 0.479 0.849 0.327 Skewness 0.614 0.042 < 1.932 0.364 0.879 0.243 注:NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 2.4 定量CT指标预测ILA与ILD 多元Logistic回归分析
将NL%、GGO%、F%、AA%、HAA、MLD、SD、Kurtosis、Skewness作为自变量,分组结果(ILA/ILD)为因变量,进行多元逐步logistic回归。
结果显示(表6),在区分对照组与ILD及ILA时,F%(β=0.620,P=0.006,OR=1.895;β=0.854,P=0.000,OR=2.349)、GGO%(β=−0.302,P=0.002,OR=0.739;β=−0.454,P=0.000,OR=0.635)、SD(β=0.026,P=0.009,OR=1.016;β=0.016,P=0.000,OR=1.026)、Kurtosis(β=−0.370,P=0.000,OR=0.691;β=−0.439,P=0.000,OR=0.645)具有统计学差异。
表 6 定量CT指标预测ILA与ILD多因素多元logistic回归结果Table 6. Multivariate logistic regression analysis of quantitative CT metrics in predicting ILA vs. ILD项目 β BE wald P OR 95% CI 下限 上限 ILA F% 0.620 0.225 7.629 0.006 1.859 1.197 2.887 GGO% −0.302 0.098 9.546 0.002 0.739 0.610 0.895 SD 0.015 0.006 6.784 0.009 1.016 1.004 1.027 Kurtosis −0.370 0.069 28.727 0.000 0.691 0.603 0.791 ILD F% 0.854 0.209 16.666 0.000 2.349 1.559 3.540 GGO% −0.454 0.092 24.385 0.000 0.635 0.530 0.760 SD 0.026 0.005 23.855 0.000 1.026 1.016 1.037 Kurtosis −0.439 0.062 50.962 0.000 0.645 0.571 0.727 注:GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;SD为标准差; Kurtosis为峰值。 3. 讨论
ILA及ILD均与CTD患者不良预后和早期死亡率密切相关,早期识别和管理对改善患者结局至关重要。但目前临床筛查仍依赖视觉评估,易导致早期病变漏诊。与既往研究相比,本研究系统量化了正常肺组织、到ILA、再到ILD的连续演变规律,为疾病发展提供客观证据;其次,构建基于定量CT的CTD患者筛查方法,为建立风险分层提供依据;最后,使用开源分析软件,免费、省时,有利于技术推广与普及。
从无ILD的CTD对照组、CTD-ILA到CTD-ILD,NL%、峰度(Kurtosis)和偏度(Skewness)逐渐下降,而GGO%、F%、AA%、MLD、HAA以及SD则逐渐上升,与Ahn等[31]及杨凯等[32]的研究一致,表明ILA是ILD的早期阶段。
定量CT指标的ROC曲线和Logistic回归分析表明,F%、GGO%、SD和Kurtosis是区分对照组与CTD-ILA/ILD的敏感指标。在密度阈值法,F%在区分对照组与CTD-ILA(AUC=0.814)和CTD-ILD(AUC=0.886)时表现最佳,提示其在早期诊断ILA和ILD方面具有重要意义。与Zhang等[33]研究结果一致,F%同样被证实为识别健康对照与特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)的最佳指标(AUC=0.962)。但本研究F%的AUC值低于其在IPF中的表现,这提示炎症主导的CTD-ILD与纤维化驱动的IPF存在差异[34],表明定量指标筛查应结合患者病因。
此外,磨玻璃密度区域百分比(GGO%)在诊断ILA及ILD方面同样具有重要价值(β1=−0.302,P=0.002,OR=0.739;β2=−0.454,P=0.000,OR=0.635)。这与马震忠等[35]发现皮肌炎/多发性肌炎相关ILD(DM/PM-ILD)患者HRCT表现以磨玻璃影为主(87.2%,123/141)一致,徐光兴等[36]证实GGO%在鉴别DM/PM-ILD与健康对照组时具有较高的诊断效能(AUC=0.91),但DM/PM-ILD患者的影像表现以非特异性间质性肺炎(NSIP)为主[9],而本研究还纳入了约30%以普通型间质性肺炎(usual interstitial pneumonia,UIP)表现为主的患者,这表明GGO%在鉴别不同亚型ILD时具有广泛适用性。
密度直方图法中,标准差(SD)和峰度(Kurtosis)是区分正常组和CTD-ILA/ILD有意义的指标。SD的曲线下面积最大(AUC=0.862,AUC=0.923),Kurtosis区分ILD(AUC=0.896)仅次于SD(AUC=0.923),与Guisado-Vasco等[37]研究一致。研究表明SD还是区分局限性和弥漫性SSc-ILD和SS-ILD的最佳鉴别参数[38-39],进一步证明SD对于判断疾病严重程度也具有重要价值。
而区分ILA与ILD的ROC曲线显示SD的AUC最大(AUC=0.649),SD>219.1为区分ILA和ILD的最佳截断值。在密度阈值法,F%的AUC最大(AUC=0.617),F%>5.450为区分ILA和ILD的最佳截断值。然而,基于定量CT区分ILD和ILA的结果仅供参考,实际应用还需结合患者临床症状、肺功能检查及随访结果进行综合评估。
基于当前证据,我们提出CTD肺部评估的大致路径:初筛阶段采用SD、F%、GGO%、和Kurtosis排除高危人群;对于异常患者采用SD和F%判断患者是否患ILA或ILD。针对ILA患者,定期随访监测病情变化;而ILD患者则评估病情程度,尽早治疗改善预后。
尽管高衰减区(HAA)未被纳入回归模型,但其在区分对照组与ILA患者时表现较好(AUC=0.830)。既往研究也表明,HAA在无症状类风湿关节炎(RA)识别ILD风险的能力最强[40],不同肺区域HAA与肺重塑的生物标志物、ILA的风险和全因死亡率相关[41],呼气HAA被认为是所有直方图分析指标中ILD严重程度的最佳预测因子[42],均提示HAA对于早期诊断的价值。此外,Shiraishi等[43]纵向评估COPD患者ILA,发现ILDvol%(磨玻璃影、网状影和蜂窝影的体积之和)与ILA 的发生相关,是识别和监测COPD患者ILA的可重复方法。这与我们的AA%指标类似,但AA%区分对照组与CTD-ILA/ILD AUC值较小,可能是3D slicer无法区分蜂窝影与肺气肿的局限性,未来需通过深度学习算法优化分割精度。
本研究的局限性。①样本量较小,尤其是CTD-ILA组。由于前期研究重点是CTD-ILD,对ILA人群关注较少,但本研究仍为该领域提供了有价值的依据,未来将增加样本量,优化研究结果。②基线资料年龄和性别存在差异,但将其纳入回归分析后模型参数并未显著优化,因此未将其纳入最终分析。③3D slicer目前无法区分肺气肿与蜂窝影,因此纳入人群时已排除合并肺气肿的患者,可能存在一定的选择偏移。④研究主要聚焦于定量CT诊断价值,忽略了血清学指标、肺功能等的诊断意义,后续研究将纳入临床指标进行分析。
综上所述,本研究不仅验证了定量CT在CTD-ILD/ILA早期诊断中的价值,还提出基于定量CT的CTD患者筛查方式,为患者精准管理提供有力支持。未来需在大样本中验证其适用性,并探索其与临床指标的协同作用。
-
表 1 CCS CTE表现
Table 1 CT enterographic features of CCS
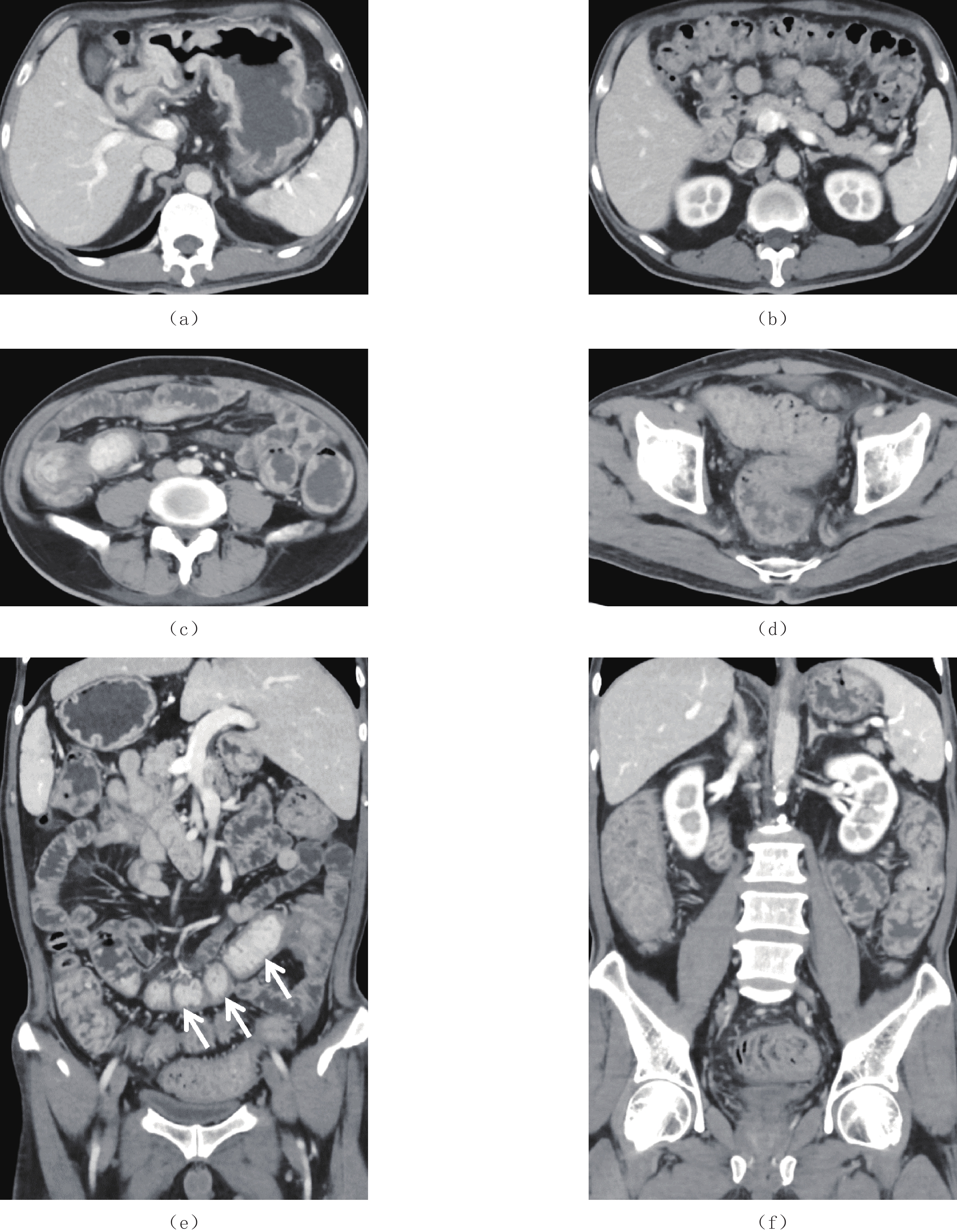
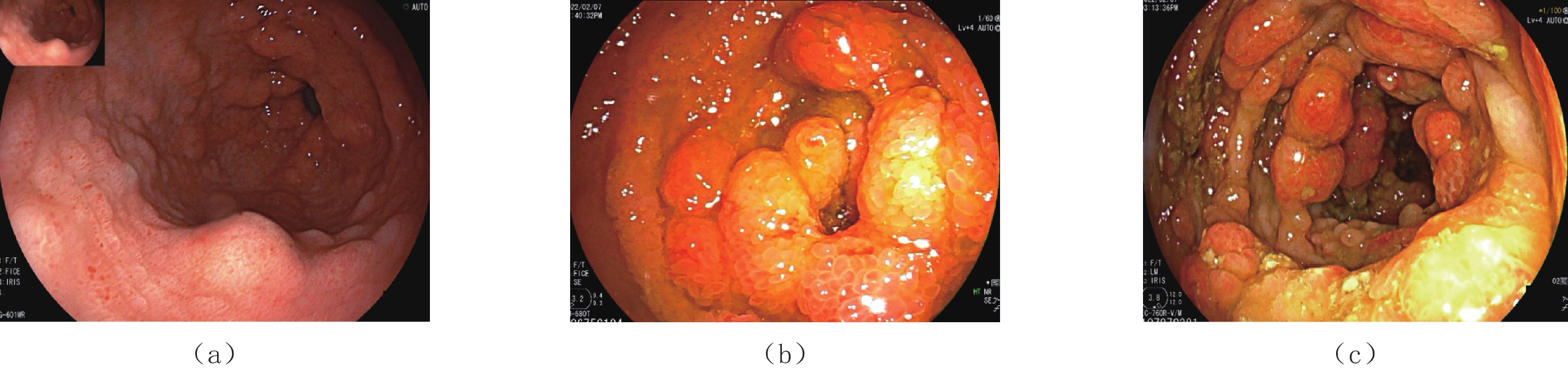
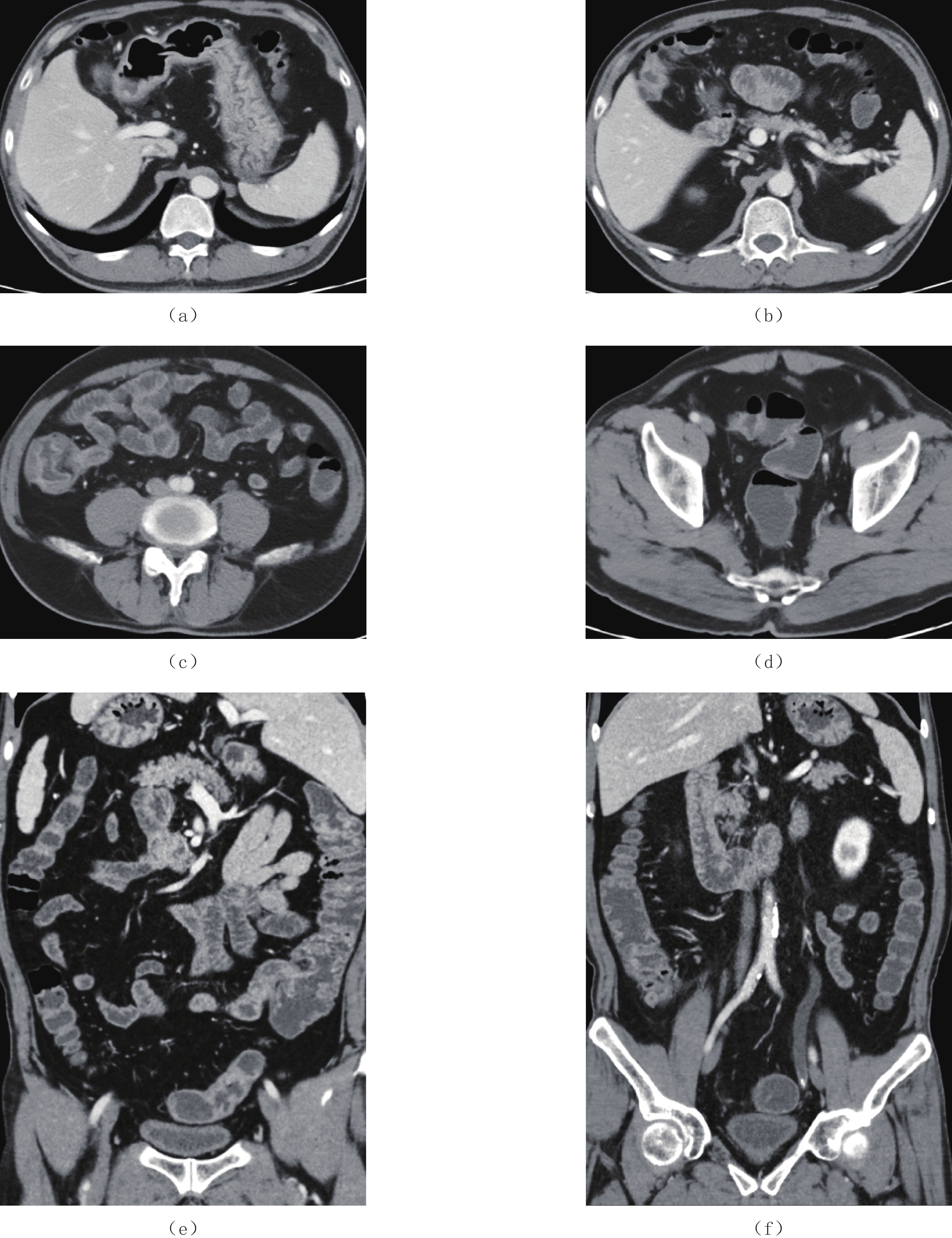
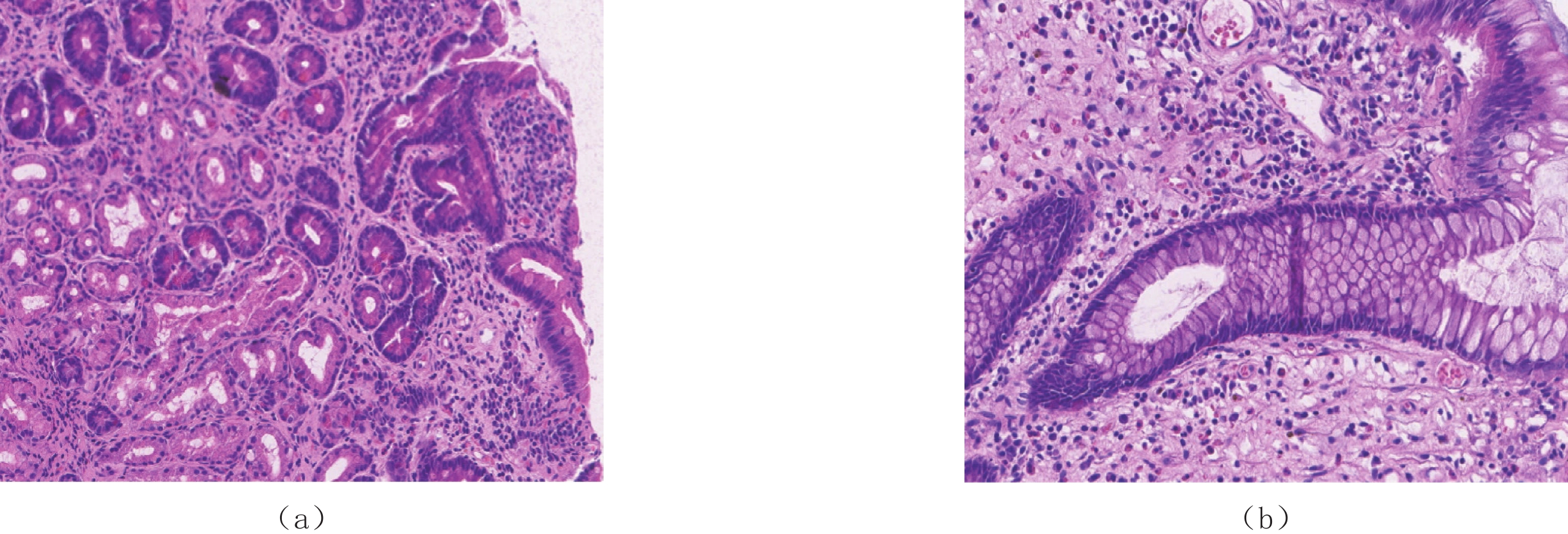
息肉 CTE特点 部位 胃底、胃体、胃角、胃窦、十二指肠球降段、空肠、回肠下段、末端回肠、回盲部、大肠 大小 大小不等,小者4 mm,大者2 cm,小肠中以末端回肠为著,大肠中以右半结肠为著 形态 椭圆形、指状,基底宽,蒂不明显 分布 弥漫性分布、地毯式覆盖 边界(与黏膜分界) 与黏膜分界不清,形成巨大息肉样黏膜皱襞 供血动脉 未见明显肠系膜供血动脉与其相连 强化方式 明显强化,尤以末端回肠强化更明显 并发症 末端回肠有套入右半结肠趋势,其他部位未见明显套叠;未见明显癌变征象;其他脏器未
见异常肠管周围及肠系膜淋巴结 肠管周围脂肪间隙清晰,未见肠系膜淋巴结增大 表 2 CCS患者实验室检查结果前后对照
Table 2 Laboratory results of the patient with CCS before and after treatment
实验室检查项目 第一次入院 随访 血红蛋白/(g/L) 128 141 总蛋白/(g/L) 45 65 白蛋白/(g/L) 29 39 -
[1] CRONKHITE L W, CANADA W J. Generalized gastrointestinal polyposis; An unusual syndrome of polyposis, pigmentation, alopecia and onychotrophia[J]. New England Journal of Medicine, 1955, 252(4): 1011−10152.
[2] WATANABE C, KOMOTO S, TOMITA K, et al. Endoscopic and clinical evaluation of treatment and prognosis of Cronkhite-Canada syndrome: A Japanese nationwide survey[J]. Journal of gastroenterology, 2016, 51(4): 327−336. doi: 10.1007/s00535-015-1107-7
[3] 陈鑫, 李变霞, 朱兰平, 等. 罕见的息肉病-Cronkhite-Canada综合征[J]. 世界华人消化杂志, 2019,27(16): 977−983. [4] IQBAL U, CHAUDHARY A, KARIM M A, et al. Cronkhite-Canada syndrome: A rare cause of chronic diarrhea[J]. Gastroenterology Research, 2017, 10(3): 196−198. doi: 10.14740/gr820w
[5] 晁帅恒, 李修岭, 张梦婷, 等. Cronkhite-Canada综合征83例临床分析[J]. 中国临床研究, 2018,31(3): 397−399. doi: 10.13429/j.cnki.cjcr.2018.03.028 [6] SWEETSER S, AHLQUIST D A, OSBORN N K, et al. Clinicopathologic features and treatment outcomes in Cronkhite-Canada syndrome: Support for autoimmunity[J]. Digestive Diseases and Sciences, 2012, (2): 496−502.
[7] TAYLOR S A, KELLY J, LOOMES D E. Cronkhite-Canada syndrome: Sustained clinical response with Anti-TNF therapy[J]. Case Reports in Medicine, 2018: 9409732. DOI: 10.1155/2018/9409732.
[8] TRIANTAFILLIDIS J K, KOUGIOUMTZIAN A, LEIVADITOU A. et al. Cronkhite-Canada syndrome associated with a giant cell bone tumor[J]. Journal of Gastrointestinal and Liver Diseases, 2012, 21(4): 345.
[9] WANG J, ZHAO L, MA N, et al. Cronkhite-Canada syndrome associated with colon cancer metastatic to liver: A case report[J]. Medicine, 2017, 96(38): e7466. doi: 10.1097/MD.0000000000007466
[10] PIRACCINI B M, RECH G, SISTI A, et al. Twenty nail onychomadesis: An unusual finding in Cronkhite-Canada syndrome[J]. Journal of the American Academy of Dermatology, 2010, 63(1): 172−174. doi: 10.1016/j.jaad.2009.04.036
[11] YASUDA T, UEDA T, MATSUMOTO I, et al. Cronkhite-Canada syndrome presenting as recurrent severe acute pancreatitis[J]. Gastrointestinal Endoscopy, 2008, 67(3): 570−572. doi: 10.1016/j.gie.2007.07.041
[12] GOTO A. Cronkhite-Canada syndrome: Epidemiological study of 110 cases reported in Japan[J]. Nippon Geka Hokan. Archiv Für Japanische Chirurgie, 1995, 64(1): 3−14.
[13] CHRISTIAN M, ANDREAS S, VAVRICKA S R, et al. ECCO-ESGAR guideline for diagnostic assessment in IBD part 1: Initial diagnosis, monitoring of known IBD, detection of complications[J]. Journal of Crohn's and Colitis, 2019, 13(2): 144−164. doi: 10.1093/ecco-jcc/jjy113
[14] UEYAMA H, FU K, OGURA K, et al. Successful treatment for Cronkhite-Canada syndrome with endoscopic mucosal resection and salazosulfapyridine[J]. Techniques in Coloproctology, 2014, 18(5): 503−507. doi: 10.1007/s10151-012-0863-0
[15] SLAVIK T, MONTGOMERY E A. Cronkhite-Canada syndrome six decades on: The many faces of an enigmatic disease[J]. Journal of Clinical Pathology, 2014, 67(10): 891−897. doi: 10.1136/jclinpath-2014-202488




 下载:
下载: