Imaging Study of COVID-19 Patients with Diabetes Mellitus by Computed Tomograpgh Quantitative Indicators Based on Deep Learning
-
摘要: 目的:探讨基于深度学习的CT定量指标对糖尿病合并新型冠状病毒感染(COVID-19)患者肺部感染的影像学特征分析。资料与方法:回顾性纳入2022年12月至2023年1月首都医科大学附属北京世纪坛医院感染科收治的COVID-19患者的临床及影像学数据,根据患者的糖尿病史分为糖尿病组及非糖尿病组,通过单因素分析两组的临床及CT定量影像学特征。结果:共纳入112例COVID-19患者,年龄26~95岁,平均(70.4±14.4)岁,女性占比44.6%(50/112例)。在临床方面,糖尿病组的C反应蛋白水平明显升高。在定量指标方面,糖尿病组患者的全肺及左肺病灶数目、病灶体积、病灶占比更大,糖尿病组的纵隔淋巴结数目更多;此外,糖尿病组患者的磨玻璃病灶及实性病灶体积更大,其磨玻璃实性病灶体积比更小。在影像学征象方面,糖尿病组患者的病灶形态呈大片状、束带状比例更高,其存在晕征、空气支气管征、空气潴留征、马赛克灌注及胸膜下黑带的比例更高。结论:糖尿病合并COVID-19患者的肺部病变具有相对的特征性,基于深度学习的CT定量指标显示糖尿病组的COVID-19患者肺部受累的病变范围更大、程度更重,其实性病灶成分占比相对增加。Abstract: Objective: To investigate the imaging characteristics of coronavirus disease 2019 (COVID-19) patients with diabetes mellitus using deep learning-based quantitative computed tomograpgh (CT) indicators. Materials and methods: The clinical and imaging data of 112 COVID-19 patients admitted to the Department of Infection, Beijing Shijitan Hospital, Capital Medical University, from December 2022 to January 2023 were retrospectively collected. The patients were divided into diabetic and non-diabetic groups according to their diabetes history, and the clinical and quantitative CT imaging characteristics of the two groups were analyzed using univariate analysis. Results: A total of 112 patients with COVID-19, aged 26-95 years (mean, (70.4±14.4) years), were included in the study, and 44.6% (50/112 cases) were female. In terms of clinical features, C-reactive protein levels were significantly higher in the diabetic group. In terms of CT quantitative indicators, patients in the diabetic group had higher number of whole lung and left lung lesions, lesion volume, and mediastinal lymph nodes than patients in the non-diabetic group. In addition, patients in the diabetic group had a larger volume of ground glass opacity and solid opacity, and patients in the diabetic group had a smaller volume ratio of ground glass opacity and solid opacity in terms of imaging signs, patients in the diabetic group had a higher proportion of lesions with large patchy and banded patterns, and they had a higher proportion of halo signs, air bronchial signs, air trapping signs, mosaic perfusion signs, and subpleural black bands. Conclusion: Pulmonary lesions in patients with diabetes combined with COVID-19 have characteristic features, and deep learning-based quantitative CT indicators, particularly the solid opacity observed in the lungs, can provide valuable information on the extent and severity of lesions in these patients.
-
Keywords:
- deep learning /
- chest CT /
- coronavirus disease 2019 /
- diabetes mellitus
-
新型冠状病毒感染(coronavirus disease 2019,COVID-19)是由新型冠状病毒引起的呼吸系统疾病,目前仍是全球关注的重要公共卫生问题。研究显示,合并基础病或年龄超过65岁的患者是COVID-19的易感人群,其临床症状明显加重[1-2]。糖尿病的高患病率使之成为COVID-19的常见合并症,存在糖尿病的COVID-19患者的预后更差、死亡率更高,两者之间存在显著相关性[3-4]。同时,糖尿病患者感染COVID-19后,其肺部受累的比例更高、程度更严重,在血糖控制不佳的人群中更显著[5]。已有部分研究显示,基于胸部CT的定量指标不仅可以确定肺部病变的区域,同时可以精准、动态地评估COVID-19的严重程度及发展趋势[6-7]。
本研究回顾性分析糖尿病合并新型冠状病毒感染者的胸部CT定量指标,对其影像学特征进行相关探讨。
1. 资料与方法
1.1 一般资料
回顾性纳入2022年12月至2023年1月首都医科大学附属北京世纪坛医院感染科收治的112例COVID-19患者的临床及影像学数据。纳入标准:①符合《新型冠状病毒感染诊疗方案(试行第十版)》诊断标准[8],根据标准诊断为轻中型新型冠状病毒感染;②胸部 CT影像显示存在肺部炎性改变。排除标准:①胸部 CT复查患者;②患者存在严重呼吸运动伪影;③临床资料不完整;④免疫受损人群(如肿瘤化疗、长期应用激素、免疫抑制剂使用等)。
糖尿病诊断标准[9]:①患者存在典型的糖尿病症状,包括烦渴多饮、多尿、多食、不明原因体重下降,加上随机血糖≥11.1 mmol/L;②或加上空腹血糖≥7.0 mmol/L;③或加上口服糖耐量试验后 2 h血糖≥11.1 mmol/L;④或加上糖化血红蛋白 A1 c≥6.5%。
1.2 CT检查方法
采用北京赛诺威盛Insitum 32排CT扫描仪。患者选择仰卧位,头先进,双手上举,屏气后行CT扫描,扫描范围包括胸廓入口至肺底。扫描参数:管电压120 kV,管电流150 mAs,层间距及层厚1.5 mm,螺距1.0,矩阵512×512,视野380~450。
1.3 基于深度学习的CT定量指标
通过深睿医疗医学影像辅助诊断软件Version 1.3.0.1获得肺部病灶定量数据。通过该软件获得全肺及双肺各自的肺炎病灶数目、病灶体积、全肺病灶占比及纵隔肿大淋巴结数目;此外,分别获得磨玻璃病灶、实性病灶的体积及其占总病灶的比值、磨玻璃与实性病灶体积比,其中,CT值=-300 HU常被作为定量鉴别磨玻璃病灶及实性病灶的阈值[7]。
1.4 CT图像评估
分析COVID-19患者的病灶情况,主要包括:①分布模式:支气管血管束分布为主、胸膜下分布为主、混合分布为主;②形态特征:结节状、斑片状、大片状及束带状(指位于肺脏外周并与胸膜平行的长径>30 mm的宽带状高密度影);③特殊征象[10]:晕征(实行密度周围环绕磨玻璃密度影)、反晕征(实性环状影包绕磨玻璃密度影)、蜂窝征(多个泡状或囊状低密度的聚集)、铺路石征(磨玻璃背景上小叶间隔增厚)、空气支气管征(实性病灶内伴充气的支气管影)、空气潴留征(肺实质内异常低密度区)、马赛克灌注(磨玻璃密度影伴马赛克状异常低密度影)、胸膜下线(平行于胸膜的弧形线样影)、胸膜凹陷征(脏层胸膜内陷改变)及胸膜下黑带(胸膜下方条状气体密度)。
以上病灶特征由两名放射科医师独立评估,当意见不一致时由第3名高级医师评定。
1.5 临床及实验室数据
记录患者的临床数据:年龄、性别、发病时间、症状(发热、喘憋、咳嗽、咳痰、咽痛、流涕、肌痛)及实验室指标(C反应蛋白、白细胞、淋巴细胞、淋巴细胞百分比、单核细胞、单核细胞百分比、中性粒细胞及中性粒细胞百分比)。此外,记录患者是否存在糖尿病病史情况。
1.6 统计学分析
通过SPSS 26.0进行统计学分析。通过Shapiro-Wilk检验定量数据的正态性,本研究中均为偏态数据,以
$M(Q_1,Q_3) $ 表示,并采用Mann-Whitney U检验进行组间比较。定性数据通过频数(频率)表示,采用使用$\chi^2 $ 检验或Fisher精确检验进行组间比较。P<0.05表示两者差异存在统计学意义。2. 结果
2.1 糖尿病合并COVID-19患者的临床资料
共计纳入112例COVID-19患者,年龄26~95岁,平均(70.4±14.4)岁,女性44.6%(50/112例)。根据患者的糖尿病史分为糖尿病组(39例)及非糖尿病组(73例)。
研究显示,糖尿病组与非糖尿病组COVID-19患者的年龄、性别、发病时间未显示明确统计学差异。两组患者临床症状未见明确差异,主要以发热、咳嗽、咳痰、咽痛、流涕、喘憋及肌痛为主。此外,糖尿病组的C反应蛋白水平较非糖尿病组明显升高(35.2(14.2,76.9)比19.9(5.6,44.5)mg/L),差异存在统计学意义(表1)。
表 1 糖尿病合并COVID-19患者的临床资料Table 1. Clinical information of COVID-19 patients with diabetes mellitus临床指标 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $Z/\chi ^2 $ P 年龄/岁($M(Q_1,Q_3)$) 73.0(66.0,84.0) 70.0(62.0,79.5) -1.607 0.108 性别(男,例(%)) 25(64.1) 37(50.7) 1.852 0.174 发病时间/天($M(Q_1,Q_3)$) 7(5.0,10.0) 7(5.5,10.0) -1.122 0.262 临床症状/例(%) 发热 39(100.0) 73(100.0) - - 喘憋 8(20.5) 14(19.2) 0.029 0.865 咳嗽 36(92.3) 67(91.8) - 1.000 咳痰 20(51.3) 37(50.7) 0.004 0.952 咽痛 16(41.0) 30(41.1) <0.001 0.994 流涕 11(28.2) 26(35.6) 0.631 0.427 肌痛 4(10.3) 4(5.5) - 0.446 实验室指标/(指标值$(M(Q_1,Q_3)$) C反应蛋白/(mg/L) 35.2(14.2,76.9) 19.9(5.6,44.5) -2.519 0.012 白细胞/(×109/L) 6.4(4.5,7.8) 6.4(5.0,8.0) -0.684 0.494 淋巴细胞百分比/% 21.0(13.3,26.4) 22.8(16.3,32.1) -1.374 0.169 单核细胞百分比/% 6.3(5.1,9.4) 7.0(5.7,9.0) -0.785 0.432 中性粒细胞百分比/% 70.1(64.3,81.5) 66.4(58.2,75.5) -1.817 0.069 淋巴细胞/(×109/L) 1.3(0.8,1.9) 1.4(1.1,1.9) -1.655 0.098 单核细胞/(×109/L) 0.4(0.3,0.6) 0.5(0.4,0.6) -1.705 0.088 中性粒细胞/(×109/L) 4.2(3.2,6.0) 4.1(3.1,5.8) -0.037 0.971 2.2 糖尿病合并COVID-19患者的CT影像定量指标
基于深睿医疗医学影像辅助诊断软件获得的CT影像定量指标见表2。与非糖尿病组COVID-19患者相比,糖尿病组患者的全肺及左肺病灶数目(全肺:8.0(5.0,12.0)比6.0(3.0,9.0);左肺:4.0(2.0,6.0)比2.0(2.0,4.0))、病灶体积(全肺:317.3(69.9,666.4)比152.3(26.3,378.6)cm3;左肺:133.0(24.2,320.6)比36.0(5.9,130.3)cm3)、病灶占比更大(全肺:9.3(1.7,19.0)比4.1(0.6,9.5);左肺:10.3(1.4,17.3)比2.1(0.4,6.7)),差异存在统计学意义。此外,糖尿病组的纵隔淋巴结数目更多(2.0(1.0,3.0)比1.0(0,2.0))。
表 2 糖尿病合并COVID-19患者的CT影像定量指标情况Table 2. Quantitative CT imaging indicators in COVID-19 patients with diabetes mellitus病变分布 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $Z/\chi^2 $ P 病灶数目/(个,$M(Q_1,Q_3)$) 全肺 8.0(5.0,12.0) 6.0(3.0,9.0) -2.269 0.023 左肺 4.0(2.0,6.0) 2.0(2.0,4.0) -2.373 0.018 右肺 3.0(3.0,7.0) 3.0(2.0,5.0) -1.569 0.117 病灶体积/(cm3,$M(Q_1,Q_3)$) 全肺 317.3(69.9,666.4) 152.3(26.3,378.6) -2.648 0.008 左肺 133.0(24.2,320.6) 36.0(5.9,130.3) -3.387 0.001 右肺 134.2(31.8,397.6) 97.8(11.0,242.5) -1.793 0.073 病灶占比/(%,$M(Q_1,Q_3)$) 全肺 9.3(1.7,19.0) 4.1(0.6,9.5) -2.602 0.009 左肺 10.3(1.4,17.3) 2.1(0.4,6.7) -3.232 0.001 右肺 7.2(1.2,25.2) 3.8(0.6,10.3) -1.862 0.063 磨玻璃病灶体积/(cm3,$M(Q_1,Q_3)$) 254.7(62.9,487.5) 125.3(23.3,311.7) -2.483 0.013 实性病灶体积/(cm3, $M(Q_1,Q_3)$) 52.9(6.7,172.2) 18.1(2.2,53.9) -3.020 0.003 磨玻璃病灶占比/(%, $M(Q_1,Q_3)$) 82.6(73.1,91.5) 85.8(79.9,93.7) -2.180 0.029 实性病灶占比/(%, $M(Q_1,Q_3)$) 17.4(8.5,26.9) 14.2(6.3,20.1) -2.177 0.029 磨玻璃实性病灶体积比/(%,$M(Q_1,Q_3)$) 4.8(2.7,10.8) 6.0(4.0,15.0) -2.171 0.030 纵隔淋巴结/(个,$M(Q_1,Q_3)$) 2.0(1.0,3.0) 1.0(0,2.0) -3.848 <0.001 分别获得磨玻璃病灶及实性病灶的体积、占比及二者体积比,两组之间存在显著性差异。糖尿病组患者的磨玻璃病灶体积更大(254.7(62.9,487.5)比125.3(23.3,311.7)cm3)及实性病灶体积更大(52.9(6.7,172.2)比18.1(2.2,53.9)cm3)。糖尿病组患者的磨玻璃病灶占比更小(82.6(73.1,91.5)比85.8(79.9,93.7))、实性病灶占比更大(17.4(8.5,26.9)比14.2(6.3,20.1))。此外,糖尿病组患者磨玻璃实性病灶体积比更小(4.8(2.7,10.8)比6.0(4.0,15.0))。
2.3 糖尿病合并COVID-19患者的CT影像特征
与非糖尿病组COVID-19患者相比,糖尿病组患者的病灶形态呈大片状、束带状比例更高,其存在晕征、空气支气管征、空气潴留征、马赛克灌注及胸膜下黑带的比例更高(表3和图1)。
表 3 糖尿病合并COVID-19患者的胸部CT病灶征象情况Table 3. Chest CT lesion signs in COVID-19 patients with diabetes mellitus影像指标 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $\chi^2 $ P 分布模式/(例(%)) 支气管血管束分布 0(0.0) 2(2.7) 2.605 0.107 胸膜下分布 3(7.7) 14(19.2) - 0.542 混合分布 36(92.3) 57(78.1) 4.062 0.044 病变形态/(例(%)) 结节状 26(66.7) 49(68.1) 0.022 0.881 斑片状 37(94.9) 70(95.9) - 1.000 大片状 29(74.4) 38(52.1) 5.261 0.022 束带状 22(56.4) 23(31.5) 6.559 0.010 特殊征象/(例(%)) 晕征 37(94.9) 54(74.0) 7.288 0.007 反晕征 18(46.2) 30(41.1) 0.266 0.606 蜂窝征 2(5.1) 4(5.5) - 1.000 铺路石征 24(61.5) 35(47.9) 1.884 0.170 空气支气管征 34(87.2) 49(67.1) 5.329 0.021 空气潴留征 18(46.2) 19(26.0) 4.655 0.031 马赛克灌注 28(71.8) 28(38.4) 11.369 0.001 胸膜下线 15(38.5) 23(31.5) 0.548 0.459 胸膜凹陷征 26(66.7) 44(60.3) 0.443 0.506 胸膜下黑带 30(76.9) 35(47.9) 8.765 0.003 ![]() 图 1 糖尿病合并COVID-19患者的胸部CT病灶征象患者,男,82岁,发热、咳嗽、咳痰3日就诊,既往合并糖尿病病史,就诊时C反应蛋白为82.61 mg/L、淋巴细胞百分比10.30%、中性粒细胞百分比为85.10%。(a)~(c)显示了基于深度学习的CT定量软件对病灶的划分;(d)~(f)显示了患者胸部CT病灶呈斑片状、大片状、束带状分布,可见马赛克灌注((d)星号)、铺路石征((d)箭头)、胸膜下黑带((e)箭头)及胸膜凹陷征((f)箭头)。Figure 1. Chest CT lesion signs in COVID-19 patients with diabetes mellitus
图 1 糖尿病合并COVID-19患者的胸部CT病灶征象患者,男,82岁,发热、咳嗽、咳痰3日就诊,既往合并糖尿病病史,就诊时C反应蛋白为82.61 mg/L、淋巴细胞百分比10.30%、中性粒细胞百分比为85.10%。(a)~(c)显示了基于深度学习的CT定量软件对病灶的划分;(d)~(f)显示了患者胸部CT病灶呈斑片状、大片状、束带状分布,可见马赛克灌注((d)星号)、铺路石征((d)箭头)、胸膜下黑带((e)箭头)及胸膜凹陷征((f)箭头)。Figure 1. Chest CT lesion signs in COVID-19 patients with diabetes mellitus3. 讨论
本研究基于深度学习的CT定量指标回顾性分析糖尿病合并新型冠状病毒感染患者的影像学特征,结果显示,糖尿病组COVID-19患者的肺部病灶数目更多、体积及病灶占比更大,纵隔淋巴结数目更多,磨玻璃病灶及实性病灶体积更大,实性病灶占比更高且磨玻璃实性病灶体积比更小。此外,糖尿病组病灶呈大片状、束带状比例更高,合并晕征、空气支气管征、空气潴留征、马赛克灌注及胸膜下黑带的比例更高。
在临床方面,本研究显示两组COVID-19患者的C反应蛋白明显升高,但糖尿病组患者的升高更显著,这支持了既往研究[11]。目前认为发生重症的COVID-19患者的血清CRP显著升高,而该物质是由肝脏产生的、与感染和炎症显著相关的生物标记物[12-13]。糖尿病患者处于慢性炎症状态,其一系列的炎性细胞反应会导致肝脏C反应蛋白生成增加[14];当其发生COVID-19感染后,其促炎细胞因子反应强烈、免疫功能障碍且血管紧张素转化酶2的水平下调,进而其预后不良的比例也相应增高[15-16]。
COVID-19感染相关性肺炎的临床症状严重程度与CT肺部感染情况具有高度相关性[17],研究显示其肺部磨玻璃灶及实性病灶的体积占比越大,患者的临床分型越严重;同时,实性病灶体积与磨玻璃病灶体积比也随着临床分型的加重而增大。同时病理相关研究表明,磨玻璃病变反应了肺泡腔的肿胀、炎性渗出等,而当渗出进一步增加,细胞纤维黏液样渗出物比例增多,其密度相应增高[7]。当而本研究显示,糖尿病组的病灶体积更大、实性成分占比更高、呈大片状或束带状比例更高,进一步说明其临床症状越严重。这支持了Koh等[18]研究,即糖尿病患者发生不良预后的比例明显增加。
本研究进一步支持了上述发现,糖尿病合并COVID-19患者的肺部感染情况更重、范围更大,故对其应进行及时有效的干预治疗。此外,在CT征象方面,糖尿病合并COVID-19患者出现空气支气管征、空气潴留征、马赛克灌注及胸膜下黑带的比例更高,而以上征象反应了病变累及小气道导致的气体潴留,同时反应了其合并细菌性感染的可能。而糖尿病患者机体免疫力相对下降,其合并不同菌群感染的风险相应上升[19]。
本研究的局限性:①本研究为单中心、回顾性研究,样本量较小,有待于进一步的大样本研究;②本研究仅将 COVID-19分为糖尿病组及非糖尿病组,未对其血糖水平进行进一步划分,原因主要是门诊患者的血糖资料不足;③本研究未对糖尿病 COVID-19患者的预后情况进行分析,下一步将进行相关随访、开展研究。
本研究表明,糖尿病合并COVID-19患者的肺部病变具有相对的特征性,基于深度学习的CT定量学指标显示糖尿病组的COVID-19患者肺部受累的病变范围更大、程度更重,其实性病灶成分占比相对增加,基于以上发现,及时对糖尿病合并COVID-19患者进行临床干预治疗具有重要意义。
-
图 1 糖尿病合并COVID-19患者的胸部CT病灶征象
患者,男,82岁,发热、咳嗽、咳痰3日就诊,既往合并糖尿病病史,就诊时C反应蛋白为82.61 mg/L、淋巴细胞百分比10.30%、中性粒细胞百分比为85.10%。(a)~(c)显示了基于深度学习的CT定量软件对病灶的划分;(d)~(f)显示了患者胸部CT病灶呈斑片状、大片状、束带状分布,可见马赛克灌注((d)星号)、铺路石征((d)箭头)、胸膜下黑带((e)箭头)及胸膜凹陷征((f)箭头)。
Figure 1. Chest CT lesion signs in COVID-19 patients with diabetes mellitus
表 1 糖尿病合并COVID-19患者的临床资料
Table 1 Clinical information of COVID-19 patients with diabetes mellitus
临床指标 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $Z/\chi ^2 $ P 年龄/岁($M(Q_1,Q_3)$) 73.0(66.0,84.0) 70.0(62.0,79.5) -1.607 0.108 性别(男,例(%)) 25(64.1) 37(50.7) 1.852 0.174 发病时间/天($M(Q_1,Q_3)$) 7(5.0,10.0) 7(5.5,10.0) -1.122 0.262 临床症状/例(%) 发热 39(100.0) 73(100.0) - - 喘憋 8(20.5) 14(19.2) 0.029 0.865 咳嗽 36(92.3) 67(91.8) - 1.000 咳痰 20(51.3) 37(50.7) 0.004 0.952 咽痛 16(41.0) 30(41.1) <0.001 0.994 流涕 11(28.2) 26(35.6) 0.631 0.427 肌痛 4(10.3) 4(5.5) - 0.446 实验室指标/(指标值$(M(Q_1,Q_3)$) C反应蛋白/(mg/L) 35.2(14.2,76.9) 19.9(5.6,44.5) -2.519 0.012 白细胞/(×109/L) 6.4(4.5,7.8) 6.4(5.0,8.0) -0.684 0.494 淋巴细胞百分比/% 21.0(13.3,26.4) 22.8(16.3,32.1) -1.374 0.169 单核细胞百分比/% 6.3(5.1,9.4) 7.0(5.7,9.0) -0.785 0.432 中性粒细胞百分比/% 70.1(64.3,81.5) 66.4(58.2,75.5) -1.817 0.069 淋巴细胞/(×109/L) 1.3(0.8,1.9) 1.4(1.1,1.9) -1.655 0.098 单核细胞/(×109/L) 0.4(0.3,0.6) 0.5(0.4,0.6) -1.705 0.088 中性粒细胞/(×109/L) 4.2(3.2,6.0) 4.1(3.1,5.8) -0.037 0.971 表 2 糖尿病合并COVID-19患者的CT影像定量指标情况
Table 2 Quantitative CT imaging indicators in COVID-19 patients with diabetes mellitus
病变分布 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $Z/\chi^2 $ P 病灶数目/(个,$M(Q_1,Q_3)$) 全肺 8.0(5.0,12.0) 6.0(3.0,9.0) -2.269 0.023 左肺 4.0(2.0,6.0) 2.0(2.0,4.0) -2.373 0.018 右肺 3.0(3.0,7.0) 3.0(2.0,5.0) -1.569 0.117 病灶体积/(cm3,$M(Q_1,Q_3)$) 全肺 317.3(69.9,666.4) 152.3(26.3,378.6) -2.648 0.008 左肺 133.0(24.2,320.6) 36.0(5.9,130.3) -3.387 0.001 右肺 134.2(31.8,397.6) 97.8(11.0,242.5) -1.793 0.073 病灶占比/(%,$M(Q_1,Q_3)$) 全肺 9.3(1.7,19.0) 4.1(0.6,9.5) -2.602 0.009 左肺 10.3(1.4,17.3) 2.1(0.4,6.7) -3.232 0.001 右肺 7.2(1.2,25.2) 3.8(0.6,10.3) -1.862 0.063 磨玻璃病灶体积/(cm3,$M(Q_1,Q_3)$) 254.7(62.9,487.5) 125.3(23.3,311.7) -2.483 0.013 实性病灶体积/(cm3, $M(Q_1,Q_3)$) 52.9(6.7,172.2) 18.1(2.2,53.9) -3.020 0.003 磨玻璃病灶占比/(%, $M(Q_1,Q_3)$) 82.6(73.1,91.5) 85.8(79.9,93.7) -2.180 0.029 实性病灶占比/(%, $M(Q_1,Q_3)$) 17.4(8.5,26.9) 14.2(6.3,20.1) -2.177 0.029 磨玻璃实性病灶体积比/(%,$M(Q_1,Q_3)$) 4.8(2.7,10.8) 6.0(4.0,15.0) -2.171 0.030 纵隔淋巴结/(个,$M(Q_1,Q_3)$) 2.0(1.0,3.0) 1.0(0,2.0) -3.848 <0.001 表 3 糖尿病合并COVID-19患者的胸部CT病灶征象情况
Table 3 Chest CT lesion signs in COVID-19 patients with diabetes mellitus
影像指标 组别 统计检验 糖尿病组(39例) 非糖尿病组(73例) $\chi^2 $ P 分布模式/(例(%)) 支气管血管束分布 0(0.0) 2(2.7) 2.605 0.107 胸膜下分布 3(7.7) 14(19.2) - 0.542 混合分布 36(92.3) 57(78.1) 4.062 0.044 病变形态/(例(%)) 结节状 26(66.7) 49(68.1) 0.022 0.881 斑片状 37(94.9) 70(95.9) - 1.000 大片状 29(74.4) 38(52.1) 5.261 0.022 束带状 22(56.4) 23(31.5) 6.559 0.010 特殊征象/(例(%)) 晕征 37(94.9) 54(74.0) 7.288 0.007 反晕征 18(46.2) 30(41.1) 0.266 0.606 蜂窝征 2(5.1) 4(5.5) - 1.000 铺路石征 24(61.5) 35(47.9) 1.884 0.170 空气支气管征 34(87.2) 49(67.1) 5.329 0.021 空气潴留征 18(46.2) 19(26.0) 4.655 0.031 马赛克灌注 28(71.8) 28(38.4) 11.369 0.001 胸膜下线 15(38.5) 23(31.5) 0.548 0.459 胸膜凹陷征 26(66.7) 44(60.3) 0.443 0.506 胸膜下黑带 30(76.9) 35(47.9) 8.765 0.003 -
[1] BAI Y, YAO L, WEI T, et al. Presumed asymptomatic carrier transmission of COVID-19[J]. Journal of the American Medical Association, 2020, 323(14): 1406−1407. doi: 10.1001/jama.2020.2565
[2] GUAN W J, NI Z Y, HU Y, et al. Clinical characteristics of coronavirus disease 2019 in China[J]. New England Journal of Medicine, 2020, 382(18): 1708−1720. doi: 10.1056/NEJMoa2002032
[3] CHEN Y, GONG X, WANG L, et al. Effects of hypertension, diabetes and coronary heart disease on COVID-19 diseases severity: A systematic review and meta-analysis[J]. Cold Spring Harbor Laboratory Press, 2020.
[4] WU C, CHEN X, CAI Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China[J]. JAMA Internal Medicine, 2020, 180(7): 2020, 180(7): 934-943.
[5] RANGANKAR V, KOGANTI D V, LAMGHARE P, et al. Correlation between CT severity scoring and diabetes mellitus in patients with COVID-19 infection[J]. Cureus, 2021, 13(12): e20199.
[6] 杜丹, 谢元亮, 李惠, 等. 人工智能定量测量对新型冠状病毒肺炎患者胸部CT炎性病灶动态变化的评估价值[J]. 中华放射学杂志, 2021,55(3): 250−256. doi: 10.3760/cma.j.cn112149-20200330-00474 DU D, XIE Y L, LI H, et al. The value of quantitative artificial intelligence measurement in evaluation of CT dynamic changes for COVID-19[J]. Chinese Journal of Radiology, 2021, 55(3): 250−256. (in Chinese). doi: 10.3760/cma.j.cn112149-20200330-00474
[7] 朱桐, 黄璐, 严祥虎, 等. 基于机器学习的CT定量指标与新型冠状病毒肺炎临床分型及肺损伤严重程度的相关性研究[J]. 中华放射学杂志, 2021, 55(3): 239-244. ZHU T, HUANG L, YAN X H, et al. Correlation study between quantitative characteristics of CT lung opacification based on machine learning and clinical subtypes and severity of lung injury of COVID-19[J]. Chinese Journal of Radiology, 2021, 55(3): 239-244. (in Chinese).
[8] 中华人民共和国国家卫生健康委员会. 新型冠状病毒感染诊疗方案(试行第十版)[J]. 中华临床感染病杂志, 2023,16(1): 1−9. doi: 10.3760/cma.j.issn.1674-2397.2023.01.001 [9] 中华医学会糖尿病学分会, 国家基层糖尿病防治管理办公室. 国家基层糖尿病防治管理指南(2022)[J]. 中华内科杂志, 2022,61(3): 249−262. doi: 10.3760/cma.j.cn112138-20220120-000063 [10] 孙莹, 李玲, 刘晓燕, 等. 早期新型冠状病毒肺炎的胸部薄层平扫CT表现特征[J]. CT理论与应用研究, 2023,32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. SUN Y, LI L, LIU X Y, et al. Imaging features of early COVID-19 on chest thin-slice non-enhanced CT[J]. CT Theory and Applications, 2023, 32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. (in Chinese).
[11] DEBI H, ITU Z T, AMIN M T, et al. Association of serum C-reactive protein (CRP) and D-dimer concentration on the severity of COVID-19 cases with or without diabetes: A systematic review and meta-analysis[J]. Expert Review of Endocrinology & Metabolism, 2022, 17(1): 83−93.
[12] CAUSSY C, PATTOU F, WALLET F, et al. Prevalence of obesity among adult inpatients with COVID-19 in France[J]. Lancet Diabetes Endocrinol, 2020, 8(7): 562−564. doi: 10.1016/S2213-8587(20)30160-1
[13] WANG G, WU C, ZHANG Q, et al. C-reactive protein level may predict the risk of COVID-19 aggravation[J]. Open Forum Infectious Diseases, 2020, 7(5): ofaa153. DOI: 10.1093/ofid/ofaa153.
[14] 孙明谨, 李雪锋, 陈世清, 等. 2型糖尿病血清C反应蛋白及血白细胞变化[J]. 中国医师杂志, 2005,7(11): 2. SUN M J, LI X F, CHEN S Q, et al. Changes of serum C-reactive protein and white blood cells in type 2 diabetes mellitus[J]. Journal of Chinese Physician, 2005, 7(11): 2. (in Chinese).
[15] ERENER S. Diabetes, infection risk and COVID-19[J]. Molecular Metabolism, 2020, 39: 101044. doi: 10.1016/j.molmet.2020.101044
[16] 相萍萍, 韦晓, 刘超. 新型冠状病毒肺炎与糖尿病: 我们何去何从?[J]. 国际内分泌代谢杂志, 2022,(1): 50−53. doi: 10.3760/cma.j.cn121383-20201116-11033 XIANG P P, WEI X, LIU C. New coronavirus pneumonia and diabetes: Where shall we go?[J]. International Journal of Endocrinology and Metabolism, 2022, (1): 50−53. (in Chinese). doi: 10.3760/cma.j.cn121383-20201116-11033
[17] BERNHEIM A, MEI X, HUANG M, et al. Chest CT findings in coronavirus disease-19 (COVID-19): Relationship to duration of infection[J]. Radiology, 2020, 295(3): 200463. doi: 10.1148/radiol.2020200463
[18] KOH H, MOH A, YEOH E, et al. Diabetes predicts severity of COVID-19 infection in a retrospective cohort: A mediatory role of the inflammatory biomarker C-reactive protein[J]. Journal of Medical Virology, 2021, 93(5): 3023−3032. doi: 10.1002/jmv.26837
[19] 王菁, 纪小奇, 姚莉. 2型糖尿病合并感染发生MODS的危险因素分析[J]. 中华内分泌外科杂志, 2019,13(3): 5. doi: 10.3760/cma.j.issn.1674-6090.2019.03.003 WANG J, JI X Q, YAO L. Analysis of risk factors for multiple organ dysfunction syndrome in patients with type 2 diabetes mellitus complicated with infection[J]. Chinese Journal of Endocrine Surgery, 2019, 13(3): 5. (in Chinese). doi: 10.3760/cma.j.issn.1674-6090.2019.03.003
-
期刊类型引用(1)
1. 张明霞,李玲,高兰,王玉华,孙莹,孙磊,霍萌,张春燕,王仁贵. 不同预后的抗MDA5抗体阳性IIMs患者肺部HRCT定量指标与临床研究. CT理论与应用研究. 2024(03): 351-358 .  本站查看
本站查看
其他类型引用(0)



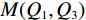
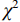
 下载:
下载:



