Imaging Features of Patients with Coronavirus Disease 2019 with/without Underlying Diseases
-
摘要: 目的:探讨合并基础病和未合并基础病的新型冠状病毒感染(COVID-19)患者的影像学特征。材料与方法:回顾性收集首都医科大学附属北京世纪坛医院于2022年11月16日至2022年12月16确诊为COVID-19的患者153例。患者均自发病后1~14 d行胸部薄层CT平扫检查。根据或者有无基础病将其分为两组,其中合并基础病患者42例,未合并基础病患者111例,对比分析两组患者的差异。结果:两组患者在发病年龄、咳嗽、双肺分布、弥漫性分布、肺内蜂窝样改变、斑片状分布、大片状分布、束带样分布、铺路石征、空气支气管征、牵拉性支气管扩张及胸腔积液上差异有统计学意义。结论:COVID-19患者临床以发热和咳嗽症状最多见,胸部CT可见双肺多发病灶,病灶类型以支气管血管束增厚及GGO为著。合并基础病的患者在蜂窝样改变、铺路石征、空气支气管征、牵拉性支气管扩张及胸腔积液上较未合并基础病的患者更多。胸部薄层CT扫描对疾病的早期发现及诊断提供了关键的参考。Abstract: Objective: To explore the imaging characteristics of patients with novel coronavirus pneumonia (COVID-19) combined with different underlying diseases. Materials and methods: COVID-19 was diagnosed in 153 patients at Beijing Shijitan Hospital, Capital Medical University, from November 16, 2022 to December 16, 2022, and data were retrospectively collected. All patients underwent chest CT scan from 1 to 14 days after onset and were divided into two groups based on the presence or absence of underlying diseases. Forty-three patients had underlying diseases, and 110 patients had none. We compared the differences between the two groups. Result: The comparison between the two groups showed statistically significant differences in age, cough, bilateral lung distribution, diffuse distribution, honeycomb-like changes in the lungs, patchy distribution, large patchy distribution, band distribution, crazy-paving sign, air bronchogram sign, traction bronchiectasis, and pleural effusion. Conclusion: Fever and cough are the most common clinical symptoms in patients with COVID-19. Chest CT showed multiple lesions in both lungs. The most common types of lesions were thickening of bronchovascular bundle and GGO. Patients with underlying diseases had more honeycomb-like changes, crazy-paving sign, air bronchogram sign, traction bronchiectasis, and pleural effusion than those without underlying diseases. Chest thin-slice CT scan provides a key reference for the early detection and diagnosis of the disease.
-
Keywords:
- X-ray computer /
- tomography /
- COVID-19 /
- underlying disease
-
肺癌已经成为世界各地癌症患者死亡的主要原因[1]。近年来,肺亚实性结节(subsolid nodules,SSNs)的检出率逐年增高,SSNs经常和肺腺癌有关[2]。由于不同病理阶段的SSNs的临床预后及治疗策略不同,因此术前影像学评估SSNs的侵袭程度对临床决策具有重要的意义[3-4]。以往对SSNs的大小测量多以最大横截面的最大横径来代表SSNs大小,以手动勾画感兴趣区内的平均CT值代表结节密度[5-8]。
本研究根据2021年WHO肺腺癌新分类标准,分为腺体前驱病变组(非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS))和腺癌组(微浸润性腺癌(minimally invasive adenocarcinoma,MIA)、浸润性腺癌(invasive adenocarcinoma,IAC)),利用一款可以测量肺结节体积密度的人工智能(artificial intelligence,AI)分析软件,对病灶进行三维定量分析;利用AI体积密度法绘制CT值分布直方图,获得体积密度系列参数,探讨AI体积密度法判断肺亚实性结节浸润性的价值。
1. 材料与方法
1.1 研究对象
收集2013年1月至2022年4月于我院收治,有完整术前胸部CT、临床资料并经病理证实的108枚SSNs。根据2021年WHO肺腺癌新分类标准,分为腺体前驱病变组25例,包括AAH 3例、AIS 22例;腺癌组83例,包括MIA 16例、IAC 67例。
纳入标准:①肺内至少 1个 SSN,大小范围为0.5~3 cm之间;②在我院行手术切除,术后病理结果经复阅证实为AAH、AIS、MIA及IAC;③具有完整 CT图像、临床和病理数据。排除标准:①术后病理证明为良性疾病或其他肺癌的病理亚型;②患者有肺部多发转移瘤或其他部位原发肿瘤;③患者曾行全身化疗。
1.2 设备与参数采集
指导患者呼吸训练后,仰卧位进行胸部CT平扫。采用GE LightSpeed VCT及宝石CT、西门子SOMATOM Definition Flash双源CT、东芝Aquilion ONE 320排CT进行扫描。扫描参数:①GE LightSpeed VCT及宝石CT:管电压120 kV,自动管电流,层厚5 mm,重建层厚1.25 mm,螺距1.0,显示野(FOV)360 mm;②SOMATOM Definition Flash双源CT:管电压120 kV,自动管电流,层厚5 mm,重建层厚1 mm,螺距1,显示野(FOV)400 mm;③Aquilion ONE 320排CT:管电压120 kV,自动管电流,层厚5 mm,重建层厚0.8 mm,螺距0.516,显示野(FOV)400 mm。
扫描矩阵512×512,并采用肺高分辨算法进行重建(图1)。将扫描得到的原始数据上传至AI肺结节筛查系统进行观察。
1.3 AI参数采集及分析
基于深度学习模型的AI软件由推想预测提供,将图像数据由PACS系统传输至“推想预测”工作站(https://www.infervision.com/),软件自动对SSNs进行分割,记录结节体积及平均径,获取CT值分布直方图,并记录该SSN的以下参数:最大CT值、最小CT值、平均CT值、偏度、峰度、CT百分位数值,其中百分位数值包括第25百分位数(Perc.25%)、第50百分位数(Perc.50%)、第75百分位数(Perc.75%)、第95百分位数(Perc.95%)。
1.4 统计学分析
计数资料以例数(百分比)表示,当T<5且n≥40时采用Fisher确切概率法检验,当T≥5、n≥40时差异性分析采用卡方检验。计量资料首先进行正态性检验,服从正态分布的数据以均值±标准差表示,采用独立样本t检验;不服从正态分布的数据以中位数(四分位间距)表示,采用Mann-Whitney U检验。利用Medcalc软件对有统计意义的变量绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC),并得出最佳临界值。采用Logistic回归分析探究数学建模对腺体前驱病变组及腺癌组的鉴别诊断能力。P<0.05为差异有统计学意义。
2. 结果
2.1 两组临床资料比较
两组中,女性患者多于男性,但性别差异无统计学意义(表1)。女性患者在各类型中所占比例分别为:18/25(72.00%)、51/83(61.45%);男性所占比例为:7/25(28.00%)、32/83(38.55%)。年龄差异在两组间无统计学意义;腺体前驱病变组患者平均年龄(60.93±8.72)岁,腺癌组患者平均年龄(60.78±9.68)岁。结节发生部位在各组之间没有统计学意义,但病灶在各组间均以右肺上叶为好发部位。结节类型在两组之间的差异无统计学意义(表1)。
表 1 腺体前驱病变组与腺癌组临床资料比较Table 1. Comparison of clinical data between the glandular prodromal disease group and adenocarcinoma group临床资料 组别 统计检验 腺体前驱病变组(25例) 腺癌组(83例) t/χ2 P 年龄/岁 60.93±8.72 60.78±9.68 0.088 0.930 性别 男 7 32 0.928 0.335 女 18 51 结节分布 右上 13 34 4.263 0.370 右中 1 5 右下 5 14 左上 3 19 左下 3 11 结节类型 pGGNs 5 13 0.260 0.760 mGGNs 20 70 2.2 两组CT分布直方图纹理参数、结节体积、结节平均径比较
腺体前驱病变组和腺癌组的CT最大值、CT最小值、平均CT值、偏度、Perc.25%、Perc.50%、Perc.75%、结节体积、结节平均径的差异有统计学意义,峰度、Perc.95% 的差异无统计学意义(表2)。
表 2 腺体前驱病变组、腺癌组的CT值分布直方图纹理参数及结节体积、结节平均径比较Table 2. Comparison of the CT value distribution histogram texture parameters, nodule volume and mean nodule diameter between the glandular precursor lesion group and adenocarcinoma group参数 组别 P 腺体前驱病变组(n=25) 腺癌组(n=83) 偏度/HU 0.45(0.25~0.70) 0.215(0.06~0.45) 0.001 峰度/HU -0.64(-1.03~-0.02) -0.95(-1.10~-0.53) 0.260 CT最大值/HU 22.00(-122.00~126.00) 167.00(41.00~338.00) <0.001 CT最小值/HU -757.00(-782.00~-711.00) -653.00(-752.25~-597.00) <0.001 平均CT值/HU -536.67±99.18 -390.16±165.59 <0.001 Perc.25%/HU -605.00(-659.00~-496.00) -416.00(-532.25~-233.50) <0.001 Perc.50%/HU -580.00(-650.00~-522.00) -418.50(-545.00~-296.00) <0.001 Perc.75%/HU -508.00(-673.00~-433.00) -449.00(-610.00~-208.75) 0.003 Perc.95%/HU -329.00(-722.00~-107.00) -528.50(-685.00~-5.25) 0.819 结节体积/mm3 646.86(278.79~1647.36) 1467.00(534.50~3270.94) <0.001 结节平均直径/mm 9.90(8.40~13.50) 15.65(11.12~19.65) <0.001 2.3 诊断效能
将两组差异有统计学意义的变量行ROC分析。其中,Perc.25% 诊断效能最佳并且敏感度最高,AUC值达0.797,诊断敏感度86.75%,特异性68.00%,诊断临界值 -578 HU;CT值平均值与Perc.50% 曲线下面积相等(AUC值0.787),诊断敏感度72.29%,特异性84.00%,诊断临界值-468 HU,阳性预测值最高(97.90%);将诊断效能最高的Perc.25% 分别于与Perc.50% 和平均CT值两两建立联合诊断模型,判断SSNs的浸润性均有诊断意义(图2和图3),其中Perc.25% 与平均CT值的模型诊断效最高(敏感度75.90%,特异度76.00%,AUC值0.816)且联合诊断模型诊断效能高于Perc.25%与平均CT值单独的诊断效能。
由于结节平均径常用于影像科医生判断SSNs浸润性的日常工作中,且两组间结节平均直径的差异具有统计学意义,本研究将诊断效能最高的Perc.25% 与结节平均直径结合得出联合诊断模型2,联合模型2曲线下面积为0.816,相比于结节平均径单独使用提高了诊断效能,并且得到了91.7的阳性预测值(表3)。
表 3 ROC分析结果Table 3. ROC analysis results参数 AUC 最佳临界值 敏感度/% 特异性/% 阳性预测
值/%阴性预测
值/%95% CI 下限 上限 偏度 0.689 0.24 56.63 76.00 88.7 34.5 0.593 0.775 CT最大值/HU 0.725 39.00 77.11 64.00 87.7 45.7 0.631 0.807 CT最小值/HU 0.731 -692.00 62.65 88.00 94.5 41.5 0.737 0.812 平均CT值/HU 0.787 -468.00 72.29 84.00 97.9 47.7 0.697 0.860 Perc.25%/HU 0.797 -578.00 86.75 68.00 90.0 60.7 0.709 0.869 Perc.50%/HU 0.787 -500.00 71.08 84.00 93.7 46.7 0.698 0.860 Perc.75%/HU 0.678 -474.00 57.83 76.00 88.9 35.2 0.581 0.765 体积/mm3 0.701 777.38 73.49 64.00 87.1 42.1 0.606 0.785 平均径/mm 0.718 13.50 63.86 76.00 89.9 38.8 0.623 0.800 联合模型1 0.814 - 75.90 76.00 91.3 48.7 0.728 0.883 联合模型2 0.816 - 75.90 76.00 91.7 48.3 0.730 0.884 3. 讨论
随着AI软件逐渐运用于肺结节的辅助诊断[9-10],影像科医生发现图像纹理分析不仅能探测到肿瘤的微观信息[11],还可提供可量化的参数用于鉴别诊断。CT分布直方图作为一种非侵入性检查手段,将患者影像图像的面积或体积像素进行统计并以更直观的方式表现出来,让影像科医生获得更多有利于诊断的CT定量参数。目前已有部分研究对SSNs的CT值分布直方图进行研究[12-14],结合多个参数值能全面反映SSNs的细微变化,对病变的浸润性起到提示作用。
本研究结果显示,SSNs的CT最大值、CT最小值、平均CT值、偏度、Perc.25%、Perc.50%、Perc.75% 分别与侵袭性有显著的相关性。这些结果表明,CT定量参数,特别是Perc.25% 有助于提高影像科医生对SSNs患者的认识,AUC值达0.797,诊断敏度86.75%,特异性68.00%,Perc.25%≥-578 HU的SSNs表现为腺癌组可能性大。
本研究得出最大CT值优于峰度来区分SSNs的浸润性,与张宏等[15]结果一致。行ROC曲线分析可知,CT最大值的AUC值达0.725,诊断敏感度77.11%,特异度64.00%,当CT最大值≥39 HU的SSNs表现为腺癌组可能性大。本文得出CT最小值对判断SSNs的侵袭性具有诊断价值,经统计学分析得出CT最小值的AUC值达0.731,诊断敏感度达62.65%,特异性为88.00%,当CT最小值≥-692 HU时诊断为腺癌组的可能性最大,与张宏等[15]结果不一致,但与徐小东等[16]结果一致。
我们认为,最小CT值不能客观反映病变内部密度的差异,只能代表SSNs未被肿瘤细胞充满的部分肺组织的密度。Kitami等[17]发现直径<1 cm或平均CT值为 -600 HU的肺纯磨玻璃结节可作为区分未侵袭性病变和侵袭性病变的临界值。本研究得出平均CT值与蔡雅倩[12]结果不同,我们认为AI勾画SSNs时已经避免勾画病灶周围的血管、支气管,但是不可避免的是依旧受患者基础疾病、年龄等因素影响。直方图的偏度是描述变量分布的是否对称的统计量,偏度绝对值越大,分布形态偏移的程度越大。与本文得出的结果相反,本文得出腺体前驱病组的偏度高于腺癌组。导致结果出现偏差的原因是本研究在设计上是回顾性的,且本研究采纳符合去选标准的AAH仅有3例,结果有差异。仅包括接受手术切除的SSNs,而一些每年随访的SSNs由于没有病理诊断而被排除。
Ikeda等[18]指出,CT密度的Perc.75% 有可能区分AAH和肺腺癌,通过ROC曲线分析得知,本研究得出鉴别腺体前驱病变与腺癌的Perc.25%、Perc.50%、Perc.75% 最佳临界值分别为 -578 HU、-500 HU、-474 HU,曲线下面积(AUC)分别为0.797、0.787、0.678,其中Perc.25%、Perc.50% 的AUC值0.7~0.9之间,这说明CT分布直方图的Perc.25%、Perc.50% 对腺体前驱病变组与腺癌组SSNs具有一定的鉴别诊断价值。在9个CT分布直方图参数中,对于腺体前驱病变组和腺癌组的鉴别,以 -578 HU为临界值的Perc.25% 为最佳,其诊断敏感度为86.75%,特异性为68.00%。
随着病变的病理浸润度逐渐增加,从AAH、AIS到MIA再到IAC,SSNs的大小逐渐增大[19]。既往研究[20]证实CT定量参数中特别是结节最长径对预测肺SSNs病变的侵袭性具有重要意义,本研究结果显示,SSNs的最大直径与侵袭性有显著的相关性。通过ROC曲线分析,本研究得出>13.50 mm是预测SSNs浸润性的可靠因子,诊断的敏感度、特异性分别为63.86%、76.00%,AUC为0.718(表3)。步玉兰等[21]的研究表明12.5 mm是侵袭前组和侵袭组的最佳直径临界值,略低于本研究的最佳临界值(13.50 mm),存在这种差异可能的原因是,步玉兰等[20]在分组时将 MIA归为浸润性病变组。在本研究中,MIA与IAC一起被分配到腺癌组,这一结果与Liu等[22]的结果相似。本研究将诊断效能最高的Perc.25% 与结节平均径结合得出联合诊断模型2,联合模型2曲线下面积为0.816,相比于结节平均径提高了诊断效能,并且得到了91.7的阳性预测值。
一般认为随着SSNs体积的增大,病灶内的实性部分趋于出现;体积的增大与SSNs的病理组织学类型是密切相关的,并不同程度上反映了侵袭程度。本研究对于SSNs结果与以往文献报道基本一致,结节的体积与侵袭性有显著的相关性,诊断的敏感度、特异性分别为73.49%、64.00%,AUC为0.701,阳性预测值为87.10%(表3)。本研究建立的Logistic回归模型(灵敏度、特异度和AUC值分别为63%、81% 和0.769)能较好地预测SSNs肺腺癌的CT病理分级,其预测值明显高于单独使用各定量参数。术前预测CT影像特征的病理分型有助于提高术前诊断和鉴别诊断水平,正确的诊断结果可以有效提高患者的存活率。
近年来,伴随着人工智能在医学技术诊断工作中的大量投入,影像医生身上的重担虽然被人工智能分担了一部分,但是责任从未减轻。本研究使用基于深度学习的AI肺结节筛查系统,对SSNs进行三维定量分析,绘制CT值分布直方图,获得体积密度系列定量参数,鉴别肺部腺体前驱病变与腺癌,为能够辅助临床进行精确的诊断以及辅助临床能够为患者提供积极的治疗方法。不足之处是手动勾画存在主观性,用感兴趣区得出CT值分布直方图反映的是二维层面的的密度并不能反映结节三维空间的不均质生长。本研究采用的是AI自动分割结节软件,避免手动分割结节产生的误差。
本研究的局限性。①这是一项源自实际临床实践的回溯性研究,为了证实本研究的结论,有必要进行前瞻性的大样本研究;②仅使用手术病例存在一定的选择性偏差;③样本量相对较小,本研究采用AI软件自动勾画所有结节的轮廓,存在勾画在内的小血管及小气管,可能影响直方图特征。未来希望能够进一步扩大样本量,采取合适的病灶选取办法,完善此项研究。
-
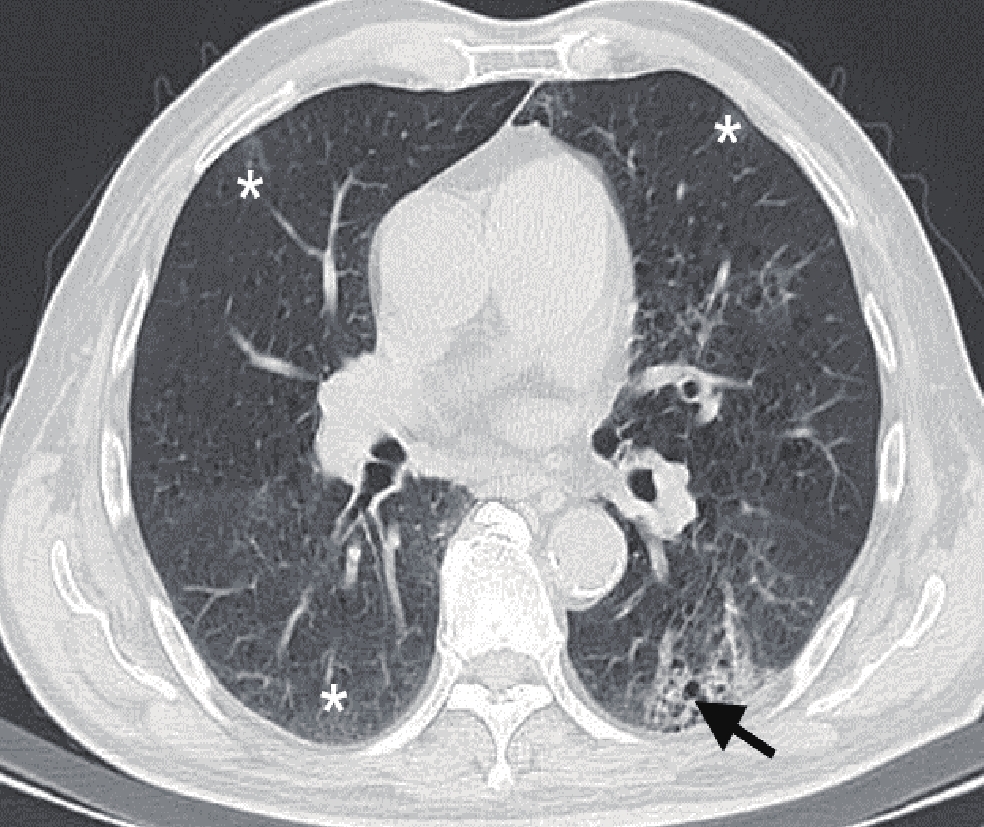
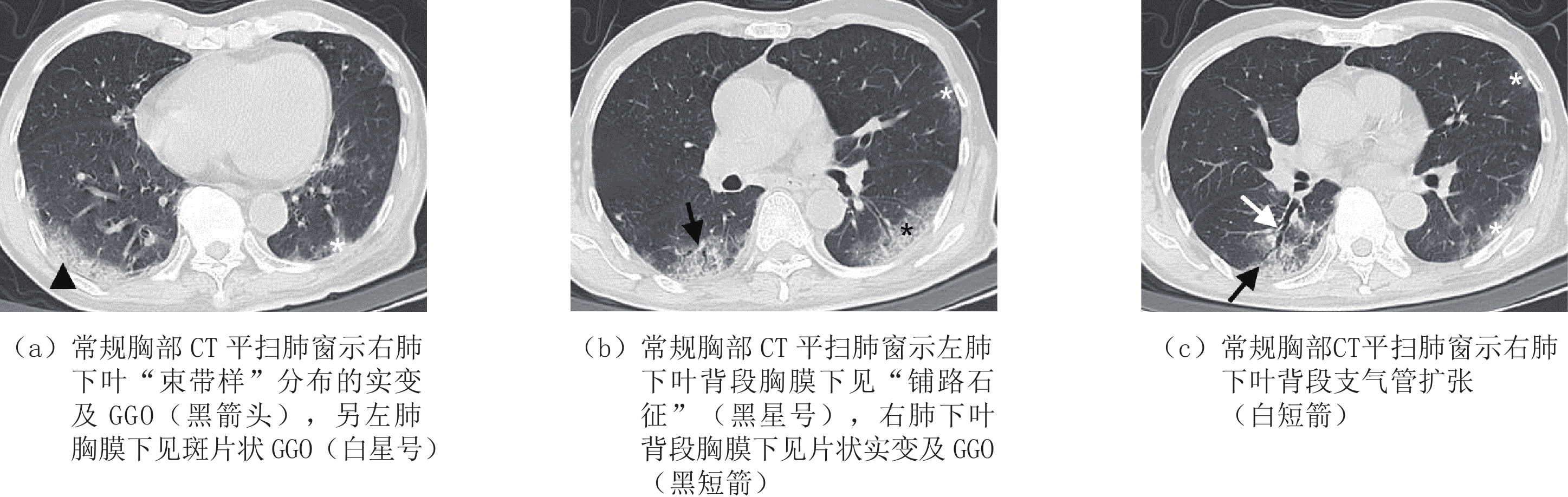
表 1 是否合并基础病的COVID-19患者一般资料比较
Table 1 Comparison of general data of COVID-19 patients with or without underlying diseases
一般情况 组别 统计检验 A组(n=42)/例(%) B组(n=111)/例(%) $\chi^2$ P 性别 男性 25(59.5) 56(50.5) 1.007 0.316 女性 17(40.5) 55(49.5) 发病中位数年龄/岁(四分位间距) 83.0(11.0) 63.0(16.0) - <0.001 病程/d ≤7 29(69.0) 75(67.6) 0.031 0.861 >7 13(31.0) 36(32.4) 表 2 是否合并基础病的COVID-19患者临床症状比较
Table 2 Comparison of clinical symptoms of COVID-19 patients with or without underlying diseases
临床症状 组别 统计检验 A组(n=42) B组(n=111) $\chi^2$ P 发热 16(38.1) 51(45.9) 0.763 0.382 胸闷 6(14.3) 29(26.1) 2.421 0.120 咳嗽 7(16.7) 41(36.9) 5.815 0.016 肌肉酸痛 0(0.0) 1(0.9) - 1.000 骨痛 0(0.0) 1(0.9) - 1.000 表 3 是否合并基础病的COVID-19患者肺内病灶分布情况对比
Table 3 Comparison of lesion distribution of COVID-19 patients with or without underlying diseases
分布情况 组别 统计检验 A组(n=42) B组(n=111) $\chi^2$ P 数量 单发 1(2.4) 5(4.5) 0.019 0.891 多发 41(97.6) 106(95.5) 0.019 0.891 累及部位 单叶 1(2.4) 16(14.4) 3.332 0.068 单肺 2(4.8) 6(5.4) 0.000 1.000 双肺 40(95.2) 88(79.3) 3.836 0.050 分布 胸膜下 32(76.2) 77(69.4) 0.692 0.405 胸膜内 39(92.9) 101(91.0) 0.002 0.964 弥漫性 35(83.3) 11(9.9) 78.125 <0.001 血管束 38(90.5) 90(81.1) 1.968 0.161 对称分布 26(61.9) 54(48.6) 2.146 0.143 非叶段分布 39(92.9) 90(81.1) 3.195 0.074 表 4 是否合并基础病的COVID-19患者肺内异常征象比对
Table 4 Comparison of abnormal pulmonary signs in COVID-19 patients with or without underlying diseases
影像学征象 组别 统计检验 A组(n=42) B组(n=111) $\chi^2$ P 病变类型 GGO 41(97.6) 99(89.2) 1.806 0.179 实变 19(45.2) 50(45.0) 0.000 0.983 网格 37(88.1) 85(76.6) 2.502 0.114 蜂窝 7(16.7) 4(3.6) 5.958 0.015 血管束增厚 42(100.0) 102(91.9) 2.302 0.129 混合 41(97.6) 95(85.6) 3.332 0.068 病变形态 结节 31(73.8) 93(83.8) 1.973 0.160 肿块 1(2.4) 1(0.9) - 0.475 树芽 11(26.2) 42(37.8) 1.826 0.177 斑片 39(92.9) 88(79.3) 3.982 0.046 大片 32(76.2) 52(46.8) 10.597 0.001 束带样 24(57.1) 32(28.8) 10.527 0.001 混合 40(95.2) 93(83.8) 3.518 0.061 病灶边缘 模糊 19(45.2) 63(56.8) 1.626 0.202 不规则 18(42.9) 54(48.6) 0.410 0.522 分叶 1(2.4) 15(13.5) 2.932 0.087 毛刺 21(50.0) 46(41.4) 0.907 0.341 伴随征象 晕征 31(73.8) 80(72.1) 0.046 0.830 反晕征 17(40.5) 38(34.2) 0.516 0.473 铺路石征 34(81.0) 54(48.6) 13.013 0.000 空气支气管征 37(88.1) 72(64.9) 8.026 0.005 空气潴留征 15(35.7) 34(30.6) 0.362 0.548 马赛克征 24(57.1) 44(39.6) 3.781 0.052 牵拉性支气管扩张 29(69.0) 54(48.6) 5.109 0.024 胸腔积液 4(9.5) 1(0.9) - 0.022 -
[1] XIE J, WANG Q, XU Y, et al. Clinical characteristics, laboratory abnormalities and CT findings of COVID-19 patients and risk factors of severe disease: A systematic review and meta-analysis[J]. Annals of Palliative Medicine, 2021, 10(2): 1928−1949. doi: 10.21037/apm-20-1863
[2] TANG Y, LIAO H, WU Q, et al. Chest CT imaging characteristics and their evolution of 48 patients with COVID-19 in Hengyang, China[J]. American Journal of Translational Research, 2021, 13(9): 9983−9992.
[3] CHAN J F W, YUAN S, KOK K H, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to- person transmission: A study of a family cluster[J]. Lancet, 2020, 395(10223): 514−523. doi: 10.1016/S0140-6736(20)30154-9
[4] STOKES E K, ZAMBRANO L D, ANDERSON K N, et al. Coronavirus disease 2019 case Surveillance-United States, January 22-May 30, 2020[J]. Morbidity and Mortality Weekly Report, 2020, 69(24): 759−765. doi: 10.15585/mmwr.mm6924e2
[5] 中华人民共和国国家卫生健康委员会. 国家卫生健康委员会新闻发布会[EB/OL]. [2020-02-04]. http://news. cctv.com/zhibo/tuwen2016/gjwjw/index.shtml. [6] 中华人民共和国国家卫生健康委员会, 新型冠状病毒感染诊疗方案(试行第十版)[EB/OL]. [2023-01-05]. http://www.gov.cn/zhengce/zhengceku/2023-01/06/5735343/files/5844ce04246b431dbd322d8ba10afb48.pdf. [7] ASSELAH T, DURANTEL D, PASMANT E, et al. COVID-19: Discovery, diagnostics and drug development[J]. Journal of Hepatology, 2021, 74(1): 168−184. doi: 10.1016/j.jhep.2020.09.031
[8] XU Z, SHI L, WANG Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. The Lancet Respiratory Medicine, 2020, 8(4): 420−422. doi: 10.1016/S2213-2600(20)30076-X
[9] ZHU N, ZHANG D, WANG W, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. The New England Journal of Medicine, 2020, 382(8): 727−733. doi: 10.1056/NEJMoa2001017
[10] 仕丽, 丁欢, 王檀, 等. 134例合并不同基础疾病新型冠状病毒肺炎患者转重率分析[J]. 吉林中医药, 2021,41(11): 1458−1461. doi: 10.13463/j.cnki.jlzyy.2021.11.016 SHI L, DING H, WNAG T, et al. An analysis on the aggravation rate of the 134 COVID-19 patients combined with different underlying diseases[J]. Jilin Journal of Traditional Chinese Medicine, 2021, 41(11): 1458−1461. (in Chinese). doi: 10.13463/j.cnki.jlzyy.2021.11.016
[11] HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497−506.
[12] KANNE J P, LITTLE B P, CHUNG J H, et al. Essentials for radiologists on COVID-19: An update-radiology scientific expert panel[J]. Radiology, 2020, 296(2): E113−E114. doi: 10.1148/radiol.2020200527
[13] 黄璐, 韩瑞, 于朋鑫, 等. 新型冠状病毒肺炎不同临床分型间CT和临床表现的相关性研究[J]. 中华放射学杂志, 2020,54(4): 300−304. doi: 10.3760/cma.j.cn112149-20200205-00087 HUANG L, HAN R, YU P X, et al. A correlation study of CT and clinical features of different clinical types of COVID-19[J]. Chinese Journal of Radiology, 2020, 54(4): 300−304. (in Chinese). doi: 10.3760/cma.j.cn112149-20200205-00087
[14] SHI H, HAN X, JIANG N, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: A descriptive study[J]. The Lancet Infectious Disease, 2020, 20(4): 425−434. doi: 10.1016/S1473-3099(20)30086-4
[15] HU Q, GUAN H, SUN Z, et al. Early CT features and temporal lung changes in COVID-19 pneumonia in Wuhan, China[J]. European Journal of Radiology, 2020, 128: 109017. doi: 10.1016/j.ejrad.2020.109017
[16] ZHAO W, ZHONG Z, XIE X, et al. Relation between chest CT findings and clinical conditions of coronavirus disease (COVID-19) pneumonia: A multicenter study[J]. American Journal of Roentgenology, 2020, 214(5): 1072−1077. doi: 10.2214/AJR.20.22976
[17] ZHOU S, ZHU T, WANG Y, et al. Imaging features and evolution on CT in 100 COVID-19 pneumonia patients in Wuhan, China[J]. European Radiology, 2020, 30(10): 5446−5454. doi: 10.1007/s00330-020-06879-6
[18] 李运江, 叶云峰, 宣伟玲, 等. 有无基础疾病的新型冠状病毒肺炎患者首次胸部高分辨率CT表现比较[J]. 浙江医学, 2021,43(14): 1575−1578, 1585. doi: 10.12056/j.issn.1006-2785.2021.43.14.2020-4418 [19] 史河水, 韩小雨, 樊艳青, 等. 新型冠状病毒(2019-nCoV)感染的肺炎临床特征及影像学表现[J]. 临床放射学杂志, 2020,39(1): 8−11. doi: 10.13437/j.cnki.jcr.20200206.002 SHI H S, HAN X Y, FAN Y Q, et al. Radiologic features of patients with 2019-nCoV infection[J]. Journal of Clinical Radiology, 2020, 39(1): 8−11. (in Chinese). doi: 10.13437/j.cnki.jcr.20200206.002
[20] MACHNICKI S, PATEL D, SINGH A, et al. The usefulness of chest CT imaging in patients with suspected or diagnosed COVID-19: A review of literature[J]. Chest, 2021, 160(2): 652−670.
[21] PAREKH M, DONURU A, BALASUBRAMANYA R, et al. Review of the chest CT differential diagnosis of ground-glass opacities in the COVID era[J]. Radiology, 2020, 297(3): E289−E302. doi: 10.1148/radiol.2020202504
[22] 孙莹, 李玲, 刘晓燕, 等. 早期新型冠状病毒肺炎的胸部薄层平扫CT表现特征[J]. CT理论与应用研究, 2023,32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. SUN Y, LI L, LIU X Y, et al. Imaging features of early COVID-19 on chest thin-slice non-enhanced CT[J]. CT Theory and Applications, 2023, 32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. (in Chinese).
[23] KOO H J, LIM S, CHOE J, et al. Radiographic and CT features of viral pneumonia[J]. Radiographics, 2018, 38(3): 719−739. doi: 10.1148/rg.2018170048
-
期刊类型引用(1)
1. 李正腾,王敏,潘冬梅,王宪凯. CCTA斑块特征在冠状动脉管腔狭窄程度进展预测及预后的价值研究. CT理论与应用研究(中英文). 2025(01): 23-30 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: