Chest Computed Tomography Findings of Patients with Severe COVID-19 Complicated with Other Pathogens
-
摘要: 目的:探讨新冠病毒感染重症患者合并其他病原菌感染的特征性胸部CT表现。方法:回顾性分析重型及危重型新冠病毒感染患者合并其他病原菌感染的胸部CT资料及不同预后。结果:收集纳入研究对象27例,病原学检查显示:13例患者分离出细菌,2例患者为真菌,其余12例同时分离出细菌和真菌。27例患者的胸部CT表现均为双肺多发病变;除6例表现为单纯典型新冠病毒感染的胸部CT特点以外,其余21例患者表现为散在或弥漫性分布的磨玻璃影、混合密度影、以肺段或肺叶分布的片状及斑片状实变影,部分可见散在结节影或小叶中心结节,磨玻璃影内可见小叶间隔增厚呈“铺路石征”和“血管增粗征”,实变影内可见空气支气管气像,多伴有胸腔积液,少数病例可见肺气囊,散在病例可见淋巴结轻度肿大。根据不同预后分为存活6例,死亡21例,死亡患者的肺部磨玻璃影、磨玻璃影伴实变影比例高于生存患者,其余影像学征象无明显统计学差。结论:重症新冠肺炎继发感染主要包括细菌和真菌感染,多为混合感染,胸部CT主要表现为无特定部位分布的磨玻璃及混合密度影、实变影、结节影,多伴有胸腔积液,少部分可见肺气囊、胸部淋巴结轻度肿大,仍可见铺路石征及血管增粗征,呈现出新冠病毒、细菌及真菌感染的混合性、多样性影像学特点。Abstract: Objective: To describe the characteristics of chest computed tomography (CT) findings of patients with severe COVID-19 complicated with other pathogens. Method: Chest CT data and outcomes of patients with severe COVID-19 complicated with other pathogens were retrospectively analyzed. Results: Twenty-seven patients were included in the study. Etiological examination showed that bacteria were isolated in 13 patients, fungi in 2 patients, and bacteria and fungi in the remaining 12 patients. Multiple lung lesions were found in the chest CT images of all 27 patients. Excluding the chest CT images of 6 patients with typical novel coronavirus pneumonia features, the remaining 21 cases mostly showed scattered or diffuse ground-glass, mixed density, patchy, and patchy-solid shadows distributed in the lung segments or lobes. Some of them were scattered in nodules or central lobular nodules, with the thickened interlobular septum showing "paving stone sign" and "vascular thickening sign" in the ground glass shadow, and air bronchial air images were visible in the solid shadows. Pleural effusion was found in most cases, with pulmonary air sacs in few cases, and mild lymph node enlargement in scattered cases. According to the outcomes, the patients were grouped into 6 patients who survived and 21 patients who died. The proportion of ground glass shadow and ground glass with solid shadow in the lung of the patients who died was higher than that of the patients who survived, and the other imaging findings were not statistically different. Conclusion: Secondary infections in patients with severe COVID-19 were mainly bacterial and fungal infections, with most infections were mixed pathogens. Chest CT images mainly showed ground glass, mixed density shadow, consolidation shadow, and nodular shadow without specific location distribution, and most cases were accompanied with pleural effusion, a few with lung sacs, and scattered cases with mild enlargement of chest lymph nodes, pavement stone sign, and vascular thickening sign. It showed the diverse imaging features of COVID-19 cases complicated with bacterial and fungal infections.
-
Keywords:
- computed tomography /
- COVID-19 /
- pneumonia /
- bacterial infection /
- fungal infection
-
弯刀综合征(scimitar syndrome,SS)是一种罕见的先天性心肺异常,发病率约为1~3/100000[1],其特征是部分或全部一侧肺静脉异常引流至下腔静脉、肝静脉、门静脉或右心房较低部位,此异常引流静脉解剖形状似“弯刀”状,因此也被称为弯刀静脉(scimitar vein,SV),左侧异常较右侧罕见[2]。弯刀综合征分为婴儿型和儿童型/成人型。婴儿型患者合并的畸形较多,预后差,迫切需要多学科联合早期精准诊疗。儿童型/成人型大部分患儿无症状或症状轻微,即使不进行医学干预也可正常生活[2]。
鉴于此,本文旨在分析弯刀综合征的CT影像学表现,比较二型的影像学差异及其临床意义,为临床及时精准诊治提供影像学依据。
1. 材料与方法
1.1 临床资料
搜集2019年1月至2024年1月经我院确诊的弯刀综合征的患儿共28例,其中男10例,女18例。婴儿型弯刀综合征15例,男5例,女10例,平均发病年龄约(6.78±3.50)月,其中3例因重症肺炎就诊,1例因先天性回肠闭锁,1例因出生后无肛就诊,1例因纵隔占位就诊,1例因哭闹后口周青紫明显就诊,8例因心脏病变就诊。
成人型弯刀综合征13例,男5例,女8例,平均年龄约(5.53±2.72)岁。其中5例因肺炎就诊,3例为发现心脏杂音来诊,2例为已经明确诊断2年余来院手术,1例因胸廓畸形来诊,1例因肺隔离症就诊,1例因一侧肺间质病变伴轻度肺动脉高压就诊(表1)。
表 1 婴儿型与成人型弯刀综合征患者的临床资料Table 1. Clinical characteristics of adult and Infantile types of patients with scimitar syndrome (SS)临床资料 组别 统计检验 婴儿型(n=15) 成人型(n=13) 统计值 P 男 5 5 — 0.554* 女 10 8 平均年龄/月 6.78±3.50 66.36±32.64 3.085 <0.001 就诊原因 重症肺炎 3例 肺炎 5例 先天性肠闭锁 1例 心脏杂音 3例 无肛 1例 胸廓畸形 1例 纵隔占位 1例 肺隔离症 2例 哭闹后口周青紫 1例 肺间质病变 1例 心脏病变 8例 明确诊断 2例 肺动脉高压/例 2 1 手术治疗/例 5 3 3.589 <0.001 介入治疗/例 0 2 死亡/例 0 0 <0.001 注:*为Fisher确切检验。 本文为回顾性研究,经医院伦理委员会批准进行。
1.2 检查方法
使用GE Revolution 256排螺旋CT扫描仪进行胸部、心脏检查。不能合作患儿,扫描前30分钟至1小时口服10%水合氯醛(剂量:0.5 mL/kg,最多不超过10 mL)镇静后进行。对比剂为欧乃派克(320 mg/mL),剂量1.6~2.0 mL/kg,流率0.9~1.8 mL/s。注射后再以1.0~2.0 mL/s的流率注入生理盐水(使用量为对比剂的1/2~2/3),用以减少对比剂的硬化伪影。
患儿仰卧于检查床上,双臂上举,身体位于检查床正中,头先进,定位像为前后正位像,肺尖为扫描基线,从胸廓入口至肺底进行螺旋扫描。扫描参数见表2。
表 2 不同年龄段低剂量CT扫描参数(胸部增强CT、心脏CT)Table 2. Low-dose CT parameters used for different age groups(contrast-enhanced chest CT, cardiac CT)年龄/岁 管电压/kV 噪声指数 管电流/mA 螺距 管球旋转时间/s 层厚/mm 后处理算法 ≤1 100 11 30~100 1.375 0.35 0.625 40% ASIR-V 1~7 100 13 60~120 1.375 0.35 0.625 40% ASIR-V ≥7 100 15 80~200 1.375 0.35 0.625 40% ASIR-V 注:ASIR-V为多模型的迭代重建算法(adaptive statistical iterative reconstructions-V)。 1.3 影像征象
对婴儿型及成人型弯刀综合征的患者的胸部增强CT扫描图像进行分析:①肺静脉异常引流的位置、有无狭窄梗阻;②体动脉分支供血的情况;③合并肺发育不良的情况;④是否伴发其他畸形包括心脏大血管畸形及其他系统畸形。
1.4 统计方法
应用SPSS 22.0统计软件进行分析。以(
$\bar x \pm s$ )表示服从正态分布的计量资料,采用t检验进行组间比较;分类资料用百分比描述,组间比较采用卡方检验。以P<0.05为差异有统计学意义。2. 结果
28例患儿中婴儿型弯刀综合征15例,男5例,女10例,平均发病年龄约(6.78±3.50)月;成人型弯刀综合征13例,男5例,女8例,平均年龄约(5.53±2.72)岁(表3)。
表 3 婴儿型与成人型弯刀综合征患者的影像学比较Table 3. Comparison of imaging features of patients with adult and infantile types of SS合并异常疾病 组别 统计检验 婴儿型(n=15)(%) 成人型(n=13)(%) $\chi^2/t $ P 右侧肺静脉异位引流 15(100) 13(100) — — 主支气管左侧镜像 15(100) 11(84.6) — — 肺发育不良 15(100) 13(100) — — 合并右位心 15(100) 13(100) — — 合并右肺动脉发育不良 15(100) 13(100) — — 体循环供应右肺 15(100) 13(100) — — 完全性右肺静脉异位引流 10(66.7) 7(53.8) 1.470 0.269 右下肺静脉异位引流 5(33.3) 6(46.1) 1.512 0.283 引流入下腔静脉 14(93.3) 13(100) 1.897 1.000* 引流入肝静脉 1(6.7) 0(0) 1.897 1.000* 合并心脏畸形 6(40.0) 0(0) 11.495 <0.001* 合并ASD 2(13.3) 0(0) 1.746 <0.001* 合并动脉导管未闭PDA 1(6.7) 0(0) 1.897 0.226* 异位引流的肺静脉狭窄(梗阻) 3(20.0) 0(0) — — 合并心外畸形 4(26.7) 1(7.7) 1.791 0.191 注:*为Fisher确切检验。 28例患儿右肺较左肺体积小,心影纵隔右移。其中26例患儿的支气管树为左侧镜像结构即左右主支气管均为两叶支气管结构,2例成人型患儿的支气管树为左二右三叶支气管的结构,但右上叶支气管较正常纤细,另外两例婴儿型患儿限局性气管狭窄;增强扫描本组28例患儿均为右侧肺静脉异位引流,右肺动脉均较左肺动脉细。28例患儿均可见弯刀静脉,26例降主动脉动脉分支供血右下肺,2例降主动脉动脉分支供血叶外型隔离肺。
婴儿型弯刀综合征15例患儿中10例为完全右肺静脉异位引流至下腔静脉,其中3例异位引流入下腔静脉处狭窄梗阻(图1),该3例患儿行部分肺静脉异位连接弯刀综合征矫治术,术后患儿随诊复查无不适,1例合并房间隔缺损及肺动脉高压,1例合并房间隔缺损、动脉导管未闭及肺动脉高压,该2例患儿均行房间隔修补术的同时行部分肺静脉异位连接弯刀综合征矫治术,合并动脉导管未闭的患儿还行动脉导管结扎术,其余5例患儿未行手术。
4例为右下肺静脉异位引流至下腔静脉,均因合并其他畸形及肺部感染变行影像检查时发现,其中3例因回肠闭锁、无肛、纵隔占位行相关手术,该4例均未行异位引流肺静脉矫正术。
1例为右上肺静脉异位引流至奇静脉并右下肺静脉引流至右心房底部,利用MPR及VR重建观察到该患儿存在多枚椎体畸形,该例患儿并未行异位引流肺静脉矫正术。
成人型弯刀综合征13例中7例为完全右肺静脉异位引流至下腔静脉(图2),其中1例因胸廓畸形(鸡胸)行部分肺静脉异位连接弯刀综合征矫治术;6例为右下肺静脉异位引流至下腔静脉,其中2例明确诊断后,药物对症治疗期间反复肺炎行部分肺静脉异位连接弯刀综合征矫治术,2例合并叶外型隔离肺行介入栓堵治疗体动脉供血。
3. 讨论
弯刀综合征又称肺发育不良综合征,其发病机制尚不清楚,可能与胚胎早期整个肺芽的发育障碍有关[3]。其特点为心脏右移右旋,小右肺、右肺动脉发育不良、部分性右肺静脉回流异常即弯刀静脉及异常体动脉的分支供血(通常是供应右下肺基底段或肺隔离症);同时存在肺叶、气管支气管分支异常,支气管树可呈左侧镜像(左-异构现象),部分患儿合并先天性心脏异常,以及心外畸形[4]。故弯刀综合征涉及多个系统及组织结构的畸形包括心脏畸形、胸腹腔大血管畸形、肺及气道畸形、部分病人还合并骨骼、消化道等其他的心外畸形。
另外,弯刀综合征患儿的血液动力学是心房水平的左向右分流,同时伴有异常体动脉的供血,导致右心容量负荷增加,其增加程度的不同、肺发育不良的程度、以及是否合并心内、心外畸形,是导致临床表现差异很大的原因,因此弯刀综合征可以在婴儿、儿童或成年人中被发现或发病。通常婴儿型患儿发病时间较早,是由于其心房水平的左向右分流量较大、和/或存在较粗的异常体动脉分支供血、和/或存在异位引流肺静脉有狭窄梗阻[5],或合并其他心内、心外畸形[6-7]。与此同时弯刀综合征的治疗手段亦不相同,包括药物治疗、介入治疗与外科治疗[6]。
CT扫描的最大优势是避免了影像的重叠,可以逐层观察图像,并且随着CT技术的发展,扫描速度明显加快,CT图像的空间、时间分辨率也明显提高,以及无间隔容积扫描、后处理重建技术的广泛应用,并结合造影剂的使用,利用平扫、增强及多种图像重建后处理方法可以精准、直观、多方位以及三维立体的显示肺、气道、血管、心脏及骨骼形态结构及病变,使之成为诊治弯刀综合征首选检查方法。
本组28例弯刀综合征的患儿均经胸部CT检查,并对图像进行重建后处理,确诊弯刀综合征。并为治疗方法的选择提供依据,其中18例患儿仅药物治疗即可保证患儿的病情稳定及正常的生长发育,8例行部分肺静脉异位连接弯刀综合征矫治术,2例行介入栓堵术,栓堵肺外型隔离肺的体循环供血动脉,解除体肺分流引起的症状。
CT图像的重建是基于前期的胸部CT平扫及增强的无间隔容积扫描的图像数据,图像重建分为二维图像重建及三维图像重建,针对弯刀综合征常用的图像重建后处理方法有多平面重建(multiplanar reformation,MPR)属于二维图像重建;以及三维图像重建包括最大密度投影(maximum intensity projection,MIP)、最小密度投影(minimum intensity projection,MIN)及容积成像(volume rendering,VR),在显示心脏、血管畸形方面几乎可以替代血管造影。
MPR是本病最基本的重建方法,可以任意平面、任意角度显示扫描范围内解剖结构的形态及走行,观察每支肺血管、弯刀静脉、气管支气管、肺叶形态及分割、异常体动脉分支的形态、粗细、走行,异常引流处的具体部位、是否狭窄以及是否合并的其他部位畸形,还可以重建出标准的矢、冠、轴位图像。MIP和MIN分别是指投影方向内最大密度和最小密度体素所参与的成像,均为部分重叠影像,MIP是基于CT增强扫描后的重建方法,用于显示血管及心脏。MIN主要基于CT平扫后的图像数据,用于显示气道或含气肺组织结构。VR为三维立体成像,为伪彩仿真立体图,按临床的要求提供心脏、大血管、气道及骨骼的整体三维影像,多方位、多角度地观察各解剖结构之间的关系,对于术前了解畸形部位特征和制定手术方案有指导作用。
本组28例患儿的胸部CT平扫的轴位图像显示这些患儿右肺体积小,右肺纹理粗细不等,且部分肺纹理走行紊乱,右肺透光度较左肺增高/减低,心影纵隔右移,部分患儿合并肺炎。之后行MPR及MIN重建发现患儿的气管支气管畸形及肺叶分割畸形,其中有1例利用MPR及VR重建观察到该患儿还存在多枚椎体畸形。
另外,由于弯刀综合征存在程度不等的心脏及血管畸形,对于分流量大于50%、异位引流肺静脉狭窄、肺动脉高压和隔离肺时需手术治疗[8]。有文献报道可根据CT增强后的MPR测量弯刀静脉汇入下腔静脉角度的大小采用不同的手术方法[9]。本组28例患儿均行胸部CT增强分期扫描,分别于动脉期及静脉期进行扫描,利用增强后的图像数据进行MPR及MIP重建对心脏、血管进行评估,其中临床症状较重的婴儿型患儿有3例在MPR及MIP图像上可见异位引流处狭窄梗阻(图1),2例可见合并了心内畸形—房间隔缺损及肺动脉主干明显增粗,其中1例还合并了较粗大的动脉导管未闭,并经手术证实,术后患儿情况良好。2例成人型患儿经MPR及MIP重建清晰显示了于膈肌水平主动脉分别发出1分支及2支血管供应肺外型隔离肺(图2),之后行介入手术,栓堵的该异常体动脉,术后患儿恢复良好。
婴儿型弯刀综合征患儿发病早的另一个主要原因是由于伴发其他致命畸形来医院就诊,而偶然被发现,本组有3例分别因无肛、回肠闭锁和纵隔占位(经病理证实为异位肝)来院准备做相应的手术,在术前CT平扫时怀疑合并有弯刀综合征,故此3例患儿经增强CT扫描和MPR、MIP、MIN及VR重建进一步证实均为右下肺静脉的单支肺静脉异位引流,分流量不大,肺动脉压未增高,由弯刀综合征所引发的症状并不严重,3例均未接受肺静脉异位连接弯刀综合征矫治术。
目前国际上报道了两例VACTERL联合征合并弯刀综合征[10],VACTERL联合征是一组非随机出现的先天性联合畸形,包括脊柱畸形(vertebral defects,V)、肛门闭锁(anal atresia,A)、气管食管瘘(trachea esophageal fistula,TE)、伴食管闭锁(esophageal atresia)、肾发育畸形(renal defects,R)、桡骨发育不良(radial dysplasia,R)、心脏发育缺陷(cardiac defects,C)和肢体畸形(1imb anomalies,L),存在3个或3个以上的先天发育异常称为VACTERL联合征[11]。本组弯刀综合征的患儿中,有6例合并上述相关畸形,其中2例合并消化道畸形为肛门闭锁伴阴道瘘和回肠闭锁、2例合并心脏畸形伴肺动脉高压、1例合并胸廓畸形(鸡胸)、1例合并椎体畸形,这几例患儿均因合并其他畸形就诊。因此在临床工作中,当弯刀综合征患儿出现上述畸形时需注意患儿是否存在VACTERL联合征。
综上,婴儿型和成人型弯刀综合征患儿的临床表现有很大差异,利用CT检查的多种成像模式,结合强大重建后处理功能对弯刀综合征患儿进行全面评估,可以为临床治疗方法的选择、手术方案的制定、改善预后及提高生活质量提供依据。
-
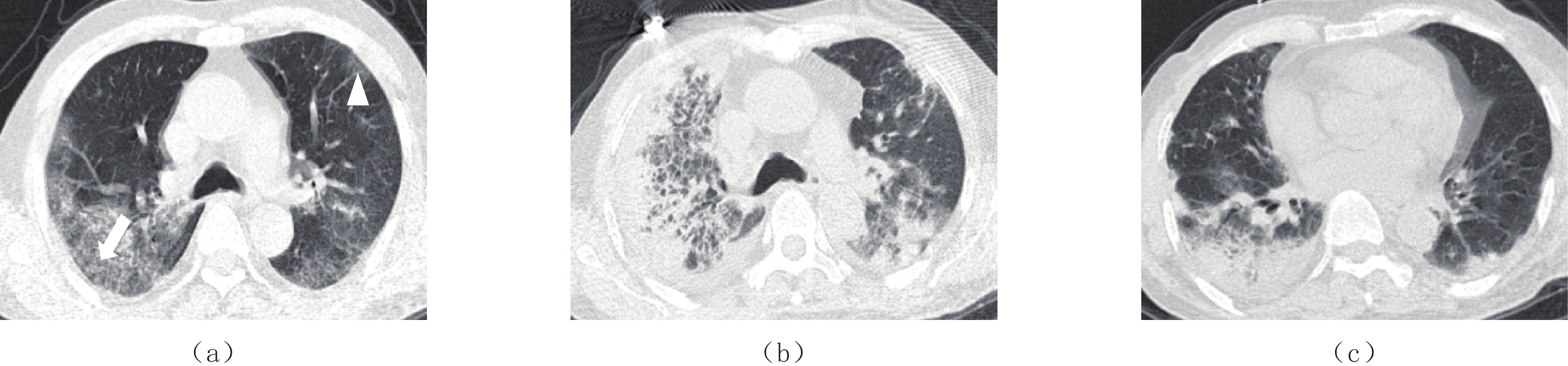
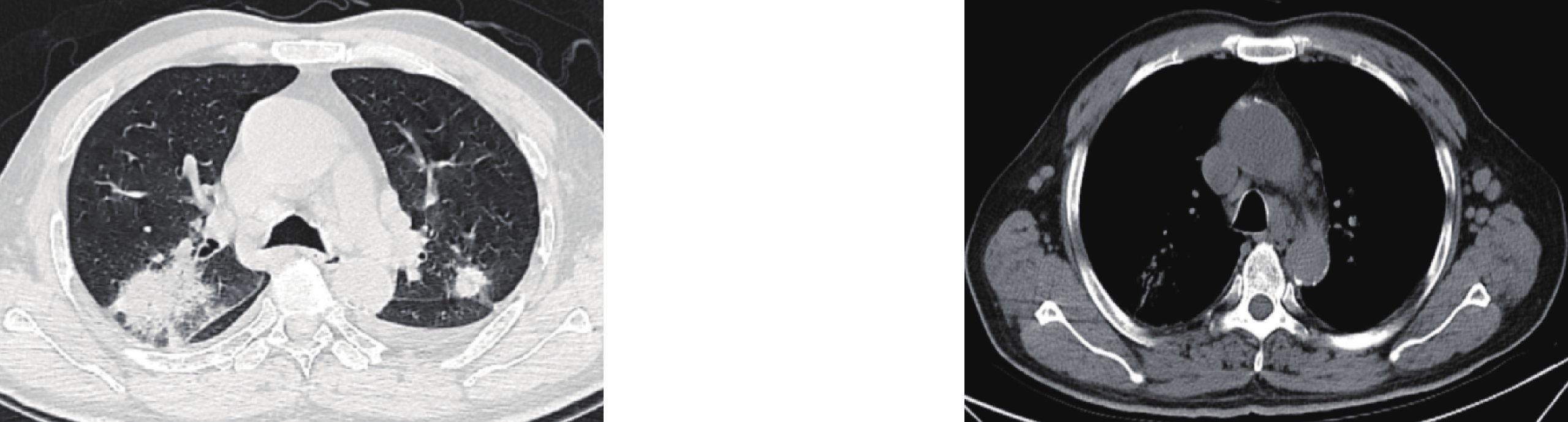
图 1 男,81岁,死亡患者,病原学检查为屎肠球菌、少量似平滑念珠菌及鲍曼氏不动杆菌,肺部CT显示双肺多发磨玻璃影,小叶间隔增厚呈“铺路石征”(白色箭号)(a),血管穿行于病灶内呈“血管增强征”(白色三角形)(a),5天后病变进展(b),右肺新发肺气囊(b),双下肺新发片状实变影伴双侧胸腔少量积液(c)
Figure 1. The CT images of an 81-year-old man who died. Etiological examination revealed Enterococcus faecium, a small amount of Candida plaliformis, and Acinetobacter baumannii. Pulmonary CT images show multiple ground-glass shadows in both lungs and thickened interlobular septa with "paving stone sign" (white arrow) (a). Blood vessels passing through the lesion presented a "vascular enhancement sign" (white triangle) (a), and the lesion progressed in five days (b) with new lamellar consolidation shadow in the lower lungs accompanied by a small amount of bilateral pleural effusion (c)
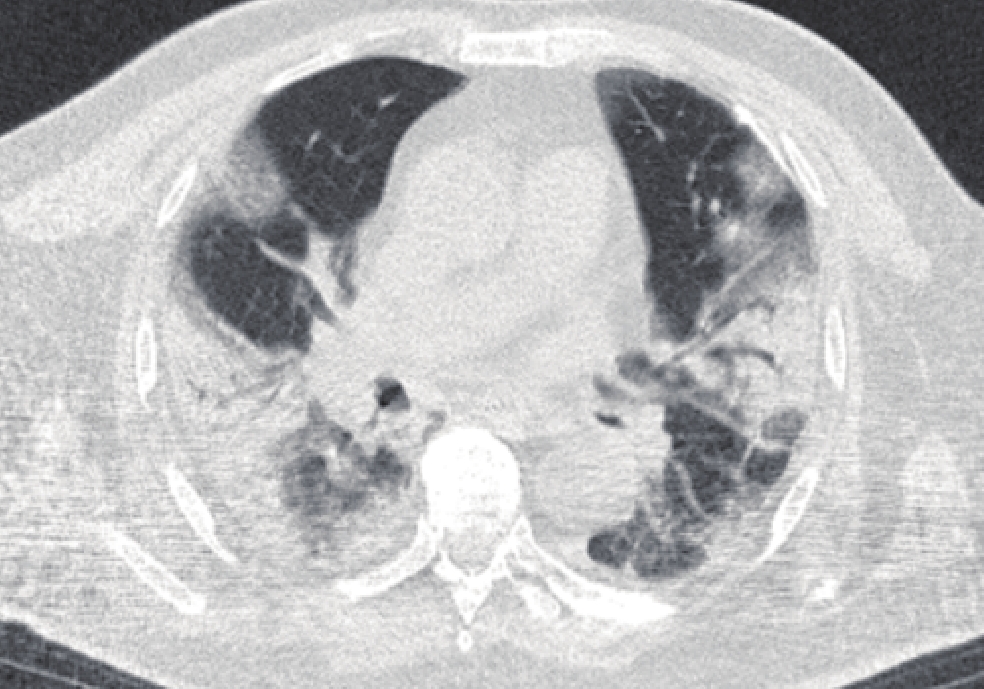
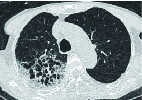
图 2 男,72岁,死亡患者,病原学检查为嗜麦芽寡养单胞菌,CT表现为胸膜下斑片状磨玻璃密度影,以肺段分布的片状实变影,病变内可见空气支气管征象
Figure 2. The CT images of a 72-year-old man who died. Etiological examination revealed Oligotrophomonas maltophila. The CT images show subpleural patellar ground glass density shadow and patellar solid shadow distributed in the lung segments; air bronchial signs are seen in the consolidated lesion
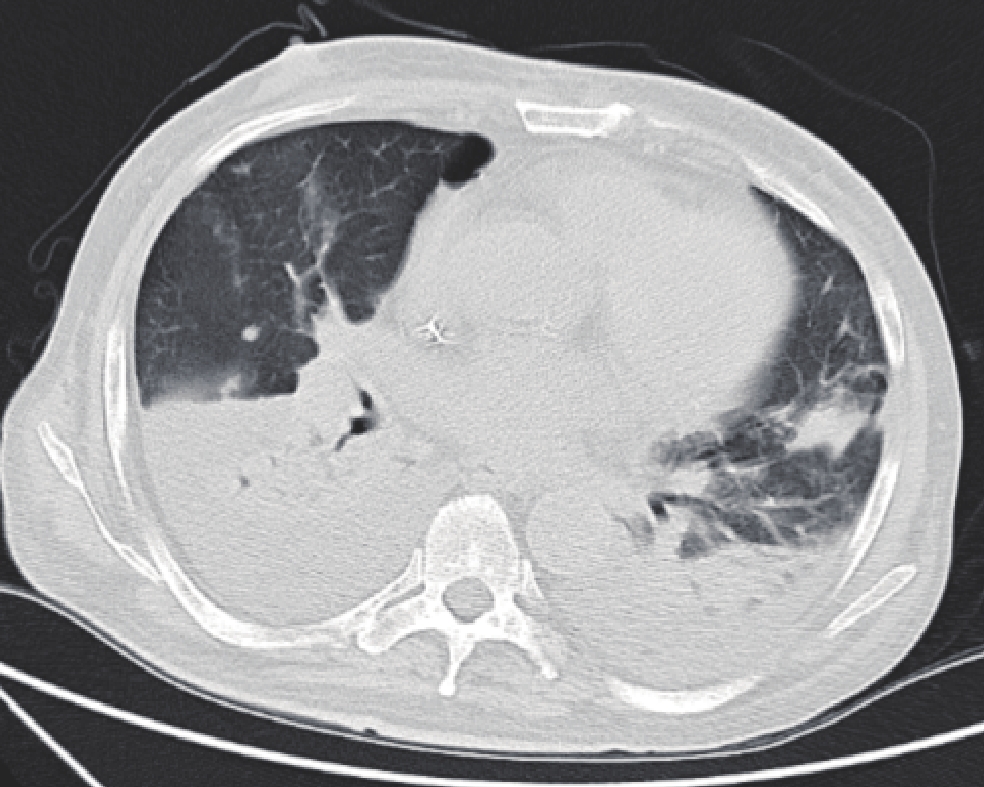
图 3 女,90岁,死亡患者,病原学检查为克雷伯氏菌。肺内多发片状混合磨玻璃影、大片状实变影及散在多发结节影,实变病变内可见空气支气管征象
Figure 3. The CT images of a 90-year-old women who died. Etiological examination revealed Klebsiella bacteria. Multiple large-flake solid shadows, mixed ground glass shadows, and scattered multiple nodules are seen in the lung CT images. Air bronchial signs are seen in the consolidated lesion
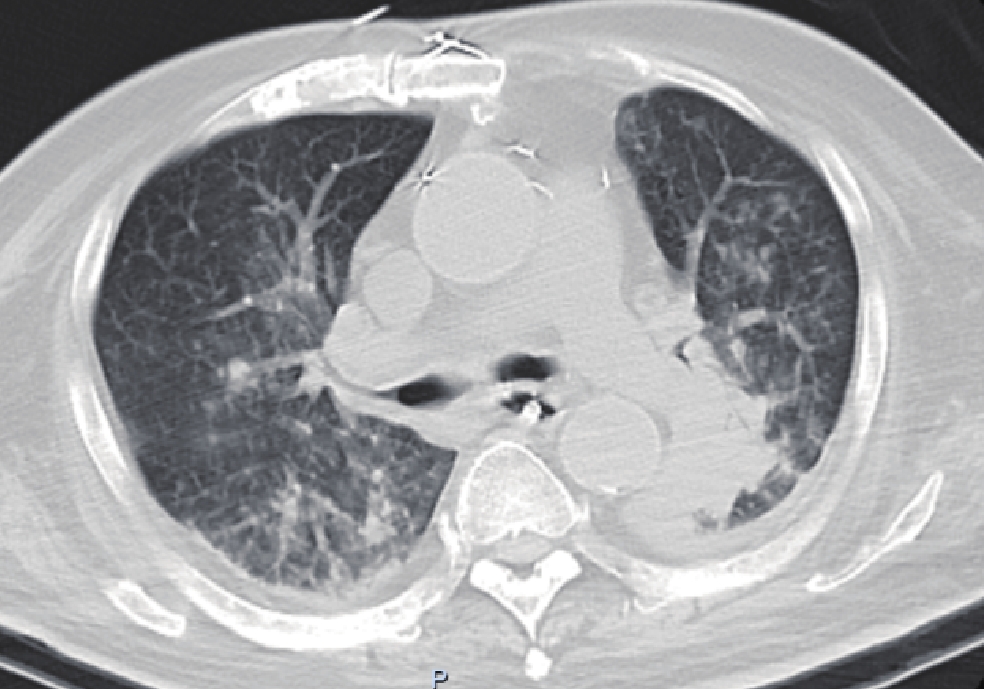
图 4 男,57岁,死亡患者,可溶性曲霉菌抗原阳性,病原学检查提示有少量白色念珠菌,肺内见片状实变影及散在小结节影,双侧胸腔有少量积液
Figure 4. The CT images of a 57-year-old man who died. The soluble aspergillus antigen test was positive. Etiological examination revealed a small amount of Candida albicans. Patchy solid shadows and scattered nodules are observed in the lung CT images, and a small amount of fluid is found in the bilateral pleural cavity
图 5 男,77岁,死亡患者,病原学检查提示有鲍曼氏不动杆菌、铜绿假单胞菌、丝带棒状杆菌、白色念珠菌、光滑念珠菌、少量屎肠球菌及表皮葡萄球菌。肺内见片状实变影及多发小叶中心结节影
Figure 5. The CT images of a 77-year-old man who died. Etiological examination revealed Acinetobacter baumannii, Pseudomonas aeruginosa, Corynebacterium rhizome, Candida albicans, Candida glabris, and a small amount of Enterococcus faecium and Staphylococcus epidermidis. The lung CT images show lamellar consolidation shadows and multiple central lobular nodules
图 7 男,90岁,死亡患者,病原学检查为鲍曼氏不动杆菌、金黄色葡萄球菌、表皮葡萄球菌,肺内见片状实变影伴肺气囊
Figure 7. The CT images of a 90-year-old man who survived. Etiological examination revealed Acinetobacter baumannii, Staphylococcus aureus, and Staphylococcus epidermidis. The lung CT images show lamellar consolidation shadows with pulmonary air sacs
表 1 一般临床资料
Table 1 General clinical data
项目 例数 占比/% 性别 男性/女性 19/8 70.3/29.6 基础病史 高血压 18 66.7 糖尿病 9 33.3 冠心病 4 14.8 恶性肿瘤 0 0.0 免疫抑制(移植术后、化疗等) 3 11.1 肝病 5 18.5 肾病 3 11.1 外科手术史 4 14.8 表 2 实验室检查指标变化情况表
Table 2 Changes in laboratory examination results
项目 例数 占比(%) 项目 例数 占比(%) WBC升高 21 77.8 SO2(%)≤93% 18 66.7 NEUT升高 22 81.5 P/F index≤30 mmHg 15 55.6 LYMPH降低 22 81.5 CRP升高 27 100.0 MONO升高 6 22.2 PCT升高 26 96.3 RBC减低 26 96.3 D-Dimer升高 21 77.8 HGB减低 25 92.6 CK升高 5 18.5 NLR升高 24 88.9 CK-MB升高 4 14.8 ALT升高 13 48.1 MYO升高 21 77.8 AST升高 19 70.4 TNI升高 23 85.2 eGFR减低 21 77.8 LNTP升高 26 96.3 注:WBC为白细胞计数,NEUT为中性粒细胞绝对值,LYMPH为淋巴细胞绝对值,MONO为单核细胞绝对值,RBC为红细胞计数,HGB为血红蛋白,NLR为中性粒细胞/淋巴细胞比值,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,eGFR为肾小球滤过率,SO2为血氧饱和度,P/F index为肺动脉氧分压与吸氧浓度的比值,CRP为C反应蛋白,PCT为降钙素原,D-Dimer为D二聚体,CK为肌酸激酶,CK-MB为肌酸激酶同工酶,MYO为肌红蛋白,TNI为肌钙蛋白,LNTP为B型氨基端利钠肽原。 表 3 新冠病毒感染重症患者合并其他感染的胸部CT表现特征情况
Table 3 Chest CT features of patients with severe COVID-19 complicated with other infections
影像表现 例数(n=27)
/例数(%)死亡(n=21)
/例数(%)存活(n=6)
/例数(%)P 病变部位 多位于肺外周或胸膜下 12(44.4) 11(52.4) 1(16.7) 0.121 节段性或肺叶性 11(40.7) 8(38.1) 3(50.0) 0.601 肺门为中心 0(0.0) 0(0.0) 0(0.0) — 病变分布 病变散在分布 20(74.1) 15(71.4) 5(83.3) 0.557 病变弥漫性分布 12(44.4) 11(52.4) 1(16.7) 0.121 病变密度 磨玻璃影 19(70.4) 17(81.0) 2(33.3) 0.024 磨玻璃伴实变影 20(74.1) 18(85.7) 2(33.3) 0.01 实变影 21(77.8) 15(71.4) 6(100.0) 0.711 病变征象 铺路石征 13(48.1) 11(52.4) 2(33.3) 0.410 血管增粗征 15(55.6) 13(61.9) 2(33.3) 0.214 空气支气管征 18(66.7) 14(66.7) 4(66.7) 1.000 结节 16(59.3) 11(52.4) 5(83.3) 0.174 空洞 0(0.0) 0(0.0) 0(0.0) — 肺气囊 6(22.2) 4(19.4) 2(33.3) 0.458 肺外表现 淋巴结肿大 9(33.3) 5(23.8) 4(66.7) 0.051 胸腔积液 16(59.3) 11(52.4) 5(83.3) 0.174 心包积液 1(3.7) 1(4.8) 0.00 0.586 其他情况(单纯表现为新冠肺炎改变) 6(22.2) 5(23.8) 1(16.7) 0.711 -
[1] CEVIK M, KUPPALLI K, KINDRACHUK J, et al. Virology, transmission, and pathogenesis of SARS-CoV-2[J]. British Medical Journal, 2020, 371: m3862.
[2] 韩晶, 史丽霞, 谢祎, 等. 新型冠状病毒肺炎患者继发感染的危险因素分析[J]. 天津医药, 2020,48(10): 916−919. doi: 10.11958/20201043 HAN J, SHI L X, XIE Y, et al. Analysis of risk factors for subsequent infection in patient with COVID-19[J]. Tianjin Medical Journal, 2020, 48(10): 916−919. (in Chinese). doi: 10.11958/20201043
[3] ROSALINO V, SANDRA G S, JUAN J J V, et al. Acinetobacter baumannii resistance: A real challenge for clinicians[J]. Anyinioyics, 2020, 9(4): 205.
[4] GRUPPER M, SPRECHER H, MASHIACH T, et al. Attributable mortality of nosocomial acinetobacter bacteremia[J]. Infection Control and Hospital Epidemiology, 2007, 28(3): 293−298. doi: 10.1086/512629
[5] SUNENSHINE R H, WRIGHT M O, MARAGAKIS L L, et al. Multidrug-resistant acinetobacter infection mortality rate and length of hospitalization[J]. Emerging Infectious Diseases, 2007, 13(1): 97−103. doi: 10.3201/eid1301.060716
[6] JOSÉ R J, BROWN J S. Opportunistic and fungal infections of the lung[J]. Medicine, 2012, 40(6): 335−339.
[7] Van WOLFSWINKEL M E, VLIEGENTHART-JONGBLOED K, de MENDONFIA MELO M, et al. Predictive value of lymphocytopenia and the neutrophil-lymphocyte count ratio for severe imported malaria[J]. Malaria Journal, 2013, 12: 101. doi: 10.1186/1475-2875-12-101
[8] JIA H P, LOOK D C, SHI L, et al. ACE2 receptor expression and severe acute respiratory syndrome. coronavirus infection depend on differentiation of human airway epithelia[J]. Journal of Virology, 2005, 79(23): 14614−14621. doi: 10.1128/JVI.79.23.14614-14621.2005
[9] HAMMING I, TIMENS W, BULTHUIS M L, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus: A first step in understanding SARS pathogenesis[J]. The Journal of Pathology, 2004, 203(2): 631−637. doi: 10.1002/path.1570
[10] XU H, ZHONG L, DENG J, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa[J]. International Journal of Oral Science, 2020, 12(1): 8. doi: 10.1038/s41368-020-0074-x
[11] PUROHIT D, AHIRWAR A K, SAKARDE A, et al. COVID-19 and lung pathologies[J]. Hormone Molecular Biology and Clinical Investigation, 2021, 42(4): 435−443. doi: 10.1515/hmbci-2020-0096
[12] 刘玉建, 仲建全, 冯浩, 等. 新型冠状病毒肺炎患者的高分辨率CT影像学特征[J]. 医疗装备, 2022,35(11): 1−4. doi: 10.3969/j.issn.1002-2376.2022.11.001 LIU Y J, ZHONG J Q, FENG H, et al. Imaging characteristics of high resolution CT for patients with corona virus disease 2019[J]. Medical Equipment, 2022, 35(11): 1−4. (in Chinese). doi: 10.3969/j.issn.1002-2376.2022.11.001
[13] CHUNG M, BERNHEIM A, MEI X, et al. CT imaging features of 2019 novel coronavirus (2019-nCoV)[J]. Radiology, 2020, 295(1): 202−207. doi: 10.1148/radiol.2020200230
[14] TAY M Z, POH C M, RÉNIA L, et al. The trinity of COVID19: Immunity, infiammation and intervention[J]. Nature Reviews. Immunology, 2020, 20(6): 363−374. doi: 10.1038/s41577-020-0311-8
[15] DEBRAY M P, CARETTE M F, LOUBET P, et al. CT features of community-acquired pneumonia at the emergency department[J]. Respiratory Medicine and Research, 2022, 81: 100892. doi: 10.1016/j.resmer.2022.100892
[16] 曹玉芳, 王小智, 谢晓红, 等. 新型冠状病毒、细菌和病毒性肺炎患者胸部影像学特征分析[J]. 中华危重病急救医学, 2023,35(1): 28−31. doi: 10.3760/cma.j.cn121430-20210318-00394 CAO Y F, WANG X Z, XIE X H, et al. Analysis of chest imaging features of novel coronavirus pneumonia, bacterial pneumonia and viral pneumonia[J]. Chinese Critical Care Medicine, 2023, 35(1): 28−31. (in Chinese). doi: 10.3760/cma.j.cn121430-20210318-00394
[17] 窦艳云, 黄葵, 蓝珂, 等. 艾滋病合并细菌性肺炎的影像学及临床特点分析[J]. 新发传染病电子杂志, 2019,4(1): 20−23. DOU Y Y, HUANG K, LAN K, et al. Analysis of clinical characteristics of AIDS complicated with bacterial pneumonia[J]. Electronic Journal of Emerging Infectious Diseases, 2019, 4(1): 20−23. (in Chinese).
[18] 袁彩云, 陶毅, 陈令金, 等. 多层螺旋 CT 在老年真菌性肺炎中的诊断价值[J]. 影像研究与医学应用, 2021,5(18): 116−117. doi: 10.3969/j.issn.2096-3807.2021.18.056 [19] KOVÁCS A, PALÁSTI P, VERÉB D, et al. The sensitivity and specificity of chest CT in the diagnosis of COVID-19[J]. 2021, 31(5): 2819-2824.
-
期刊类型引用(1)
1. 李岩,王志忠,芦春花. DXA联合胸腹部CT扫描筛查骨质疏松症的效果. 实用临床医学. 2025(01): 80-82 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: