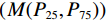Correlation Analysis between Dynamic Changes in Computed Tomography Findings and Clinical Outcomes in Cases Infected with Different Strains of Coronavirus Disease 2019
-
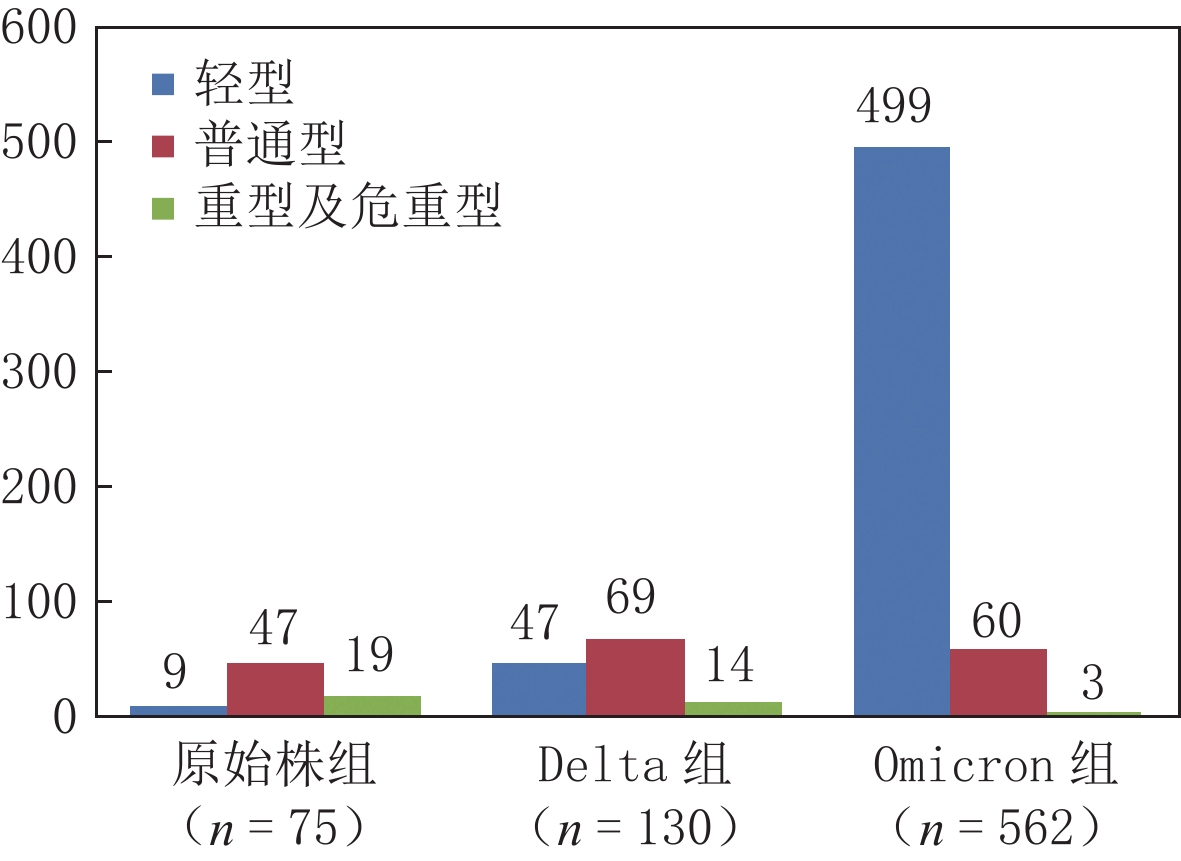
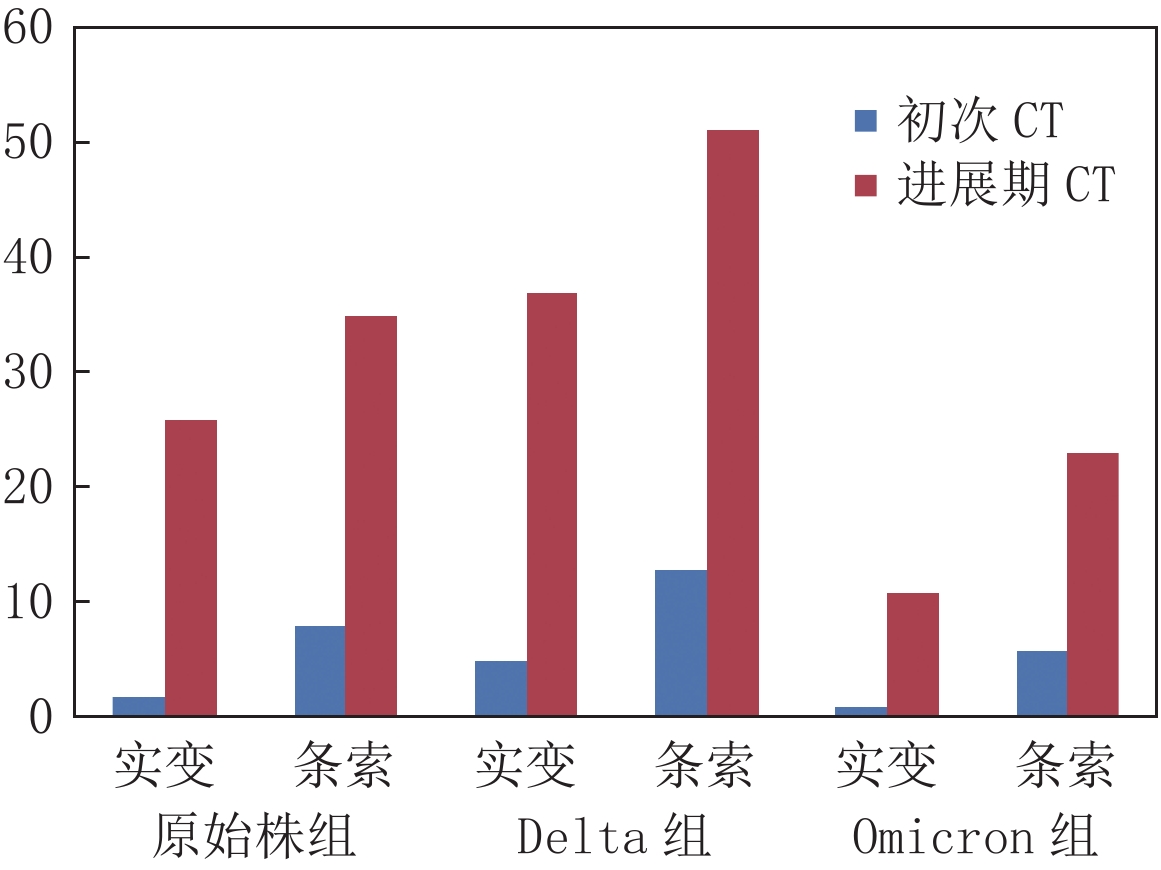
摘要: 目的:分析、对比新型冠状病毒感染不同毒株胸部CT表现及其演变特点,探讨其与临床转归的相关性。方法:收集、整理内蒙古自治区75例原始株、130例德尔塔(Delta)变异株和562例奥密克戎(Omicron)变异株病例的胸部CT图像,分析、对比不同毒株CT表现及变化规律。结果:Omicron组中的轻型患者比例(499例,88.79%)明显多于原始株组(9例,12.00%)和Delta组(47例,36.15%)。相对于原始株组,Delta组轻型患者发生率较高(47例,36.15% vs.9例,12.00%),重症发生率较低(14例,16.87% vs.19例,28.79%)。96.97%(64例)原始株组病例,93.98%(78例)Delta组病例,98.41%(62例)Omicron组病例初次CT表现以磨玻璃影为主,3组间无统计学差异。在磨玻璃影形态和分布方面,19.05%(12例)Omicron组病例表现为腺泡结节磨玻璃影,明显多于原始株组(3.03%,2例)及Delta组(3.61%,3例),3组病例病灶主要沿胸膜下分布,但Omicron组较原始株组及Delta组沿支气管血管束周围分布比例更高。在伴随征象方面,初次CT中伴随实变和条索比例较低,原始株组、Delta组及Omicron组病例伴随实变比例分别为3.03%(2例),6.02%(5例)和5.00%(1例);伴随条索比例分别为12.12%(8例),15.66%(13例)和20.00%(4例)。原始株组和Delta组病程中病灶影像学表现会出现变化,原始株组39.39%(26例)病例在原磨玻璃影基础上出现实变,53.03%(35例)病例在原磨玻璃影基础上出现条索,明显高于初次CT实变和条索比例;Delta组44.58%(37例)病例在原磨玻璃影基础上出现实变,61.45%(51例)病例在原磨玻璃影基础上出现条索;Omicron组34.38%(11例)病例在原磨玻璃影基础上出现实变,71.88%(23例)病例在原磨玻璃影基础上出现条索,二者同样明显高于初次CT实变和条索比例。原始株组、Delta组和Omicron组病例病灶明显吸收距发病时间中位天数分别为16、16和9 d。结论:新型冠状病毒感染不同毒株胸部CT表现的动态变化,可以反映病变随临床病程的演变规律,对新型冠状病毒感染病程判定和疾病管理具有临床应用价值。Abstract: Objective: To analyze and compare chest computed tomography (CT) findings and evolutionary characteristics of different strains of novel corona virus pneumonia and to explore the correlation of CT findings and strain characteristics with clinical outcomes. Methods: Chest CT images of 75 cases of the original strain, 130 cases of the Delta variant, and 562 cases of the Omicron variant from the Inner Mongolia Autonomous Region, were collected and sorted. The CT manifestations and their changes for different strains were analyzed and compared. Results: The proportion of patients with mild disease in the Omicron variant group (499 cases, 88.79%) was significantly higher than that in the original strain (9 cases, 12.00%) and Delta variant groups (47 cases, 36.15%). Compared to the original strain group, the Delta variant group showed higher incidences of mild cases% (47 cases, 36.15% vs. 9 cases, 12.00%) and lower incidences of severe cases (14 cases, 16.87% vs. 19 cases, 28.79%). A total of 96.97% (64 cases) of the original strain group, 93.98% (78 cases) of the Delta variant group, and 98.41% (62 cases) of the Omicron variant group showed ground-glass opacities, which were the main manifestations on the first CT scan. There was no statistically significant difference among the three groups. In terms of morphology and distribution of ground-glass opacity, 12 cases (19.05%) of the Omicron group showed acinular nodule ground-glass opacity, which was significantly higher than that shown by the original strain group (2 cases, 3.03%) and the Delta variant group (3 cases, 3.61%). The lesions in the three groups were mainly distributed along the subpleural lung regions. However, the Omicron variant group had a higher distribution ratio along the bronchial vascular bundle than the original strain and Delta variant groups. In terms of concomitant signs, concomitant consolidation and cable proportion were significantly lower on the first CT image. The proportions of concurrent consolidation in the original strain, Delta variant, and Omicron variant groups were 3.03% (2 cases), 6.02% (5 cases), and 5.00% (1 case), respectively. The proportions of accompanying cables in the original strain, Delta variant, and Omicron variant groups were 12.12% (8 cases), 15.66% (13 cases), and 20.00% (4 cases), respectively. The imaging findings of the lesions in the original strain and Delta variant groups changed over the course of the disease. In the original strain group, 39.39% (26 cases) had realistic changes based on the original ground-glass opacity and 53.03% (35 cases) had a cord based on the original ground-glass opacity. This proportion was significantly higher than the proportion of consolidation and cord based on the first CT. In the Delta variant group, 44.58% (37 cases) of patients showed inflammatory consolidation based on the original ground-glass opacity and 61.45% (51 cases) of patients showed a cord based on the original ground-glass opacity. In the Omicron variant group, 34.38% (11 cases) had inflammatory consolidation based on the original ground-glass opacity and 71.88% (23 cases) had cord based on the original ground-glass opacity, both of which were significantly higher than the proportions of primary inflammatory consolidation and cord. The median number of days from apparent absorption to onset in the original strain, Delta variant and Omicron variant groups were 16 days, 16 days, and 9 days, respectively. Conclusions: The dynamic changes in chest CT findings of cases infected with different strains of COVID-19 can reflect the evolution of lesions with the clinical course of the disease. This prediction has clinical application value in determining the course of COVID-19 and disease management.
-
Keywords:
- computed tomography /
- coronavirus disease 2019 /
- Delta /
- Omicron /
- dynamic changes
-
计算机断层成像(computed tomography,CT)技术可以提供人体的断层解剖结构和形态学特征[1]。在很多情况下,不同组织有着非常相似的CT值,单能CT无法对其进行区分,因此能谱CT应运而生,它拓展了CT的应用范围,也使CT成为临床应用中不可或缺的一种影像诊断设备[2]。
当前,能谱CT在临床应用最广泛的模式是双能CT(dual-energy computed tomography,DECT),也是当前研究最多的能谱技术,其将物质分解为组成元素的能力源于X射线衰减的能量和元素的依赖性[3]。此时,X射线的衰减主要为光电效应和康普顿效应[4]。早期,Maass等[5]采用图像域分解算法成功得到两物质分解图像,从而能够有效地替代线性衰减系数进行组织区分,对物质成分进行判断,进而实现物质识别。但往往由于人体组织成分并不只是由两种物质构成,故在肝脂肪定量检测等多组织分析时,就需要用到多物质分解(multi-material decomposition,MMD),对物质成分进行精确定性定量判断[6-7]。
目前,基材料分解方法分为两大类:一类是将图像重建和基材料分解两个过程结合在一起的直接迭代基材料分解法,也叫“一步法”,此方法由于计算过程复杂,求解过程耗时较长,因此应用较少[8];另一类为“两步法”,即把图像重建和基材料分解分成了两步进行;“两步法”根据高低能投影数据集是否沿着相同的射线路径扫描可分为投影域和图像域基材料分解法[9-10]。基于投影域的分解法理论上能有效消除射束硬化伪影的影响,但大多数DECT无法满足高低能投影数据集沿着相同的射线路径进行扫描;基于图像域的分解法往往更加灵活,适用于大多数DECT,在计算上也更为简便[11]。
本文主要针对“两步法”中的第二步,即对两幅高、低能CT图像分解成两物质分解图像或多物质分解图像所运用到的主要的图像域基材料分解算法展开综述。
1. 两物质分解方法
1.1 直接矩阵求逆分解
根据基于图像的分解理论,CT图像的线性衰减系数近似为两个基材料图像的加权和[12],即:
$$ \left( {\begin{array}{*{20}{c}} {{{\boldsymbol{X}}_{H,i,j}}} \\ {{{\boldsymbol{X}}_{L,i,j}}} \end{array}} \right) = \left( {\begin{array}{*{20}{c}} {{x_{1H}}}&{{x_{2H}}} \\ {{x_{1L}}}&{{x_{2L}}} \end{array}} \right)\left( {\begin{array}{*{20}{c}} {{{\boldsymbol{d}}_{1,i,j}}} \\ {{{\boldsymbol{d}}_{2,i,j}}} \end{array}} \right) \text{,} $$ (1) 其中,
$ {{\boldsymbol{X}}_{H/L}} $ 表示以mm-1为单位的在不同能级下重建的CT图像;$ {{\boldsymbol{d}}_{1/2}} $ 表示基材料图像或称为分解图像,是无量纲的;$ i,j $ 是图像像素指数;成分矩阵由$ {x_{kH/L}} $ ($ k= $ 1或2)元素组成,$ {x_{kH/L}} $ 是在高、低能量下测量的基材料线性衰减系数或质量衰减系数。此时,求解基材料图像只需将矩阵求逆然后计算即可,过程如(2)式所示:$$ \left( {\begin{array}{*{20}{c}} {{{\boldsymbol{d}}_{{1},i,j}}} \\ {{{\boldsymbol{d}}_{{2},i,j}}} \end{array}} \right) = {\frac{{1}}{{{x_{{1}H}}{x_{{2}L}} - {x_{{2}H}}{x_{{1}L}}}}} \left( {\begin{array}{*{20}{c}} {{x_{{2}L}}}&{ - {x_{{2}H}}} \\ { - {x_{{1}L}}}&{{x_{{1}H}}} \end{array}} \right)\left( {\begin{array}{*{20}{c}} {{{\boldsymbol{X}}_{H,i,j}}} \\ {{{\boldsymbol{X}}_{L,i,j}}} \end{array}} \right) \text{,} $$ (2) 直接矩阵求逆分解是图像域基材料分解的基础方法,其他方法都是在此法上衍变出来的。该方法的优点是计算简便,缺点是分解过程中放大了图像的噪声,分解图像质量较差。
为解决通过直接矩阵求逆生成分解图像的噪声问题,人们提出了分解后去噪和分解前去噪两种解决方案(表1),最初的方案是分解后去噪,这类方法在分解之后直接对分解图像进行噪声抑制,以此提高分解图像的信噪比。自迭代技术成功应用于CT图像重建之后,分解前去噪的方案得到广泛应用。通过对CT图像重建过程进行优化,从而获得去噪后的CT图像,以尽可能降低噪声在后续分解过程中的干扰。两种解决方法均可在一定程度上抑制噪声,提高图像的信噪比,但这两种方法都是独立于分解过程的去噪方法,没有考虑分解过程的噪声对图像的影响,所以分解图像还是会存在噪声干扰。
表 1 两种解决方案的主要研究Table 1. Main research of two solutions方法 文献 时间 优点 缺点 分解后去噪 [13] 1976 方法实现简单,计算效率高 由于图像分辨率损失很大,效果有限 [14] 1984 实现简便 效果有限 [15] 1985 实现简单 效果有限 [16] 1988 缓解了空间分辨率损失的问题 有边缘伪影 [17] 1995 算法可以在不考虑噪声相关性的情况下实现
噪声抑制分解后的图像中高频噪声被过度抑制,导致图像纹理的改变 [18] 2003 算法利用CT或分解图像的冗余结构或统计信
息进行噪声抑制,可以更好地抑制噪声没有完全描述DECT图像和分解图像之间的映射关系 分解前去噪 [19] 2014 使重建的两幅CT图像噪声变得强烈相关,进
而使得分解图像的噪声得到显著抑制CT重建和图像分解的结合增加了计算的复杂性,并且算法需要大量迭代才能收敛 [20] 2015 可以在保留定量测量和高频边缘信息的同
时显著降低噪声在心肌成像中仍会存在边缘效应 [21] 2018 在抑制噪声的同时可以保持图像边缘细节 没有考虑分解过程的噪声对图像的影响 [22] 2019 可获得高质量的重建CT图像以便后续分解 没有考虑分解过程的噪声对图像的影响 1.2 迭代分解
迭代分解在直接矩阵求逆分解的基础上,充分挖掘分解过程的噪声统计特性,将物质分解和抑制噪声两步骤结合在一起,在分解过程中逐步抑制噪声,可产生较好的图像质量。结果表明,迭代分解可以在很大程度上抑制图像的噪声,明显提高分解图像的质量,但同时也增加了计算量。
比较经典的图像域迭代分解是Niu等[23]在2014年提出的,该算法采用光滑正则化的最小二乘估计模型作为分解模型框架,在最小二乘项中包括分解图像的估计变量协方差矩阵的逆作为惩罚权重,以获得更好的噪声抑制性能;与传统惩罚加权最小二乘模型去噪不同,此模型结合分解和去噪,采用共轭梯度迭代方法,边去噪边分解,最后得到高质量的分解图像。然而,该算法并没有完全描述CT图像和分解图像之间的映射关系,不能在CT图像的对象边界分布和噪声行为上实现明显的区分。
为解决上述问题,Tang等[24]充分探讨了CT图像边界和噪声在频域的分布差异,在2015年提出了一种基于多尺度惩罚加权最小二乘(penalized weighted least square,PWLS)的DECT图像域分解算法,利用基于各向同性扩散的多尺度分解算法将高能量和低能量CT图像分解到尺度空间,该方法充分利用了信号处理在每个尺度上的灵活性,以抑制放大的噪声,同时保持物质特定图像的高空间分辨率。
Li等[25]对分解模型框架中的正则化项进行创新,提出了DECT-MULTRA(mixed union of learned transforms,MULTRA)算法,运用机器学习的方法对正则化项进行改进,正则化项使用的是基于混合学习稀疏变换的混合联合模型,加了正则化项的分解模型可以加强分解后图像的平滑度、同时保留边缘锐度。结果显示,该方法显示出了巨大的优越性,无论是在增加低对比度边缘的清晰度还是减少不同软组织图像边界的伪影上,DECT-MULTRA方法分解的图像质量最好。此外,与其他方法相比较,DECT-MULTRA迭代收敛速度快,但是需要仔细调整合适的参数,计算量很大。王冲旭等[26]使用了一种深度迭代残差网络(IR-Net)对正则化项进行改进,实验结果显示,相较于DECT-MULTRA调参过程复杂,运行时间过长,使用IR-Net可以在很短的时间内完成分解,提高了基材料分解效率。
根据文献[27]对直接矩阵求逆分解法和Niu提出的迭代分解法的模拟复现结果如图1所示,从图像质量上可见迭代分解优于直接矩阵求逆分解。
1.3 基于深度学习方法的分解
迭代分解显著提高了图像的信噪比,但因其计算量过大等问题限制了算法的发展。近年来,随着深度学习在医学领域的广泛应用,图像域基材料分解问题也可以用深度学习的方法来解决(表2)[28-30]。结果显示,使用基于深度学习方法的分解算法可以在极大程度上抑制基材料图像的噪声,甚至一些神经网络分解的基材料图像不存在噪声干扰的问题,此外,还提升了基材料分解的精度和效率,但是基于深度学习的分解算法需要大量的数据集训练网络模型,训练样本的数量制约着算法的发展。
表 2 基于深度学习方法分解图像的主要研究Table 2. Main research of image decomposition based on deep learning method2. 多物质分解方法
2.1 直接矩阵求逆分解
假设DECT重建图像中每个体素都是由各种基材料组成的,那么每个体素所反映的吸收系数可以理解为是由各种基材料吸收系数共同组合而成[34],如公式(3)所示:
$$ \mu \left( E \right) = \sum\limits_{i = {1}}^N {{\alpha _i}\;{\mu _i}} \left( E \right), {\rm{subject }}\;{\rm{to}}\quad \sum\limits_{i = {1}}^N {{\alpha _i} = {1}} ,\quad{0} \leqslant {\alpha _i},\quad i = {1},2, \cdots ,N, $$ (3) 式中
$ \mu \left( E \right) $ 表示在能量级E下各种基材料衰减系数的总和,N表示基材料的数目,$ {\mu _i}\left( E \right) $ 表示在能量级E下第i种基材料的衰减系数,$ {\alpha _i} $ 表示第i种基材料体积占所有基材料总体积的体积分数。利用DECT的能谱数据可重建出两幅单能图像,如公式(4):
$$ \left( {\begin{array}{*{20}{c}} {{\mu _{1}}\left( {{E_{1}}} \right)}&{{\mu _{2}}\left( {{E_{1}}} \right)}&{{\mu _{3}}\left( {{E_{1}}} \right)} \\ {{\mu _{1}}\left( {{E_{2}}} \right)}&{{\mu _{2}}\left( {{E_{2}}} \right)}&{{\mu _{3}}\left( {{E_{2}}} \right)} \\ {1}&{1}&{1} \end{array}} \right)\left( {\begin{array}{*{20}{c}} {{\alpha _{1}}} \\ {{\alpha _{2}}} \\ {{\alpha _{3}}} \end{array}} \right) = \left( {\begin{array}{*{20}{c}} {\mu \left( {{E_{1}}} \right)} \\ {\mu \left( {{E_{2}}} \right)} \\ {1} \end{array}} \right),\quad {0} \leqslant {\alpha _i} \leqslant {1},\;\;i = {1},{2},{3} 。 $$ (4) 求解DECT测量的多物质分解是一个不适定问题,因为要从两幅图像中得出多幅图像,为了解决这个问题,2009年,Liu等[35]提出了一种使用质量分数守恒为约束条件的三物质分解方法。该算法成功求出基材料的质量分数,但前提是在混合物的组成已知的情况下,所以该方法适用性不高。2014年,Mendonça等[36]独创的提出了一种图像域 MMD方法,成功将一次扫描得到的低能量和高能量的滤波反投影图像分解为多个基材料图像。该方法分解的MMD图像已成功地应用于虚拟非对比增强图像、脂肪肝和肝纤维化的应用,也成为了图像域MMD直接矩阵求逆的基本方法,为其他方法的拓展奠定了基础。然而,直接矩阵求逆分解的图像容易受噪声的干扰。
Jiang等[37]提出了一种用于DECT的MMD图像域噪声抑制方法,算法推导了MMD噪声的传播规律,采用多维旋转策略来寻找噪声干扰最小的主轴,沿主轴方向抑制噪声。该方法在不改变噪声分布和空间结构的前提下,有效地抑制了分解后图像的噪声,提高了图像质量,但没有考虑分解前噪声对图像的干扰。Lee等[38]提出了一个用于DECT的MMD框架,该框架包括分解前和分解后阶段,将全变分去噪方法作为一种噪声抑制手段应用于分解前和分解后阶段,结果表明,该方法能在提高分解精度的同时更清晰地区分密度差较小的基材料,但没有考虑分解图像的噪声特性。为此,降俊汝等[39]利用字典学习充分发掘分解图像的稀疏性,进一步提高了分解图像的准确性,但处理步骤繁多,参数难调,增加了计算问题的复杂度。
2.2 迭代分解
MMD直接矩阵求逆分解方法中,高低能量的线性衰减系数只逐像素估计基材料的体积分数,而不考虑测量的噪声统计特性,为此,采用统计模型建模,迭代求解来抑制噪声。Long等[40]提出了一种基于边缘保持正则化的惩罚似然(penalized-likelihood,PL)方法,PL方法显著降低了分解图像中的噪声、条纹和交叉污染伪影。然而,这种方法计算量大,主要是由于多个基材料图像之间的正向和反向投影以及对低能量和高能量的正弦图像的映射,而且没有考虑每个像素中基材料类型的稀疏性。
随后,Xue等[41]建立带有负对数似然项和边缘保持(edge-preserving,EP)正则化的PWLS估计模型,后称为PWLS-EP-LOOP方法。与Mendonça提出的图像域直接矩阵求逆相比,PWLS-EP-LOOP方法在保持基材料图像解剖结构和分解精度的同时,能显著抑制噪声。由于不需要正向或反向投影,因此在计算上比PL方法更实用。同PL方法一样,没有考虑每个像素中基材料类型的稀疏性,为此,Ding等[42]考虑了分解图像梯度的低秩性、基材料成分的稀疏性以及质量和体积守恒提出了一种带有3个正则化项的PWLS模型,该方法减少了交叉污染,提高了分解图像的精度,但图像中高频噪声被过度抑制,易导致图像纹理的改变。
3. 总结和展望
本文对双能CT图像域基材料分解的两物质分解和多物质分解法进行了总结。对于两物质分解法,深度学习方法在图像去噪和保持图像细微结构方面好于直接矩阵求逆、迭代分解法[33];对于多物质图像分解方法中,有报道[42]迭代分解法在基材料分解精度方面明显优于直接矩阵求逆法,但未见深度学习分解法的应用。因此基于深度学习的基材料图像分解方法将是下一步研究的重要内容。
尽管基材料分解算法理论上可以帮助临床医生更好的分析病灶,但低X射线能量图像噪声会影响物质分解的准确性,鲁棒性好的基材料分解算法可能会克服这一限制,因此基材料分解算法还需要进一步提升[43]。
图像域基材料分解有3个重要的发展方向,①减小噪声对基材料分解的影响至关重要;②由于图像重建过程中产生的光束硬化伪影无法消除,消除伪影的影响可以极大程度的提高分解图像的精确度;③以光子计数探测器 CT(photon-counting detector CT,PCD CT)为代表的能谱CT成像技术一经问世便引起了广泛关注,PCD CT成像较DECT成像的优势在于重建过程受能谱硬化效应的影响小,可以有效抑制射束硬化伪影的产生,但其尚未在临床上应用。
能谱CT的图像域基材料分解研究将是一个新的发展方向,为完全消除射束硬化伪影的影响带来了曙光。
-
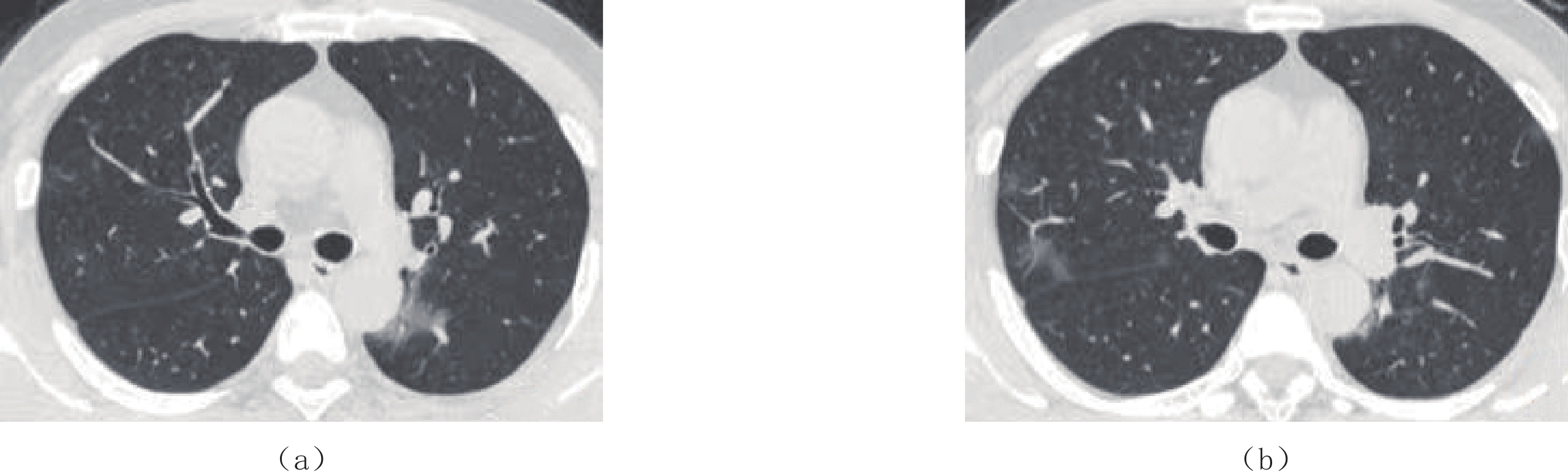
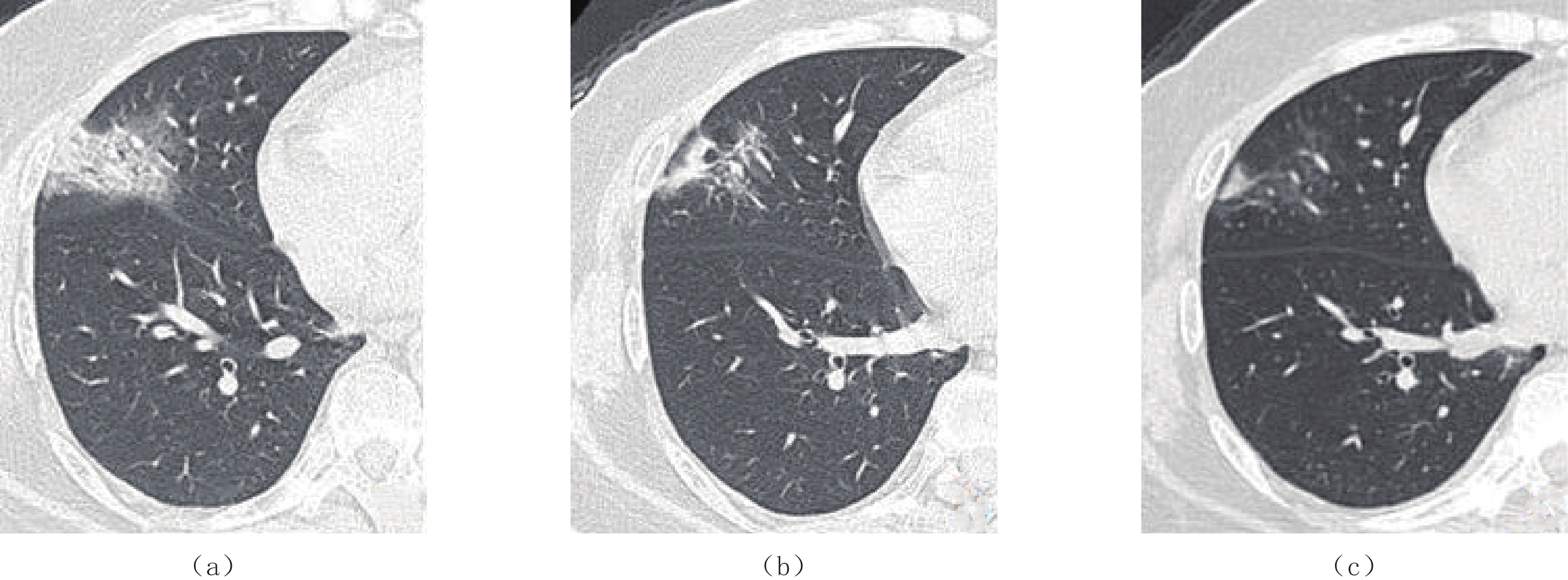
图 4 男,39岁,原始株组患者,临床诊断为新型冠状病毒感染普通型
(a)发病第3天初次CT示右肺上叶胸膜下磨玻璃影,伴支气管充气征及血管增粗。(b)发病第8天后复查CT,病灶范围增大,且密度增高,呈实变表现,另可见双肺上叶新出现病灶。(c)发病13天后复查,病灶基本完全吸收,仅残留少量磨玻璃影,密度较淡,边缘模糊。
Figure 4. A computed tomography image of a 39-year-old male from the original strain group, which is clinically diagnosed as common COVID-19
表 1 新型冠状病毒感染不同毒株肺炎发生情况
Table 1 Incidence of pneumonia in cases infected with different strains of COVID-19
罹患肺炎情况 合计 发生情况 统计检验 发生 未发生 $\chi^2$ P 原始株组a、b 75 66 9 297.682 0.000 Delta组c 130 83 47 Omicron组 562 63 499 注:a-原始株组与Delta组发生率比较有统计学意义,P<0.05校正值;b-原始株组与Omicron组发生率比较有统计学意义,P<0.05校正值;c-Delta组与Omicron组发生率比较有统计学意义,P<0.05校正值。 表 2 新型冠状病毒感染不同毒株临床分型情况
Table 2 Clinical classification of cases infected with different strains of COVID-19
组别 分型 统计检验 轻型 普通型 重型及危重型 $\chi^2$ P 原始株组 9 47 19 321.168 0.000 Delta组 47 69 14 Omicron组a 499 60 3 注:a-Omicron组与原始株组、Delta组在临床分型比较均有统计学意义,P<0.05校正值。 表 3 新型冠状病毒感染不同毒株患者初次CT病变分布情况
Table 3 Distribution of primary computed tomography lesions in patients infected with different strains of COVID-19
病变分布 组别 统计检验 原始株组(n=66) Delta组(n=83) Omicron组(n=63) $\chi^2$ P 累计范围 单肺 13 20 23 5.064 0.08 双肺 53 63 40 累计肺叶数量b 1 12 15 18
250.770
0.0002 10 19 27 3 11 14 15 4 9 13 2 5 24 22 1 病灶分布 胸膜下 40 55 30
45.760
0.000胸膜下伴支气
管血管束周围26 24 11 支气管血管
束周围a0 4 22 注:a-Omicron组与原始株组、Delta组比较均有统计学意义,P<0.05校正值;b-原始株组、Delta组、Omicron组两两比较均有统计学意义,P<0.05校正值。 表 4 初次CT影像学表现
Table 4 Primary computed tomography imaging findings
CT表现 组别 统计检验 原始株组(n=66) Delta组(n=83) Omicron组(n=63) $\chi^2/F$ P 斑片状磨玻璃影a 62 75 50 7.190 0.027 腺泡结节磨玻璃影a 2 3 12 14.799 0.001 实变 2 5 1 2.087 0.352 铺路石征b 32 43 15 12.919 0.002 支气管充气征 19 25 21 0.332 0.847 条索 8 13 6 1.247 0.536 血管增粗 27 33 19 1.957 0.376 胸腔积液 3 2 1 1.113 0.573 注:a-Omicron组与原始株组、Delta组比较均有统计学意义,P<0.05校正值;b-原始株组与Delta组、Omicron组比较有统计学意义,P<0.05校正值。 表 5 不同毒株进展期磨玻璃影变化特点
Table 5 Change characteristics of ground-glass opacity in advanced stage of COVID-19 infection with different strains
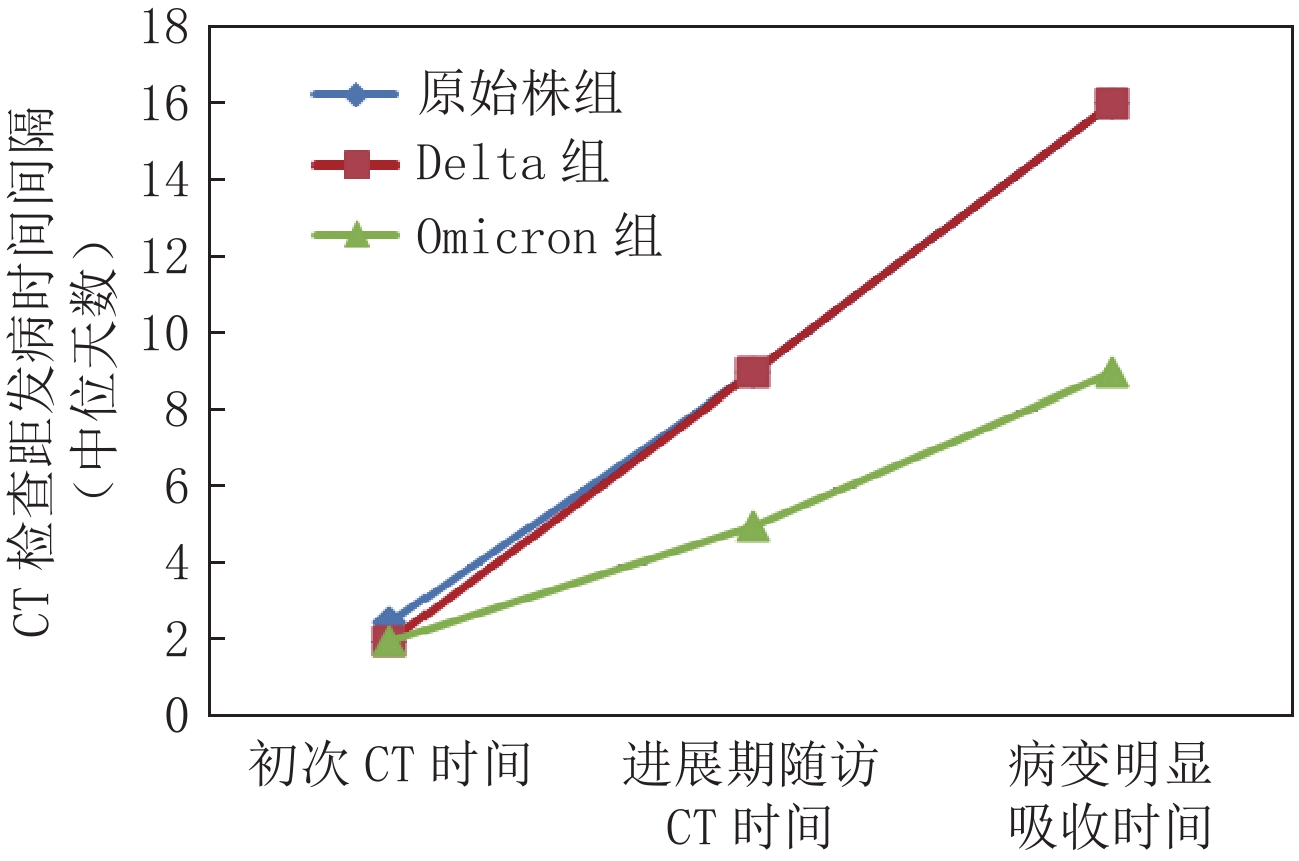
CT变化 组别 统计检验 原始株组(n=66) Delta组(n=83) Omicron组(n=32) $\chi^2$ P 病灶变化 无变化 8 7 4 0.967 0.915 吸收 43 56 22 进展 15 20 6 原病变中是否出现实变 26 37 11 1.090 0.580 原病变中是否出现条索 35 51 23 3.291 0.193 是否新出现胸腔积液 3 4 1 0.161 0.923 表 6 不同毒株患者病程中CT检查时间间隔
$({{{M}}}({P}_{25},{P}_{75}))$ Table 6 Time interval of computed tomography examinations in the course of disease with different strains of COVID-19
$({M}({P}_{25}, {P}_{75}))$ CT检查时间间隔/d 初次CT时间 进展期随访CT时间 病变明显吸收时间 原始株组(n=66)a、b 2.5(2~4) 9(8~11) 16(12.75~22.25) Delta组(n=83)c 2(1~2) 9(8~10) 16(14~17) Omicron组(n=32) 2(1~2) 5(4.25~6) 9(8~10) $\chi^2$ 21.037 70.906 61.210 P 0.000 0.000 0.000 注:a-原始株组与Omicron组在初次CT时间、进展期随访CT时间、病变明显吸收时间比较均有统计学意义,P<0.05校正值;b-原始株组与Delta组组在初次CT时间、进展期随访CT时间比较均有统计学意义,P<0.05校正值;c-Delta组与Omicron组在进展期随访CT时间、病变明显吸收时间上比较均有统计学意义,P<0.05校正值。 -
[1] World Health Organization. Tracking SARS-CoV-2 variants[EB/OL]. (2021-12-06)[2021-12-09]. https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.
[2] RAMAN R, PATEL K J, RANJAN K. COVID-19: Unmasking emerging SARS-CoV-2 variants, vaccines and therapeutic strategies[J]. Biomolecules, 2021, 11(7): 993. doi: 10.3390/biom11070993
[3] 张影, 李晓鹤, 陈凤, 等. 新型冠状病毒德尔塔和奥密克戎变异株感染患者的临床特征分析[J]. 新发传染病电子杂志, 2022,7(3): 22−26. DOI: 10.19871/j.cnki.xfcrbzz.2022.03.005. ZHANG Y, LI X H, CHEN F, et al. Clinical characteristics of patients infected with SARS-CoV-2 Delta and Omicron variants[J]. Electronic Journal of Emerging Infectious Diseases, 2022, 7(3): 22−26. DOI: 10.19871/j.cnki.xfcrbzz.2022.03.005. (in Chinese).
[4] ARAF Y, AKTER F, TANG Y D, et al. Omicron variant of SARS-CoV-2: Genomics, transmissibility, and responses to current COVID-19 vaccines[J]. Journal of Medical Virology, 2022, 94(5): 1825−1832. doi: 10.1002/jmv.27588
[5] GUAN C S, LV Z B, LI J J, et al. CT appearances, patterns of progression, and follow-up of COVID-19: Evaluation on thin-section CT[J]. Insights into Imaging, 2021, 12: 73. doi: 10.1186/s13244-021-01019-0
[6] 国家卫生健康委员会. 《新型冠状病毒感染的肺炎诊疗方案》试行(第九版)[EB/OL]. [2022-03-15]. http://www.nhc.gov.cn/xcs/zhengcwj/. [7] HANSELL D M, BANKIER A A, MACMAHON H, et al. Fleischner society: Glossary of terms for thoracic imaging[J]. Radiology, 2008, 246(3): 697−722. DOI: 10.1148/radiol.2462070712.
[8] FANG Y C, ZHANG H Q, XIE J C, et al. Sensitivity of chest CT for COVID-19: Comparison to RT-PCR[J]. Radiology, 2020, (2): 200432−7.
[9] 中华医学会放射学分会传染病学组, 中国医师协会放射医师分会感染影像专委会, 中国研究型医院学会感染与炎症放射专委会, 等. 新型冠状病毒感染的肺炎影像学诊断指南(2020 第二版)[J]. 首都医科大学学报, 2020,41(2): 168−173. doi: 10.3969/j.issn.1006-7795.2020.02.004 Committee of the Infectious Diseases Radiology Group of Chinese Society of Radiology, Committee of the Infectious Diseases Radiology Section of Chinese Medical Doctor Association, Infectious Disease Imaging Group, Infectious Disease Branch, Chinese Research Hospital Association, et al. Guideline for imaging diagnosis of novel corona virus (2019-nCoV) infected pneumonia (2st edition 2020)[J]. Journal of Capital Medical University, 2020, 41(2): 168−173. (in Chinese). doi: 10.3969/j.issn.1006-7795.2020.02.004
[10] FENG Z C, YU Q Z, Y S H, et al. Early prediction of disease progression in 2019 novel corona virus pneumonia patients out-side wuhan with CT and clinical characteristics[EB/OL]. ( 2020-02-23). https://www.medrxiv.Org/content/10.1101/2020.02.19.20025296v1.
[11] 黄璐, 韩瑞, 于朋鑫, 等. 新型冠状病毒肺炎不同临床分型间CT和临床表现的相关性研究[J]. 中华放射学杂志, 2020,54: 1005−201. [12] HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel corona virus in Wuhan, China[J]. Lancet, 2020, (20): 30183−5.
[13] 刘茜, 王荣帅, 屈国强, 等. 新型冠状病毒肺炎死亡尸体系统解剖大体观察报告[J]. 法医学杂志, 2020,36(1): 21−23. doi: 10.12116/j.issn.1004-5619.2020.01.005 [14] NG M Y, LEE E Y P, YANNG J, et al. Imaging profile of the COVID-19 infection: Radiologic findings and literature review[J]. Radiology, 2020, 2(1): 1−9.
[15] 车宏伟, 张晓琴, 柴军, 等. 新型冠状病毒肺炎临床表现及CT影像学分析[J]. CT理论与应用研究, 2021,30(4): 525−532. DOI: 10.15953/j.1004-4140.2021.30.04.14. CHE H W, ZHANG X Q, CHAI J, et al. Clinical manifestations and CT imaging analysis of corona virus disease 2019[J]. CT Theory and Applications, 2021, 30(4): 525−532. DOI: 10.15953/j.1004-4140.2021.30.04.14. (in Chinese).
[16] PAN F, YE T, SUN P, et al. Time course of lung changes at chest CT during recovery from corona virus disease 2019 (COVID-19)[J]. Radiology, 2020, 295(3): 715−721. doi: 10.1148/radiol.2020200370
[17] KANNE J P. Chest CT findings in 2019 novel corona virus (2019-nCoV) infections from Wuhan, China: Key points for the radiologist[J]. Radiology, 2020, 295(1): 16−17. doi: 10.1148/radiol.2020200241
[18] 向颖, 杨全新, 孙泓泓, 等. 新型冠状病毒肺炎患者胸部CT表现及动态演变[J]. 南方医科大学学报, 2020,40(3): 327−332. XIANG Y, YANG Q X, SUN H H, et al. Chest CT findings and their dynamic changes in patients with COVID-19[J]. Journal Southern Medical University, 2020, 40(3): 327−332. (in Chinese).
[19] YU M, LIU Y, XU D, et al. Prediction of the development of pulmonary fibrosis using serial thin-section CT and clinical features in patients discharged after treatment for COVID-19 pneumonia[J]. Korean Journal of Radiology, 2020, 21(6): 746−755.
[20] 李秀梅, 刘伟, 常然, 等. 新型冠状病毒肺炎影像演变规律及肺纤维化危险因素[J]. 中国医学影像学杂志, 2022,30(1): 29−34. LI X M, LIU W, CHANG R, et al. Patterns of pulmonary image evolution and the risk factors of pulmonary fibrosis in patients with COVID-19[J]. Chinese Journal of Medical Imaging, 2022, 30(1): 29−34. (in Chinese).
-
期刊类型引用(4)
1. 李超. 改善经验模态分解端点问题的方法. 石油地质与工程. 2024(02): 72-76 .  百度学术
百度学术
2. 刘雅芳,谷志锋,李梦佳,刘靖波,李伦迪,张晓亮,阮振鹏,孔子君. 基于CEEMDAN算法的光伏功率信号光滑降噪. 电力电容器与无功补偿. 2023(03): 119-125 .  百度学术
百度学术
3. 潘兴良,刘建国. 基于经验模态分解法的下穿铁路工程对既有轨道变形监测数据降噪方法. 城市轨道交通研究. 2022(06): 96-101 .  百度学术
百度学术
4. 郭晓菲,欧同庚,马武刚,吴林斌,赵义飞,刘军,徐春阳. 基于CEEMDAN和小波变换的地震信号随机噪声压制新方法. 大地测量与地球动力学. 2022(11): 1202-1206+1210 .  百度学术
百度学术
其他类型引用(4)











 下载:
下载: