Diagnosis of Tuberous Sclerosis Complex with Multiple Organ Involvement using Computer Tomography: A Clinical Case Analysis
-
摘要:
结节性硬化症(TSC)是一种由于抑癌基因TSC1和/或TSC2突变引起的常染色体显性遗传病,其临床表现主要为反复癫痫发作、智力低下及面部血管纤维瘤等。本文报道1例TSC多器官受累病例,自幼年反复癫痫发作,右枕部皮肤鲨鱼革斑,双颊部多发紫红色小结节;CT平扫发现双侧侧脑室周围多发小钙化灶,肺淋巴管肌瘤病,双肾多发血管平滑肌脂肪瘤,左心室后壁心肌内存在多发脂肪灶。本文旨在提高对该病的认识。
Abstract:Tuberous sclerosis complex (TSC) is an autosomal dominant genetic disease caused by mutations in the tumor suppressor genes TSC1 and/or TSC2. Its clinical manifestations include recurrent seizures, intellectual disability, and facial angiofibromas. Herein, we report the case of a patient with TSC who had recurrent seizures since childhood, shark skin nevus on the right occipital region, and multiple purple-red nodules on both cheeks. Computer tomography (CT) revealed multiple small calcifications around the lateral ventricles, pulmonary lymphangioleiomyomatosis, multiple renal angiomyolipomas, and multiple lipomatous lesions on the left ventricular wall. Through this case report, we aimed to improve the understanding of TSC.
-
Keywords:
- CT diagnosis /
- tuberous sclerosis complex /
- multiple organ involvement
-
结节性硬化症(tuberous sclerosis complex,TSC)是一种非常罕见的、由抑癌基因TSC1和TSC2突变引起的常染色体显性遗传病[1-2],人群中发病率约为0.01%[3]。TSC最典型的临床表现为癫痫、智力低下和面部血管纤维瘤,又称为TSC“三联征”[4]。但其中60% 以上的患者仅以癫痫发作为首发症状到医院就诊[5]。TSC典型的CT影像表现包括侧脑室周围多发钙化结节,肺淋巴管肌瘤病,肝脏和肾脏多发血管平滑肌脂肪瘤[6]。部分婴幼儿还会并发心脏横纹瘤,但多在2岁以后随年龄增长逐渐消退,成人不可见[6]。目前临床对于成年TSC患者心脏受累表现的认知有限,尚无文献总结成年TSC患者心脏方面的临床及影像学表现。
现报道1例TSC伴全身多脏器受累的女性癫痫患者,总结其临床和影像学特征,以提高影像和临床医师对该疾病的认识和诊治能力。
1. 病历资料
1.1 临床表现
患者,女,27岁,自3岁开始出现癫痫发作,表现为突然倒地,四肢僵直伴抽搐,牙关紧闭,口吐白沫,呼之不应,症状持续1~2 min,清醒后患者无法回忆整个发病过程。发病后患者曾到外院就诊,被诊断为“癫痫”并服用苯巴比妥和苯妥英钠控制癫痫症状。出院后患者数年来一直反复癫痫发作,发作时间间隔无规律性,从几天到几个月不等。
患者上小学时,无法与同学进行交流和玩耍,自语自笑,日常生活自理存在一定困难。2022年2月1日患者因“烦躁抑郁”到我院住院治疗。
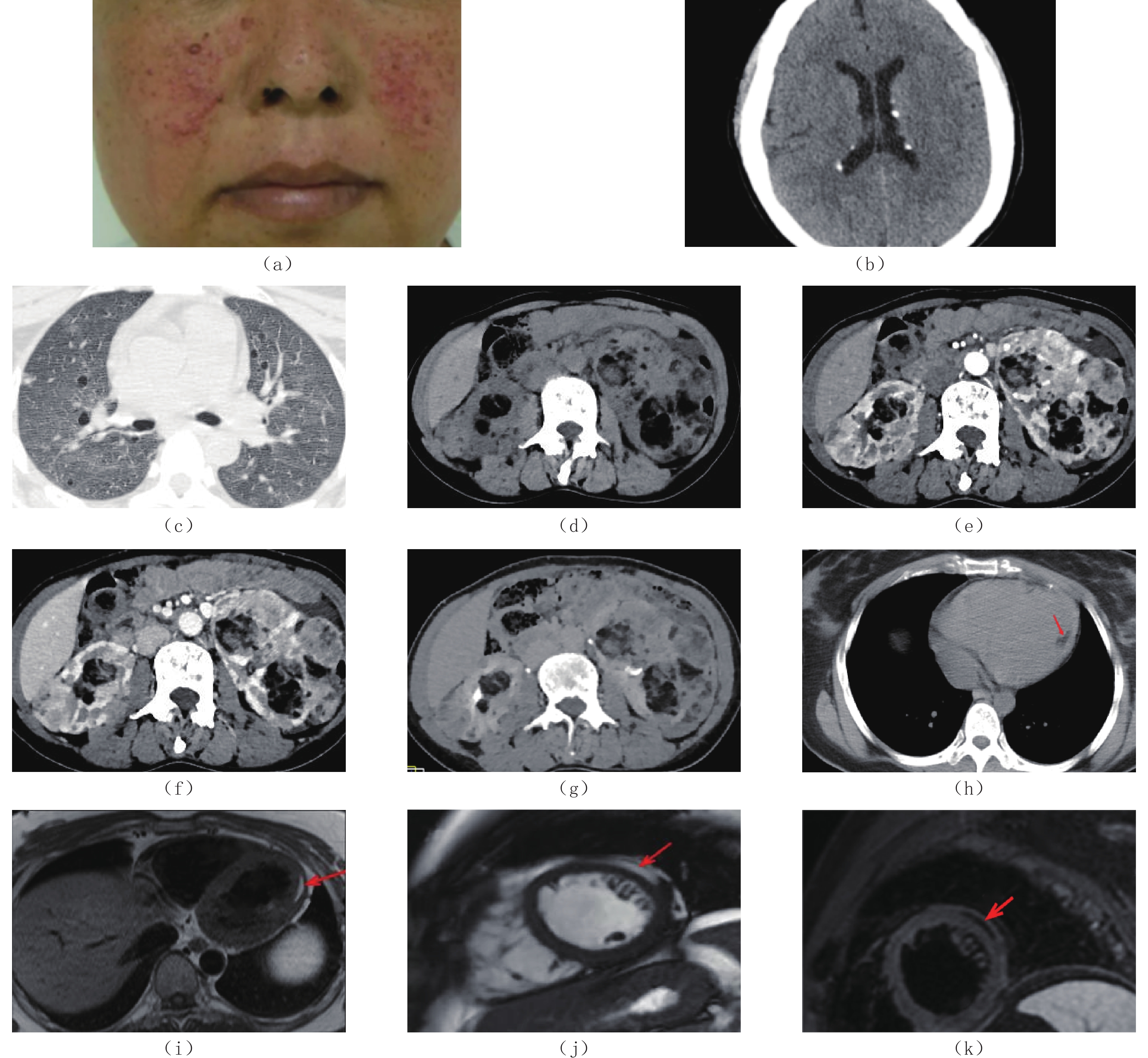
入院时患者心率87次/min,血压132/79 mmHg,心电图检查结果正常。查体:患者右枕部皮肤见鲨鱼革斑;双侧颜面部皮肤多发暗红色小结节(图1(a))。汉密尔顿焦虑量表(HAMA)评分:16分,汉密尔顿抑郁量表(HAMD)评分:20分,说明患者还伴有间歇性的焦虑抑郁发作。
1.2 CT表现
患者入院后行头颅、胸部和腹部CT检查。CT表现:①双侧侧脑室旁多发钙化小结节(图1(b))。②双肺多发大小不一的类圆形透亮影,直径在1~17 mm之间,以2~5 mm者居多,囊壁较薄,厚度约1~2 mm,囊壁内外缘光滑,囊腔内未见肺血管影,双肺内病灶呈散在随机分布,各肺叶肺段内分布无明显差异(图1(c))。③双肾形态失常,体积增大,平扫其内多发软组织密度与脂肪密度混杂影(图1(d)),增强扫描动脉期和实质期软组织密度部分明显强化,CT值均约115~130 HU(图1(e)和图1(f)),其内可见多发迂曲增粗血管影,延迟期大致均匀强化,强化程度稍减低,CT值约100~121 HU(图1(g)),脂肪组织增强各期均呈轻度强化。上述考虑双肾多发血管平滑肌脂肪瘤。④CT平扫患者左心室后壁心肌内多发小斑片状低密度影,多点测量病灶的CT值均在-23~-49 HU之间(图1(h)红色箭头所示)。
为确定病灶性质,我们对患者进行心脏MRI检查:T1WI和T2WI图像上均可见左室后壁心肌内见小条状高信号影,边界清楚,信号与皮下脂肪组织信号一致(图1(i)和图1(j)红色箭头所示),运用双反转恢复快速自旋回波(DIRFSE)结合STIR脂肪抑制的心脏三反转黑血技术,病灶呈低信号(图1(k)红色箭头所示)。证明左心室后壁心肌内的异常信号灶为脂肪组织,考虑为心肌内的脂肪灶。
综合患者的临床和影像学资料,参照国际结节性硬化症专家共识[1],该患者最终诊断为:TSC合并多器官受累。
1.3 治疗
使用卡马西平200 mg bid控制患者的癫痫发作,后序贯给予mTOR受体抑制剂依维莫司10 mg qd口服治疗。治疗两周后患者好转出院,住院期间患者无药物治疗不良反应。
1.4 随访
患者在出院后近1年的随访过程中,无再次出现癫痫及其他精神疾病发作。1年后再次入院复查,患者智力水平较1年前无明显降低。CT检查胸腹部病灶均未见增大。
2. 讨论
2.1 病因及发病机制
TSC是由于抑癌基因TSC1和/或TSC2发生突变,导致其编码的错构瘤蛋白(hamartin)和/或马铃薯球蛋白(tuberlin)功能降低,对雷帕霉素靶蛋白(mTOR)的抑制作用减弱[6]。
mTOR过度激活会使细胞内磷酸化核糖体S6蛋白激酶(p70S6K)和4E结合蛋白1(4E-BP1)异常增多,进而影响大脑的发育及电活动,导致患者出现癫痫、智力低下等临床症状[7]。同时其还能引起机体内各种组织细胞发生异常增殖以及细胞的分化、定位和移行出现障碍,因此全身多个器官和系统出现错构瘤。
2.2 临床特征
TSC患者多在1~3岁时以反复发作的癫痫起病,女性多于男性,患者智力通常低于同龄人群,部分患者会伴随焦虑、抑郁等精神疾病[4]。体格检查患者的皮肤具有特征性表现,例如出现黑色素斑、鲨革样斑、白色斑疹、面部血管纤维瘤、沙格林斑块、纤维性头斑、蹄部纤维瘤等。
本例患者为青年女性,以3岁开始反复癫痫发作起病,查体患者枕后部有鲨鱼革斑,额面部有多发暗红色小结节,伴智力低下,与既往文献报道中TSC患者的典型症状相符[1-3]。但患者无家族遗传史,属于散发病例[4]。同时,本例患者还伴有间歇性焦虑抑郁发作,属于TSC患者中较少见伴随精神疾病者。
2.3 影像学表现
TSC为多器官受累的显性遗传病,观察内容包括患者颅脑、胸部及腹部的CT图像。双侧侧脑室周围多发钙化灶、肺淋巴管肌瘤病、双肾和/或肝脏多发血管平滑肌脂肪瘤是TSC患者特征性的CT影像学表现[5]。另外,我们还发现本例患者CT图像上左室后壁及室间隔肌壁内存在多个小斑片状低密度灶,多点测量病灶的CT值均在
$- $ 23~$- $ 49 HU之间,初步考虑病灶为脂肪组织或富含脂肪成分的病变。为此,我们进一步对患者进行心脏MRI检查予以证实。MRI图像上左心室后壁存在多发小斑片状脂肪灶。既往国内外文献资料显示,TSC患者最常见的心脏并发症为横纹肌瘤,其通常在2岁以后随年龄增长而自发消退,成人基本不可见[8]。心脏横纹肌瘤在MRI T1WI图像上呈等信号,T2WI呈高信号,T2WI脂肪抑制序列上无信号减低区[8-11],说明病灶内不含脂肪成分,可与本例患者进行鉴别。已有文献报道TSC患者大腿及背部的脂肪细胞发生异常增殖,出现脂肪堆积和脂肪瘤[12]。
与之类似,本例患者是由于mTOR过度激活引起左心室后壁心肌内的脂肪细胞发生异常增殖,进而出现心肌内的脂肪灶。此外尽管本例成年患者左心室后壁存在多发脂肪灶,但患者的心电图、血压等均未见异常,说明TSC患者影像学检查若发现心肌内的脂肪灶,一定程度上可以长期随访观察,临床上无需积极干预治疗。
2.4 治疗与预后
基于结节性硬化症是由于TSC基因发生突变引起mTOR过度激活,目前临床上主要使用mTOR抑制剂治疗TSC,常用药物有博来霉素、依维莫司等。在使用过程中需要严密监测药物不良反应,如口腔炎、月经失调和感染等[13]。
TSC患者总体死亡率较低,约4.99%,但早期(18岁以前)进行诊断和治疗对降低患者死亡率具有重要价值[14]。因此熟悉TSC患者的临床及影像学表现,具有重要意义。
2.5 诊断与鉴别诊断
TSC的诊断标准:目前临床上广泛采用的是2012年国际TSC大会的诊断标准,包括基因诊断和临床诊断两种方法。如果基因检测发现TSC1或TSC2基因存在突变,可直接确诊为TSC。在基因检测结果阴性或无条件进行基因检测的情况下,需要依据临床特征来诊断TSC,其包含11个主要特征和6个次要特征。
主要特征包括:①色素脱失斑(≥3个,直径≥5 mm);②面部血管纤维瘤(≥3个)或头部纤维斑块;③指(趾)甲纤维瘤(≥2个);④“鲨鱼革”样斑;⑤多发性视网膜错构瘤;⑥皮质发育不良(包括皮质结节和白质放射状移行线);⑦室管膜下结节;⑧室管膜下巨细胞型星形细胞瘤(subependymal giant cell astrocytoma,SEGA);⑨心脏横纹肌瘤;⑩肺淋巴管肌瘤病;⑪肾血管平滑肌脂肪瘤。
次要特征包括:①“斑斓”样皮肤损害;②牙釉质凹陷超过 3个;③口腔内纤维瘤 3个及以上;④视网膜色素脱失斑;⑤多发性骨囊肿;⑥非肾脏错构瘤。在上述特征中,如果患者存在2个主要特征或者1个主要特征加上2个及2个以上次要特征,即使患者未进行基因检测,也可确诊为TSC。但对于仅存在肺淋巴管肌瘤病和肾血管平滑肌脂肪瘤这两个主要特征的患者,还需要其他特征支持才能诊断为TSC。
在临床工作中,如果头颅CT扫描发现侧脑室周围存在室管膜下结节的患者,应高度警惕患TSC的可能。此时需要对患者进一步行头颅MRI检查,仔细观察并寻找患者头颅MRI图像上有无皮层发育不良和SEAG。若存在皮层发育不良或SEAG,能够帮助确诊为TSC。若未发现皮层发育不良和SEAG,患者还需要再进一步行胸部和腹部CT检查,如果发现肺淋巴管肌瘤病或者肾血管平滑肌脂肪瘤,也可帮助我们确诊TSC。
TSC需要与肺淋巴管肌瘤病、TORCH综合征、致心律失常心肌病等相鉴别。
(1)肺淋巴管肌瘤病:影像学表现为双肺多发类圆形透亮影,部分患者会合并有纵隔淋巴结肿大、气胸或胸腔积液等。但患者侧脑室周围无钙化灶,心肌内无脂肪灶,且患者无癫痫、智力低下等临床表现。
(2)TORCH综合征:即围产期非致畸性病原体感染,患者多在幼年期以癫痫发作起病,患者智力常低于正常同龄人水平,颅脑CT/MRI图像上可见侧脑室周围多发钙化结节[15],但TORCH患者无鲨鱼革斑、暗红色皮疹等TSC特征性皮肤改变,双肺、肝脏及双肾影像学检查多无异常,可与TSC相鉴别。
(3)致心律失常性心肌病:左/右心室肌内均可出现脂肪灶,以右心室受累更常见,伴有心室腔扩大,心肌壁变薄,心肌射血功能减低等改变[16],而TSC患者心室腔大小、心室壁厚度及心室舒缩功能均正常,且一般不发生心律失常。
3. 结论
总之,头颅CT检查侧脑室周围存在钙化灶的患者,都应考虑到TSC的可能。结合患者典型的皮肤改变以及肺淋巴管肌瘤病、肝/肾错构瘤等影像表现,能够帮助确诊。
另外,本病例表明成年TSC患者会出现心肌多发脂肪灶,丰富了TSC患者在心脏受累方面的不典型影像学表现。对于TSC患者,进行详细全面的全身影像学检查具有重要的临床价值。
-
[1] NORTHRUP H, KRUEGER D A. Tuberous sclerosis complex diagnostic criteria update: Recommendations of the 2012 international tuberous sclerosis complex consensus conference[J]. Pediatric Neurology, 2013, 49(4): 243−254.
[2] PORTOCARRERO L K L, QUENTAL K N, SAMORANO L P, et al. Tuberous sclerosis complex: Review based on new diagnostic criteria[J]. Anais Brasileiros de Dermatologia, 2018, 93(3): 323−331.
[3] Von RANKE F M, FARIA I M, ZANETTI G, et al. Imaging of tuberous sclerosis complex: A pictorial review[J]. Radiologia Brasileira, 2017, 50(1): 48−54. DOI: 10.1590/0100-3984.2016.0020.
[4] RODRIGUES D A, GOMES C M, COSTA I M. Tuberous sclerosis complex[J]. Anais Brasileiros de Dermatologia, 2012, 87(2): 184−196. DOI: 10.1590/S0365-05962012000200001.
[5] CURATOLO P, MOAVERO R, de VRIES P J. Neurological and neuropsychiatric aspects of tuberous sclerosis complex[J]. Lancet Neurology, 2015, 14(7): 733−745. DOI: 10.1016/S1474-4422(15)00069-1.
[6] RITTER D M, FESSLER B K, EBRAHIMI-FAKHARI D, et al. Prevalence of thoracoabdominal imaging findings in tuberous sclerosis complex[J]. Orphanet Journal of Rare Diseases, 2022, 17(1): 124−134.
[7] MIZUGUCHI M, OHSAWA M, KASHII H, et al. Brain symptoms of tuberous sclerosis complex: Pathogenesis and treatment[J]. International Journal of Molecular Sciences, 2021, 22(13): 6677−6692.
[8] LIN Y, WU W, GAO L, et al. Multimodality imaging of benign primary cardiac tumor[J]. Diagnostics (Basel), 2022, 12(10): 2543−2562.
[9] HOEY E T, MANKAD K, PUPPALA S, et al. MRI and CT appearances of cardiac tumours in adults[J]. Clinical Radiology, 2009, 64(12): 1214−1230. DOI: 10.1016/j.crad.2009.09.002.
[10] ALSHOABI S A, HAMID A M, ALHAZMI F H, et al. Diagnostic features of tuberous sclerosis complex: Case report and literature review[J]. Quantitative Imaging in Medicine and Surgery, 2022, 12(1): 846−861.
[11] 王乐, 秦娜, 郝美美, 等. 中国结节性硬化症患者的临床特点及诊断现状分析[J]. 现代生物医学进展, 2019, 19(8): 1567−1572. WANG L, QIN N, HAO M M, et al. Clinical features and diagnosis of patients with tuberous sclerosis complex, a current evaluation in China[J]. Progress in Modern Biomedicine, 2019, 19(8): 1567−1572. (in Chinese).
[12] ILYAS M, QUEZADA J, OPFER E K. Lipomatous infiltration in tuberous sclerosis complex: A case series and literature review[J]. Child Neurology Open, 2021, 20(8): 48−65.
[13] LUO C, YE W R, SHI W, et al. Perfect match: mTOR inhibitors and tuberous sclerosis complex[J]. Orphanet Journal of Rare Diseases, 2022, 17(1): 106−109. DOI: 10.1186/s13023-022-02266-0.
[14] PENG J H, TU H P, HONG C H. A population-based study to estimate survival and standardized mortality of tuberous sclerosis complex (TSC) in Taiwan[J]. Orphanet Journal of Rare Diseases, 2021, 16(1): 335−348.
[15] 李林, 赵建设. MRI是儿童先天性TORCH综合征治疗的首选影像学检查方式[J]. 分子影像学杂志, 2019, 42(4): 430−433. LI L, ZHAO J S. Application and clinical analysis of MRI in the TORCH of children[J]. Journal of Molecular Imaging, 2019, 42(4): 430−433. (in Chinese).
[16] CIPRIANI A, MATTESI G, BARIANI R, et al. Cardiac magnetic resonance imaging of arrhythmogenic cardiomyopathy: Evolving diagnostic perspectives[J]. European Radiology, 2023, 33(1): 270−282.



 下载:
下载:




