Clinical Characteristics and Imaging Features of COVID-19 at Initial Diagnosis in Fever Clinic
-
摘要: 目的:探讨重型危重型新型冠状病毒感染者在门诊首诊时的临床特征和肺部CT表现。方法:回顾性分析发热门诊就诊的140例新型冠状病毒感染患者,其中中型组101例,重型危重型组39例。比较两组患者的一般人口学特征、临床表现、胸部薄层平扫CT(HRCT)检查及血常规+C反应蛋白(CRP)的差异性。结果:中型组和重型危重型组相比,①基线特征显示重型危重型组的年龄更高(66.05±14.38 vs. 77.90±13.12),首诊时病程更短(5.40±3.81 vs. 3.97±3.12),血氧饱和度(SPO2)更低(97.88±1.73 vs. 92.92±4.01),体温峰值(Tmax)更高(38.32±0.66 vs. 38.68±0.63);②肺部 CT显示重型危重型组的肺炎容积半定量更大(18.85±13.51 vs. 34.41±19.34);③血常规+CRP实验室检查显示重型危重型组的CRP更高(29.42±26.93 vs. 80.67±48.01),淋巴细胞计数(LYM)更低(1.64±0.68 vs. 0.95±0.64),粒细胞淋巴细胞比值更高(NLR)(3.48±2.46 vs. 9.36±10.42)。logistic回归分析显示年龄(OR=1.090,95%CI 1.006~1.181)、肺炎容积半定量(OR=1.086,95%CI 1.086~1.019)和SPO2(OR=0.261,95%CI 0.089~0.762)与新冠病毒感染重症危重症的发生相关,差异具有统计学意义;CRP(OR=1.054,95%CI 1.023~1.087)和LYM(OR=0.039,95%CI 0.04~0.391)与新冠病毒感染重症危重症的发生相关,差异具有显著统计学意义。结论:高龄、首诊时病程更短、SPO2更低、肺炎容积半定量更大、CRP升高、LYM下降与后期发展至新冠感染重型危重型相关,需要早期识别。Abstract: Objective: Objective: To explore and analyze the clinical features and chest thin-slice non-enhanced computed tomography (CT) imaging features of patients with coronavirus disease 2019 (COVID-19) at initial diagnosis in a fever clinic. Methods: A retrospective analysis was performed on 140 patients with COVID-19 at initial diagnosis in a fever clinic, including 101 and 39 cases in the moderate and severe and critical groups , respective-ly. Baseline, clinical characteristics, complete blood count + C-reactive protein (CBC+CRP), and chest thin-slice non-enhanced CT imaging characteristics of the patients were analyzed. Results: (1) The comparison between the moderate and severe and criti-cal groups showed that there were statistically significant differences in age (66.05±14.38 vs. 77.90±13.12,), course of initial diagnosis (5.40±3.81 vs. 3.97±3.12), SPO2 (97.88±1.73 vs. 92.92±4.01), and Tmax (38.32±0.66 vs. 38.68±0.63).(2) CT features between the two groups showed statistically significant differences in semi-quantitative volume (18.85±13.51 vs. 34.41±19.34). (3) The comparison between the moderate and severe and critical groups showed that there were statistically significant differ-ences in CRP (29.42±26.93 vs. 80.67±48.01), LYM (1.64±0.68 vs. 0.95±0.64), and NLR (3.48±2.46 vs. 9.36±10.42). (4) Six indicators, namely age, the course of initial diagnosis, SPO2, semi-quantitative volume, CRP, and LYM, were screened for multivariate logistic regression analysis. The result show that age (OR=1.090, 95%CI 1.006 ~ 1.181), semi-quantitative (OR=1.086, 95%CI 1.086 ~ 1.019), and SPO2 (OR=0.261, 95%CI 0.089 ~ 0.762), are related to the occurrence of severe and critical COVID-19 infection, and the difference is statistically significant; CRP (OR=1.054, 95%CI 1.023 ~ 1.087) and LYM (OR=0.039, 95%CI 0.04 ~ 0.391) are related to the occurrence of severe and critical COVID-19 infection, and the difference is significant statistically significant. Conclusion: Age, lower SPO2 and LYM, a shorter course; a higher Tmax, semi-quantitative volume, CRP, and NLR are associ-ated with severe and critical cases and required early identification.
-
Keywords:
- CT /
- COVID-19 /
- Omicron /
- clinical characteristics
-
2002年世界卫生组织软组织肿瘤分类将腺泡状软组织肉瘤(alveolar soft part sarcoma,ASPS)归入“分化不明的肿瘤”类别[1]。ASPS是一种罕见的恶性软组织肿瘤,主要发生于青少年和年轻人,可以出现在身体的任何部位,但最常见于四肢的深层软组织。ASPS通常表现为一种相对惰性但致命的肉瘤,特点是晚期转移和延长的临床病程[2]。然而,当根治性切除时,局部复发很少见,长期生存是可能的[3]。因此,术前区分ASPS与其他软组织肿瘤对于优化患者管理和治疗计划以改善预后很重要,诊断成像在病变识别及在初步病变表征中起着至关重要的作用。
我国相关病例报道不多,目前临床对ASPS认知较少,为提高对ASPS认识,现将我院收治1例ASPS患者分析报道,主要对其CT及MRI特点进行归纳和总结,并复习相关文献,帮助临床医生将此病与其他常见的软组织肿瘤进行鉴别诊断。
1. 病例资料
1.1 临床表现
患者男性,37岁,以“5年前发现右腋窝肿物,诊断为血管瘤,未进行治疗,近期出现间断性头晕伴失写、视物变形”为主诉而入院。右侧腋窝触及约10 cm×5 cm大小肿块,肿物表面不规则,坚韧,活动度差,有压痛,右侧肱二头肌疼痛,肢端血运可,尺桡动脉可扪及;患者出现失写,视物变形,实验室检查阴性。
1.2 影像学表现
右侧上肢CTA提示右侧腋下肌肉深部不规则软组织肿块影,部分边界清晰,部分边界不清,平扫呈均匀等密度,增强后明显不均匀强化,肿瘤内和肿瘤周围可见多发迂曲增宽的血管影(图1)。
右肩部MRI显示右侧腋下肌肉深部不规则软组织肿块影,T1WI呈均匀等、稍高信号,T2WI呈不均匀稍高信号,肿瘤内和肿瘤周围可见多发迂曲增宽血管流空信号影,增强后明显不均匀强化,可见多发增粗流空血管影,肿瘤部分边界不清(图2)。头颅MRI显示左侧顶枕叶巨大占位,周围大片水肿,侧脑室受压推移,中线结构明显右偏,增强扫描病灶明显不均匀强化,周围见增粗迂曲血管影(图3)。胸部X线片显示两肺多发结节(图4)。
1.3 治疗
为缓解临床症状行颅内肿瘤切除术,病理提示“转移性腺泡状软组织肉瘤”。随后,行右侧腋下肿瘤切除,病理提示“腺泡状软组织肉瘤”,考虑右侧腋下为原发灶(图5)。
2. 讨论
2.1 病因及发病机制
ASPS是一种罕见实体瘤,它最初由Christopherson等[4]于1952年描述和命名,是由t(X;17)(p11;q25)染色体易位引起的,从而导致产生融合基因ASPSLTFE 3。
2.2 临床特点
ASPS在所有软组织肉瘤中占比不足1%[5-6],主要发生于青少年和年轻人,以女性为主。原发性肿瘤最常见的部位是四肢,主要是大腿和臀部(58%~60%)、躯干(16%~28%)和头颈部(12%)。也可起源于其他少见部位,比如前列腺、子宫、膀胱和乳房等部位。ASPS通常表现为一种相对惰性但致命的肉瘤,特点是晚期转移和延长的临床病程[2]。转移通常是肺(90%)、骨(26%)和脑(11%~19%)[5,7-9]。已发表的报道显示与其他肉瘤相比,脑转移的发生率高出3倍[10]。
本例患者为年轻男性,病灶发生于上肢深部,病灶惰性生长5年余,直至发生肺和脑转移后出现临床症状才被重视治疗。
2.3 影像学表现
ASPS在影像学上具有独特的影像学特征,最突出的影像学特征是肿瘤内和肿瘤周围血管的存在,应该有助于诊断。
超声通常作为一种成像方式,从发育、炎症、创伤或肿瘤等方面对软组织病变进行鉴别。有报道显示,ASPS病灶多为边界清晰的低回声或混合回声肿块,伴肿瘤周围粗大血管影[11-12]。MRI提示ASPS的一个特征是肿瘤存在流空信号,流空信号同时存在于肿瘤的外围和中心[11,13-18],同时MRI和CT显示大多数肿瘤外围血管呈上下极分布,这些血管向肿瘤中心汇聚[13,18]。传统血管造影显示这个血管丰富的肿瘤动脉期有许多粗大扩张血管,动静脉分流,随后有明显的肿瘤染色,尽管血液分流很快,但造影剂从病变中流出速度很慢[14-17],呈现出快进慢出的特点。ASPS肿瘤在增强MRI或CT表现为明显强化[13,15-16,19],少数表现出中度强化[18],尚未见任何肿瘤显示出轻微强化或完全没有强化的报道。本文报道这例也显示肿瘤外围血管主要分布于肿瘤上下极,增强后肿瘤呈明显强化。
另一个比较特征性的表现是肿瘤在MRI的T1WI序列上相对于肌肉多表现出稍高信号[13,15-16,19],而其他软组织肉瘤多为等信号或低信号[20]。此外ASPS大多数肿瘤的边缘清晰呈分叶状,较少出现坏死和钙化,当出现坏死时,坏死总是位于病灶中心位置,周围为厚壁的存活肿瘤组织[18]。本文这例T1WI呈等、稍高信号,肿瘤较大呈分叶状,大部分边缘清晰,无坏死钙化。
ASPS肿瘤转移率高,有研究报道了转移瘤的影像学特点:肺是最常见的转移部位,其次是骨和脑[5,7-9,12-13],淋巴结转移少见[12,21];转移瘤与原发肿瘤同样表现为具有粗大血管及明显强化的富血管特征[22]。此病例出现了肺和脑转移瘤,脑转移瘤可见肿瘤周围血管影及肿瘤明显强化,与报道一致。
2.4 治疗及转归
ASPS的治疗通常包括原发肿瘤手术切除和转移性疾病的全身治疗。传统的蒽环类化疗在很大程度上是无效的,实体瘤的反应率低于10%[23-25]。
对一些患者来说,完全广泛切除可能是可以治愈的,复发率低,但肿瘤转移在长期随访中很常见,有时在原发肿瘤切除后10年或更长时间。与其他软组织肉瘤一样,一些患者可以采取转移瘤切除术,但手术切除如何影响这些患者的生存尚不清楚[5,26]。本文报道的病例因出现脑转移、影响脑功能,而选择脑转移瘤切除,患者生存情况有待随访。
2.5 诊断及鉴别诊断
ASPS的诊断主要依靠病理,但其比较有特征性影像学表现,也可以给临床医生提供一些诊断依据。然而这些肿瘤的常见表现是缓慢生长的无痛肿块及其多发畸形血管及富血管性,它们经常被误诊为动静脉畸形(arteriovenous malformation,AVM),这些肿瘤最终由于诊断延误而出现远处转移,因为被误诊为动静脉畸形后几乎不进行组织病理学检查或手术。Pennacchioli等[27]的研究表明,大约9%(3/33)的患者最初在MRI上被认是血管畸形,因此延误了诊断治疗。与ASPS相比,AVM通常缺乏软组织成分,它们在T1WI和T2WI主要表现为流空的低信号,增强显示为早期动脉供血和早期静脉冲洗[13,27];而ASPS则以软组织成分为主伴有多发的血管流空低信号,增强表现为长期肿瘤染色和晚期冲洗的富血供病变[28],且T1WI上相对于肌肉为稍高信号[13,15-16,19]。
另一个比较容易混淆的良性肿瘤是血管瘤。在Viry等[13]对6名患有ASPS的儿童的综述中,1例眼眶ASPS最初被怀疑是血管瘤并栓塞。然而,已知血管瘤发生在比ASPS年轻得多的年龄组,通常从出生起就存在;此外,与ASPS相比,它们在动脉早期开始强化,ASPS则在动脉晚期或静脉早期开始强化;而且动脉瘤在T1WI多呈等信号或稍低信号,T2WI呈明显高信号,ASPS在T1WI多呈稍高信号,T2WI呈稍高信号。
我们在鉴别这些明显强化的富血管性病变时,也要考虑到来源于肾和甲状腺原发性肿瘤的转移瘤的可能性[12],另外,血管瘤样的肿瘤,如血管肉瘤、血管外皮瘤也可能有类似的影像表现[28]。然而,这些血管瘤样肿瘤通常会出现出血坏死,而ASPS出血坏死少见。
总而言之,ASPS是一种罕见的在青少年和年轻人中呈懒惰生长的软组织肉瘤。其较大的均匀肿块伴瘤内及肿瘤上下极粗大血管比较有特征性,T1WI上呈稍高信号也是一大特征,通过T1WI、T2WI上细微信号差别可以与部分肿瘤进行鉴别。肿瘤早期广泛切除可能有助于延长病程,早期误诊可导致晚期疾病的转移。
-
表 1 新型冠状病毒感染患者140例一般资料比较
Table 1 Statistics of baseline and clinical characteristics of moderateand and severe and critical groups
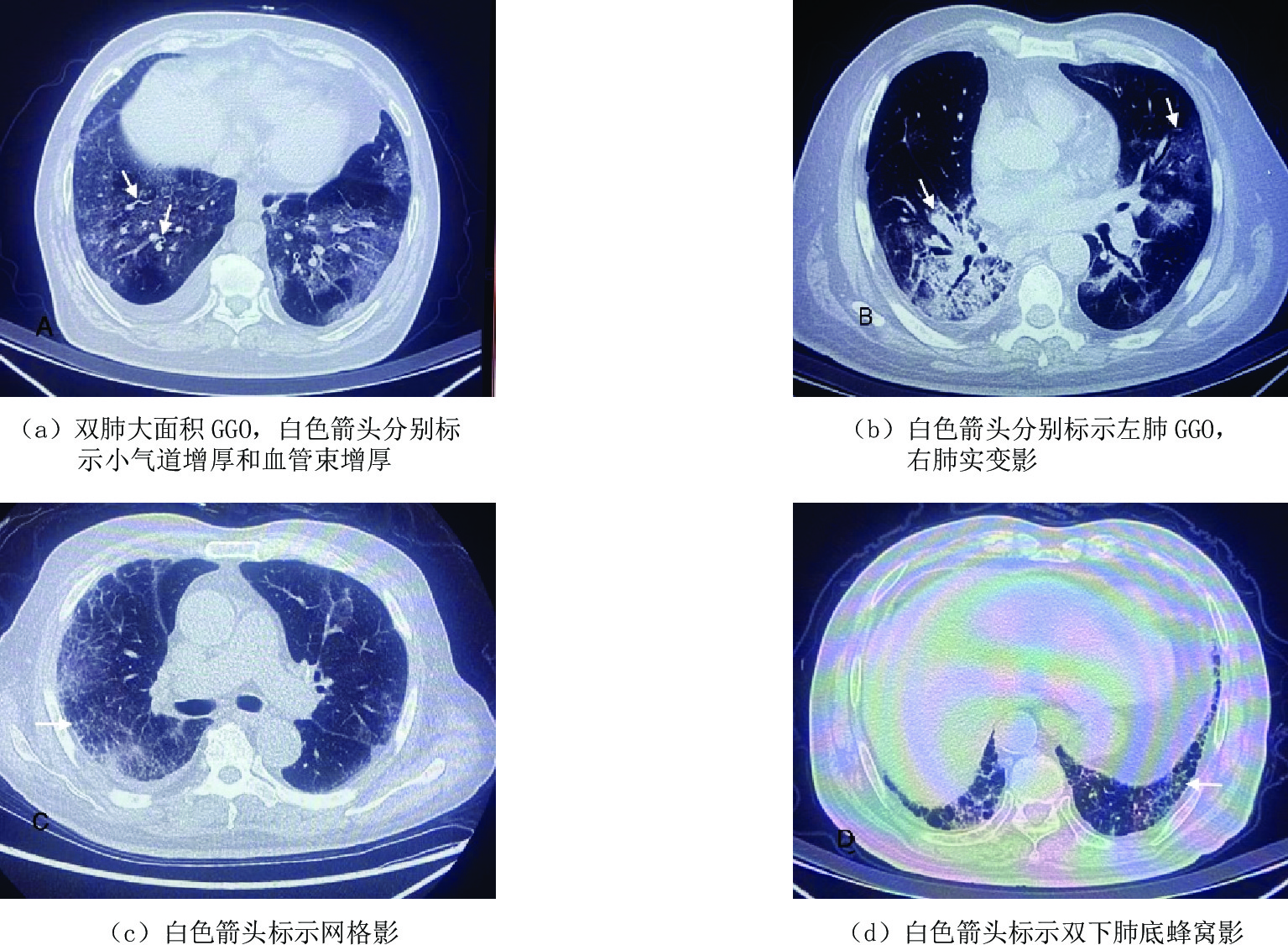
一般资料 中型组(n=101) 重型危重型组(n=39) 统计检验 $\chi^2/t $ P 性别(男)/例(%) 56(55.4) 22(56.4) 0.011 0.981 年龄/岁 66.05±14.38 77.90±13.12 -4.476 0.000** 临床症状 SPO2/% 97.88±1.73 92.92±4.01 3.285 0.004** 首诊时间/d 5.40±3.81 3.97±3.12 2.053 0.042* 发热/例(%) 99(99.0) 39(100.0) - 1.000 体温高峰/℃ 38.32±0.66 38.68±0.63 -2.575 0.012* 咳嗽/例(%) 87(86.1) 31(79.5) 0.940 0.332 咽痛/例(%) 33(32.7) 9(23.1) 1.234 0.267 胸闷/例(%) 8(7.9) 5(12.8) 0.326 0.568 腹泻/例(%) 8(7.9) 2(5.1) 0.044 0.834 高危因素 高龄(≥65岁)/(例%) 61(60.4) 33(84.6) 7.481 0.006** 肺部基础病/例(%) 9(8.9) 6(15.4) 0.649 0.421 糖尿病/例(%) 28(27.7) 15(35.8) 1.525 0.217 高血压/例(%) 31(30.7) 22(56.4) 7.910 0.050 冠心病/例(%) 18(17.8) 12(30.8) 2.810 0.094 肿瘤/例(%) 6(5.9) 3(7.7) 0.000 1.000 其高危因素(慢性肝病、肾病、维持性透析、晚期妊娠围产期、肥胖、重度吸烟)/例(%) 2(2.0) 5(12.8) 4.866 0.008** 注:*为P<0.05表示差异有统计学意义,**为P<0.01表示差异有显著统计学意义。 表 2 患者肺内病变HRCT征象比对
Table 2 Comparison of abnormal pulmonary signs on CT in patients with COVID-19
CT征象 总患者(n=140) 中型(n=101) 重型和危重型(n=39) 统计检验 $\chi^2/t $ P 病变密度/例(%) GGO为主 131(93.5) 93(92.1) 38(97.2) 1.930 0.165 实变影为主 62(44.3) 46(45.5) 16(41.0) 0.048 0.826 网格影为主 113(80.7) 79(78.2) 34(86.1) 1.473 0.225 蜂窝影为主 11(7.9) 10(9.9) 1(2.6) 5.632 0.018 病变分布/例(%) 0.619 0.431 双肺 121(86.4) 86(85.1) 35(89.7) 0.506 0.477 上肺为主 16(11.4) 12(11.9) 4(10.3) 0.000 1.000 下肺为主 62(44.3) 49(49.8) 13(33.3) 2.263 0.105 周围为主 65(46.4) 52(51.5) 13(33.3) 3.727 0.054 中央为主 25(17.9) 17(16.8) 8(20.5) 0.260 0.610 病变面积 9.201 0.002 容积半定量(%) - 18.85±13.51 34.41±19.34 -4.691 0.001** 面积>50%(例%) - 3(3.0) 14(35.9) 25.59 0.000** 伴随病变/例(%) 胸膜增厚 102(72.9) 72(71.7) 30(76.9) 0.452 0.501 小气道壁增厚 103(73.6) 75(74.3) 28(71.8) 0.767 血管束增厚 133(95.0) 94(93.1) 39(100) 0.210 胸腔积液 5(3.8) 4(4.0) 1(2.6) - 1.000 注:*为P<0.05表示差异有统计学意义,**为P<0.01表示差异有显著统计学意义。 表 3 中型组和重症危重症组实验室指标对比情况
Table 3 Comparison of laboratory results in moderate and severe and critical groups
检验项目 中型(n=101) 重型和危重型(n=39) 统计检验 $\chi^2/t $ P C反应蛋白/(mg/L) 29.42±26.93 80.67±48.01 -8.170 0.000** WBC/(×109/L) 6.85±2.25 7.29±3.60 -0.911 0.555 白细胞升高/例(%) 14(14) 7(17.9) 0.341 0.559 NEU/(×109/L) 4.96±3.71 5.77±2.96 -1.009 0.364 LYM/(×109/L) 1.64±0.68 0.95±0.64 5.412 0.000** NLR 3.48±2.46 9.36±10.42 -5.127 0.000** NLR>6.5/例(%) 9(9.0) 17(43.6) 22.080 0.000** NLR>3/例(%) 44(44) 36(92.3) 26.802 0.000** PLT/(×1012/L) 190.96±61.95 182.57±70.36 0.396 0.694 注:WBC为白细胞计数,NEU为中性粒细胞计数,LYM为淋巴细胞计数,PLT为血小板,NLR为中性粒细胞/淋巴细胞比值。*为P<0.05表示差异有统计学意义,**为P<0.01表示差异有显著统计学意义。 表 4 影响新型冠状病毒感染中型组及重型及危重型组的logistic回归分析结果
Table 4 Logistic regression analysis in moderate and severe and critical groups
变量 B值 SE值 Wald卡方值 OR值 95%CI P 年龄/岁 0.086 0.041 4.487 1.090 1.006~1.181 0.034* 首诊时间/d -0.203 0.144 1.967 0.817 0.615~1.084 0.161 SPO2 -1.345 0.547 6.039 0.664 0.664~0.350 0.014* 容积半定量 0.082 0.033 6.396 1.609 1.019~1.157 0.011* CRP 0.053 0.015 11.666 1.054 1.023~1.087 0.001** LYM -3.234 1.172 7.620 0.039 0.004~0.391 0.006** 注:*为P<0.05表示差异有统计学意义,**为P<0.01表示差异有显著统计学意义。 -
[1] WHO. Coronavirus (COVID-19) dashboard [EB/OL]. (2023-07-28) [2023-07-28]. https://covid19.who.int/.
[2] 中华人民共和国家卫生健康委会. 新型冠状病毒感染诊疗方案(试行第十版)[EB/OL]. (2023-01-05) [2023-01-05]. https://www.nhc.gov.cn. [3] HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497−506. doi: 10.1016/S0140-6736(20)30183-5
[4] MAHASE E. Coronavirus: COVID-19 has killed more people than SARS and MERS combined, despite lower case fatality rate[J]. British Medical Journal, 2020, 18(368): m641.
[5] 张影, 李晓鹤, 陈凤, 等. 新型冠状病毒德尔塔和奥密克戎变异株感染患者的临床特征分析[J]. 新发传染病电子杂志, 2022, 7(3): 22-26. ZHANG Y, LI X H, CHEN F, et al. Clinical characteristics of patients infected with SARS-CoV-2 Delta and Omicron variants[J/CD]. Electronic Journal of Emerging Infectious Diseases, 2022, 7(3): 22-26. (in Chinese).
[6] BERKHOUT B, HERRERA-CARRILLO E. SARS-CoV-2 evolution: On the sudden appearance of the omicron variant[J]. Journal of Virology, 2022, 96(7):
[7] MANNAR D, SAVILLE J W, ZHU X, et al. SARS-CoV-2 Omicron variant: Antibody evasion and cryo-EM structure of spike protein-ACE2 complex[J]. Science, 2022, 375(6582): 760−764. doi: 10.1126/science.abn7760
[8] 中国疾病预防控制中心. 全国新型冠状病毒感染疫情情况[EB/OL]. (2023-02-21) [2023-02-21]. https://www.chinacdc.cn/jkzt/crb/zl/szkb_11803/jszl_13141/202302/t20230218_263807.html. [9] 车霄, 王乐霄, 赵磊, 等. 重症新型冠状病毒肺炎患者的临床特征及预后风险因素分析[J]. 解放军医学院学报, 2023,44(2): 101−107. doi: 10.3969/j.issn.2095-5227.2023.02.001 CHE X, WANG L X, ZHAO L, et al. Clinical characteristics and prognostic factors of severe COVID-19[J]. Academic Journal of Chinese PLA Medical School, 2023, 44(2): 101−107. (in Chinese). doi: 10.3969/j.issn.2095-5227.2023.02.001
[10] GAO J, ZHANG S, ZHOU K, et al. Epidemiological and clinical characteristics of patients with COVID-19 from a designated hospital in Hangzhou City: A retrospective observational study[J]. Hong Kong Medical Journal, 2022, 28(1): 54−63.
[11] 董宗祈, 朱达清, 黄开伟, 等. 无创氧饱和度换算动脉氧分压及其在儿科急救中的应用[J]. 实用儿科杂志, 1992,(1): 21−23. [12] 罗炎杰. 血气分析常用指标及其临床意义[J]. 中国临床医生, 2009,37(11): 30−33. [13] 韩文斌. 影响无创血氧饱和度监测值的相关因素[J]. 医疗卫生装备, 2011,32(7): 79−81. doi: 10.3969/j.issn.1003-8868.2011.07.034 [14] 陆世琼, 王琼. 影响急诊患者无创脉搏血氧饱和度监测结果的非疾病因素的原因分析[J]. 中华高血压杂志, 2015,23: 91−92. [15] 孙莹, 李玲, 刘晓燕, 等. 早期新型冠状病毒肺炎的胸部薄层平扫CT表现特征[J]. CT理论与应用研究, 2023,32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. SUN Y, LI L, LIU X Y, et al. Imaging features of early COVID-19 on chest thin-slice non-enhanced CT[J]. CT Theory and Applications, 2023, 32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. (in Chinese).
[16] 李莉, 王珂, 任美吉, 等. 新型冠状病毒肺炎早期胸部CT表现[J]. 首都医科大学学报, 2020, 41(2): 174-177. LI L, WANG K, REN M J, et al. Early chest CT manifestations of COVID-19[J]. Journal of Capital medical University, 2020, 41(2): 174-177. (in Chinese).
[17] BATTAGLINI D, LOPES-PACHECO M, CASTRO-FARIA-NETO H C, et al. Laboratory biomarkers for diagnosis and prognosis in COVID-19[J]. Frontiers in Immunology, 2022.
[18] KARIMI A, SHOBEIRI P, KULASINGHE A, et al. Novel systemic inflammation markers to predict COVID-19 prognosis[J]. Front Immunol, 2021, 12: 741061. doi: 10.3389/fimmu.2021.741061
[19] LUO X, ZHOU W, YAN X, et al. Prognostic value of C-reactive protein in patients with coronavirus 2019[J]. Clinical Infectious Diseases, 2020, 71(16): 2174−2179. doi: 10.1093/cid/ciaa641
[20] WANG D, HU B, HU C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA, 2020, 323(11): 1061−1069. doi: 10.1001/jama.2020.1585
[21] ZAHOREC R. Ratio of neutrophil to lymphocyte counts—rapid and simple parameter of systemic inflammation and stress in critically ill[J]. Bratisl Lek Listy, 2001, 102(1): 5−14.
[22] CANNON N A, MEYER J, IYENGAR P, et al. Neutrophil-lymphocyte and platelet-lymphocyte ratios as prognostic factors after stereotactic radiation therapy for early-stage non-small-cell lung cancer[J]. Journal of Thoracic Oncology, 2015, 10(2): 280−285. doi: 10.1097/JTO.0000000000000399
[23] BENITES-ZAPATA V A, HERNANDEZ A V, NAGARAJAN V, et al. Usefulness of neutrophil-to-lymphocyte ratio in risk stratification of patients with advanced heart failure[J]. The American Journal of Cardiology, 2015, 115(1): 57−61. doi: 10.1016/j.amjcard.2014.10.008
[24] HWANG S Y, SHIN T G, JO I J, et a l. Neutrophil-to-lymphocyte ratio as a prognostic marker in critically-ill septic patients[J]. The American Journal of Emergency Medicine, 2017, 35: 234−239. doi: 10.1016/j.ajem.2016.10.055
[25] SARI R, KARAKURT Z, AY M, et al. Neutrophil to lymphocyte ratio as a predictor of treatment response and mortality in septic shock patients in the intensive care unit[J]. Turkish Journal of Medical Sciences, 2019, 49(5): 1336−1349. doi: 10.3906/sag-1901-105
[26] WANG Y, JU M, CHEN C, et al. Neutrophil-to-lymphocyte ratio as a prognostic marker in acute respiratory distress syndrome patients: A retrospective study[J]. Journal of Thoracic Disease, 2018, 10(1): 273−282. doi: 10.21037/jtd.2017.12.131
[27] ULLOQUE-BADARACCO J R, IVAN SALAS-TELLO W, AL-KASSAB-CORDOVA A, et al. Prognostic value of neutrophil-to-lymphocyte ratio in COVID-19 patients: A systematic review and meta-analysis[J]. International Journal of Clinical Practice, 2021, 75(11): e14596.
[28] PARTHASARATHI A, PADUKUDRU S, ARUNACHAL S, et al. The role of neutrophil-to-lymphocyte ratio in risk stratification and prognostication of COVID-19: A systematic review and meta-analysis[J]. Vaccines, 2022, 10(8): 1233. doi: 10.3390/vaccines10081233
[29] FEI M, TONG F, TAO X, et al. Value of neutrophil-to-lymphocyte ratio in the classification diagnosis of coronavirus disease 2019[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2020, 32(5): 554−558.
[30] KUMAR A, SARKAR P G, PANT P, et al. Does neutrophil-to-lymphocyte ratio at admission predict severity and mortality in COVID-19 Patients? A systematic review and meta-analysis[J]. Indian Journal of Critical Care Medicine, 2022, 26(3): 361−375. doi: 10.5005/jp-journals-10071-24135




 下载:
下载: