All-Digital PET Imaging Software Based on Plug and Imaging
-
摘要:
传统正电子发射断层成像(PET)系统采用模拟电路对信号进行处理,通过符合电路实现符合事件甄别,软件算法多集中于处理投影数据和图像数据,损失了生成图像前的大量信息,算法可扩展性相对较差。全数字PET系统利用精确采样和全数字处理带来硬件极简化和软件极大化的设计理念,将更多操作交由软件算法完成,具有过程数据完整、算法丰富且替换优化方便的特点。把探测器和算法当作“积木”,即插即成像(PnI)平台构建成像协议层、成像算法层和成像设备层,实现了成像过程定义、成像算法扩展和多种设备定义,从而支持动物、临床和各种应用专用型全数字PET系统的搭建。而且,全数字PET配合PnI平台可以将信息挖掘的入口从图像层面提前到闪烁脉冲数据层面,支持更多算法的灵活接入。基于以上背景,本文综述PnI即插即成像软件的研究进展,具体说明全数字PET系统结构、成像过程、软件架构以及应用案例,旨在提高科学家搭建数字PET科研仪器的灵活性,为开发快速高效搭建不同PET系统与软件算法提供参考。
Abstract:Traditional positron emission tomography (PET) systems apply analog circuits for signal processing and achieve coincidence event detection through coincident circuitry. However, these systems suffer from a significant loss of information during projection and image data processing, leading to poor algorithm scalability. In contrast, All-Digital PET systems leverage precise sampling and comprehensive digital processing to simplify hardware design while maximizing software capabilities. These advanced systems rely on software algorithms to handle more operations, thereby providing complete process data, abundant algorithms, and convenient optimization for replacement. By treating detectors and algorithms as fundamental “building blocks,” the plug and imaging (PnI) platform constructs imaging protocols, algorithms, and equipment layers to define the imaging process, extend algorithmic capabilities, and support the construction of diverse animal or clinical PET system types. Moreover, integrating PnI into All-Digital PET systems allows for early information mining from scintillation pulse data levels rather than at the image level, facilitating flexible additional algorithm integration. Based on the aforementioned background, in this study, we critically investigated PnI software-related research advancements, precisely elucidating the comprehensive structure of All-Digital PET systems, architectural flowcharting of the imaging process, and exemplary application cases. Our primary objective was to enhance flexibility for scientists involved in constructing All-Digital PET research instruments while providing valuable references for the expeditious and efficient development of diverse PET systems alongside software algorithmic enhancements.
-
正电子发射断层成像(positron emission tomography,PET)是一种先进的核医学分子显像技术,也是目前唯一可在活体上显示生物分子代谢、受体及神经介质活动的新型影像技术[1-7]。传统PET系统多使用模拟电路[8-10]对信号进行处理,抗干扰能力弱[11],系统校正流程繁琐[12]。传统PET系统中,软件的数据处理通常基于正弦图(Sinogram)数据[13]或列表模式(List-mode)符合事件[14],例如:Inveon[15]、RatCAP[16]和 LabPET[10]等系统通过硬件进行信号处理和符合甄别,然后将数据传输至计算机进行重建。现代主流数字PET系统则使用模数转换器(anolog-to-digital converter,ADC)进行信号处理[12],但一般仍以符合事件作为软件的数据处理起点。这些系统的软件生成图像之前的原始数据信息并未得到保存,又或者无法再被重复利用,并且由于流程固定性较高,导致算法可扩展性相对较差。
采用多电压阈值(Multi-Voltage Threshold, MVT)[17]数字化信号精确读出方法可以有效改善模拟技术运用带来的缺点,在前端对光电转换器件的输出信号直接数字化采样获取信息,并有效减小外部环境带来的干扰[18-20]。基于MVT方法的全数字PET系统不仅改变了PET系统的构建方式,将探测单元和脉冲采样单元集成为探测器,能够支持以“搭积木”的方式搭建PET系统[21];同时还改变了PET成像过程中的计算流程,则将闪烁脉冲作为数据处理起点,除了MVT数字化电路外几乎没有其他硬件电路存在。随后的数据处理和图像重建等过程全部交由软件来完成,因此最大程度地发挥了软件设计的优势,实现了“硬件极简化,软件极大化”,从而为算法在整个成像过程中提供更好基础和更大空间发挥效果。
全数字PET系统具备灵活的系统构建能力和软件极大化潜力,然而相较于其他PET系统,其搭建过程也带来了新的问题与挑战[22-23]。①软件算法的可扩展性:全数字PET系统的设计理念在硬件方面追求极小化,同时通过软件算法实现更多操作,具备高度可编程性、稳定性和丰富灵活的功能。然而,该系统也面临着诸如采集单元集成度、符合单元的并行能力以及数据传输带宽瓶颈等问题。②系统结构的灵活性:全数字PET系统的PET探测单元能够在特定条件下自由组合成多种几何结构,每个探测单元都可独立向计算机系统发送数据。为实现各功能模块解耦并支持不同PET系统接入,灵活的硬件结构需要配备完善的计算机软件来描述几何结构和信号路径。
为了解决上述问题,本文提出即插即成像[24](plug & imaging, PnI)架构,通过将软硬件解耦,将成像过程解耦,使得不同的全数字PET探测器可以在不改变硬件电路的基础上仅调整或者更改软件与算法即可支持新型PET系统开发,不仅能够支持多种全数字PET系统的搭建,也能够方便地进行各种算法的替换和优化。基于PnI,本文综述全数字PET成像软件的研究现状与进展,具体说明全数字PET系统结构、成像过程、软件架构以及应用案例,提供解决成像问题的方法和思路,旨在构建一个开放的科研平台从而提高科学家搭建数字PET科研仪器的灵活性。
1. 全数字PET系统结构
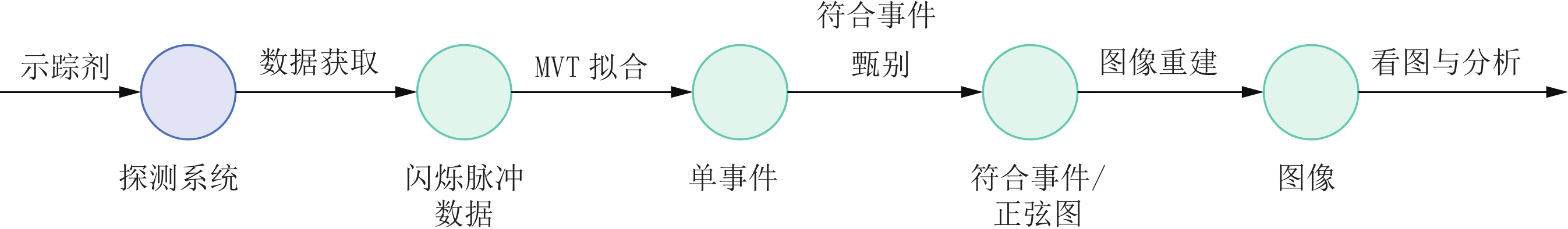
传统PET系统由PET探测系统、硬件电路系统和计算机系统3部分构成,在采样后由硬件电路系统完成拟合[25-26]、符合事件甄别[27],得到列表模式符合事件[14]或正弦图数据[13],在计算机系统中完成图像重建[28]。全数字PET系统由全数字PET探测系统和计算机系统两部分组成,全数字PET探测系统直接对原始脉冲信号进行MVT精确采样,之后在计算机系统上通过拟合算法完成对闪烁脉冲数据的时间、能量、位置信息的提取,转换为单事件数据,在软件符合事件甄别算法[29-32]中选用特定的符合策略与参数将单事件数据配对并转换为正弦图数据,最后由重建算法通过投影计算还原出示踪剂在实验物体内的活度分布图(图1)。
传统PET系统由于采用硬件电路实现拟合、符合[33-37],一般不保留占用空间大的原始数据,对数据的重复利用率较低。全数字PET系统则可以保存全部过程数据,意味着仅仅一次数据获取就能够使用不同方法、参数在软件上进行多次实验,数据重复利用率高,为PET研究带来了更多的灵活性与可扩展性,也为研究者带来了便利[21]。
2. 全数字PET成像过程
全数字PET探测系统只采集闪烁脉冲数据,后续的所有操作都在计算机系统完成。如图2所示,在计算机系统上,全数字PET成像过程主要包括:数据获取、MVT拟合、符合事件甄别、图像重建4个过程。
2.1 数据获取
全数字PET系统的每个探测器都会独立完成闪烁脉冲信号采集,并行地发送数据至计算机系统。后续伽马光子的时间、能量以及位置信息解析,符合事件的甄别等操作都交由计算机系统中的软件算法进行处理。
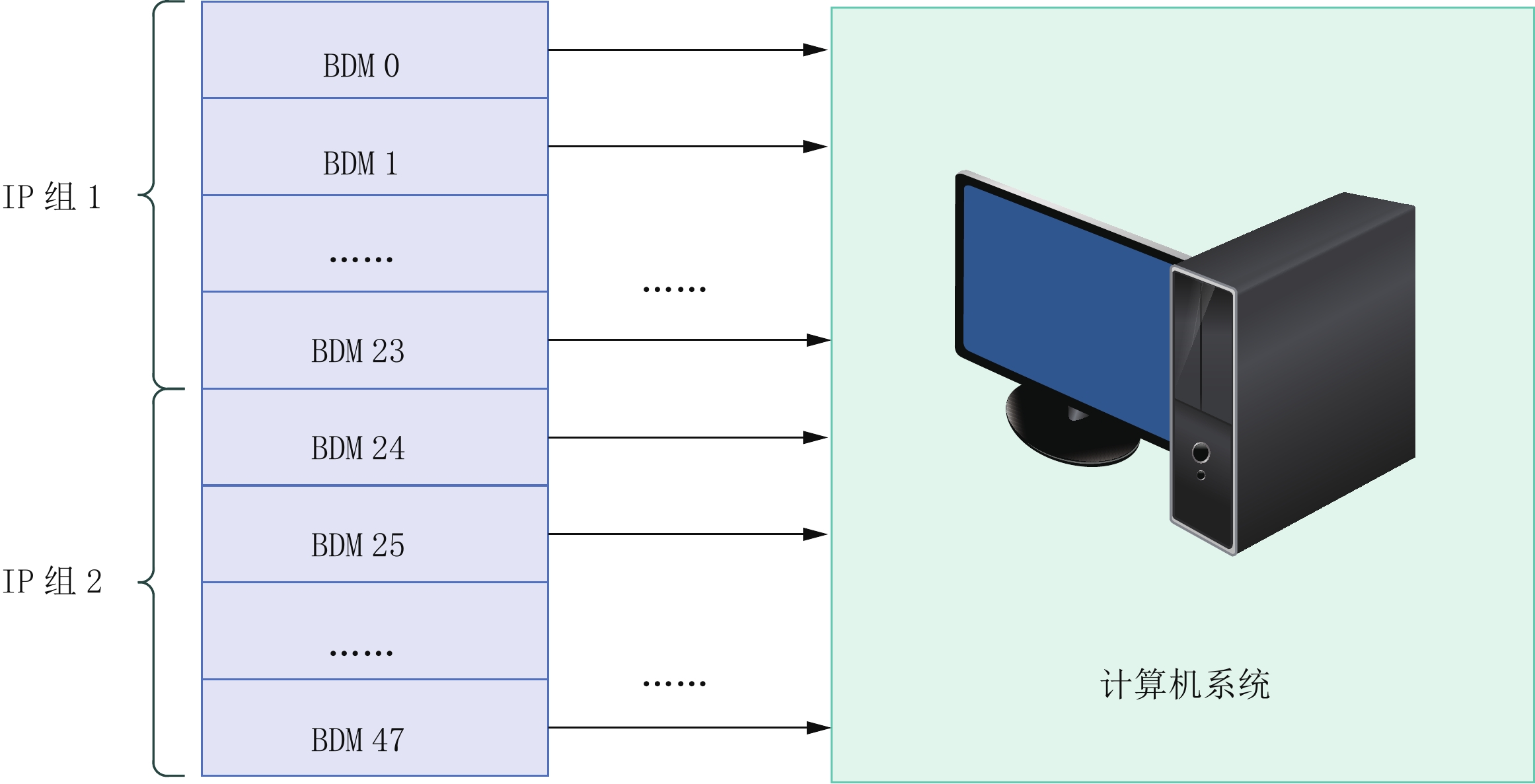
全数字PET探测系统整体采用数字化和模块化的思想,在数据传输时以基本探测单元(basic detector module, BDM)[23]为最小单位,每个BDM都可以单独传输数据,所有的BDM可通过光纤并行地向交换机发送数据包,交换机与计算机也通过光纤相连接,计算机预先设定IP(internet protocol)地址和端口号即可进行数据获取。由于全数字PET系统BDM数量众多,数据传输带宽较大,通常编写的数据获取方法会采用缓冲区策略对数据进行转储,例如,全数字小动物PET系统开发时尝试单缓冲区、多缓冲区、循环缓冲区等策略[22]。
全数字PET数据获取时将PET系统的数据流路径分解为多个独立模块,实现了数据获取与符合事件甄别的解耦,软件与硬件能够分别独立进行开发和升级,对于PET设备的性能提高和软件系统更新迭代都起到了促进和加速作用。并且,探测器配合交换机以及计算机即可快速组成一台完整可用的PET成像系统。这不仅是针对应用的适应性PET系统构建的技术基础,更提供了后续与其他系统更便捷地共同协作的可能[12]。
2.2 MVT拟合
全数字PET探测器使用MVT采样方法,可直接对闪烁脉冲进行数字化。通过预先设定电压阈值采样点信息拟合闪烁脉冲信号,计算光子到达时间[38-39]和沉积能量信息[40-41],以及与晶体阵列耦合的硅光电倍增器(silicon photomultiplier, SiPM)[42]确定位置信息,输出至计算机进行解码得到单事件。
(1)时间和能量信息提取
MVT采样方法将闪烁脉冲数字化为若干个采样点的信息,表示为电压-时间对的数据形式。随后采样点结合闪烁脉冲的先验知识,经过计算,还原为重构闪烁脉冲,提取出闪烁脉冲的时间、能量信息[43]。实际实施时,对每个闪烁脉冲单独处理,将采样点第一点确定为时间零点,其他点进行相应的坐标变换。
闪烁脉冲的能量通过对还原脉冲进行积分得到,时间信息因为MVT采样方式的特性可直接取前沿的时间点,即LED(leading-edge discrimination)[44]方法。或者通过还原脉冲与时间轴的交点(过零点),加上前沿的时间点信息获得其在全局时钟下的时间信息[12]。
(2)位置信息提取
如果是SiPM与闪烁晶体1︰1耦合的探测系统,可直接根据SiPM阵列确定光子位置信息。如果是SiPM与闪烁晶体并非1︰1耦合的紧凑型探测系统,可采用带状线通道复用等方法[45]获取光子位置信息,将多个SiPM输出接入带状线中,定位发生光电转换的SiPM,获取光子入射位置信息。
当数据获取完成并经过MVT拟合后,会在计算机中保存多组单事件集合,其中每一个单事件都包含:光子被探测器接收的时间、光子被探测器接受的位置以及光子在探测器内沉积的能量大小[46-47]。
2.3 符合事件甄别
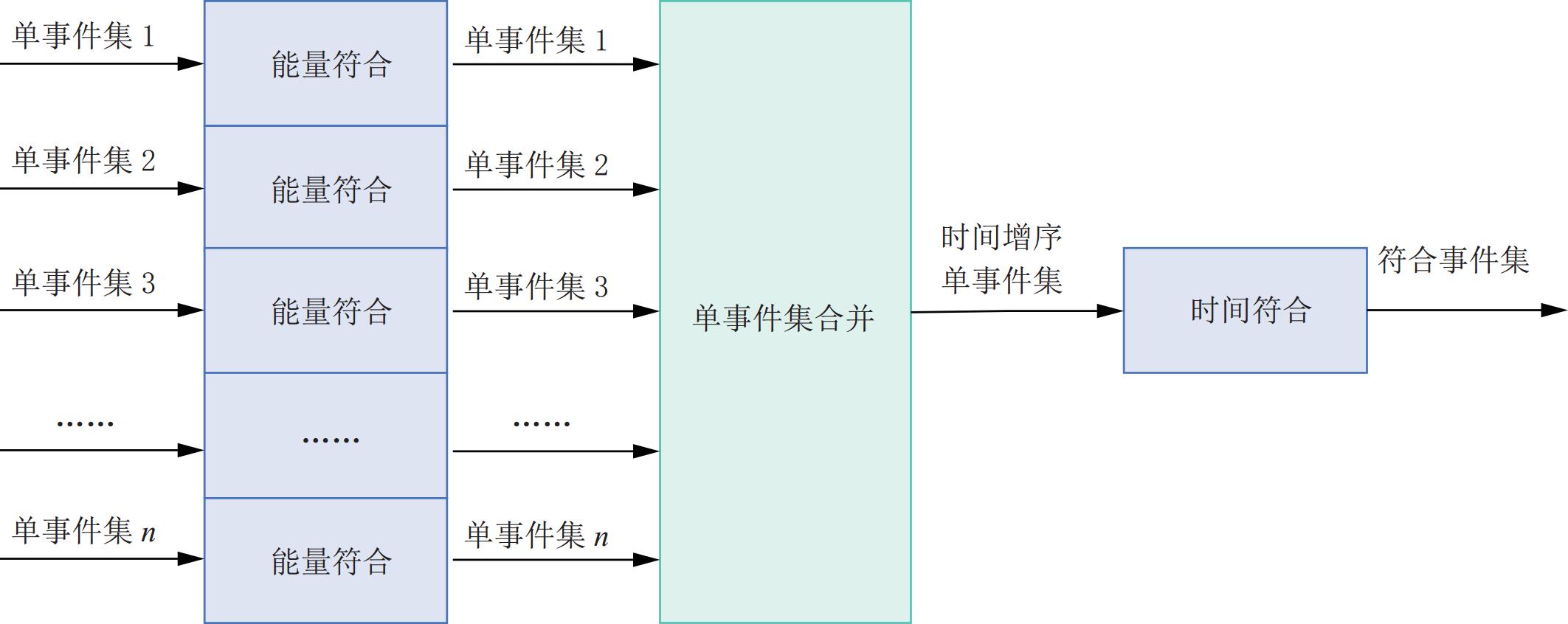
全数字PET符合事件的甄别由软件符合算法完成[22]。在理想情况下,每一组单事件集合按照被接收时间戳的增序排列。如图3所示,软件符合事件甄别需要对所有的单事件进行能量和时间筛选才能最终确定所有满足条件的List-mode符合事件,并根据这些事件按照角度和径向展开形成正弦图数据[13],以用作后续图像重建的输入。
软件符合事件甄别可以设置不同步骤的不同参数以及策略,一次数据获取得到的单事件可进行多次符合产生不同的List-mode数据和正弦图,对于系统评估、图像重建与校正和影像学分析等研究而言十分方便快捷,并且能够开发出更新颖的符合事件甄别算法[48]。
(1)能量符合
选择一个能窗范围,如果单事件能量值在这个范围内则被保留,反之则被排除,能窗范围会对符合效果产生显著影响,但是大能窗会引入更多散射事件,小能窗又有可能忽略真实事件,能窗的选取需要权衡所使用的示踪剂、系统性质与参数等因素[33-37]。鉴于系统能量分辨率以及正电子伽马光子能级,正常情况下选择350~650 keV[49]作为标准的全局能窗。
(2)单事件集合并
在进行能量符合初步排除散射光子,减少了总事件数据量后。需要将多组经过能量符合判断的单事件集合并为一组按照时间增序排列的单事件集合。在全数字PET数据获取后,会保存所有单事件信息,即便是经过一次能量符合进行了约一半单事件的排除,余留数据量依旧较大。需要能在可接受的时间复杂度内完成单事件数据的多路合并排序[50]。
也有一部分系统不需要在全局时间顺序的单事件集下进行时间符合,这类系统通常探测器组合数量较少,可直接采用组合式的时间符合方法,对可构成响应线的探测器组合分别进行时间符合得到符合事件对集合,最后合并至List-mode符合事件或正弦图[32]。
(3)时间符合
时间符合前需要获得全局时间增序排列的单事件流,需要对所有经过能量符合的单事件按照到达时间戳顺序进行排序,得到全局时间顺序排列的单事件流之后,根据选取的时窗大小、时窗打开方式、时间符合策略进行时间符合[51],最终得到List-mode符合事件集。
时间符合过程可分为两个步骤:第1步,触发时间窗打开,只有在同一时间窗内的事件才可能被匹配为符合事件。这里存在两种开窗方式,第1种是参考时间进行开窗,在每个未进入时间窗的单个事件上打开一个窗口,确保每个时间窗范围不会重叠;第2种是参考事件进行开窗,在每个单独的事件上打开一个窗口,并无需检查时间窗是否重叠[48]。第2步,在时间窗内对单个事件进行匹配。不同的时间符合配对策略将影响多重符合事件的选择。根据GATE仿真软件[52]的建议,通过对单个事件能量和位置信息进行不同筛选来实施不同的配对策略,最终得到不同List-mode符合事件集合。
2.4 图像重建与校正
2.4.1 PET数据校正
在进行PET重建前,一般需要对数据做校正以消除探测器和物理因素引入的误差,例如归一化校正、衰减校正、随机校正、散射校正、死时间校正等。
(1)归一化校正
因PET各个探测器的效率不可能完全相同,所以需要对PET数据进行归一化校正,将不同探测器的探测效率差异加入系统响应建模中。归一化校正一般有直接归一化方法和基于组件的归一化方法[53]。
(2)衰减校正
由于伽马光子在组织中运动会发生衰减,不进行衰减校正的图像会出现高衰减区计数较少,低衰减区计数较多的现象,导致重建图像不均匀。一般使用相同物体扫描得到的计算机断层成像(computed tomography, CT)[54]或核磁共振(magnetic resonance, MR)[55]图像计算衰减因子进行衰减校正。
(3)随机校正
如果来自两个不同湮灭事件的伽马光子被甄别为符合事件,这类事件被称为随机符合事件,此时需要使用随机校正对这类事件做剔除。可采用延时窗法[56]进行随机校正,或者使用相同物体扫描的CT图进行校正。
(4)散射校正
当伽马光子与组织内其他粒子碰撞发生康普顿效应时,其运动轨迹会偏离原来的轨道,导致其与另一伽马光子形成符合事件,这类事件被称为散射符合事件。散射事件在符合事件中占比较高,可使用能窗法[57]、单散射模拟[58]和多散射模拟[59]等方法进行校正。
(5)死时间校正
在PET探测系统中,需要有最短的时间来分割事件并记录为单独的脉冲,这个最小时间间隔被称为死时间[60]。由于放射衰变的不确定性,系统可能会丢失一些真事件,尤其是高计数率场景。死时间效应在全数字PET系统中可通过瘫痪模型配合单事件探测、非瘫痪模型配合符合事件探测以及联合模型等方式[61-63]进行校正。
2.4.2 图像重建
(1)解析法
滤波反投影(filtered back projection, FBP)[64]算法是断层扫描的标准算法。它相当于连续采样极限下的直接傅里叶重构,但其离散实现有所不同[3]。FBP算法基于中心切片定理,对投影数据使用斜坡滤波后再进行反投影变换,故称为滤波反投影算法。
FBP算法一般应用于2D正弦图数据,如果需要应用到3D正弦图,有两种方法:一种是对原始正弦图数据做重缠绕,例如单切片重缠绕(single slice rebinning, SSRB)、多切片重缠绕(multi-slice rebinning, MSRB)傅里叶重缠绕(Fourier rebinning, FORE)等算法[65-68];另一种是使用3D解析重建,例如三维重投影(3-D reprojection, 3DRP)[69]算法。
(2)迭代法
由于FBP算法对投影数据要求较高,所以目前较常用的是基于统计假设的迭代重建算法,这其中又以最大似然期望最大化(maximum likehood expectation maximization, MLEM)和有序子集期望最大化(ordered subset expectation maximization, OSEM)[70-72]算法应用最广泛。MLEM算法基于统计假设:投影数据满足泊松分布,并依此将未知图像分布作为参数建立最大似然函数,使用期望最大化求解最大似然函数的极值。
MLEM是全局收敛的算法,但因其存在收敛较慢和迭代时间过长的问题,所以之后提出其加速版本的OSEM算法。OSEM通过将投影数据分为多个有序子集,每次只迭代一个子集,从而使得图像更快收敛。
但是,使用最大似然方法迭代超过一定次数将显著增加噪声而导致图像质量降低[73],此时可以使用最大后验方法(maximum a-posteriori, MAP)[74],利用有关图像的其他先验信息来提高图像质量。
3. 基于PnI的成像软件架构
从软件层面来看,PnI一词涵盖两个方面。①探测器即插即成像:不同几何结构的探测器采集到的数据均能正确地进行完整成像计算。②算法即插即成像:既支持更多算法的灵活接入,要求能够根据应用需求定义成像计算的流程,而成像流程中每个计算过程的算法具有多样性,可以方便地进行选择、替换和优化迭代;对于一次数据获取,可以采用不同的流程、不同的算法或者不同的参数进行多次成像计算。
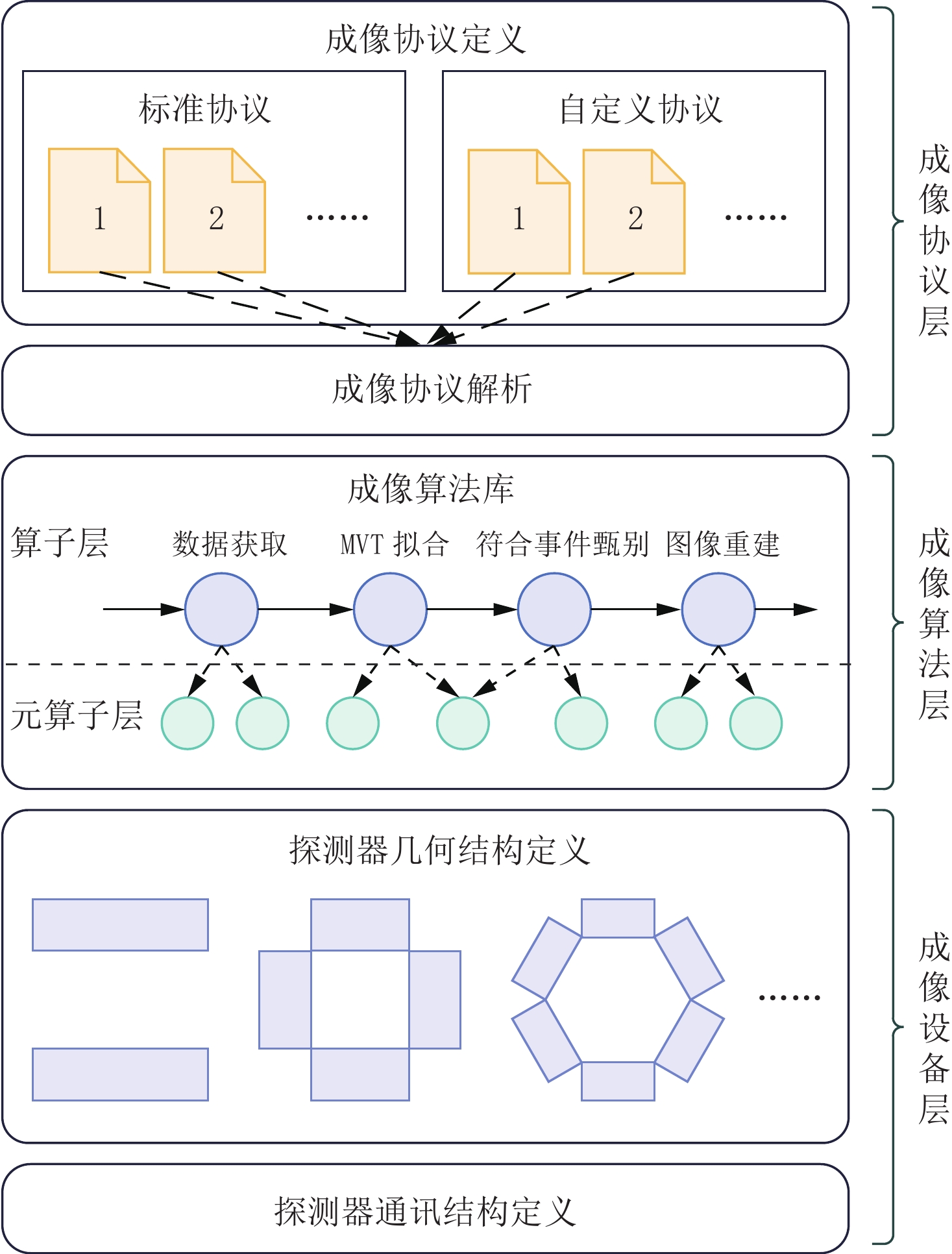
要实现以上两个方面的即插即成像,我们需要将软硬件解耦、成像过程解耦。解耦软硬件可以通过引入探测器设备描述实现;解耦成像过程则可引入各个过程的结果文件并将其标准化,从而保证各个成像计算输入输出的一致性,同时通过保存全过程数据支持多次成像计算。因此,我们提出PnI软件架构以解决上述两个问题,如图4所示,PnI软件包括成像协议层、成像算法层和成像设备层。
3.1 成像协议层
成像协议即一系列成像过程的定义,包括需要进行哪些成像过程、每个成像过程使用什么算法及其采用什么参数等等。系统会提供一些标准协议,同时也允许用户自定义协议。定义一个成像协议需要描述整个成像过程所需的成像计算及其对应的参数列表。两个相邻的成像计算能够进行组装,前提是前一个成像计算的输出和后一个计算的输入文件格式一致。
(1)成像协议定义
如图5所示,完整的成像协议由若干个主成像过程和辅成像过程构成。其中,主成像过程一般按照顺序排列,每个主成像过程可能会包含若干个辅成像过程。每个成像过程可定义参数表,通过解析参数表方可执行该过程,每个主成像过程都会等待前一个主成像过程和它本身的辅成像过程的所有输出作为输入,一旦接收到所有输入就开始执行,结束后将输出结果输入到下一个主成像过程。完成定义的成像协议会被保存到自定义协议库内,以供后续使用。
(2)成像协议解析
对于已经完成定义的协议,经过成像协议解析层得到所有成像过程中所需要使用的算法、参数列表、输入输出文件、流程顺序等信息,完成上述所有信息的校验后,进行本次协议所定义的成像过程的调度:首先将所有的成像过程依次放入一个循环队列,并以轮询方式进行调度,期间遇到可运行的过程便直接执行,如若遇到前置条件不满足的过程则跳过,直到所有过程都完成为止。
3.2 成像算法层
成像协议解析后将对成像计算算法进行调度,这些算法构成算法库。成像计算必须的拟合、符合、校正、重建算法构成算子层,而其中通用的计算步骤则构成元算子层。算法库中的每个算法都有标准的接口,算法库中的每个算法按照一定规范编写程序源码编译生成动态库,即成为一个独立的插件,在成像过程管理平台PnI内加载插件并通过固定接口调用算法图6。
(1)基础设施
算法库中的与算法构成基本无关的基础工具被称为基础设施,包含文件管理、参数管理、数据类型定义和过程控制这些每个元算子都会使用的功能。
(2)元算子
成像算法库中的一个算子由若干元算子组成,元算子一般是这个算子的每个子过程或需要使用的辅助过程,例如符合算子需要用到数据排序、数据处理等元算子来完成算子过程。通过封装和使用元算子,减少算子中重复逻辑的编写,能够更高效的构建算子。
(3)算子
算法库中一个完整的算子需要接收它所需要的输入数据以及参数列表,在算子完成运算后生成输出数据,提供给其他算子作为输入数据。如此不断计算直到整个成像过程中的所有算子都完成输出。
3.3 成像设备层
PET设备的几何结构参数广泛应用于整个PET成像过程中,结构是对PET数据获取设备的几何特征的一个详细表征。无论一个探测单元组的排列方式如何变化,其最小组成单元一定是晶体条,而无论晶体条有多少个,一个响应线(line of response, LOR)只可能在两个不同的晶体条间构成。几何结构的定义需要明确晶体和LOR的编号方式,和相应参数的计算方式,当一个探测单元组的几何结构唯一确定时,它的系统矩阵也能确定,就可以在确定的环境下开展各种成像工作。
(1)探测器几何结构定义
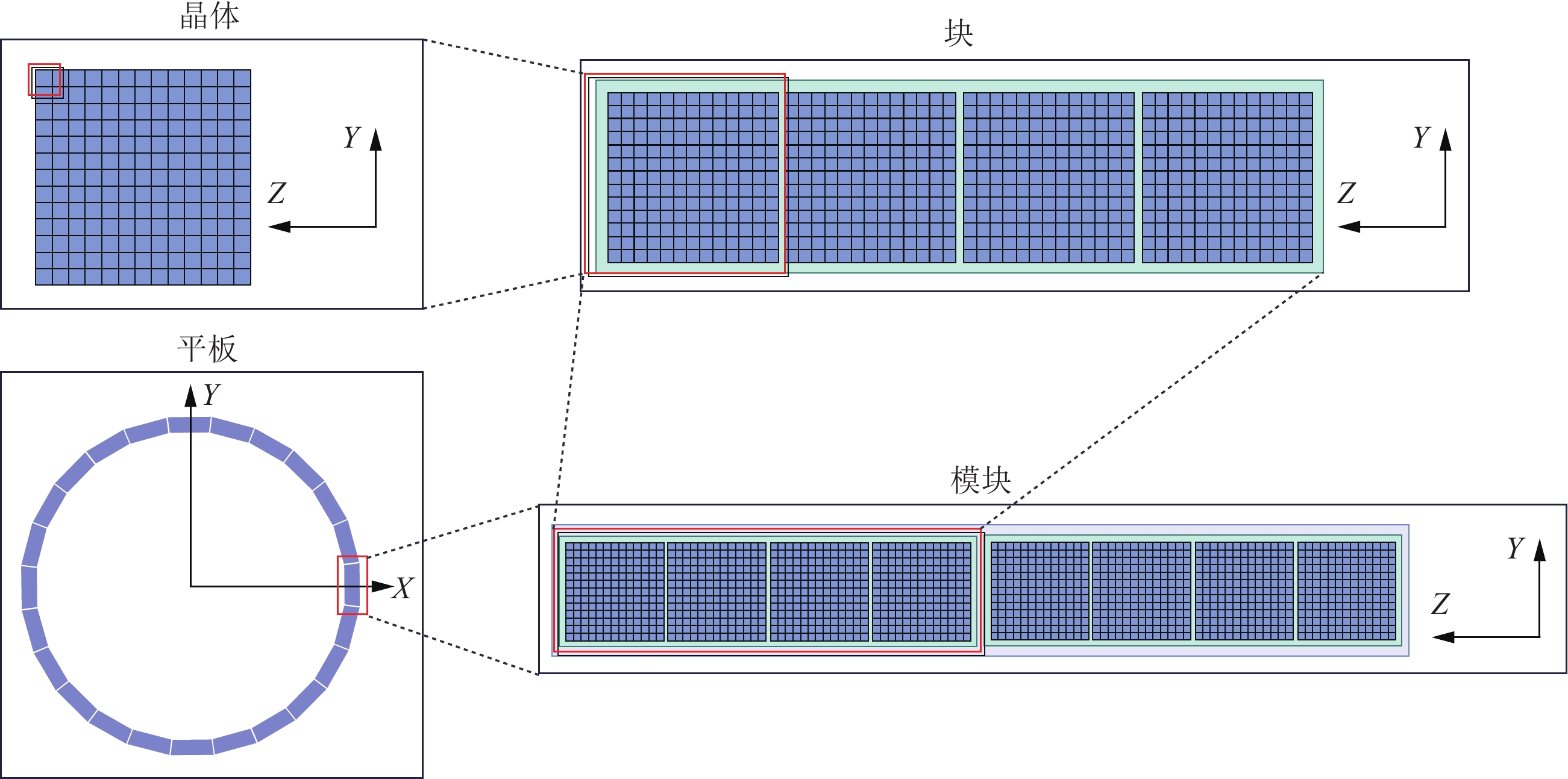
图7是探测器几何结构的示意图,其中,进入环的反方向是z轴正向,垂直地面向上是y轴正向,按照右手定则确定x轴正向。按照系统特点,探测单元组结构可分为4层:晶体、块、模块和平板。一个块包含若干个晶体,一个模块包含若干个块,一个平板包含若干个模块。
晶体:是探测器空间结构中的最小单元,每个晶体对应探测器内的一个晶体条。
块:是一系列晶体的阵列,每个块对应探测器内的一个探测单元。探测器内的探测单元摆放类似于晶体在块内的阵列摆放方式。
模块:是一系列块的阵列,每个模块对应一个探测器。平板内的探测器摆放类似于晶体在块内、块在模块内的阵列摆放方式。
平板:是一系列模块的阵列,每个平板至少由一个探测器组成,并且每个平板完全相同。
最后,若干结构相同的平板围绕视场(field of view, FOV)中心排列成一个正多面体,形成环状探测系统。
(2)探测器通讯结构定义
探测器环的每个平板中的一个模块构成一个通信单元,每个模块具有独立的IP地址与主机进行通信。几何结构和通信协议共同构成探测器的设备描述信息。
如图8所示,全数字PET系统中的模块一般是一个BDM,每个BDM拥有一个独特的端口号,若干个BDM共享一个IP地址。所有的BDM编号、IP和端口号会形成一个BDM列表,计算机通过列表可以对所有BDM的数据进行获取。如果需要对不同的全数字PET系统做数据获取,只需更改BDM列表中的BDM编号、IP和端口号即可。
4. 基于PnI的动物PET成像软件
目前,动物[47]、临床和各种应用专用型[75-78]全数字PET系统一般是环形、双平板、四平板等拓扑为环形的几何结构,所以可以用统一的几何结构描述方式接入PnI。又因为PnI支持探测器和算法的即插即成像,探测器通过统一的通讯方式传输数据,各个成像过程的算法可以快速地开发与替换,最终可以支持全数字PET系统的快速搭建。
以小动物PET系统为例,介绍PnI已经完成的Trans-PET D180动物全数字PET系统[47]搭建。
4.1 几何结构
Trans-PET D180属于环状PET,其中D180有1个环,每一个环包含了24个BDM,系统FOV分别对应大小为160 mm×160 mm×100 mm和160 mm×160 mm×200 mm的圆柱形区域。
Trans-PET D180系统几何结构具体如表1所示,参考前述探测器几何结构定义。
表 1 D180几何结构Table 1. D180 Geometric structure几何参数 D180 X Y Z 晶体数量 1 13 13 晶体尺寸/mm 13.00 1.89 1.89 晶体封装尺寸/mm 13.00 2.00 2.00 块数量 1 1 4 块尺寸/mm 13.30 26.00 26.00 块封装尺寸/mm 13.30 26.50 26.50 模块数量 1 1 1 模块尺寸/mm 20.00 26.50 106.00 模块封装尺寸/mm 20.00 26.50 108.00 平板数量 24 平板尺寸/mm 20.00 26.50 108.00 平板封装尺寸/mm 20.00 26.50 108.00 通过探测单元结构表,按照成像设备层定义可构建系统几何结构描述。再根据模块数量和平板数量填写BDM列表信息,用于数据获取。
4.2 成像软件功能
该平台实现了数据获取、拟合、符合事件甄别、图像重建的主过程且均支持批处理操作,还配备了各种校正因子生成与使用、可视化看图与分析等功能。同时,不同设备只需将探测器参数配置在平台中,即可实现不同设备在PnI中的系统快速搭建,下面具体阐述平台内各个成像流程的具体功能。
(1)数据获取:PnI中采用了双缓冲区多快照采集算法,支持高速率场景下对数据进行不丢失地接收并存储到计算机外存中。
(2)MVT拟合:使用双指数拟合模型完成对单事件的时间、位置和能量信息的提取。
(3)符合事件甄别:支持能量窗口和时间窗口的自由调节。时间符合策略实现了“Kill All”、“Take All Goods”等,有算法均支持并行计算。
(4)图像重建:实现了OSEM-Raytracing、OSEM-PSF、FBP-SSRB、FBP-FORE等重建算法,所有算法支持并行计算。
(5)PET数据校正:支持PET数据的归一化、随机、衰减、散射、死时间等校正方法。
另外,PnI平台还支持对复杂成像流程协议的定义,例如多床位扫描协议,动态成像协议,多次扫描协议,系统评估协议等等,用户也可以根据要求自行添加自定义协议。
4.3 部分系统评估结果
为了证明系统的可用性和认证系统的性能基线是否符合国际标准,需根据美国电气制造商协会标准出版物NU-4-2008[79]:小动物正电子发射断层扫描仪的性能测量(NEMA-NU-4-2008)进行系统评估。基于PnI平台搭建的Trans-PET D180[47]系统评估指标如下:
(1)空间分辨率:使用一个直径为0.3 mm、活性为0.71 MBq的 22Na点源,该点源嵌入边长限制在10.0 mm范围的丙烯酸立方体中。用FBP评估的FOV中心径向空间分辨率约为(2.56±0.04)mm于半高全宽(full width at half maximum, FWHM)。由于视差效应,在距离视场中心50 mm处,其FWHM降低至(4.32±0.03)mm。使用3D-OSEM-PSF算法时,空间分辨率显著提高,使径向、切向和轴向空间分辨率分别约为(1.34±0.04)mm FWHM、(1.35±0.05)mm FWHM和(1.64±0.04)mm FWHM。由于视差效应引起的退化也得到了控制,直到距离视场中心50 mm的径向距离的空间分辨率均低于1.8 mm FWHM。
(2)灵敏度:使用与上述相同的源测量灵敏度,在视野中心处,灵敏度最大值为(4.00±0.02)%。相应的总系统灵敏度和总绝对系统灵敏度分别为(20±3)cps/kBq和(2.25±0.01)%。
(3)计数率:制作了3个尺寸逐个变大的假体模拟小鼠、大鼠和猴子进行的小动物实验,类小鼠假体的噪声等效计数率(noise equivalent count rate, NECR)曲线峰值在96.43 MBq时为(713±2)kcps,类大鼠假体的NECR曲线峰值在97.03 MBq时为(207±2)kcps,类猴假体的NERC曲线峰值在97 MBq时为(47±1)kcps。
(4)图像质量:使用NEMA-NU4-2008定义的图像质量假体来生成图像,模拟一种小型啮齿动物(直径为30 mm,长度为50 mm)全身成像研究中获得的图像,表2显示了5尺寸热棒的恢复系数(recovery coefficient, RC)和相应的标准差。充气和充水气缸的溢出比(spill-over ratio, SOR)分别为(0.12±0.02)和(0.11±0.02),相应的标准差为(6.76±0.02)% 和(7.90±0.02)%。
表 2 恢复系数和标准差的测量Table 2. RC and STD measurements棒直径/mm 1 2 3 4 5 恢复系数/% 13±1 52±2 79±2 84±2 86±2 标准差/% 8.52±0.02 7.21±0.02 4.86±0.02 5.52±0.02 4.92±0.02 5. 总结
基于PnI的全数字PET成像软件,将成像过程中的算法当作“积木”,整个成像过程用算法调度,将信息挖掘入口从传统影像层面提前到原始数据层面,支持算法的灵活接入。通过PnI概念构建的开放平台,可以支持研究者对算法进行开发、评估、优化和应用,大大提高了科学家搭建科研仪器的灵活性,计算机、数学、人工智能、医学、生物学的研究人员都能加入这个研究平台,适应大科学装置等复杂的应用场景。
致谢:感谢曾令畅、张事业为基于PnI的动物PET成像软件所做的实现与测试等工作,感谢邱奥对论文修改提出的宝贵建议。
-
表 1 D180几何结构
Table 1 D180 Geometric structure
几何参数 D180 X Y Z 晶体数量 1 13 13 晶体尺寸/mm 13.00 1.89 1.89 晶体封装尺寸/mm 13.00 2.00 2.00 块数量 1 1 4 块尺寸/mm 13.30 26.00 26.00 块封装尺寸/mm 13.30 26.50 26.50 模块数量 1 1 1 模块尺寸/mm 20.00 26.50 106.00 模块封装尺寸/mm 20.00 26.50 108.00 平板数量 24 平板尺寸/mm 20.00 26.50 108.00 平板封装尺寸/mm 20.00 26.50 108.00 表 2 恢复系数和标准差的测量
Table 2 RC and STD measurements
棒直径/mm 1 2 3 4 5 恢复系数/% 13±1 52±2 79±2 84±2 86±2 标准差/% 8.52±0.02 7.21±0.02 4.86±0.02 5.52±0.02 4.92±0.02 -
[1] 王荣福, 刘红洁, 张春丽. PET 受体显像的研究应用进展[J]. 中国医学影像技术, 2006, 10: 1599−1603. DOI: 10.3321/j.issn:1003-3289.2006.10.043. WANG R F, LIU H J, ZHANG C L. Prospect of study and application on PET receptor imaging[J]. Chinese Journa of Medical Imaging Technology, 2006, 10: 1599−1603. DOI: 10.3321/j.issn:1003-3289.2006.10.043. (in Chinese).
[2] ADLER S, SEIDEL J, CHOYKE P. Advances in preclinical PET[J]. Seminars in Nuclear Medicine, 2022, 52(3): 382-402.
[3] 曾更生. 医学图像重建[M]. 北京: 高等教育出版社, 2010. ZENG G S, Medical image reconstruction[M]. Beijing: Higher Education Press, 2010. (in Chinese).
[4] LECOQ P, MOREL C, PRIOR J O, et al. Roadmap toward the 10 ps time-of-flight PET challenge[J]. Physics in Medicine and Biology, 2020, 65(21): 21RM01.
[5] RACCAGNI I, VALTORTA S, MORESCO R M, et al. Tumour hypoxia: Lessons learnt from preclinical imaging[J]. Clinical and Translational Imaging, 2017, 5(5): 407-425.
[6] KRISHNAMOORTHY S, BLANKEMEYER E, MOLLET P, et al. Performance evaluation of the MOLECUBES β-CUBE-a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors[J]. Physics in Medicine and Biology, 2018, 63(15): 155013.
[7] MIRANDA A, STAELENS S, STROOBANTS S, et al. Motion dependent and spatially variant resolution modeling for PET rigid motion correction[J]. IEEE Transactions on Medical Imaging, 2020, 39(7): 2518−2530. DOI: 10.1109/TMI.2019.2962237.
[8] SURTI S, KUHN A, WERNER M E, et al. Performance of Philips Gemini TF PET/CT scanner with special consideration for its time-of-flight imaging capabilities[J]. Journal of Nuclear Medicine, 2007, 48(3): 471−480.
[9] JAKOBY B W, BERCIER Y, CONTI M, et al. Physical and clinical performance of the mCT time-of-flight PET/CT scanner[J]. Physics in Medicine and Biology, 2011, 56(8): 2375. DOI: 10.1088/0031-9155/56/8/004.
[10] BERGERON M, CADORETTE J, BEAUDOIN J F Ç, et al. Performance evaluation of the labPET APD-based digital PET scanner[J]. IEEE Transactions on Nuclear Science, 2009, 56(1): 10−16. DOI: 10.1109/TNS.2008.2010257.
[11] 刘志强. 模拟电路设计[M]. 北京: 清华大学出版社, 2011. LIU Z Q, Analog circuit design[M]. Beijing: Tsinghua University Press, 2011. (in Chinese).
[12] 奚道明. 数字闪烁探测器[D]. 武汉: 华中科技大学, 2015. XI D M, The digital scintillation detector[D]. Wuhan: Huazhong University of Science and Technology, 2015. (in Chinese).
[13] FAHEY, FREDERIC H. Data acquisition in PET imaging[J]. Journal of Nuclear Medicine Technology, 2002(2): 11.
[14] CHERRY S R, DAHLBOM M. PET: Physics, instrumentation, and scanners[M]//Phelps ME. PET: Molecular Imaging and Its Biological Applications, New York, NY, USA: Springer, 2006: 1-117.
[15] CONSTANTINESCU C C, MUKHERJEE J. Performance evaluation of an Inveon PET preclinical scanner[J]. Physics in Medicine and Biology, 2009, 54(9): 2885. DOI: 10.1088/0031-9155/54/9/020.
[16] VASKA P, WOODY C L, SCHLYER D J, et al. RatCAP: Miniaturized head-mounted PET for conscious rodent brain imaging[J]. IEEE Transactions on Nuclear Science, 2004, 51(5): 2718−2722. DOI: 10.1109/TNS.2004.835740.
[17] XIE Q, KAO C M, HSIAU Z, et al. A new approach for pulse processing in positron emission tomography[J]. IEEE Transactions on Nuclear Science, 2005, 52(4): 988-995.
[18] KIM H, KAO C M, XIE Q, et al. A multi-threshold sampling method for TOF-PET signal processing[J]. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, 2009, 602(2): 618-621.
[19] XI D, KAO C M, LIU W, et al. FPGA-only MVT digitizer for TOF PET[J]. IEEE Transactions on Nuclear Science, 2013, 60(5): 3253−3261.
[20] XIE Q, CHEN Y, ZHU J, et al. Implementation of LYSO/PSPMT block detector with all digital DAQ system[J]. IEEE Transactions on Nuclear Science, 2013, 60(3): 1487−1494. DOI: 10.1109/TNS.2013.2245771.
[21] XIE Q, XI D, ZHU J, et al. LEGO for Kids, Trans-PET for scientists[C]//2014 International Symposium on Next-Generation Electronics (ISNE). IEEE, 2014: 3-5.
[22] 李曦蒙. 全数字PET数据获取系统设计与实现[D]. 武汉: 华中科技大学, 2023. LI X M, All-Digital PET data acquisition system design and implementation[D]. Wuhan: Huazhong University of Science and Technology, 2023. (in Chinese).
[23] LIU T, MING N, GU S, et al. A ∼0.7 mm spatial resolution All-Digital animal PET system using improved trans-PET detectors[C]//2016 IEEE Nuclear Science Symposium, Medical Imaging Conference and Room-Temperature Semiconductor Detector Workshop (NSS/MIC/RTSD). IEEE, 2016: 1-3.
[24] LIU Y, XI D, KAO C M, et al. Trans-PET: Towards plug and imaging coincidence measurement[C]//2015 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC). IEEE, 2015: 1-3.
[25] JHA A K, Van DAM H T, KUPINSKI M A, et al. Simulating silicon photomultiplier response to scintillation light[J]. IEEE Transactions on Nuclear Science, 2013, 60(1): 336−351. DOI: 10.1109/TNS.2012.2234135.
[26] LEMING E, SANTO A, SALVATORE F, et al. A GEANT4 Monte Carlo simulation to describe the time response of a coupled SiPM and LYSO detection system[J]. Journal of Instrumentation, 2014, 9(6): C06008−C06008. DOI: 10.1088/1748-0221/9/06/C06008.
[27] LI H, WONG W H, URIBE J, et al. A high speed position-decoding electronics for BGO block detectors in PET[J]. IEEE Transactions on Nuclear Science, 2000, 47(3): 1006−1010. DOI: 10.1109/23.856539.
[28] LI A, XIE Q, LI B, et al. Multiple reconstructions with different data quality for a single scan using kernel method in digital PET[C]//2020 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC). IEEE, 2020: 1-5.
[29] GOLDSCHMIDT B, LERCHE C W, et al. Towards software-based real-time singles and coincidence processing of digital PET detector raw data[J]. IEEE Transactions on Nuclear Science, 2013, 60(3): 1550-1559.
[30] GOLDSCHMIDT B, SCHUG D, LERCHE C W, et al. Software-based real-time acquisition and processing of PET detector raw data[J]. IEEE Transactions on Biomedical Engineering, 2016, 63(2): 316-327.
[31] LEUNG E K, JUDENHOFER M S, CHERRY S R, et al. Performance assessment of a software-based coincidence processor for the EXPLORER total-body PET scanner[J]. Physics in Medicine and Biology, 2018, 63(18): 18NT01.
[32] SHI Y, MENG F, ZHOU J, et al. GPU-based real-time software coincidence processing for digital PET system[J]. IEEE Transactions on Radiation and Plasma Medical Sciences, 2022, 6(6): 707-720.
[33] DEWITT D, JOHNSON-WILLIAMS N G, MIYAOKA R S, et al. Design of an FPGA-Based algorithm for real-time solutions of statistics-based positioning[J]. IEEE Transactions on Nuclear Science, 2010, 57(1): 71-77.
[34] CHIOU Y S, LIU Y H, CHEN Y J, et al. Design and implementation of 3D real-time positioning and tracking algorithms in FPGA for location estimation[C]//2020 IEEE Eurasia Conference on IOT, Communication and Engineering. IEEE, 2020: 40-43.
[35] HASELMAN M, DEWITT D, MCDOUGALD W, et al. FPGA-based front-end electronics for positron emission tomography[J]. FPGA, 2009: 93-102.
[36] Van DAM H T, SEIFERT S, VINKE R, et al. Improved nearest neighbor methods for gamma photon interaction position determination in monolithic scintillator PET detectors[J]. IEEE Transactions on Nuclear Science, 2011, 58(5): 2139−2147. DOI: 10.1109/TNS.2011.2150762.
[37] ALIAGA R J, MARTINEZ J D, GADEA R, et al. Corrected position estimation in PET detector modules with multi-anode PMTs using neural networks[J]. IEEE Transactions on Nuclear Science, 2006, 53(3): 776-783.
[38] HENZLER S, HENZLER S. Time-to-digital converter basics[M]. Springer Netherlands, 2010.
[39] DUDEK P, SZCZEPANSKI S, HATFIELD J V. A high-resolution CMOS time-to-digital converter utilizing a Vernier delay line[J]. IEEE Journal of Solid-State Circuits, 2000, 35(2): 240−247. DOI: 10.1109/4.823449.
[40] FUKUDA S, FUKUDA Y, ISHITSUKA M, et al. Constraints on neutrino oscillations using 1258 days of Super-Kamiokande solar neutrino data[J]. Physical Review Letters, 2001, 86(25): 5656. DOI: 10.1103/PhysRevLett.86.5656.
[41] BRYSK H. Fusion neutron energies and spectra[J]. Plasma Physics, 1973, 15(7): 611. DOI: 10.1088/0032-1028/15/7/001.
[42] CALÒ P P, CICIRIELLO F, PETRIGNANI S, et al. SiPM readout electronics[J]. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, 2019, 926: 57-68.
[43] XIE Q, KAO C M, WANG X, et al. Potentials of digitally sampling scintillation pulses in timing determination in PET[J]. IEEE Transactions on Nuclear Science, 2009, 56(5): 2607−2613. DOI: 10.1109/TNS.2009.2023656.
[44] BESPALKO V, BURAK I, SALMINS K. Estimating the precision of a leading-edge discriminator with amplitude correction[J]. Instruments and Experimental Techniques, 2019, 62(6): 788-793.
[45] 华越轩. 紧凑型数字PET探测器[D]. 武汉: 华中科技大学, 2017. HUA Y X, Compact digital PET detector[D]. Wuhan: Huazhong University of Science and Technology, 2017. (in Chinese).
[46] WANG L, ZHU J, LIANG X, et al. Performance evaluation of the trans-PET BioCaliburn LH system: A large FOV small-animal PET system[J]. Physics in Medicine and Biology, 2015, 60(1): 137−150. DOI: 10.1088/0031-9155/60/1/137.
[47] LIANG X, JING L, EMANUELE A, et al. NEMA-2008 and In-Vivo animal and plant imaging performance of the large FOV preclinical digital PET/CT system discoverist 180[J]. IEEE Transactions on Radiation and Plasma Medical Sciences, 2020, 5: 622−629.
[48] LI A, PENG X, XIE Q. A random estimation framework for variable coincidence sorting methods in digital PET[C]//2019 IEEE Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC), IEEE, 2019: 1-4.
[49] BAILEY D L, TOWNSEND D W, VALK P E, et al. Positron emission tomography[M]. 1ed. London: Springer-Verlag, 2005.
[50] WEN Z F. Multiway merging in parallel[J]. IEEE Transactions on Parallel and Distributed Systems, 1996, 7(1): 11-7.
[51] LONG A, XIAO P, LIU W, et al. An investigation of coincidence detection methods for Trans-PET[C]//2011 IEEE Nuclear Science Symposium Conference Record. Valencia, Spain: IEEE, 2011, 897-900.
[52] JAN S, SANTIN G, STRUL D, et al. GATE: A simulation toolkit for PET and SPECT[J]. Physics in Medicine and Biology, 2004, 49(19): 4543.
[53] BADAWI R D, MARSDEN P. Developments in component-based normalization for 3D PET[J]. Physics in Medicine and Biology, 1999, 44(2): 571. DOI: 10.1088/0031-9155/44/2/020.
[54] KINAHAN P E, TOWNSEND D, BEYER T, et al. Attenuation correction for a combined 3D PET/CT scanner[J]. Medical Physics, 1998, 25(10): 2046−2053. DOI: 10.1118/1.598392.
[55] HOFMANN M, BEZRUKOV I, MANTLIK F, et al. MRI-based attenuation correction for whole-body PET/MRI: Quantitative evaluation of segmentation-and atlas-based methods[J]. Journal of Nuclear Medicine, 2011, 52(9): 1392−1399. DOI: 10.2967/jnumed.110.078949.
[56] BRASSE D, KINAHAN P E, LARTIZIEN C, et al. Correction methods for random coincidences in fully 3D whole-body PET: Impact on data and image quality[J]. Journal of Nuclear Medicine, 2005, 46(5): 859−867.
[57] GROOTOONK S, SPINKS T, SASHIN D, et al. Correction for scatter in 3D brain PET using a dual energy window method[J]. Physics in Medicine and Biology, 1996, 41(12): 2757. DOI: 10.1088/0031-9155/41/12/013.
[58] WATSON C C, NEWPORT D, CASEY M E. A single scatter simulation technique for scatter correction in 3D PET[M]//Three-dimensional Image Reconstruction in Radiology and Nuclear Medicine, Dordrecht, Springer Netherlands, 255-268.
[59] WATSON C C, HU J, ZHOU C. Double scatter simulation for more accurate image reconstruction in positron emission tomography[J]. IEEE Transactions on Radiation and Plasma Medical Sciences, 2020, 4(5): 570−584. DOI: 10.1109/TRPMS.2020.2990335.
[60] KNOLL G F. Radiation detection and measurement[M]. 4ed. New York: John Wiley and Sons, 2010.
[61] YOUSAF M, AKYUREK T, USMAN S. A comparison of traditional and hybrid radiation detector dead-time models and detector behavior[J]. Progress in Nuclear Energy, 2015, 83: 177-185.
[62] LEE, S H, GARDNER, R P. A new G-M counter dead time model[J]. Applied Radiation and Isotopes, 53(4/5): 731-737.
[63] USMAN S, PATIL A. Radiation detector deadtime and pile up: A review of the status of science[J]. Nuclear Engineering and Technology, 2018, 50(7): 1006-1016.
[64] DEÁK Z, GRIMM J M, TREITL M, et al. Filtered back projection, adaptive statistical iterative reconstruction, and a model-based iterative reconstruction in abdominal CT: An experimental clinical study[J]. Radiology, 2013, 266(1): 197−206 DOI: 10.1148/radiol.12112707.
[65] BOUALLEGUE F B, CROUZET J F, COMTAT C, et al. Exact and approximate Fourier rebinning algorithms for the solution of the data truncation problem in 3-D PET[J]. IEEE Transactions on Medical Imaging, 26(7): 1001-1009.
[66] DEFRISE M, KINAHAN P E, TOWNSEND D W, et al. Exact and approximate rebinning algorithms for 3-D PET data[J]. IEEE Transactions on Medical Imaging, 16(2): 145-158.
[67] DEFRISE M, LIU X. A fast rebinning algorithm for 3D positron emission tomography using John’s equation[J]. Inverse Problems, 1999, 15(4): 1047-65.
[68] DEFRISE M, CASEY M E, MICHEL C, et al. Fourier rebinning of time-of-flight PET data[J]. Physics in Medicine and Biology, 2005, 50(12): 2749−63. DOI: 10.1088/0031-9155/50/12/002.
[69] KINAHAN P E, ROGERS J G, Analytic three-dimensional image reconstruction using all detected events[J]. IEEE Transactions on Nuclear Science, 1989, 36(1): 964-968.
[70] RAPISARDA E, BETTINARDI V, THIELEMANS K, et al. Image-based point spread function implementation in a fully 3D OSEM reconstruction algorithm for PET[J]. Physics in Medicine and Biology, 2010, 55(14): 4131. DOI: 10.1088/0031-9155/55/14/012.
[71] KADRMAS D J. LOR-OSEM: Statistical PET reconstruction from raw line-of-response histograms[J]. Physics in Medicine and Biology, 2004, 49(20): 4731. DOI: 10.1088/0031-9155/49/20/005.
[72] DEMPSTER A P, LAIRD N M, RUBIN D B. Maximum likelihood from incomplete data via the EM algorithm[J]. Journal of the Royal Statistical Society: Series B (methodological), 39(1): 1-22.
[73] SNYDER D L, MILLER M I, THOMAS L J, et al. Noise and edge artifacts in maximum-likelihood reconstructions for emission tomography[J]. IEEE Transactions on Medical Imaging, 1987, 6(3): 228-238.
[74] QI J, LEAHY R M, Resolution and noise properties of MAP reconstruction for fully 3-D PET[J]. IEEE Transactions on Medical Imaging, 2000, 19(5): 493-506.
[75] D’ASCENZO N, GAO M, CHEN H H, et al. A new in-beam proton therapy monitoring system based on digital MVT readout[C/OL]//2018 IEEE Nuclear Science Symposium and Medical Imaging Conference Proceedings (NSS/MIC). Sydney, Australia: IEEE, 2018: 1-2.
[76] D’ASCENZO N, ANTONECCHIA E, GAO M, et al. Evaluation of a digital brain positron emission tomography scanner based on the plug & imaging sensor technology[J]. IEEE Transactions on Radiation and Plasma Medical Sciences, 2020, 4(3): 327−334. DOI: 10.1109/TRPMS.2019.2937681.
[77] 董超群. 面向运动目标的PET成像运动校正研究[D]. 武汉: 华中科技大学, 2021. DONG C Q. A research about motion correction of PET imaging for moving objects[D]. Wuhan: Huazhong University of Science and Technology, 2021. (in Chinese).
[78] ANTONECCHIA E, BÄCKER M, CAFOLLA D, et al. Design study of a novel positron emission tomography system for plant imaging[J]. Frontiers in Plant Science, 2022, 12: 736221. DOI: 10.3389/fpls.2021.736221.
[79] National Electrical Manufacturers Association. NEMA NU4-2008: performance measurements of small animal positron emission tomographs[S]. National Electrical Manufacturers Association, 2008.




 下载:
下载: