CT Radiomics Nomogram Prediction for Tumor Deposits and Prognosis in Colorectal Cancer
-
摘要:
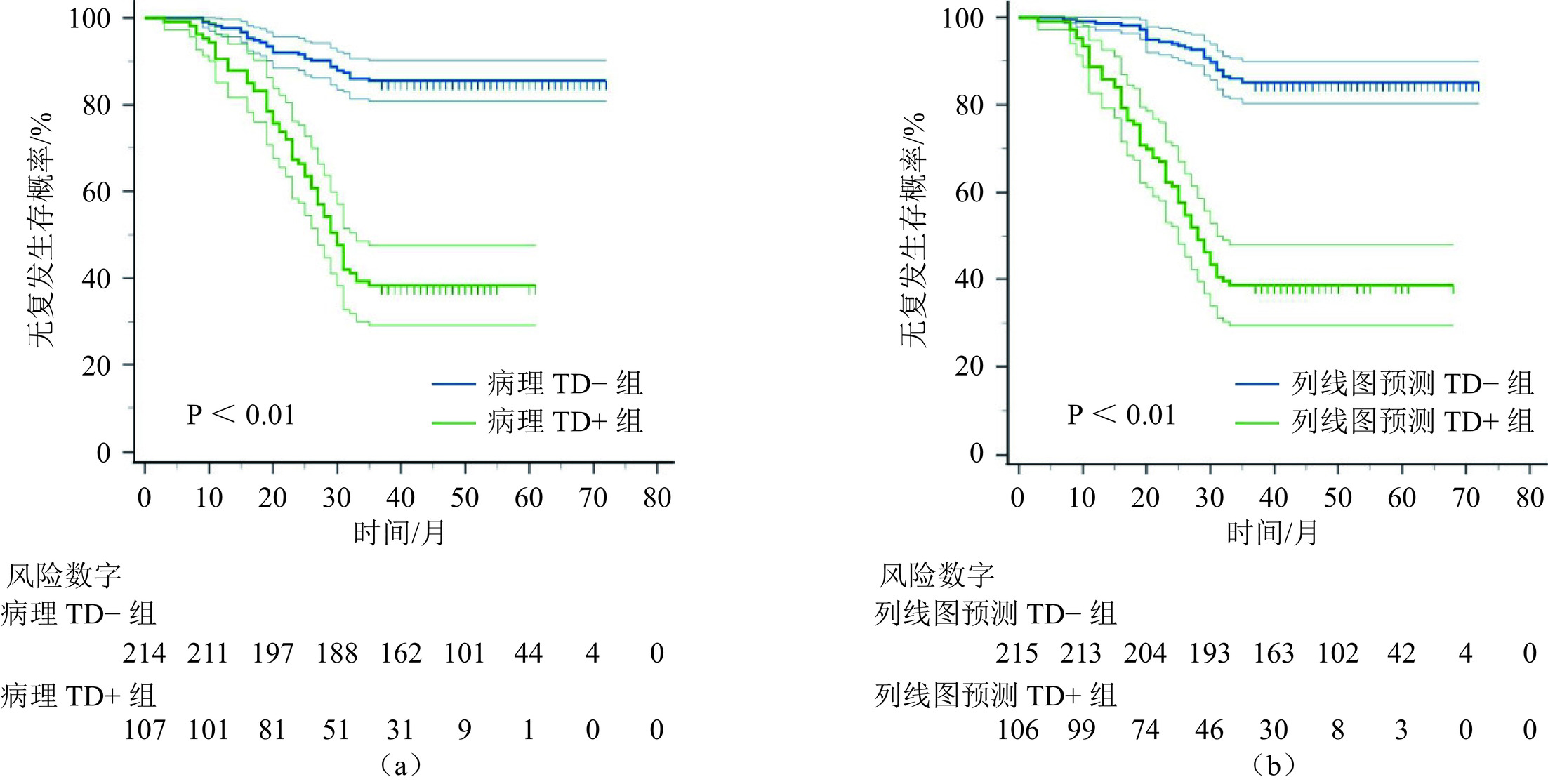
目的:建立CT影像组学列线图术前预测结直肠癌(CRC)患者肿瘤沉积(TD)和无复发生存(RFS)。方法:回顾性研究321例经手术病理证实的CRC患者,患者以6∶4分为训练集和验证集。从门静脉CT图像中提取基于肿瘤原发灶的影像组学特征,使用最小绝对收缩选择算子(LASSO)筛选与TD相关的影像组学特征。临床−影像组学列线图是根据筛选的影像组学特征和最具预测性的临床因素开发的。采用单、多因素Cox回归分析筛选3年无复发生存(RFS)的独立危险因素。结果:在训练集和验证集中,影像组学模型的曲线下面积(AUC)分别为0.80和0.79。结合影像组学特征和临床预测因子(CEA,CA199,CT报告的淋巴结状态)构建列线图以术前预测TD,列线图在训练集和验证集AUC分别为0.85和0.85。此外,列线图预测的TD是RFS的独立危险因素,TD阳性组的RFS差于TD阴性组。结论:CT影像组学列线图能够有效术前预测CRC患者TD和预后。
Abstract:Objective: To establish computed tomography (CT) radiomics nomogram for preoperative prediction of tumor deposits (TD) and recurrence-free survival (RFS) in patients with colorectal cancer (CRC). Methods: A retrospective study was conducted on 321 CRC patients confirmed by surgical pathology. The patients’ data were divided were divided into a training set and a validation set at a ratio of 6:4, respectively. Radiomics features based on the primary tumor site were extracted from portal venous phase CT images, and the least absolute shrinkage and selection operator (LASSO) algorithm was employed to select radiomics features associated with tumor deposits (TD). The LASSO regression algorithm was applied to choose radiomics features related to TD. A clinical-radiomics nomogram was developed based on the selected radiomics features and the most predictive clinical factors. Univariate and multivariate Cox regression analyses identified independent risk factors for a 3-year relapse free survive (RFS). Results: The radiomics model achieved an area under the curve (AUC) of 0.80 in the training set and 0.79 in the validation set. By integrating radiomics features with clinical predictors (CEA, CA199, and CT-reported lymph node status), a nomogram was developed for the preoperative prediction of TD. The nomogram achieved an AUC of 0.85 in the training and validation sets. Furthermore, TD predicted by the nomogram was an independent risk factor for RFS, with poorer RFS observed in the TD-positive group compared to the TD-negative group. Conclusion: CT radiomics nomogram can effectively preoperatively predict TD and prognosis in CRC patients.
-
Keywords:
- tomography /
- X-ray computed /
- radiomics /
- colorectal neoplasms /
- tumor deposits
-
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是很常见的胃肠道间叶组织肿瘤,具有多向分化潜能,主要由胃肠道Cajal细胞或者同源的间叶干细胞的c-kit基因和PDGFRA基因发生功能获得性突变所造成的[1]。在GIST的诊疗过程中,c-kit等基因检测始终扮演着重要角色,并发挥着日益重要的作用[2]。CT影像是GIST诊疗过程中最常用到的影像学方法,相比较基因检测具有可重复使用、低成本等优点,但是临床医生通常难以通过CT影像直接对GIST基因突变进行鉴别。纹理分析和影像组学的发展,使得影像信息和基因信息之间打通了连接桥梁[3-4],可以通过挖掘CT影像信息,发现和构建有助于鉴别基因突变的影像组学特征和模型。
本研究假设GIST的CT影像组学特征和c-kit基因型具有相关性,有助于区分9/11号外显子突变。在过往研究中,已有部分工作报道了CT影像纹理分析在鉴别c-kit以及PDGFRA基因信息之间的相关性[5-6],也为本研究假设提供支持。本研究收集经基因病理检查证实c-kit基因突变的GIST患者的增强CT影像数据,首次探讨利用CT影像组学分析来鉴别c-kit基因的9和11号外显子突变,初步构建能够进行分类诊断的预测模型,为GIST的智能化和个性化治疗提供更多依据。
1. 资料与方法
1.1 一般资料
本研究回顾性收集2018年至2020年在保定市第一中心医院及河北医科大学第四医院经手术后病理学检查证实的49例GIST患者的病例和影像资料。纳入标准:①经过基因病理学检查证实为GIST患者,且c-kit基因的9/11号外显子突变为阳性;②有完整的术前增强CT影像;③肿瘤最大径≥1 cm;④患者检查前未经手术、化疗及放疗等任何治疗,其中9号外显子突变的有9例,男7例,女2例,年龄40~70岁,平均59.3岁;11号外显子突变的有40例,男15例,女25岁,年龄34~86岁,平均62.5岁。
1.2 扫描前肠道准备
检查当日禁食,扫描前90 min进行肠道清洁:口服生理盐水500 mL+80 mL甘露醇2~3组。
1.3 扫描参数
所纳入患者均应用Brilliance iCT 256层螺旋CT行全腹部扫描,管电压120 kV,层厚及层距为5 mm,同时联合三期增强扫描,获取动脉期、门脉期及延迟期三期图像。增强扫描时,使用非离子型对比剂碘海醇(300 mgI/mL),剂量1.3~1.5 mL/kg,采用高压注射器以3~3.5 mL/s的注射速率,经肘前静脉团注。
注射对比剂后采用自动检测触发扫描模式,扫描范围包括所有病变区域,当腹主动脉CT值达150 HU即触发扫描,获得动脉期、门脉期(约65 s)及延迟期(120 s)三期图像。
1.4 基因检测
参考GIST诊断标准[7],通过聚合酶链反应扩增DNA直接测序法进行基因检测。整个过程均由有多年工作经验的病理科医生进行操作及审核。
1.5 感兴趣区域勾画
选取动脉期图像,采用ITK-SNAP 3.8.0[8](www.itksnap.org)进行感兴趣区域的勾画。感兴趣区域包括整个GIST肿瘤区域(图1),并尽量避开了血管和钙化等区域。
由两名影像科医生分别在不知道病理结果的情况下进行勾画(一位具有3年工作经验,一位具有15年工作经验),并通过交流讨论达成最终的勾画意见。
1.6 影像组学分析
使用Python Pyradiomics 3.0.1[9]进行CT影像组学特征的提取,共提取特征105个,其中包括形状特征(14个)、一阶直方图特征(18个)、灰度共生矩阵(gray level co-occurrence matrix,GLCM)特征(22个)、灰度大小区域矩阵(gray level size zone matrix,GLSZM)特征(16个)、灰度运行长度矩阵(gray level run length matrix,GLRLM)特征(16个)、灰度相关矩阵(gray level dependence matrix,GLDM)特征(14个)和邻近灰度区别矩阵(neighbouring gray tone difference matrix,NGTDM)特征(5个)。相关特征均符合成像生物标志物标准化倡议[10],详细细节可参考Pyradiomics说明文档[11]。
最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法可以将高维度小样本数据的特征进行筛选[12-13],选出7个最具有相关性的组学特征纳入到下一步统计分析,最终逻辑回归(logistics regression,LR)算法用来实现基因鉴别模型的构建。
1.7 统计学分析
相关统计分析由SPSS 22.0统计软件进行处理,使用Mann-Whitney U检验来评估各个临床因素以及影像组学特征在9/11号外显子突变之间的差异性,P<0.05表明差异有统计学意义。LASSO和LR算法基于Python语言实现。
通过箱线图展示最终的组学特征在两组数据中的差异性,通过受试者工作特征曲线(receiver operating characteristic curve,ROC)以及曲线下面积(area under curve,AUC)来评价各组学特征以及鉴别模型的诊断性能。
2. 结果
2.1 一般资料
最终入组的49例GIST患者,其临床统计信息如表1所示。性别和年龄均不具备区分c-kit基因9/11两种外显子突变的统计学意义,与报道[14]的结果基本一致。
表 1 GIST患者临床信息Table 1. Clinical characteristics of GIST项目 c-kit 基因外显子 9 突变 c-kit 基因外显子 11 突变 P 性别 男 7 15 0.46 女 2 25 年龄 59.3(40,70) 62.5(34,86) 0.55 2.2 影像组学特征
基于提取到的105个影像组学特征,经过LASSO特征筛选(图2(a)),最终选出7个相关性强的特征,其他特征被赋予0权重而筛除。7个特征分别为小相关性高灰度强调因子(small dependence high gray level emphasis,SDHGLE)F1、聚类阴影(cluster shade)F2、最大三维直径(maximum 3D diameter,M3D)F3、偏斜度(skewness)F4、强度(strength)F5、延伸率(elongation)F6 和最大二维切片直径(maximum 2D diameter slice,M2DS)F7。
图2(b)为不同组学特征之间的相关性热图,用于显示特征之间的相关性程度,其中F3和F7均被LASSO选出且具备高度相关性(R=0.96)。
2.3 统计学分析
不同的组学特征在9/11号外显子突变两组之间的统计学差异如图3所示。其中,小相关性高灰度强调因子、偏斜度、强度和延伸率均在9号突变中要显著高于11号突变,而最大三维直径和最大二维切片直径在9号突变中要显著低于11号突变,聚类阴影在两组间不具备统计学差异。
2.4 影像组学模型
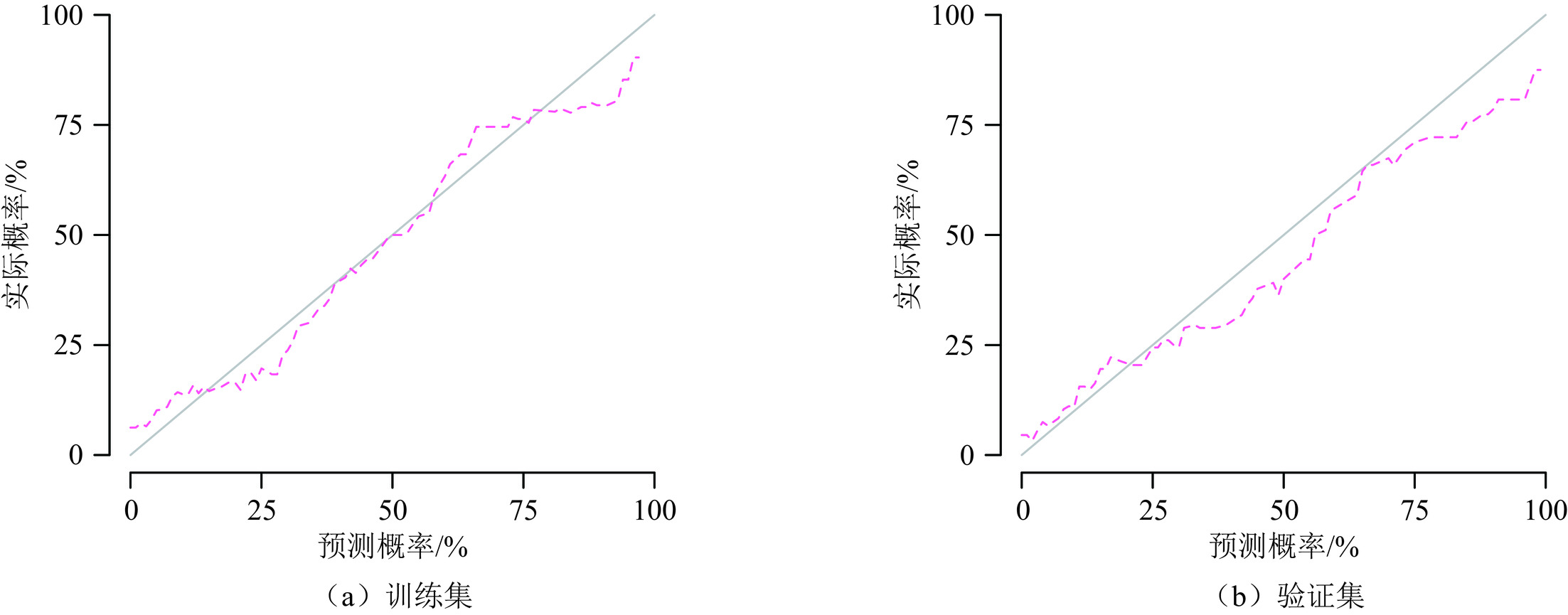
影像组学特征以及最终的组学模型在鉴别两种基因突变的ROC曲线如图4所示。延伸率、强度和小相关性高灰度强调因子具备更优的诊断性能,AUC分别为0.69、0.68和0.67。最终的逻辑回归模型拥有最佳的诊断性能AUC为0.79。
3. 讨论
随着CT成像以及图像后处理技术的发展,基于CT影像的影像组学研究显著增多[15],CT影像组学已经被证实可以用于疾病诊断、病理分级、疗效评估以及生存期预测等[16-18]。基于CT图像的影像组学在基因预测方面也显示出较大的潜力[19-20]。不过目前,影像组学在GIST中的研究比较有限,且大多数集中于探讨纹理特征与GIST生物学行为之间的关系,有研究证实了CT纹理参数与GIST恶性风险的相关性,建立了CT纹理分析在预测GIST恶性风险中的作用[21]。而关于GIST基因组表型相关的影像组学的研究报道更为鲜见。有学者研究发现,GIST的c-kit基因11号外显子突变的有无,可以通过CT纹理分析为鉴别提供指导意见,较高的CT结构参数标准偏差是无c-kit基因11号外显子突变的GIST的独立预测因子[6]。任采月等[5]发现,在鉴别GIST患者的c-kit/PDGFRA基因突变型时,经过CT图像的纹理分析所获得的相关参数可以起到有价值的指导作用,其中c-kit突变型GIST的CT图像纹理较短,灰度值较高,纹理分布更均匀。
基于国内外研究现状,本研究通过对增强CT影像的回顾性影像组学分析,尝试构建用于鉴别c-kit基因中9/11号外显子突变的模型,可以初步判断CT影像组学具有区分c-kit基因9/11号外显子突变的潜力,也为CT影像组学预测GIST其他基因型表达提供了借鉴。
实验结果表明,在c-kit基因9号外显子突变的GIST患者中,小相关性高灰度强调因子、偏斜度、强度及延伸度具有更高的表达,而最大三维直径和最大二维切片直径则要低于11号外显子突变的患者。其中小相关性高灰度强调因子和强度属于纹理异质性特征,偏斜率和延伸率分别属于一阶直方图特征和形状特征,表明不同层次的影像特征或许均有区分不同c-kit基因型表达的潜力。相关的研究均发现纹理信息可以区分c-kit以及PDGFRA两种基因突变型[5],为纹理分析在GIST基因诊断的研究提供经验支持。最大三维直径以及最大二维切片直径可以反映肿瘤在三维以及二维层面上的大小,尚未有研究表明肿瘤大小有助于区分c-kit的9/11号基因突变,该发现或许对今后的研究工作有所指引。
本研究虽然有一些有趣的发现,但是也存在明显的限制和不足。作为一个小样本的回顾性研究,计算机通常难以从数据分布中学习到具有普适性的规律,其预测性能的泛化性也因为缺少多中心验证而证据不足。此外,缺乏较多的临床信息统计,从而缺少纹理特征与临床、基因相关性的深入探索。作为一个初步研究,给出了具有指导性的实验结果,在今后的研究中,还需要通过更大量的具有前瞻性的数据集去做更深入的研究探索。
综上所述,本研究首次探索CT影像组学在鉴别胃肠道间质瘤c-kit基因9/11号外显子突变的潜力,并且在初步研究中显示出一定的预测价值。CT影像组学作为一项新兴技术,可以在临床鉴别GIST中c-kit基因9/11号外显子突变中,提供更多有价值的信息,并且有望在临床上为GIST患者的个体化靶向治疗,提供更多有价值的指导。
-
表 1 321例CRC患者基线资料比较
Table 1 Comparison of baseline data of 321 patients with CRC
临床资料 TD阴性(n=214例) TD阳性(n=107例) $\chi^2 $/Z P 性别 0.41 0.52 女 90 49 男 124 58 年龄 67 (60,74) 68 (62,74) −0.35 0.72 CEA (阳性>5 ng/mL) 19.55 <0.01 阴性 128 36 阳性 86 71 CA199 (阳性>30 U/mL) 22.63 <0.01 阴性 181 65 阳性 33 42 白蛋白/球蛋白比值
(阳性<1.5 or >2.5)2.25 0.13 阴性 117 49 阳性 97 58 乳酸脱氢酶 2.62 0.11 阴性 185 85 阳性 29 22 肿瘤位置 4.70 0.10 右侧结肠 63 36 左侧结肠 110 42 直肠 41 29 CT报告的淋巴结状态 22.21 <0.01 无转移 143 42 有转移 71 65 肿瘤大小/cm 4.20(3.50,5.50) 4.50(3.00,5.90) −1.05 0.29 病理T分期 9.40 0.02 1 7 0 2 20 5 3 74 29 4 113 73 病理N分期 49.20 <0.01 0 130 25 1 63 44 2 21 38 病理M分期 22.14 <0.01 0 208 88 1 6 19 肿瘤分级 9.72 <0.01 Ⅰ 13 1 Ⅱ 171 79 Ⅲ 30 27 表 2 影像组学模型、临床模型及列线图预测CRC患者TD的效能
Table 2 The efficacy of radiomics model, clinical model and nomogram in predicting TD in patients with CRC
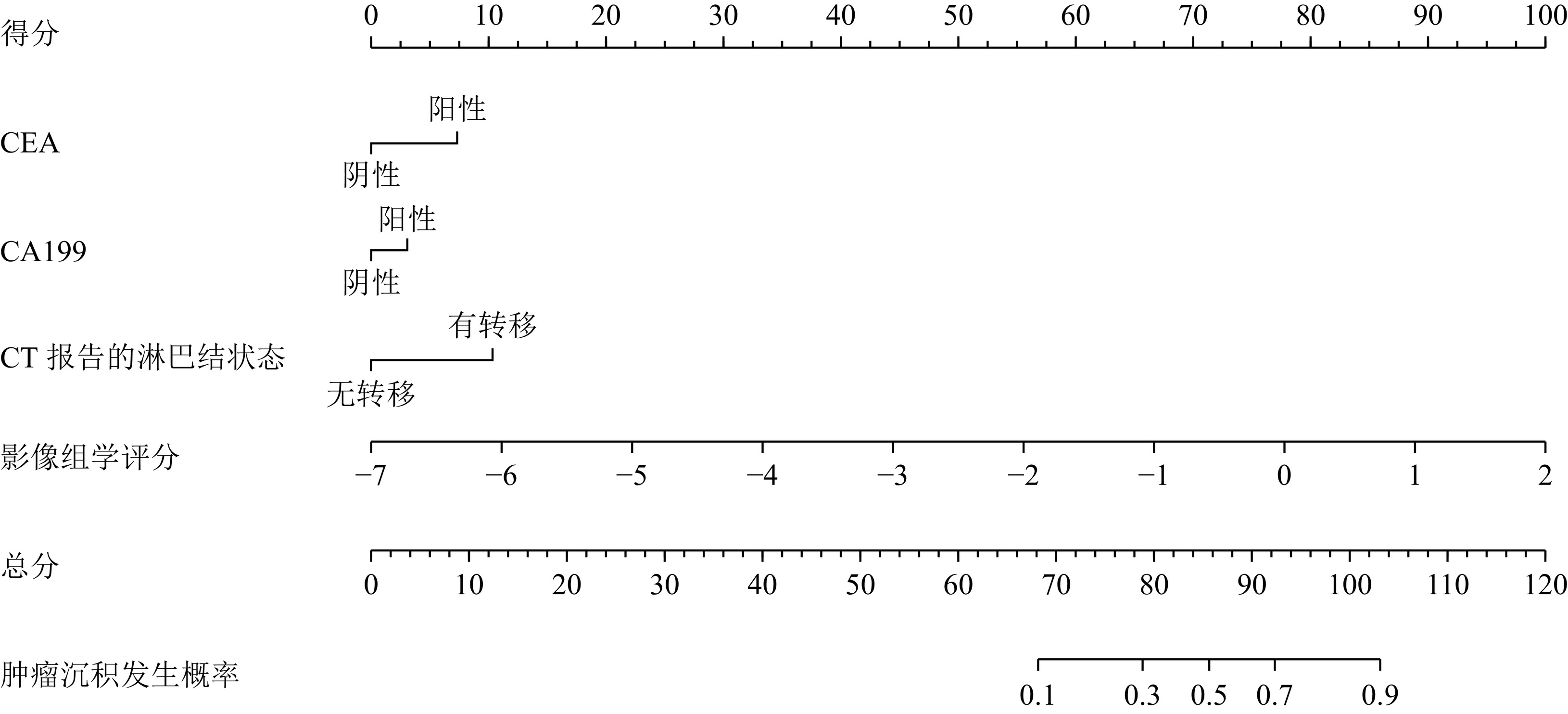
模型 AUC 准确率 敏感度 特异度 影像组学模型 训练集 0.80 0.75 0.72 0.77 验证集 0.79 0.70 0.67 0.72 临床模型 训练集 0.72 0.68 0.55 0.74 验证集 0.71 0.69 0.45 0.80 列线图 训练集 0.85 0.82 0.71 0.88 验证集 0.85 0.77 0.64 0.84 -
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA: A Cancer Journal for Clinicians, 2022, 72(1): 7-33. DOI: 10.3322/caac.21708.
[2] RYU H S, KIM J, PARK Y R, et al. Recurrence patterns and risk factors after curative resection for colorectal cancer: Insights for postoperative surveillance strategies[J]. Cancers (Basel), 2023, 15(24): 5791. DOI: 10.3390/cancers15245791.
[3] DELATTRE J F, SELCEN OGUZ ERDOGAN A, COHEN R, et al. A comprehensive overview of tumour deposits in colorectal cancer: Towards a next TNM classification[J]. Cancer Treatment Reviews, 2022, 103: 102325. DOI: 10.1016/j.ctrv.2021.102325.
[4] MOON J Y, LEE M R, HA G W. Prognostic value of tumor deposits for long-term oncologic outcomes in patients with stage III colorectal cancer: A systematic review and meta-analysis[J]. International Journal of Colorectal Disease, 2022, 37(1): 141-151. DOI: 10.1007/s00384-021-04036-z.
[5] PRICOLO V E, STEINGRIMSSON J, MCDUFFIE T J, et al. Tumor deposits in stage III colon cancer: Correlation with other histopathologic variables, prognostic value, and risk stratification-time to consider “N2c”[J]. American Journal of Clinical Oncology, 2020, 43(2): 133-138. DOI: 10.1097/COC.0000000000000645.
[6] AMIN M B, GREENE F L, EDGE S B, et al. The eighth edition AJCC cancer staging manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging[J]. CA: A Cancer Journal for Clinicians, 2017, 67(2): 93-99. DOI: 10.3322/caac.21388.
[7] RATTO C, RICCI R, ROSSI C, et al. Mesorectal microfoci adversely affect the prognosis of patients with rectal cancer[J]. Diseases of the Colon and Rectum, 2002, 45(6): 733-743. DOI: 10.1007/s10350-004-6288-8.
[8] ZHANG L N, XIAO W W, XI S Y, et al. Tumor deposits: Markers of poor prognosis in patients with locally advanced rectal cancer following neoadjuvant chemoradiotherapy[J]. Oncotarget, 2016, 7(5): 6335-6344. DOI: 10.18632/oncotarget.6656.
[9] SHI M, ZHANG H, YAO G, et al. The role of tumor deposits in predicting the efficacy of chemotherapy in stage III colon cancer[J]. Frontiers in Oncology, 2020, 10: 586603.
[10] ROLLVEN E, ABRAHAM-NORDLING M, HOLM T, et al. Assessment and diagnostic accuracy of lymph node status to predict stage III colon cancer using computed tomography[J]. Cancer Imaging, 2017, 17(1): 3. DOI: 10.1186/s40644-016-0104-2.
[11] ROLLVEN E, BLOMQVIST L, OISTAMO E, et al. Morphological predictors for lymph node metastases on computed tomography in colon cancer[J]. Abdominal Radiology (NY), 2019, 44(5): 1712-1721. DOI: 10.1007/s00261-019-01900-z.
[12] CHEN L D, LI W, XIAN M F, et al. Preoperative prediction of tumour deposits in rectal cancer by an artificial neural network-based US radiomics model[J]. European Radiology, 2020, 30(4): 1969-1979. DOI: 10.1007/s00330-019-06558-1.
[13] YANG Y S, FENG F, QIU Y J, et al. High-resolution MRI-based radiomics analysis to predict lymph node metastasis and tumor deposits respectively in rectal cancer[J]. Abdominal Radiology, 2021, 46(3): 873-884. DOI: 10.1007/s00261-020-02733-x.
[14] MIZUNO H, MIYAKE H, NAGAI H, et al. Optimal cutoff value of preoperative CEA and CA19-9 for prognostic significance in patients with stage II/III colon cancer[J]. Langenbeck’s Archives of Surgery, 2021, 406(6): 1987-1997. DOI: 10.1007/s00423-021-02236-3.
[15] SHAN J, GU B, SHI L, et al. Prognostic value of CEA and CA19-9 in patients with local advanced rectal cancer receiving neoadjuvant chemoradiotherapy, radical surgery and postoperative chemotherapy[J]. Translational Cancer Research, 2021, 10(1): 88-98. DOI: 10.21037/tcr-20-2269.
[16] LONG Q, XU Y, MA G, et al. Prognostic value of tumor deposit counts in patients with stage III colorectal cancer: A population-based study[J]. Journal of Investigative Surgery, 2022, 35(7): 1502-1509. DOI: 10.1080/08941939.2022.2069306.
-
期刊类型引用(2)
1. 乔吉灵,张泽平,隋昌盛,杨爱佳,杨婧. 影像组学在胃肠道间质瘤诊疗中的研究进展. 分子影像学杂志. 2024(11): 1249-1253 .  百度学术
百度学术
2. 谢诚瑶,刘军,万翠霞,凌文峰,陈湘光. 胃间质瘤危险度分级评估中多层螺旋CT的应用价值. 影像研究与医学应用. 2023(22): 110-112 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: