Application Value of Myocardial Extracellular Volume in Preoperative Assessment of TAVI
-
摘要:
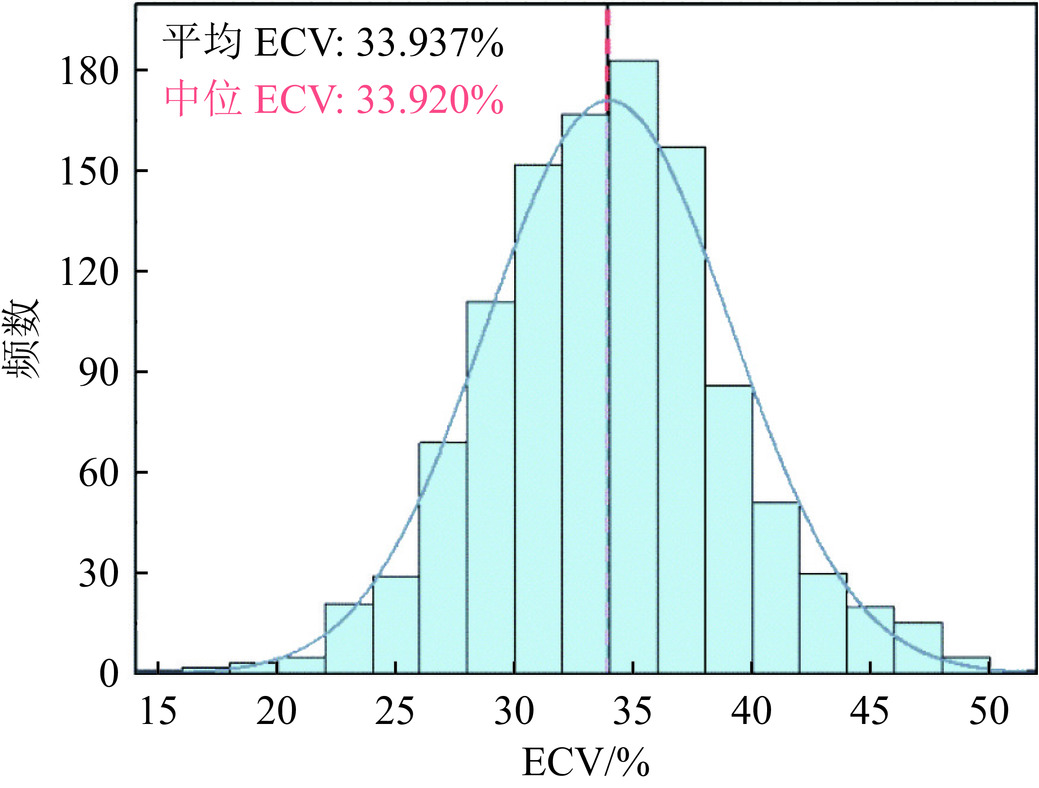
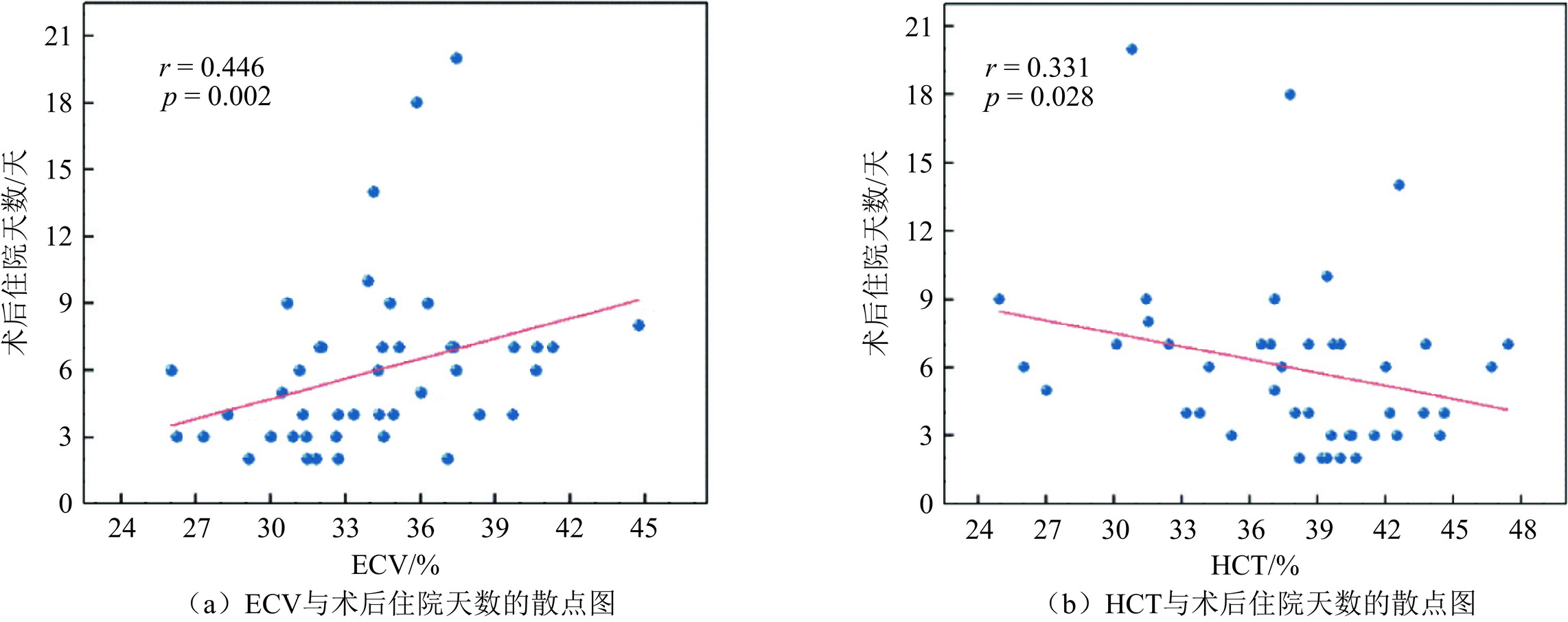
目的:探究双能CT测量的心肌细胞外容积(ECV)在经导管主动脉瓣置入(TAVI)术前风险分层评估中的应用价值。方法:前瞻性纳入2023年6月至2024年6月行TAVI术前CT评估的患者71例。患者均接受了双能CT延迟增强扫描用来计算ECV,根据ECV中位数分为高ECV组和低ECV组。观察各组患者TAVI手术及术后早期恢复情况。结果:测得71例患者的中位ECV为33.92±6.37%,并观察到49例患者最终在本院接受了TAVI手术,高ECV组26例,低ECV组23例。术后高ECV组住院天数、ICU停留天数及心血管不良事件的发生率大于低ECV组,差异具有统计学意义。ECV与术后住院天数呈现正相关(r=0.446, P=0.002),多因素Logistic回归分析显示ECV是患者术后短期发生心血管不良事件的独立危险因素(OR=1.399, P=0.037)。结论:基于双能CT的心脏ECV具有主动脉瓣病变患者TAVI术前风险分层的潜力。
Abstract:Objective: To explore the value of myocardial extracellular volume measured using dual-energy computed tomography (CT) in preoperative risk stratification for transcatheter aortic valve implantation (TAVI). Methods: We prospectively included 71 patients who underwent CT assessment before TAVI between June 2023 and June 2024, all of whom underwent dual-energy CT-delayed enhancement scans to calculate the ECV. Based on the median ECV, the patients were divided into high-ECV and low-ECV groups. The aim was to observe TAVI surgical outcomes and early postoperative recovery among the two patient groups. Results: The median ECV of the 71 patients was 33.92 ± 6.37%. Of these, 49 patients ultimately underwent TAVI surgery at our hospital, with 26 patients in the high-ECV group and 23 patients in the low-ECV group. The postoperative hospital stay, intensive care unit (ICU) stay, and incidence of cardiovascular adverse events were significantly greater in the high-ECV group than in the low-ECV group. Correlation analysis showed a positive correlation between ECV and the length of postoperative hospital stay (r=0.446, P=0.002). Multifactorial logistic regression analysis showed that ECV was an independent risk factor for short-term postoperative adverse cardiovascular events (OR=1.399, P=0.037). Conclusion: Cardiac ECV based on dual-energy CT has potential for preoperative risk stratification in patients with aortic valve disease undergoing TAVI.
-
-
表 1 手术患者基线特征
Table 1 Baseline characteristics of the surgical patients
项目 高ECV组(n=26) 低ECV组(n=23) 统计检验 t/$\chi^2 $/Z P 一般资料 年龄(岁) 68.500±7.431 68.739±7.990 −0.109▲ 0.914 男性n (%) 17(65.400) 18(78.300) 0.991★ 0.319 身体质量指数BMI(kg/m2) 23.592±5.080 25.660±3.899 −1.924▼ 0.054 红细胞压积HCT(%) 36.642±6.006 40.357±3.403 −2.701▲ 0.010 主动脉瓣病变类型 主动脉瓣狭窄n (%) 16(61.500) 15(65.200) 0.175◆ 1.000 主动脉瓣关闭不全n (%) 5(19.200) 4(17.400) 主动脉狭窄伴关闭不全n (%) 5(19.200) 4(17.400) 合并其他疾病 心力衰竭n (%) 18(69.200) 17(73.900) 0.131★ 0.717 冠脉血管病变n (%) 19(73.100) 15(65.200) 0.355★ 0.551 高血压n (%) 16(61.500) 13(56.500) 0.127★ 0.721 糖尿病n (%) 4(15.400) 4(17.400) < 0.001★ 1.00 注:连续变量表示为平均值±标准差或中位数±四分位数间距,并根据情况使用两独立样本 t 检验(▲)或 Mann-Whitney U 检验(▼)进行比较;计数资料表示为计数和百分比,并使用$\chi^2 $(★)或Fisher精确检验(◆)进行比较;*P < 0.05。 表 2 高ECV组与低ECV组患者术后住院天数和ICU停留天数的比较
Table 2 Comparison of postoperative hospitalization days and ICU stays between patients in the high-ECV group and low-ECV group
项目 高ECV组 低ECV组 统计检验 Z P 术后住院天数(天) 7.000±4.500 3.500±2.750 −3.419 0.010 ICU停留天数(天) 2.000±2.000 1.000±1.750 −2.252 0.024 注:变量表示为中位数±四分位数间距,使用Mann-Whitney U 检验进行比较;*P < 0.05。 表 3 高ECV组与低ECV组患者术后短期不良事件的比较
Table 3 Comparison of short-term postoperative adverse events between patients in the high- versus low-ECV group
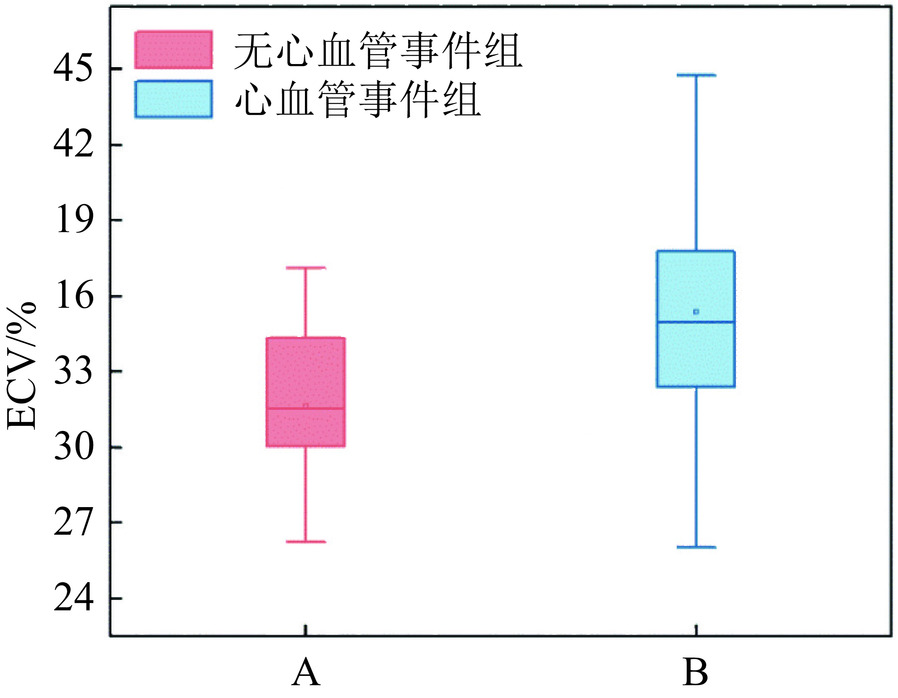
项目 高ECV组 低ECV组 统计检验 $\chi^2 $ P 危重(死亡或意识丧失)n (%) 3(11.500) 0 1.017 0.313 心血管事件n(%) 22(84.600) 10(47.600) 7.318 0.007 肝/肾损伤事件n(%) 11(42.300) 4(19.000) 2.892 0.089 注:变量表示为计数和百分比,并使用$\chi^2 $或连续校正$\chi^2 $的进行比较;*P < 0.05。 表 4 心血管事件组与无心血管事件组患者基线特征
Table 4 Baseline characteristics of the patients in the cardiovascular event versus no-cardiovascular-event group
项目 心血管事件组(n=32) 无心血管事件组(n=15) 统计检验 t/$\chi^2 $ P值 一般资料 年龄 68.531±8.332 70.200±5.087 0.713 0.479 男性n (%) 20(62.500) 13(86.700) 1.813★ 0.178 身体质量指数BMI(kg/m2) 24.598±4.529 25.009±3.295 0.314 0.755 红细胞压积HCT(%) 37.094±5.760 40.233±2.645 2.561 0.014 细胞外容积ECV(%) 35.383±3.971 31.621±2.950 −3.264 0.002 主动脉瓣病变类型 主动脉瓣狭窄n (%) 16(50.000) 14(93.300) 8.256◆ 0.012 主动脉瓣关闭不全n (%) 8(25.000) 0 主动脉狭窄伴关闭不全n (%) 8(25.000) 1(6.700) 合并其它疾病 心力衰竭n (%) 22(68.800) 12(80.000) 0.206★ 0.650 冠脉血管病变n (%) 22(68.800) 10(66.700) < 0.001★ 1.00 高血压n (%) 20(62.500) 8(53.300) 0.356★ 0.551 糖尿病n (%) 4(12.500) 3(20.000) 0.055★ 0.815 注:连续变量表示为平均值±标准差,使用两独立样本的t检验进行比较;计数资料表示为计数和百分比,并使用$\chi^2 $ (★)或 Fisher精确检验(◆)进行比较;*P < 0.05。 表 5 术后心血管不良事件的多因素Logistic回归分析
Table 5 Multifactorial logistic regression analysis of postoperative adverse cardiovascular events
自变量 B OR值(95%) P值 ECV 0.336 1.399(1.020~1.919) 0.037 红细胞压积HCT −0.122 0.886(0.707~1.110) 0.291 主动脉瓣病变类型(狭窄) −2.151 0.116(0.100~1.305) 0.081 -
[1] 中国医师协会心血管内科医师分会结构性心脏病专业委员会. 中国经导管主动脉瓣置换术临床路径专家共识(2021版)[J]. 中国循环杂志, 2022, 37(01): 12-23. DOI: 10.3969/j.issn.1000-3614.2022.01.003. [2] CRIBIER A, ELTCHANINOFF H, BASH A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description[J]. Circulation, 2002, 106(24): 3006-3008. DOI: 10.1161/01.cir.0000047200.36165.b8.
[3] VAHANIAN A, BEYERSDORF F, PRAZ F, et al. 2021 ESC/EACTS guidelines for the management of valvular heart disease developed by the task force for the management of valvular heart disease of the European society of cardiology (ESC) and the European association for cardio-thoracic surgery (EACTS)[J]. European Heart Journal 2022, 43(7): 561-632. DOI: 10.1093/eurheartj/ehab395.
[4] NISHIMURA R A, OTTO C M, BONOW R O, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American college of cardiology/American heart association task force on clinical practice guidelines[J]. Circulation, 2017, 135(25): e1159-e1195. DOI: 10.1161/cir.0000000000000503.
[5] DWECK M R, BOON N A, NEWBY D E. Calcific aortic stenosis: a disease of the valve and the myocardium[J]. Journal of the American College of Cardiology, 2012, 60(19): 1854-1863. DOI: 10.1016/j.jacc.2012.02.093.
[6] WEIDEMANN F, HERRMANN S, STöRK S, et al. Impact of myocardial fibrosis in patients with symptomatic severe aortic stenosis[J]. Circulation, 2009, 120(7): 577-584. DOI: 10.1161/circulationaha.108.847772.
[7] MILANO A D, FAGGIAN G, DODONOV M, et al. Prognostic value of myocardial fibrosis in patients with severe aortic valve stenosis[J]. Journal Thorac Cardiovasc Surgery, 2012, 144(4): 830-837. DOI: 10.1016/j.jtcvs.2011.11.024.
[8] HEIN S, ARNON E, KOSTIN S, et al. Progression from compensated hypertrophy to failure in the pressure-overloaded human heart: structural deterioration and compensatory mechanisms[J]. Circulation, 2003, 107(7): 984-991. DOI: 10.1161/01.cir.0000051865.6123.b7.
[9] HAN D, LIN A, KURONUMA K, et al. Cardiac computed tomography for quantification of myocardial extracellular volume fraction: a systematic review and meta-analysis[J]. Journal of the American College of Cardiology: Cardiovascular Imaging, 2023, 16(10): 1306-1317. DOI: 10.1016/j.jcmg.2023.03.021.
[10] ODA S, EMOTO T, NAKAURA T, et al. Myocardial late iodine enhancement and extracellular volume quantification with dual-layer spectral detector dual-energy cardiac CT[J]. Radiology. Cardiothoracic Imaging, 2019, 1(1): e180003. DOI: 10.1148/ryct.2019180003.
[11] EVERETT R J, TREIBEL A, FUKUI M, et al. Extracellular myocardial volume in patients with aortic stenosis[J]. Journal of the American College of Cardiology, 2020, 75(3): 304-316. DOI: 10.1016/j.jacc.2019.11.032.
[12] 李国荣, 孙阳, 张婷婷. CMR在亚临床期糖尿病心肌病的应用进展[J]. CT理论与应用研究, 2023, 32(6): 836-842. DOI: 10.15953/j.ctta.2022.255. LI G R, SUN Y, ZHANG T T. Advances in the use of CMR in subclinical diabetic cardiomyopathy[J]. CT Theory and Applications, 2023, 32(6): 836-842. DOI: 10.15953/j.ctta.2022.255.
[13] 林青, 王佳佳, 葛英辉. 磁共振T1-mapping及细胞外容积在肥厚型心肌病中的应用价值[J]. 放射学实践, 2021, 36(09): 1095-1100. DOI: 10.13609/j.cnki.1000-0313.2021.09.004. LIN Q, WANG J J, GE Y H. Application of magnetic resonance T1-mapping and extracellular volume in hypertrophic cardiomyopathy[J]. Radiologic Practice, 2021, 36(09): 1095-1100. DOI: 10.13609/j.cnki.1000-0313.2021.09.004.
[14] LEE H J, IM YOUN J C, et al. Myocardial extracellular volume fraction with dual-energy equilibrium contrast-enhanced cardiac CT in non-ischemic cardiomyopathy: a prospective comparison with cardiac MR imaging[J]. Radiology, 2016, 280(1): 49-57. DOI: 10.1148/radiol.2016151289.
[15] 王瑞, 刘新民, 罗太阳, 等. 定量评价慢性心力衰竭患者心肌细胞外容积-双能量CT与心脏磁共振的对照研究[J]. 心肺血管病杂志, 2020, 39(07): 839-842. DOI: 10.3969/j.issn.1007-5062.2020.07.020. [16] WANG R, LIU X M, LUO T Y, et al. Quantitation of extracellular volume in patients with heart failure: dual-energy CT vs. cardiac magnetic resonance[J]. Journal of Cardiovascular and Pulmonary Diseases, 2020, 39(07): 839-842. DOI: 10.3969/j. issn. 1007-5062.2020. 07.020. SUZUKI M, TOBA T, IZAWA Y, et al. Prognostic impact of myocardial extracellular volume fraction assessment using dual-energy computed tomography in patients treated with aortic valve replacement for severe aortic stenosis[J]. Journal of the American Heart Association, 2021, 10(18): e020655. DOI: 10.1161/JAHA.120.020655. DOI: 10.3969/j.issn.1007-5062.2020.07.020. (in Chinese).
[17] AJMONE MARSAN N, DELGADO V, SHAH D J, et al. Valvular heart disease: shifting focus to the myocardium[J]. European Heart Journal, 2023, 44(1): 28-40. DOI: 10.1093/eurheartj/ehac504.
[18] DODD J D, LEIPSIC J A. Evolving developments in cardiac CT[J]. Radiology, 2023, 307(3): e222827. DOI: 10.1148/radiol.222827.
[19] VIGNALE D, PALMISANO A, GNASSO C, et al. Extracellular volume fraction (ECV) derived from pre-operative computed tomography predicts prognosis in patients undergoing transcatheter aortic valve implantation (TAVI)[J]. European Heart Journal Cardiovascular Imaging, 2023, 24(7): 887-896. DOI: 10.1093/ehjci/jead040.
[20] WANG R, LIU X, SCHOEPF U J et al. Extracellular volume quantitation using dual-energy CT in patients with heart failure: comparison with 3T cardiac MR[J]. International Journal of Cardiology, 2018, 268: 236-240. DOI: 10.1016/j.ijcard.2018.05.027.
[21] PAN W, ZHOU D, CHENG L, et al. Aortic regurgitation is more prevalent than aortic stenosis in Chinese elderly population: Implications for transcatheter aortic valve replacement[J]. International Journal of Cardiology, 2015, 201: 547-548. DOI: 10.1016/j.ijcard.2014.10.069.
[22] 郑育聪, 陆敏杰, 尹刚, 等. 心血管MR T1mapping/iECV定量分析在主动脉瓣关闭不全评价中的价值[J]. 中华放射学杂志, 2021, 55(3): 269-275. DOI: 10.3760/cma.j.cn112149-20200312-00378. ZHENG Y C, LU M J, YIN G et al. Quantitative study of cardiac MR T1 mapping/iECV in patients with aortic insufficiency[J]. Chinese Journal of Radiology, 2021, 55(3): 269-275. DOI: 10.3760/cma.j.cn112149-20200312-00378.
[23] HAMDY A, KITAGAWA K, GOTO Y, et al. Comparison of different imaging time points in delayed phase cardiac CT for myocardial scar assessment and extracellular volume fraction estimation in patients with old myocardial infarction[J]. The International Journal of Cardiovascular Imaging, 2019, 35(5): 917-926. DOI: 10.1007/s10554-018-1513-z.
[24] WAYANGANKAR S A, ELGENDY I Y, XIANG Q, et al. Length of stay after transfemoral transcatheter aortic valve replacement: an analysis of the society of thoracic surgeons/American college of cardiology transcatheter valve therapy registry[J]. Journal of the American College of Cardiology: Cardiovascular interventions, 2019, 12(5): 422-430. DOI: 10.1016/j.jcin.2018.11.015.
[25] PATEL K P, SCULLY P R, SABERWAL B, et al. Regional distribution of extracellular volume quantified by cardiac CT in aortic stenosis: insights into disease mechanisms and impact on outcomes[J]. Circulation Cardiovascular Imaging, 2024, 17(5): e015996. DOI: 10.1161/circimaging.123.015996.
[26] 文娟, 王文菊, 赵仕玉, 等. 老年慢性心衰患者红细胞压积、总血红蛋白水平与左心室功能的相关性[J]. 心血管康复医学杂志, 2020, 29(06): 660-664. DOI: 10.3969/j.issn.1008-0074.2020.06.03. WEN J, WANG W J, ZHAO S Y, et al. Correlation among hematocrit, total hemoglobin level and left ventricular function in aged patients with chronic heart failure[J]. Chinese Journal of Cardiovascular Rehabilitation Medicine, 2020, 29(06): 660-664. DOI: 10.3969/j.issn.1008-0074.2020.06.03.
[27] NAGATOMO Y, YOSHIKAWA T, OKAMOTO H, et al. Anemia is associated with blunted response to β-blocker therapy using carvedilol-insights from Japanese chronic heart failure (J-CHF) study[J]. Circulation Journal: official journal of the Japanese Circulation Society, 2018, 82(3): 691-698. DOI: 10.1253/circj. CJ-17-0442. DOI: 10.1253/circj.CJ-17-0442.
[28] KIM P K, HONG Y J, SAKUMA H, et al. Myocardial extracellular volume fraction and change in hematocrit level: MR evaluation by using T1 mapping in an experimental model of anemia[J]. Radiology, 2018, 288(1): 93-98. DOI: 10.1148/radiol.2018171342.
[29] MOON J C, MESSROGHLI D R, KELLMAN P, et al. Myocardial T1 mapping and extracellular volume quantification: A society for cardiovascular magnetic resonance (SCMR) and CMR working group of the European society of cardiology consensus statement[J]. Journal of Cardiovascular Magnetic Resonance: official journal of the Society for Cardiovascular Magnetic Resonance, 2013, 15(1): 92. DOI: 10.1186/1532-429X-15-92.
[30] 宋怡沛, 胡梦瑶, 龚良庚. 基于双能CT细胞外容积定量评估心肌纤维化的临床进展[J]. 临床放射学杂志, 2024, 43(07): 1222-1225. DOI: 10.13437/j.cnki.jcr.2024.07.029.



 下载:
下载: