Correlation between Carotid Artery Fat Density and Atherosclerosis
-
摘要:
目的:本文旨在探讨颈动脉周围脂肪密度与动脉粥样硬化型狭窄及脑缺血事件的相关性,为颈动脉粥样硬化型狭窄的早期识别提供临床参考。方法:回顾性收集盘锦市中心医院2023年1月至2023年8月接受颈动脉计算机断层血管成像(CTA)检查具有完整临床资料有明确诊断的患者,共224侧血管纳入研究,根据是否有动脉粥样硬化分为狭窄组及对照组,狭窄组细分为轻度、中重度狭窄,根据不同年龄划分为Ⅰ、Ⅱ、Ⅲ组,根据患者有无症状分为有症状组及无症状组,探讨血管周围脂肪密度(PFD)与颈动脉粥样硬化型狭窄及脑血管事件的相关性。结果:临床资料中高血压、高血脂及年龄与颈动脉粥样硬化狭窄有关,差异有统计学意义。随颈动脉狭窄程度的加重,颈动脉PFD会逐渐升高。PFD随年龄增长而逐渐增加。相关性分析显示:PFD、年龄、高血压病史、高血脂病史与颈动脉狭窄间存在正相关。狭窄侧血管有症状组PFD高于无症状组,二元Logistic矫正混杂因素后差异仍有统计学意义。结论:颈动脉PFD是颈动脉粥样硬化型狭窄的独立危险因素,且症状性颈动脉狭窄患者颈动脉周围脂肪密度高。
Abstract:Objective: In this study, we aim to investigate the correlation between carotid artery fat density and atherosclerotic stenosis, providing a clinical reference for the early identification of carotid atherosclerotic stenosis. Methods: A retrospective analysis was conducted on patients with complete clinical data and confirmed diagnoses who underwent carotid computed tomography angiography (CTA) at Panjin Central Hospital between January 2023 and August 2023. A total of 224 blood vessels were included in the study. Patients were divided into a stenosis group and a control group based on the presence or absence of atherosclerosis. The stenosis group was further categorized into mild, moderate, and severe stenosis, and classified into Groups I, II, and III based on age. Additionally, patients were classified into symptomatic and asymptomatic groups based on their symptom status, and the correlation between perivascular fat density (PFD), carotid atherosclerotic stenosis, and cerebrovascular events was explored. Results: Hypertension, hyperlipidemia, and age were significantly associated with carotid atherosclerotic stenosis. PFD increased with the degree of stenosis and age. Correlation analysis revealed a positive correlation between PFD, age, history of hypertension, history of hyperlipidemia, and carotid artery stenosis. The PFD in the symptomatic group was higher than in the asymptomatic group, and the difference remained statistically significant after binary logistic correction for confounding factors. Conclusion: Carotid artery PFD is an independent risk factor for carotid atherosclerotic stenosis. Patients with symptomatic carotid artery stenosis exhibit higher carotid fat density compared to their asymptomatic counterparts.
-
随着人民生活水平提高,我国饮食结构及生活习惯发生显著变化,缺血性脑卒中严重危害人类健康,而颈动脉粥样硬化(atherosclerosis,AS)是最主要因素之一[1],AS的发生与炎症有关[2]。脂肪组织遍布于全身,过去脂肪组织被认为仅仅具有保护和储能作用,近年来,研究表明脂肪组织已成为主要内分泌器官:如脂肪因子和炎性细胞因子[3]。白色脂肪组织(white adipose tissue,WAT)中过量的脂质积累会导致脂肪细胞肥大和功能障碍,有害脂肪因子和炎性细胞因子分泌增加到循环中,从而损害血管内皮的功能。与WAT不同,棕色脂肪组织(brown adipose tissue,BAT)可以通过解耦线粒体电子传递链上的氧化来吸收脂质以产生热量,这有助于清除血浆脂质并防止脂质在WAT和其他器官中的储存,功能失调的WAT可能与动脉粥样硬化的发展呈正相关,而BAT的激活可以防止动脉粥样硬化的发生[4]。而血管周围脂肪组织(perivascular adipose tissue,PVAT)是根据解剖部位命名的一种围绕于血管周围的脂肪组织,PVAT的特征与BAT和WAT相类似,在脉管系统中的不同位置,PVAT由不同类型细胞构成,在脉管系统中的不同位置,PVAT由不同类型细胞构成,如肠系膜动脉、颈动脉和股动脉等小动脉周围的PVAT大多为WAT样,而冠状动脉周围脂肪组织更像米色脂肪(beAT)[5]。研究表明冠脉周围脂肪组织密度的改变与炎症过程密切相关。通过CT成像评估心外脂肪组织的密度,可以提供有价值的信息,揭示其结构和代谢特征。脂肪组织的变化对于揭示心外脂肪组织与冠状动脉粥样硬化发生和进展之间错综复杂的关系有重要贡献[6-8]。但关于颈动脉周围脂肪组织的临床意义尚不明确,因此展开本研究。
1. 资料与方法
1.1 研究对象
回顾性分析2023年1月至2023年8月在我院接受颈动脉CT造影检查患者资料,根据是否有颈动脉粥样硬化分为狭窄组及对照组,依据狭窄程度不同分为轻度狭窄及中重度狭窄,将患者年龄 < 45岁定义为Ⅰ组,45~64岁定义为Ⅱ组,≥65岁定义为Ⅲ组[9]。
纳入标准:①明确颈动脉粥样硬化型狭窄(本实验颈动脉狭窄仅包括颈总动脉及颈内动脉颅外段狭窄患者),其中111例狭窄血管中有65例为颈总动脉狭窄测量颈总动脉PFD,46例颈内动脉狭窄测量颈内动脉PFD,对照组血管统一测量颈动脉分叉处PFD;②有完整临床资料的患者(包括年龄、性别、高血压、高血糖、高血脂、冠心病、高同型半胱氨酸及吸烟饮酒病史)。排除标准:①栓子来源明确患者,其他非动脉粥样硬化导致狭窄;②入院后已行静脉溶栓或血管内治疗患者;③入院前一月内曾发生急慢性感染且使用抗生素药物治疗患者;④颈动脉闭塞患者;⑤临床资料缺失患者。
颈动脉狭窄程度测量采用北美颈动脉狭窄分级,狭窄率=(狭窄远端正常动脉内径-狭窄最明显处动脉内径)/狭窄远端正常动脉内径×100%。依据狭窄程度将其分为:轻度狭窄( < 30%)、中重度狭窄(30%~99%)[10]。
1.2 方法
1.2.1 仪器设备与扫描参数
受检者仰卧检查床,头部放至头架内,头先进,螺旋式扫描,扫描范围从主动脉弓扫至颅顶。扫描参数:管电压100 kV,管电流321 mA,螺距
0.9937 mm,层厚5 mm。所有患者采用双筒高压注射器,经肘静脉注入碘海醇溶液80 mL,流率5 mL/s,使用对比剂团注追踪技术自动触发扫描感兴趣区常置于主动脉弓,设定阈值80~100 HU,到达阈值后触发检查,触发后延迟2~3 s。1.2.2 图像与数据处理
研究所需数据需要由两名具有10年诊断经验的临床医生评估,所有操作在双盲下进行。CTA测量数据包括颈动脉血管周围脂肪密度(perivascular fat density,PFD),结果以亨斯菲尔德单位(Hounsfield Units,HU)表示,使用预定义的图像设置窗宽500 HU;窗位100 HU在原始CT增强横断位图像上测量,有多处颈动脉斑块患者选取狭窄最严重的层面进行分析,未狭窄患者选择分叉处进行分析,在血管周围脂肪组织中勾画出2个感兴趣区域(ROI 2.5 mm2),ROI距颈动脉壁外缘至少1 mm,以避免动脉壁和周围组织等结构的干扰[11]。
1.3 统计学方法
对收集的所有数据使用IBM SSPS 25.0和R4.3.1统计学软件进行分析,计量资料符合正态分布使用t检验,用均数±标准差表示,不符合正态分布使用非参数秩和检验分析数据,用中位数(四分位间距)表示;计数资料组间差异使用卡方检验,计数资料用自然数与百分数表示。利用Spearman相关分析各变量间关系,采用二元Logistic回归分析影响颈动脉粥样硬化狭窄的独立影响因素,P < 0.05差异有统计学意义,利用ICC检验两名医生测量数据的一致性。
2. 结果
2.1 基线资料
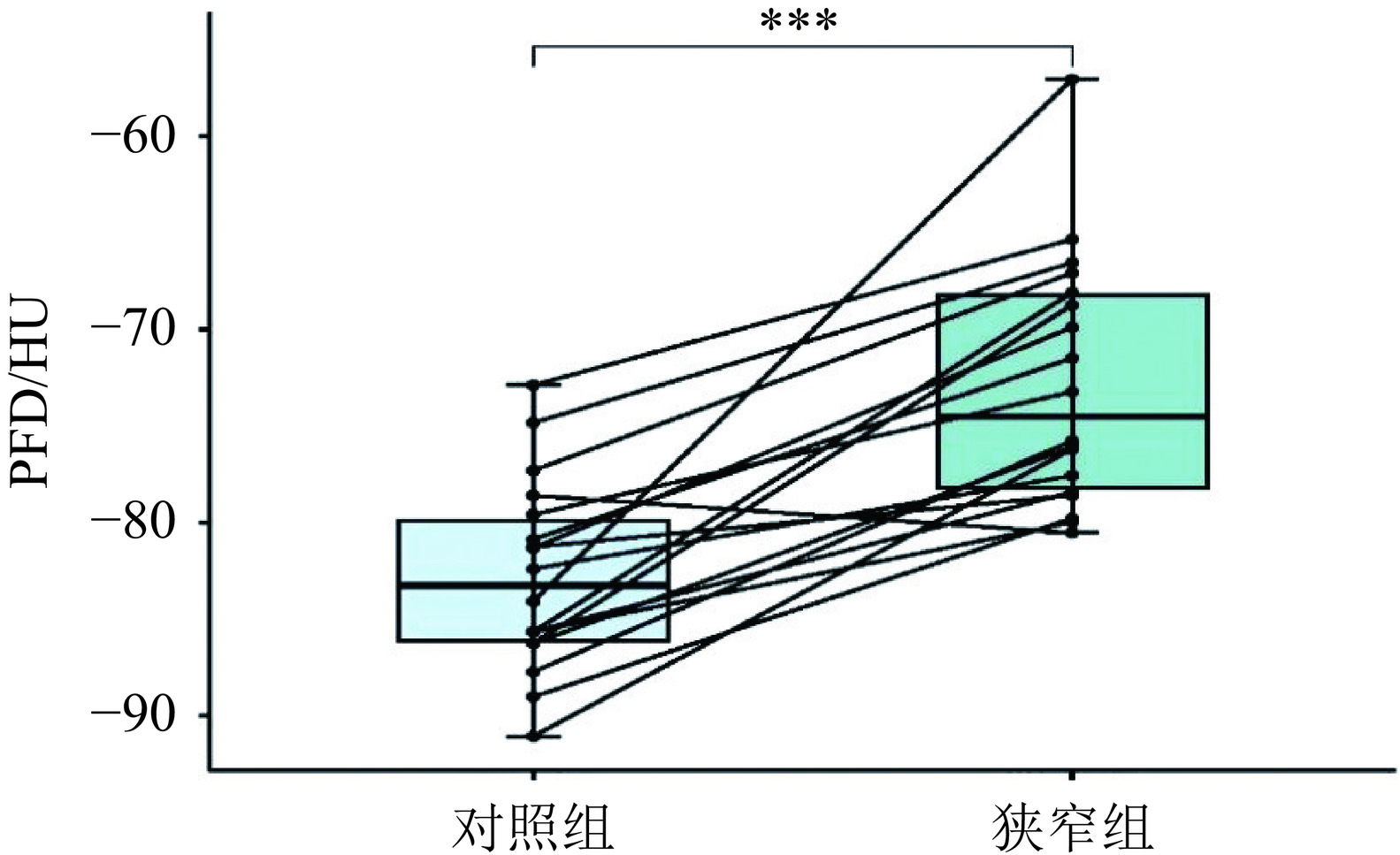
本研究依据纳入标准选入424例血管,依据排除标准排除临床资料不完整186例血管,颈动脉闭塞及接受溶栓治疗血管14例,共选入224例血管,狭窄组111例(49.55%),对照组113例(50.45%),两组比例近似1∶1。除年龄为连续数值型变量外,其余临床资料均为分类变量,进行卡方检验,其中性别、高血糖、高同型半胱氨酸、冠心病病史、吸烟饮酒病史差异无统计学意义;而高血压、高血脂病史差异有统计学意义。患者入院时年龄,PFD为非正态分布,采用Mann-Whitney U 检验,差异有统计学意义(表1)。
表 1 患者一般情况比较Table 1. Comparison of general conditions of patients指标 狭窄组(n=111) 对照组(n=113) Z/$\chi^2 $ P 性别,男性 73.87%(82/29) 63.72%(72/41) 2.689 0.101 年龄/岁 65(57,72) 57(46,65.5) 5.026 < 0.001 高血压 70.27%(78/33) 50.44%(57/56) 9.193 0.002 糖尿病 16.22%(18/93) 20.35%(23/90) 0.641 0.423 高同型半胱氨酸 7.21%(8/103) 2.65%(3/110) 2.485 0.115 高血脂 14.41%(16/95) 5.31%(6/107) 5.241 0.022 烟酒史 12.61%(14/97) 6.19%(7/106) 2.715 0.099 冠心病 13.51%(15/96) 7.96%(9/104) 1.802 0.179 PFD/HU −71.61(−77.55,−66.84) −82.96(−86.23,−79.61) 10.334 < 0.001 2.2 不同狭窄程度PFD比较
一致性分析显示两名医师测量的PFD值一致性较高,差异有统计学意义。狭窄组按照颈动脉狭窄程度分型分为轻度狭窄、中重度狭窄,设置无狭窄患者为对照组,3组颈动脉PFD均满足正态分布,采用非参数秩和检验,中重度狭窄组PFD > 轻度狭窄组PFD > 对照组PFD,P < 0.001,差异有统计学意义,其中两两比较,差异均有统计学意义(表2)。
表 2 不同狭窄程度PFD比较Table 2. Comparison of PFD across different degrees of stenosis组别 对照组(n=113) 轻度狭窄组(n=81) 中重度狭窄(n=30) H P PFD −82.96(−86.32,−79.61) −75.08(−77.96,−69.38) ▲ −65.64(−69.37,−59.61)*# 114.911 < 0.001 注:*表示对照组与中重度狭窄组相比P < 0.05;#表示轻度狭窄组与中重度狭窄组相比P < 0.05;▲表示对照组与轻度狭窄组相比P < 0.05。 研究中考虑到其他因素的影响,提出探讨同一患者的PFD与动脉粥样硬化狭窄关系,在已收集数据中寻找仅有单侧存在颈动脉粥样狭窄的患者共18名患者,36侧血管。以显著性水平α=0.05,采用配对t检验的功效分析得出最低样本量需要总样本量11例,即22例血管,本研究样本量满足要求。按有无狭窄分狭窄组和对照组,两组数据满足正态分布,故采用配对t检验,P值 < 0.001,差异有统计学意义(表3)。
表 3 同一患者狭窄组与对照组PFD比较Table 3. Comparison of PFD between stenosis and control groups in the same patients组别 狭窄组(n=18) 对照组(n=18) t P值 PFD均值 −72.79±6.43 −82.79±4.90 6.59 < 0.001 2.3 年龄与PFD关系
将收集的所有颈周脂肪密度PFD按照年龄分为Ⅰ、Ⅱ、Ⅲ 3组,分析PFD与年龄的关系。3组PFD呈偏态分布,同样采用Kruskal-Wallis H检验,P < 0.001,差异有统计学意义,其中两两相比,Ⅰ组与Ⅱ组相比,P=0.04;Ⅰ组与Ⅲ组相比,P < 0.001;Ⅱ组与Ⅲ组相比,P=0.047,各组间P < 0.05,每两组间PFD均存在显著差异(表4)。
表 4 不同年龄段PFD比较Table 4. Comparison of PFD across different age groupsⅠ组(n=30) Ⅱ组(n=103) Ⅲ组(n=91) H P值 PFD −82.46(−86.14,−78.55) −78.75(−83.69,−72.69)▲ −76.53(−80.01,−67.82)*# 17.743 < 0.001 注:Ⅰ组与Ⅲ组相比*P < 0.05;Ⅱ组与Ⅲ组相比#P < 0.05;Ⅰ组与Ⅱ组相比▲P < 0.05。 2.4 颈动脉狭窄危险因素分析
Spearman相关性分析结果显示PFD与颈动脉狭窄间存在显著相关关系,P < 0.01,相关系数为0.692 > 0,这说明两者间有较强正相关关系。同样年龄与颈动脉粥样硬化型狭窄相关系数为0.337,P < 0.01,存在轻度正相关。高血压病史、高血脂病史同样与颈动脉狭窄存在正相关,P < 0.05。(表5)
表 5 各指标与颈动脉狭窄的相关性分析Table 5. Correlation analysis between various indices and carotid artery stenosis指标 r P PFD 0.692 < 0.001 年龄 0.337 < 0.001 性别 0.110 0.101 冠心病 0.090 0.179 高血脂 0.153 0.022 高同型半胱氨酸 0.105 0.115 糖尿病 −0.053 0.426 烟酒史 0.110 0.099 高血压 0.203 0.002 2.5 二元Logistic回归分析
采用Logistic分析导致颈动脉粥样硬化狭窄发生的危险因素,调整混杂因素前PFD(OR=1.366,95% CI:1.258~1.485,P < 0.001)、年龄(OR=1.070,95% CI:1.042~1.099,P < 0.001)纳入年龄、高血压、高血脂病史、分叉类型及PFD构建多因素Logistic回归模型,结果显示调整混杂因素后PFD(OR=1.357,95%CI:1.242~1.484,P < 0.001)、年龄(OR=1.045,95% CI:1.009~1.083,P=0.014)是颈动脉粥样硬化型狭窄发生的危险因素(表6)。
表 6 二元Logistic回归分析Table 6. Binary logistic regression analysis调整前 调整后 OR 95%CI P OR 95%CI P PFD 1.366 1.258-1.485 < 0.001 1.357 1.242-1.484 < 0.001 年龄 1.070 1.042-1.099 < 0.001 1.045 1.009-1.083 0.014 2.6 ROC曲线
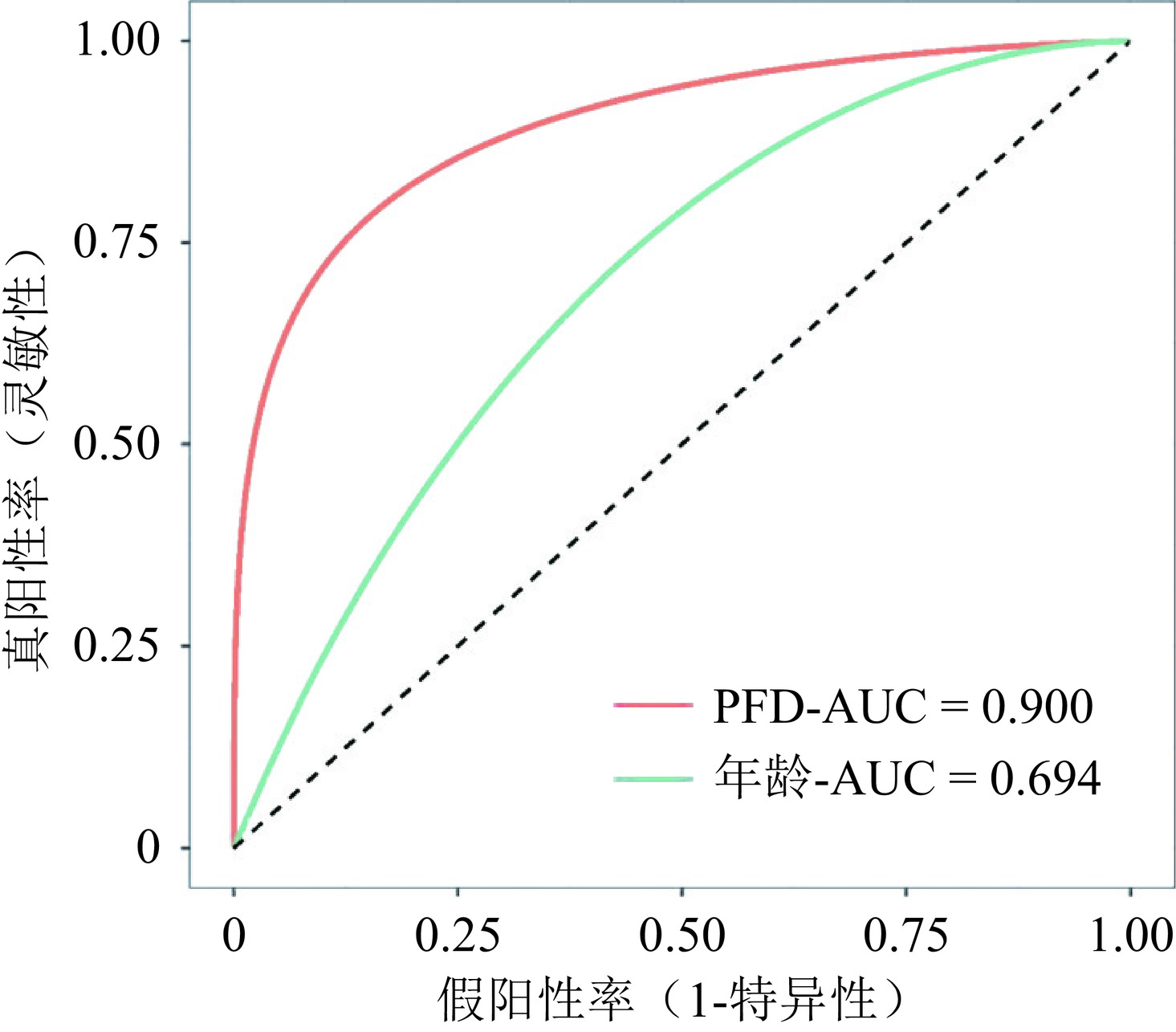
ROC曲线结果显示,颈动脉PFD ROC曲线下面积(AUC=0.900,95% CI:0.859~0.940,P < 0.001),敏感度为0.892,特异度为0.796;年龄(AUC=0.694,95% CI:0.626~0.763,P < 0.001),敏感度为0.703,特异度为0.628。颈动脉PFD及年龄对颈动脉狭窄的发生有较高预测诊断价值。
2.7 PFD与脑血管事件的关系
在狭窄组中,有症状患者血管55例,无症状患者56例。在对照组中,有症状患者血管47例,无症状患者66例。两组数据均不满足正态分布,故采用非参数秩和检验,对照组中有症状与无症状患者颈动脉PFD差异无统计学意义。狭窄组中有症状患者颈动脉PFD高于无症状患者,P=0.02,通过Logistic回归分析,校正混杂因素前(OR=1.060,95% CI:1.010~1.113,P=0. 019),校正混杂因素后,两组间PFD差异仍有统计学意义(OR=1.073,95% CI:1.013~1.136,P=0. 017)。
表 7 有症状与无症状患者PFD均值比较Table 7. Comparison of mean PFD between symptomatic and asymptomatic patientsPFD 有症状 无症状 Z P 狭窄组 −68.74(−76.96,−64.52) −74.97(−77.71,−69.43) −2.327 0.020 对照组 −83.00(−86.25,−79.91) −82.74(−86.05,−79.00) −0.367 0.714 表 8 狭窄组中有症状与无症状患者二元Logistic回归Table 8. Binary logistic regression analysis of symptomatic and asymptomatic patients in the stenosis group调整前 调整后 OR 95%CI P OR 95%CI P PFD 1.060 1.010-1.113 0.019 1.073 1.013-1.136 0.017 3. 讨论
目前,我国脑卒中致残率高居各类疾病之首[12]。在缺血性脑血管病中,以大动脉粥样硬化为主要病因的占绝大多数。而颈动脉粥样硬化性狭窄是最常见的情况[13]。研究表明约20%的缺血性脑卒中及短暂脑缺血发作患者伴有颈动脉狭窄[14]。
颈动脉硬化性狭窄的发生率随年龄的增长而增高,且与性别、高血压、糖尿病、高血脂、吸烟等疾病史有关[15]。在本研究中狭窄组患者的年龄高于对照组,这强化了动脉粥样硬化是一种动脉慢性疾病过程的假设。两组间患者高血压、高血脂病史差异有统计学意义,但性别、吸烟、糖尿病等未表现出明显差异。这可能与收集样本量太少有关。
血管周围脂肪组织用于调节血管分泌及舒缩功能,两者之间的关系是复杂的双向的。目前关于国内外对脂肪密度的研究多集中于冠状动脉,Akihiro等[16]研究发现破裂斑块侧3条动脉平均冠脉PVAT衰减高于斑块侵蚀患者。Haruhito等[17]表明高PCAT衰减患者与低PCAT衰减患者相比具有更高心肌梗死及不稳定型心绞痛易感率。而本研究以颈动脉为切入点展开。本研究结果显示颈动脉PFD随狭窄程度加重而逐渐升高。血管周围脂肪组织通过内分泌和旁分泌的作用释放细胞炎症因子调控血管功能[18-19]。生理状态下,脂肪组织释放一氧化氮(nitric oxide,NO)及脂联素抵抗血管动脉粥样硬化的发生[20]。但当血管壁损伤时,血管壁释放的炎症因子,不仅能抑制周围脂肪的生成还可以刺激周围组织中脂肪的分解,导致血管周围脂肪细胞中脂质含量的降低,动脉周围会形成不同梯度的脂肪密度[21],相应水含量会增高,通过改变血管周围脂肪中脂质与水的占比,造成周围脂肪组织对CT衰减增加,表现为CT值的增加[22],这与本研究中狭窄侧颈动脉周围脂肪密度增加的结果相吻合。研究过程中我们选取仅单侧颈动脉狭窄的患者,左右两侧进行配对t检验直接排除了年龄、性别及患者自身其他疾病的干扰,发现同一患者狭窄侧的PFD衰减高于非狭窄侧。提示炎症反应可能蔓延到斑块周围的脂肪组织中,这与Hediyeh等[11]的结果相符。
研究表明[23-25]卒中患者狭窄侧颈动脉周围脂肪密度均值和最大值均高于对侧,受血管周围脂肪影响的上游大动脉的结构和功能变化可能会改变下游小血管的血流动力学[26]。一项病理学研究显示较高密度的周围脂肪与冠脉斑块发生有关[27],斑块分为稳定斑块和脆弱斑块,两者在脂质积累量上有所区别并由不同类别脂蛋白决定,而这些离不开血管炎症的参与,尤其是参与脂蛋白摄取和代谢、生长因子分泌的巨噬细胞的浸润[28-32]。而炎症的增加通过诱导增值和以旁分泌方式抑制前脂肪细胞的分化,使脂肪组织脂质相转化为水相,表现为CT值的升高[33];同时在本研究中我们还发现在颈动脉狭窄侧,有症状患者的颈动脉周围脂肪密度高于无症状患者,与Baradaran结果一致[34],这表明可以将颈动脉周围脂肪密度作为反映颈动脉炎症的敏感指标,并且有理由推测颈动脉周围脂肪密度的改变与危险斑块间存在一定联系。本研究还探讨不同年龄组间PFD的关系,发现整体及组间PFD比较均有统计学意义,这表示随着年龄增长颈周脂肪密度的衰减逐渐在增加,斑块发生率逐步提高,这与先前的研究相符[35]。Spearman相关性分析结果显示年龄与颈动脉斑块发生和颈动脉PFD间存在正相关,但相关性较弱,而且本实验中Logistic回归显示年龄的OR值为1.044,略微高于1.0,这可能因为本实验样本量相对较少,未来需要扩大样本量进一步研究。
另外,本研究存在一定不足之处。此研究为回顾性研究,而且纳入对象多有一定的临床症状,无法推断颈动脉周围PFD的衰减与颈动脉狭窄发生的因果关系。综上所述,颈动脉PFD是颈动脉粥样硬化型狭窄的独立危险因素,症状性颈动脉狭窄患者颈动脉周围脂肪密度高于无症状患者,PFD对颈动脉粥样硬化型狭窄的发生有较高预测诊断价值。
-
表 1 患者一般情况比较
Table 1 Comparison of general conditions of patients
指标 狭窄组(n=111) 对照组(n=113) Z/$\chi^2 $ P 性别,男性 73.87%(82/29) 63.72%(72/41) 2.689 0.101 年龄/岁 65(57,72) 57(46,65.5) 5.026 < 0.001 高血压 70.27%(78/33) 50.44%(57/56) 9.193 0.002 糖尿病 16.22%(18/93) 20.35%(23/90) 0.641 0.423 高同型半胱氨酸 7.21%(8/103) 2.65%(3/110) 2.485 0.115 高血脂 14.41%(16/95) 5.31%(6/107) 5.241 0.022 烟酒史 12.61%(14/97) 6.19%(7/106) 2.715 0.099 冠心病 13.51%(15/96) 7.96%(9/104) 1.802 0.179 PFD/HU −71.61(−77.55,−66.84) −82.96(−86.23,−79.61) 10.334 < 0.001 表 2 不同狭窄程度PFD比较
Table 2 Comparison of PFD across different degrees of stenosis
组别 对照组(n=113) 轻度狭窄组(n=81) 中重度狭窄(n=30) H P PFD −82.96(−86.32,−79.61) −75.08(−77.96,−69.38) ▲ −65.64(−69.37,−59.61)*# 114.911 < 0.001 注:*表示对照组与中重度狭窄组相比P < 0.05;#表示轻度狭窄组与中重度狭窄组相比P < 0.05;▲表示对照组与轻度狭窄组相比P < 0.05。 表 3 同一患者狭窄组与对照组PFD比较
Table 3 Comparison of PFD between stenosis and control groups in the same patients
组别 狭窄组(n=18) 对照组(n=18) t P值 PFD均值 −72.79±6.43 −82.79±4.90 6.59 < 0.001 表 4 不同年龄段PFD比较
Table 4 Comparison of PFD across different age groups
Ⅰ组(n=30) Ⅱ组(n=103) Ⅲ组(n=91) H P值 PFD −82.46(−86.14,−78.55) −78.75(−83.69,−72.69)▲ −76.53(−80.01,−67.82)*# 17.743 < 0.001 注:Ⅰ组与Ⅲ组相比*P < 0.05;Ⅱ组与Ⅲ组相比#P < 0.05;Ⅰ组与Ⅱ组相比▲P < 0.05。 表 5 各指标与颈动脉狭窄的相关性分析
Table 5 Correlation analysis between various indices and carotid artery stenosis
指标 r P PFD 0.692 < 0.001 年龄 0.337 < 0.001 性别 0.110 0.101 冠心病 0.090 0.179 高血脂 0.153 0.022 高同型半胱氨酸 0.105 0.115 糖尿病 −0.053 0.426 烟酒史 0.110 0.099 高血压 0.203 0.002 表 6 二元Logistic回归分析
Table 6 Binary logistic regression analysis
调整前 调整后 OR 95%CI P OR 95%CI P PFD 1.366 1.258-1.485 < 0.001 1.357 1.242-1.484 < 0.001 年龄 1.070 1.042-1.099 < 0.001 1.045 1.009-1.083 0.014 表 7 有症状与无症状患者PFD均值比较
Table 7 Comparison of mean PFD between symptomatic and asymptomatic patients
PFD 有症状 无症状 Z P 狭窄组 −68.74(−76.96,−64.52) −74.97(−77.71,−69.43) −2.327 0.020 对照组 −83.00(−86.25,−79.91) −82.74(−86.05,−79.00) −0.367 0.714 表 8 狭窄组中有症状与无症状患者二元Logistic回归
Table 8 Binary logistic regression analysis of symptomatic and asymptomatic patients in the stenosis group
调整前 调整后 OR 95%CI P OR 95%CI P PFD 1.060 1.010-1.113 0.019 1.073 1.013-1.136 0.017 -
[1] LIU H H, JING J, WANG A X, ET AL. Stroke recurrence and antiplatelets in posterior versus anterior circulation minor stroke or transient ischemic attack[J]. Stroke, 2023, 54(4): 964-972. DOI: 10.1161/STROKEAHA.122.041738.
[2] WAKSMAN R, MERDLER I, PATEL P, ET AL. Targeting inflammation in atherosclerosis: overview, strategy and directions[J]. EuroIntervention, 2024, 20(1): 32-44. DOI: 10.4244/EIJ-D-23-00606.
[3] YUSUKE A, KAZUTAKA U, SEITARO N, ET AL. Beiging of perivascular adipose tissue regulates its inflammation and vascular remodeling[J]. Nature Communications, 2022, 13(1): 5117. DOI: 10.1038/s41467-022-32658-6.
[4] QI X Y, QU S L, XIONG W H, ET AL. Perivascular adipose tissue (PVAT) in atherosclerosis: a double-edged sword[J]. Cardiovascular diabetology, 2018, 17(1): 1-20. DOI: 10.1186/s12933-017-0656-x.
[5] CHENG C K, DING H, JIANG M, ET AL. Perivascular adipose tissue: Fine-tuner of vascular redox status and inflammation[J]. Redox Biology, 2023, 20(4): 102683.
[6] 冉值祯, 马跃, 侯阳. 心外膜脂肪组织密度对冠状动脉粥样硬化性心脏病的诊断价值[J]. 中国现代医学杂志, 2022, 32(1): 47-51. DOI: 10.3969/j.issn.1005-8982.2022.01.009. RAN Z Z, MA Y, HOU Y. Diagnostic value of epicardial adipose tissue density in coronary atherosclerotic heart disease[J]. China Journal of Modern Medicine, 2022, 32(1): 47-51. DOI: 10.3969/j.issn.1005-8982.2022.01.009. (in Chinese).
[7] MA R, VAN ASSEN M, SIDORENKOV G, ET AL. Relationships of pericoronary and epicardial fat measurements in male and female patients with and without coronary artery disease[J]. European Journal of Radiology, 2023, 169: 111154. DOI: 10.1016/j.ejrad.2023.111154.
[8] MANUBOLU V S, LU J Y, MONTANO B, et al. Exploring the relationship between epicardial fat and coronary plaque burden and characteristics: Insights from cardiac CT imaging[J]. The International Journal of Cardiovascular Imaging. 2024, 40(9): 1951-1959.
[9] 孙万京, 仲玲珊, 李春阳, 等. 颈动脉分叉角同颈内动脉起始处粥样硬化的相关性[J]. 影像研究与医学应用, 2019, 3(7): 221. DOI: 10.3969/j.issn.2096-3807.2019.07.155. SUN W J, ZHONG L S, LI C Y, ET AL. Correlation between carotid bifurcation Angle and atherosclerosis at the beginning of internal carotid artery[J]. Imaging Research and Medical Applicati on, 2019, 3(7): 221. DOI: 10.3969/j.issn.2096-3807.2019.07.155. (in Chinese).
[10] 余苗, 孟闫凯, 徐含波, 等. 颈动脉周围脂肪密度与急性缺血性脑卒中事件的相关性研究[J]. 临床放射学杂志, 2023, 42(6): 910-914. YU M, MENG Y K, XU H B, ET AL. Correlation between peripheral carotid fat density and acute ischemic stroke[J]. Journal of Clinical Radiology, 2023, 42(6): 910-914. (in Chinese).
[11] HEDIYEH B, K P M, PRANEIL P, ET AL. Association between carotid artery perivascular fat density and cerebrovascular ischemic events[J]. Journal of the American Heart Association, 2018, 7(24): 10383-10387.
[12] 中国心血管健康与疾病报告2022概要[J]. 中国循环杂志, 2023, 38(6): 583-612. The Writing Committee of the Report on Cardiovascular Health and Diseases in China[J]. Chinese Circulation Journal, 2023, 38(6): 583-612. (in Chinese).
[13] FLAHERTY M L, KISSELA B, KHOURY J C, ET AL. Carotid artery stenosis as a cause of stroke[J]. Neuroepidemiology, 2013, 40(1): 36-41. DOI: 10.1159/000341410.
[14] CHENG S F, BROWN M M, SIMISTER R J, ET AL. Contemporary prevalence of carotid stenosis in patients presenting with ischaemic stroke[J]. The British Journal of Surgery, 2019, 106(7): 872-878. DOI: 10.1002/bjs.11136.
[15] SONG P G, FANG Z, WANG H Y, ET AL. Global and regional prevalence, burden, and risk factors for carotid atherosclerosis: A systematic review, meta-analysis, and modelling study[J]. Lancet Glob Health, 2020, 8(5): 721-729. DOI: 10.1016/S2214-109X(20)30117-0.
[16] AKIHIRO N, TOMOYO S, MAKOTO A, ET AL. Plaque Rupture, compared with plaque erosion, is associated with a higher level of pancoronary inflammation[J]. JACC. Cardiovascular imaging, 2021, 15(5): 828-839.
[17] HARUHITO Y, TOMOYO S, KEISHI S, ET AL. Coronary inflammation and plaque vulnerability: A coronary computed tomography and optical coherence tomography study[J]. Circulation: Cardiovascular Imaging, 2023, 10(1): 59-63.
[18] CASSIE H, I A G. The pathobiology of perivascular adipose tissue (PVAT), the fourth layer of the blood vessel wall[J]. Cardiovascular pathology: the official journal of the Society for Cardiovascular Pathology, 2022, 61(1): 459-461.
[19] CAI M, ZHAO D, HAN X, ET AL. The role of perivascular adipose tissue-secreted adipocytokines in cardiovascular disease[J]. Frontiers in immunology, 2023, 14(1): 49-51.
[20] RYSZARD N, J T G. Perivascular adipose tissue inflammation in vascular disease[J]. British journal of pharmacology, 2017, 174(20): 3496-3513. DOI: 10.1111/bph.13705.
[21] BERMAN DS, KWIECINSKI J. Imaging coronary inflammatory risk[J]. JACC. Cardiovascular imaging, 2021, 15(3): 472-475.
[22] OIKONOMOU E K, ANTONOPOULOS A S, SCHOTTLANDER D, ET AL. Standardized measurement of coronary inflammation using cardiovascular computed tomography: integration in clinical careas a prognostic medical device[J]. Cardiovascular research, 2021, 117(13): 2677-2690.
[23] HU X, CHEN J, FU H, ET AL. Association between carotid artery perivascular fat density and embolic stroke of undetermined source[J]. Frontiers in Neurology, 2022, 12(1): 765962.
[24] 牛稳, 邱晓晖, 刘艺超. 颈动脉粥样硬化狭窄的血管周围脂肪密度与脑梗死之间的关系[J]. 实用医学杂志, 2023, 39(1): 103-108. NIU W, QIU X H, LIU Y C. The relationship between perivascular fat density and cerebral infarction in carotid atherosclerosis[J]. Journal of Practical Medicine, 2023, 39(1): 103-108. (in Chinese).
[25] SABA L, ZUCCA S, GUPTA A, ET AL. Perivascular fat density and contrast plaque enhancement: does a correlation exist[J]. AJNR Am J Neuroradiol, 2020, 41(8): 1460-1465 DOI: 10.3174/ajnr.A6710.
[26] ZHANG D H, JIN J L, ZHU C F, ET AL. Association between carotid artery perivascular fat density and cerebral small vessel disease[J]. Aging, 2021, 13(14): 839-851.
[27] HENRICHOT E, JUGE-AUBRY C E, PERNIN A, ET AL. Production of chemokines by perivascular adipose tissue: A role in the pathogenesis of atherosclerosis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2005, 25(12): 2594-2599. DOI: 10.1161/01.ATV.0000188508.40052.35.
[28] USUI E, MATSUMURA M, MINTZ G S, ET AL. Clinical outcomes of low-intensity area without attenuation and cholesterol crystals in non-culprit lesions assessed by optical coherence tomography[J]. Atherosclerosis, 2021, 332(1): 41-47.
[29] OIKONOMOU E K, MARWAN M, DESAI M Y, ET AL. Non-invasive detection of coronary inflammation using computed tomography and prediction of residual cardiovascular risk (the CRISP CT study): a post-hoc analysis of prospective outcome data[J]. Lancet, 2018, 392(10151): 929-939. DOI: 10.1016/S0140-6736(18)31114-0.
[30] 应伟峰, 陈穹, 张莹, 等. 冠状动脉易损与非易损斑块的冠周与主动脉根部心外膜脂肪CT衰减指数比值差异[J]. 中国医学影像学杂志, 2023, 31(8): 818-823. DOI: 10.3969/j.issn.1005-5185.2023.08.005. YING W F, CHEN Q, ZHANG Y, ET AL. The difference of CT attenuation index ratio between pericardial and epicardial fat in vulnerable and non-vulnerable coronary plaques[J]. Chinese Journal of Medical Imaging, 2023, 31(8): 818-823. DOI: 10.3969/j.issn.1005-5185.2023.08.005.
[31] MUSHENKOVA N V, SUMMERHILL V I, ZHANG D, ET AL. Current advances in the diagnostic imaging of atherosclerosis: insights into the pathophysiology of vulnerable plaque[J]. International Journal of Molecular Sciences, 2020, 21(8): 2992. DOI: 10.3390/ijms21082992.
[32] 李静, 乔建民, 王俊奇, 等. 心外膜及心周脂肪体积与颈动脉粥样斑块的关系[J]. CT理论与应用研究, 2017, 26(6): 761-768. LI J, QIAO J M, WANG J Q, ET AL. Relationship between epicardial and pericardiac fat volume and carotid atherosclerotic plaque[J]. CT Theoretical and Applied Research, 2017, 26(6): 761-768.
[33] ANTONOPOULOS AS, SANNA F, SABHARWAL N, ET AL. Detecting human coronary inflammation by imaging perivascular fat[J]. Science Translational Medicine, 2017, 9(398): 2658. DOI: 10.1126/scitranslmed.aal2658.
[34] BARADARAN H, MYNENI P K, PATEL P, ET AL. Association between carotid artery perivascular fat density and cerebrovascular ischemic events[J]. Journal of the American Heart Association, 2018, 7(24): e010383. DOI: 10.1161/JAHA.118.010383.
[35] XIA R, FAN S, JIAN H, ET AL. Impact of carotid hemodynamics on carotid plaque location: Age difference[J]. Neuro endocrinology letters, 2023, 44(6): 399-409.



 下载:
下载: