Diagnosis of Lynch Syndrome-associated Prostatic Small Cell Neuroendocrine Carcinoma: A Clinical Case Analysis
-
摘要:
林奇综合征是一种常染色体显性遗传的癌症综合征,发病机制为DNA错配修复基因中的生殖系突变。林奇综合征相关前列腺小细胞神经内分泌癌是一种非常罕见的林奇综合征肠外癌症,本文报告1例54岁的男性林奇综合征患者并发前列腺肿瘤,病理证实为前列腺小细胞神经内分泌癌,伴有MSH2和PMS2蛋白表达缺失。本文结合临床特征和影像对该病进行综述,以提高对该病的临床认识,为该病的早期诊断提供思路。
-
关键词:
- 林奇综合征相关前列腺小细胞神经内分泌癌 /
- 诊断 /
- 临床特征 /
- 影像学表现
Abstract:Lynch syndrome is an autosomal dominant hereditary cancer syndrome characterized by germline mutations in DNA mismatch repair genes. Lynch syndrome-associated small cell neuroendocrine carcinoma of the prostate is an extremely rare extracolonic tumor associated with Lynch syndrome. This article reports the case of a 54-year-old male with Lynch syndrome who developed a prostate tumor pathologically confirmed as small cell neuroendocrine carcinoma of the prostate, accompanied by a loss of MSH2 and PMS2 protein expression. This article reviews the clinical features and imaging findings of this disease to enhance clinical awareness and provide insights for early diagnosis of this condition.
-
林奇综合征(Lynch syndrome,LS),也称为遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC),是一种以家族癌症易感性为特点的常染色体显性遗传疾病,其发病机制主要涉及DNA错配修复(mismatch repair,MMR)基因的生殖系突变,如MLH1、MSH2、MSH6和PMS2基因。此外,LS的典型表现包括频发的早发性结直肠癌和子宫内膜癌,但近年来研究发现,LS患者也面临较高风险罹患其他部位的癌症,包括前列腺癌。前列腺小细胞癌(small cell carcinoma,SCC)是一种前列腺神经内分泌癌,其在普通前列腺癌患者中的发病率极低,预后较差,且其在LS患者中的表现及机制尚未完全明确。
目前关于LS相关前列腺SCC的文献报道极为稀少,本文将通过对现有病例的分析,探讨LS相关前列腺SCC的诊断标准、临床表现、影像学特征及治疗,为临床诊疗提供参考。
1. 病历资料
1.1 临床表现与实验室检查
患者男性,54岁,自述1999年行乙状结肠切除术(具体不清),术后病理为腺癌,后化疗并定期随访。于2013年行横结肠癌根治术,术后病理为粘液腺癌,化疗并随访至今。于2023年7月行CTA及胃肠镜检查,发现炎性息肉(病理证实)并摘除。
患者有父亲与姐姐曾患升结肠恶性肿瘤的家族史。此次以“右下腹痛伴尿频尿痛2周”为主诉入院。查体腹部可见陈旧性瘢痕,余正常。
实验室检查。神经元特异性烯醇化酶(neuron-specific enolase,NSE)升高(80.40 ng/mL),总前列腺特异性抗原(prostate-specific antigen,PSA)和游离PSA均正常,分别为0.262和0.028 ng/mL。
1.2 CT及MRI表现
主要观察肿瘤的部位、大小、形态、分布、边界、强化方式及盆腔淋巴结。
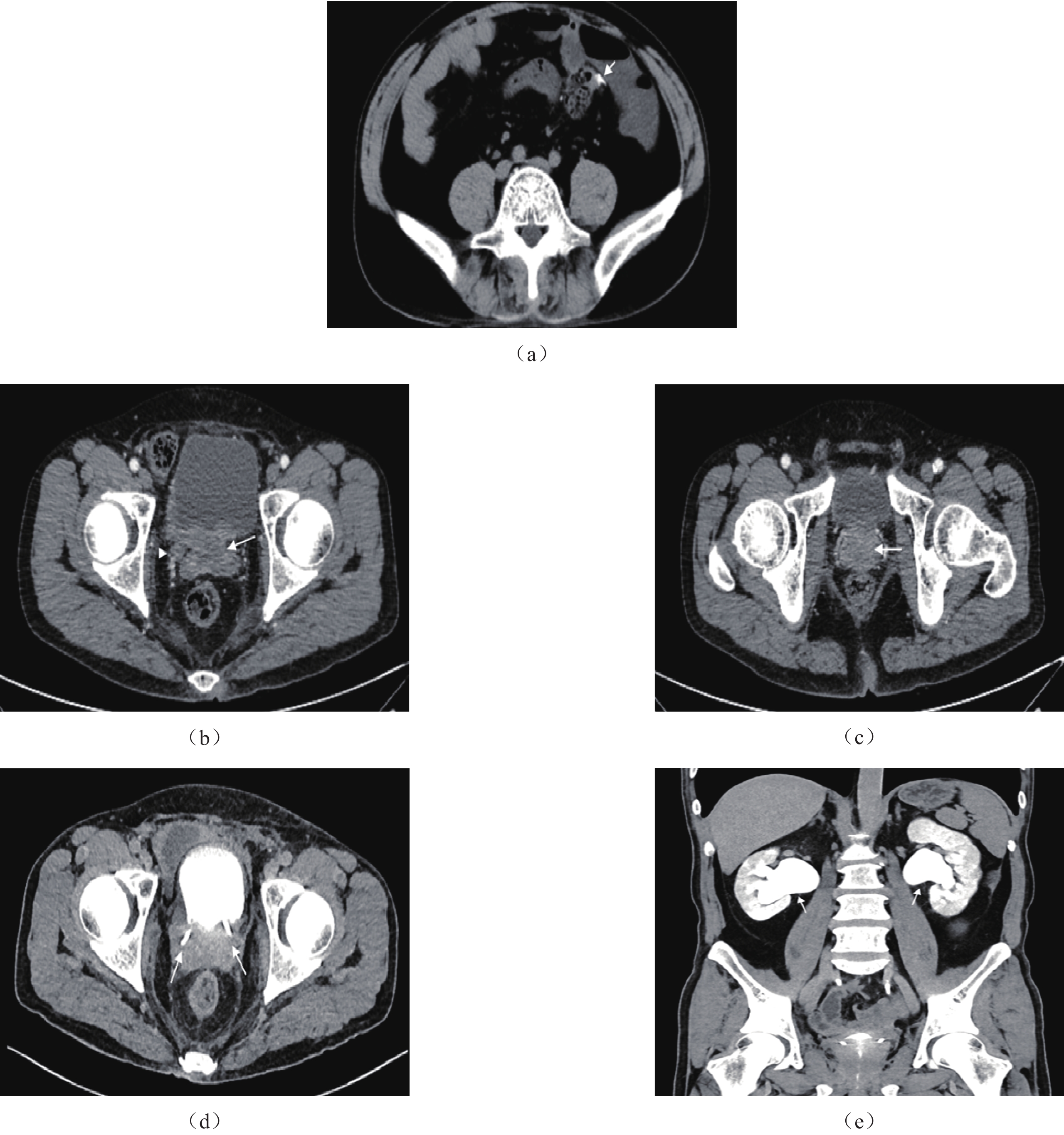
CT表现。①膀胱后壁−前列腺−两侧精囊区占位,双侧输尿管下段受累。②肿块形态不规则,边界欠清。③增强扫描不均匀强化。④双侧尿路积水扩张,膀胱周围局部脂肪间隙模糊,盆腔内多发淋巴结影(图1)。
MRI表现。①前列腺体积增大,膀胱顶后壁、前列腺、精囊腺及双侧输尿管下段异常信号影。②T1WI呈等信号,T2WI呈稍高信号,DWI呈明显高信号,ADC呈低信号;增强后呈欠均匀明显强化;DWI图像上测得病灶最大横径为3.2 cm,根据PI-RADS V2.1评分标准,本病例评分为PI-RADS 5级[1]。③双侧输尿管扩张,盆腔少量积液,盆腔内可见肿大淋巴结(图2)。
1.3 病理结果
行前列腺穿刺活检术,术后病理提示:前列腺小细胞神经内分泌癌(图3)。免疫组化:肿瘤细胞:AE1/AE3(核旁点状+),CK7(核旁点状+),CgA(部分+),SYN(+),CD56(+),Insm-1(+),Ki67(90%+),SATB-2(+),TTF-1(+),AR(部分+),P504s(−),ERG(−),34βE12(−),P63(−),CK5/6(−),NKX3.1(−),CK20(−),MLH1(蛋白表达缺失),PMS2(蛋白表达缺失),MSH2(蛋白表达),MSH6(蛋白表达)。
![]() 图 3 林奇综合征相关前列腺小细胞神经内分泌癌的病理图片注:(a)为送检的前列腺穿刺活检组织,在显微镜低倍视野下的全貌,肿瘤细胞散在分布于间质中,呈片状、巢团状排列;(b)和(c)为前列腺穿刺组织(HE 20×),显示肿瘤细胞核呈圆形或卵圆形,核染色深,染色质细腻,核仁不明显,符合神经内分泌癌的分化特点;(d)为Syn(突触素)免疫组化标记,肿瘤细胞胞质呈弥漫的强阳性表达,符合前列腺小细胞神经内分泌癌的特点。Syn为神经内分泌标志物,在神经内分泌癌中常呈阳性表达。Figure 3. Pathological images of Lynch syndrome-associated prostatic small cell neuroendocrine carcinoma
图 3 林奇综合征相关前列腺小细胞神经内分泌癌的病理图片注:(a)为送检的前列腺穿刺活检组织,在显微镜低倍视野下的全貌,肿瘤细胞散在分布于间质中,呈片状、巢团状排列;(b)和(c)为前列腺穿刺组织(HE 20×),显示肿瘤细胞核呈圆形或卵圆形,核染色深,染色质细腻,核仁不明显,符合神经内分泌癌的分化特点;(d)为Syn(突触素)免疫组化标记,肿瘤细胞胞质呈弥漫的强阳性表达,符合前列腺小细胞神经内分泌癌的特点。Syn为神经内分泌标志物,在神经内分泌癌中常呈阳性表达。Figure 3. Pathological images of Lynch syndrome-associated prostatic small cell neuroendocrine carcinoma1.4 治疗
确诊后给予患者度伐利尤单抗联合EC方案治疗,具体为:度伐利尤单抗
1500 mg(d1)、依托泊苷160 mg/m2(d1~d3)、卡铂500 mg(d1)静脉注射治疗,治疗周期21天。维持该方案至今。2. 讨论
2.1 林奇综合征诊断标准
LS是一种以家族癌症易感性为特征的疾病。该病遵循常染色体显性遗传模式,发病机制为MMR基因中的生殖系突变,包括MLH1、MSH2、MSH6和PMS2;或EPCAM基因的胚系3'端缺失[2]。LS最常见的表型是频发的早发性结直肠癌和子宫内膜癌。据报道,LS相关结直肠癌在西方国家的患病率为0.7%至2.8%,在中国的报告患病率约为1.9%至2.9%[3]。除此之外,LS同时伴有较低程度的其他部位癌症风险,如卵巢、胃、小肠、输尿管和肾盂癌等[4]。
LS的确诊必须依赖基因检测,但对所有潜在患者均进行检测极端耗费耗时。因此,国际遗传性非息肉病大肠癌协作组和美国国家癌症研究中心专门分别设立了LS的诊断标准,主要包括阿姆斯特丹标准II标准[5]和改良版贝斯特指南[6]。然而,由于这些标准高度依赖家族史且相对严格,高达68%的个体未能被诊断出来[7]。而这一情况在中国更为严重,因为中国的家庭规模相对较小,家族史往往不清晰,这意味着在中国使用阿姆斯特丹标准可能高达90%的LS患者无法检出[8]。因此,我国提出了适合自己的LS标准(表1)。本例中,患者的父亲和姐姐相继罹患结直肠癌,且患者50岁以前有两次肠内患癌史,符合LS的诊断。
表 1 林奇综合征不同临床诊断标准对比Table 1. Comparison of clinical diagnostic criteria for Lynch syndrome标准 家谱信息 附加标准 阿姆斯特丹标准Ⅱ 至少有3位亲属患有
林奇综合征相关癌症所有以下标准均需满足: 1.其中1人应是另外两人的一级亲属; 2.至少有连续两代人受影响; 3.至少有1例结直肠癌在50岁之前诊断; 4.排除家族性腺瘤性息肉病。 改良版贝斯特指南 − 所有以下标准均需满足: 1.在50岁以下患者中诊断出的结直肠癌; 2.存在同时或异时、结直肠或其他林奇综合征相关肿瘤,无论年龄; 3.结直肠癌伴有微卫星不稳定性(肿瘤浸润性淋巴细胞、克罗恩病样
淋巴细胞反应、黏液性或印戒细胞分化,或髓样生长模式);4.在患者中诊断出结直肠癌且患者有1名或更多一级亲属患有林奇综
合征相关癌症,其中一种癌症在50岁之前诊断;5.在患者中诊断出结直肠癌且患者有2名或更多一级或二级亲属患有
林奇综合征相关癌症,无论年龄。中国林奇综合征标准 1个家庭中至少有2名
兄弟姐妹患有结直肠癌满足以下任意一条标准: 1.发生多发性结直肠癌; 2.至少有一例结直肠癌在50岁之前诊断; 3.家族中出现林奇综合征相关的结直肠外癌症。 2.2 林奇综合征相关前列腺小细胞神经内分泌癌
目前LS相关前列腺SCC十分罕见,据我们所知,仅有1例个案文献报道[9],描述了一名87岁的患有LS的白人男性,其前列腺活检显示前列腺中存在混合型常规腺癌和小细胞神经内分泌型的高级别前列腺上皮内瘤变,所有这些都表现出MSH2微卫星不稳定性和MSH2表达丧失。一些研究表明,LS患者罹患前列腺癌的风险更高。Raymond等[10]报告称,LS男性患前列腺癌的风险估计是一般男性人群的约两倍。IMPACT研究表明,携带MSH2和MSH6致病性变异的个体比非携带者对照组具有更高的前列腺癌发病率[11]。
前列腺的神经内分泌肿瘤是一类异质性较强的肿瘤群体,包括具有局灶分化的常规前列腺腺癌、具有潘氏细胞样神经内分泌分化的肿瘤、类癌肿瘤、大细胞神经内分泌癌和SCC。大多数研究表明,神经内分泌分化对常规前列腺腺癌患者的预后没有影响[12]。相比之下,作为最常见的前列腺神经内分泌癌,前列腺SCC通常预后极差,其中位生存期仅为10个月[13]。纯型前列腺SCC仅占前列腺癌的不到1%[14]。而在经历雄激素剥夺治疗后出现去势抵抗性前列腺癌的男性中SCC更为常见;对死于去势抵抗性前列腺腺癌的男性进行的尸检研究报告称,SCC在10%至20%的病例中存在[15]。而在本例中,该患者表现为纯型前列腺SCC,不伴有前列腺腺癌,这在LS相关肿瘤中还未见报道。
2.3 临床特征与诊断
LS相关前列腺SCC的诊断依赖于两部分,即LS的诊断与前列腺SCC的诊断,前者见于讨论第一部分,此处不再赘述。前列腺SCC的表现与其腺癌类型截然不同,独特的特征包括对激素治疗无反应、快速进展、溶骨性骨病变的风险增加、存在内脏转移、前列腺显著增大,以及相对于肿瘤负荷较低的PSA水平[16-17]。患者最常出现的症状包括排尿困难、神经系统症状(如意识混乱和感觉或运动功能障碍)或全身性症状。纯型前列腺SCC需与混合型前列腺SCC相鉴别。
如前所述,后者常继发于去势抵抗性前列腺癌。与其他部位的神经内分泌肿瘤(包括SCC)一样,前列腺SCC与分泌多种异位神经肽有关,包括嗜铬蛋白A(CgA)、促肾上腺皮质激素和促胃泌素释放肽[12]。鉴于其倾向于分泌异位肽,前列腺SCC也与副肿瘤综合征有关,如库欣综合征、高钙血症、Eaton-Lambert综合征和抗利尿激素异常分泌综合征。此外,血清NSE以及5-羟色胺等亦可辅助支持诊断前列腺SCC[12]。
在临床怀疑或(少数情况下)组织学确诊的前列腺SCC患者中,几项前瞻性研究根据与前列腺SCC相关的1个或多个典型特征入组。例如,一项研究评估了在去势抵抗性前列腺腺癌患者中使用铂类治疗的效果[18],入组标准为至少具备以下特征之一:有前列腺SCC(纯型或混合型)的组织学证据、仅限于内脏转移、通过常规影像诊断的溶骨性骨转移、体积较大的(≥5 cm)淋巴结肿大或前列腺或骨盆内体积较大的(≥5 cm)Gleason评分≥8的瘤块、初次表现时PSA水平≤10 ng/mL(在去势治疗前或在去势环境下症状进展时)加上大量(≥20处)骨转移、初次诊断时或进展时组织学或血清中的神经内分泌标志物存在、血清乳酸脱氢酶升高、恶性高钙血症或血清癌胚抗原升高,或者对雄激素剥夺疗法的反应不佳(≤6个月),导致雄激素非依赖性进展。
另一个区别于前列腺腺癌的特征是前列腺SCC更容易转移到大脑,通常表现为中枢神经系统受累相关的症状。
简而言之,当出现低PSA水平并伴随疾病异常迅速进展时,应高度怀疑前列腺SCC。本例患者NSE水平升高,CgA阳性,但不伴有PSA升高,且肿瘤侵及前列腺邻近组织或器官,符合前列腺SCC的临床表现。
2.4 影像表现及鉴别诊断
鉴于其罕见性,只有少数病例报告描述了前列腺SCC的影像学表现;其表现为非特异性,包括前列腺肿大伴有增强的分叶状软组织肿块、局部侵袭和远处转移[19]。此外,患者往往表现出由晚期疾病引起的梗阻性尿路病变症状。
CT检查可显示广泛的骨转移及腹部和盆腔淋巴结肿大[20]。MRI上,肿瘤通常较大且异质性明显,在T1WI上呈现低到中等信号强度,在T2WI上信号强度较高,并在高b值DWI上显示高信号,而在ADC成像上则呈现中等低信号强度。这些肿瘤在使用钆增强时显著增强[21]。
本例患者CT及MRI可显示肿瘤累及膀胱后壁和双侧精囊腺,增强扫描可见肿瘤不均匀强化。CTU有助于显示双侧尿路积水,MRI的多序列成像则更清楚显示肿瘤侵及的范围并有助于良恶性的判断。
鉴别诊断时,前列腺SCC需要与前列腺腺癌进行鉴别,前列腺SCC通常具有非典型的转移模式。溶骨性骨转移、特异性内脏转移、不寻常的转移部位(如网膜、阴茎、皮肤、胸膜或大脑),以及在PSA水平低或稳定的情况下症状进展是比较常见的[22],而前列腺腺癌中骨转移常为硬化性病灶[23]。正电子发射断层扫描(PET/CT)可以作为一种功能影像学方法,用于进一步评估SCC的病情。PSMA-PET/CT通常在典型前列腺腺癌中显示高摄取,而SCC可能在某些部位显示为低摄取区域,同时FDG-PET/CT可显示这些区域的高代谢活性,这提示肿瘤的去分化和神经内分泌特性[24-25]。
本病还需要与前列腺肉瘤进行鉴别。前列腺肉瘤患者的发病年龄相对较低,且疾病早期便可能侵袭周围结构并远处转移。其肿瘤体积较大、密度偏低,并常伴有大范围的坏死。在增强扫描中,肿瘤的实性区域可见轻度强化,这与前列腺神经内分泌癌的影像表现相似,因此两者难以区分,确诊仍需依赖病理检查[26]。
2.5 治疗及预后
区分前列腺SCC和非小细胞神经内分泌分化的前列腺癌非常重要,因为后者应按前列腺腺癌的治疗范式进行治疗,而前者则应类似于其他非前列腺SCC进行治疗。以顺铂和依托泊苷为基础的化疗方案通常被用于治疗肺小细胞癌,并且显示出较高的有效率和缓解率[27]。
目前,前列腺SCC的治疗很大程度上基于对小细胞肺癌的治疗经验。与肺部SCC类似,前列腺SCC对化疗和放疗通常敏感,但这些反应通常是短暂的。鉴于这种疾病相对罕见,缺乏前瞻性试验,标准治疗方法通常是从小型病例系列或少数单臂临床试验中推导出来的[12]。对于非转移性疾病的最佳治疗方案尚未明确,因为这种疾病通常表现为已有转移的情况。与小细胞肺癌类似,前列腺切除术后应考虑使用含铂双联化疗(如顺铂或依托泊苷)作为辅助治疗[28]。在手术病理标本中发现手术切缘阳性或T3 a疾病的男性中,辅助放疗也可能有益。当计划放疗时,也应考虑同步进行铂类治疗。
基于LS相关癌症MSI基因变异的特点,免疫检查点抑制剂可以考虑作为患者的潜在治疗手段。鉴于目前缺乏LS相关前列腺SCC的免疫治疗经验,也许可以参考MSI-H前列腺癌的免疫治疗经验。例如,帕博利珠单抗(Pembrolizumab)于2017年获批作为MSI-H/MMR缺陷晚期实体瘤的二线或后续疗法。
研究表明MSI-H/MMR缺陷的前列腺癌患者可以获得良好且通常持久的反应[29-30]。Yoshida报道了1例继发于去势抵抗性前列腺癌的SCC案例,在检测患者为MSI-H后,将治疗方案由化疗转变为帕博利珠单抗治疗之后,患者的局部症状消失并无进展维持了12个月[31]。帕博利珠单抗的安全性是可以接受的,一项针对258名转移性去势抵抗性前列腺癌患者的研究发现,60%的患者会出现治疗相关不良事件,15%出现3至5级不良事件,最常见的治疗相关不良事件为疲劳、腹泻、食欲减退和免疫介导的结肠炎[32]。
考虑到免疫治疗在MSI-H肿瘤患者的潜在作用,针对本例患者,将度伐利尤单抗(一种抗PD-L1单克隆抗体)联合双铂(依托泊苷和卡铂)化疗作为其治疗方案。
3. 小结
本文总结了林奇综合征相关前列腺小细胞神经内分泌癌的一个罕见病例,详细描述了患者的临床表现、影像学表现和病理结果,并结合文献进行回顾,讨论了与林奇综合征相关的前列腺小细胞癌的诊断标准、临床特点、影像学表现及鉴别和治疗方案。
本病例的报道为临床医师提供了有关林奇综合征相关前列腺神经内分泌癌的诊断和治疗的新见解,强调了早期识别和综合治疗的重要性。
-
图 3 林奇综合征相关前列腺小细胞神经内分泌癌的病理图片
注:(a)为送检的前列腺穿刺活检组织,在显微镜低倍视野下的全貌,肿瘤细胞散在分布于间质中,呈片状、巢团状排列;(b)和(c)为前列腺穿刺组织(HE 20×),显示肿瘤细胞核呈圆形或卵圆形,核染色深,染色质细腻,核仁不明显,符合神经内分泌癌的分化特点;(d)为Syn(突触素)免疫组化标记,肿瘤细胞胞质呈弥漫的强阳性表达,符合前列腺小细胞神经内分泌癌的特点。Syn为神经内分泌标志物,在神经内分泌癌中常呈阳性表达。
Figure 3. Pathological images of Lynch syndrome-associated prostatic small cell neuroendocrine carcinoma
表 1 林奇综合征不同临床诊断标准对比
Table 1 Comparison of clinical diagnostic criteria for Lynch syndrome
标准 家谱信息 附加标准 阿姆斯特丹标准Ⅱ 至少有3位亲属患有
林奇综合征相关癌症所有以下标准均需满足: 1.其中1人应是另外两人的一级亲属; 2.至少有连续两代人受影响; 3.至少有1例结直肠癌在50岁之前诊断; 4.排除家族性腺瘤性息肉病。 改良版贝斯特指南 − 所有以下标准均需满足: 1.在50岁以下患者中诊断出的结直肠癌; 2.存在同时或异时、结直肠或其他林奇综合征相关肿瘤,无论年龄; 3.结直肠癌伴有微卫星不稳定性(肿瘤浸润性淋巴细胞、克罗恩病样
淋巴细胞反应、黏液性或印戒细胞分化,或髓样生长模式);4.在患者中诊断出结直肠癌且患者有1名或更多一级亲属患有林奇综
合征相关癌症,其中一种癌症在50岁之前诊断;5.在患者中诊断出结直肠癌且患者有2名或更多一级或二级亲属患有
林奇综合征相关癌症,无论年龄。中国林奇综合征标准 1个家庭中至少有2名
兄弟姐妹患有结直肠癌满足以下任意一条标准: 1.发生多发性结直肠癌; 2.至少有一例结直肠癌在50岁之前诊断; 3.家族中出现林奇综合征相关的结直肠外癌症。 -
[1] TURKBEY B, ROSENKRANTZ A B, HAIDER M A, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2[J]. European Urology, 2019, 76(3): 340-351. DOI: 10.1016/j.eururo.2019.02.033.
[2] WARD R L, HICKS S, HAWKINS N J. Population-based molecular screening for Lynch syndrome: Implications for personalized medicine[J]. Journal of Clinical Oncology, 2013, 31(20): 2554-2562. DOI: 10.1200/JCO.2012.46.8454.
[3] YU J, DING P R, JIANG W. Screening and management of Lynch syndrome: The Chinese experience[J]. Clinics in Colon and Rectal Surgery, 2023, 36(6): 369-377. DOI: 10.1055/s-0043-1767706.
[4] WIN A K, YOUNG J P, LINDOR N M, et al. Colorectal and other cancer risks for carriers and noncarriers from families with a DNA mismatch repair gene mutation: A prospective cohort study[J]. Journal of Clinical Oncology, 2012, 30(9): 958-964. DOI: 10.1200/JCO.2011.39.5590.
[5] VASEN H, WATSON P, MECKLIN J, et al. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative Group on HNPCC[J]. Gastroenterology, 1999, 116(6): 1453-1456. DOI: 10.1016/S0016-5085(99)70510-X.
[6] UMAR A, BOLAND C R, TERDIMAN J P, et al. Revised bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability[J]. Journal of the National Cancer Institute, 2004, 96(4): 261-268. UMAR A, BOLAND C R, TERDIMAN J P, et al. Revised bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability[J]. Journal of the National Cancer Institute, 2004, 96(4): 261-268.
[7] BARNETSON R A, TENESA A, FARRINGTON S M, et al. Identification and survival of carriers of mutations in DNA mismatch-repair genes in colon cancer[J]. New England Journal of Medicine, 2006, 354(26): 2751-2763. DOI: 10.1056/NEJMoa053493.
[8] JIANG W, CAI M, LI S, et al. Universal screening for Lynch syndrome in a large consecutive cohort of Chinese colorectal cancer patients: High prevalence and unique molecular features[J]. International Journal of Cancer, 2019, 144(9): 2161-2168. DOI: 10.1002/ijc.32044.
[9] WAGNER D G, GATALICA Z, LYNCH H T, et al. Neuroendocrine-type prostatic adenocarcinoma with microsatellite instability in a patient with Lynch syndrome[J]. International Journal of Surgical Pathology, 2010, 18(6): 550-553. DOI: 10.1177/1066896910379406.
[10] RAYMOND V M, MUKHERJEE B, WANG F, et al. Elevated risk of prostate cancer among men with Lynch syndrome[J]. Journal of Clinical Oncology, 2013, 31(14): 1713-1718. DOI: 10.1200/JCO.2012.44.1238.
[11] BANCROFT E K, PAGE E C, BROOK M N, et al. A prospective prostate cancer screening programme for men with pathogenic variants in mismatch repair genes (IMPACT): Initial results from an international prospective study[J]. Lancet Oncology, 2021, 22(11): 1618-1631. DOI: 10.1016/S1470-2045(21)00522-2.
[12] NADAL R, SCHWEIZER M, KRYVENKO O N, et al. Small cell carcinoma of the prostate[J]. Nature Reviews Urology, 2014, 11(4): 213-219. DOI: 10.1038/nrurol.2014.21.
[13] ZAFFUTO E, POMPE R, ZANATY M, et al. Contemporary incidence and cancer control outcomes of primary neuroendocrine prostate cancer: A SEER database analysis[J]. Clinical Genitourinary Cancer, 2017, 15(5): e793-e800. DOI: 10.1016/j.clgc.2017.04.006.
[14] HU J, HAN B, HUANG J. Morphologic spectrum of neuroendocrine tumors of the prostate: An updated review[J]. Archives of Pathology & Laboratory Medicine, 2020, 144(3): 320-325.
[15] SHAH R B, MEHRA R, CHINNAIYAN A M, et al. Androgen-independent prostate cancer is a heterogeneous group of diseases[J]. Cancer Research, 2004, 64(24): 9209-9216. DOI: 10.1158/0008-5472.CAN-04-2442.
[16] PALMGREN J S, KARAVADIA S S, WAKEFIELD M R. Unusual and underappreciated: Small cell carcinoma of the prostate[J]. Seminars in Oncology, 2007, 34(1): 22-29. DOI: 10.1053/j.seminoncol.2006.10.026.
[17] 蔡建良, 李宁忱, 那彦群. 前列腺小细胞神经内分泌癌诊治特点分析[J]. 中华泌尿外科杂志, 2010, 31(6): 391-394. DOI: 10.3760/cma.j.issn.1000-6702.2010.06.011. CAI J L, LI N C, NA Y Q. Small cell neuroendocrine carcinoma of the prostate[J]. Chinese Journal of Urology, 2010, 31(6): 391-394. DOI: 10.3760/cma.j.issn.1000-6702.2010.06.011. (in Chinese).
[18] APARICIO A M, HARZSTARK A L, CORN P G, et al. Platinum-based chemotherapy for variant castrate-resistant prostate cancer[J]. Clinical Cancer Research, 2013, 19(13): 3621-3630. DOI: 10.1158/1078-0432.CCR-12-3791.
[19] BERNIKER A V, ABDULRAHMAN A A, TEYTELBOYM O M, et al. Extrapulmonary small cell carcinoma: Imaging features with radiologic-pathologic correlation[J]. Radiographics, 2015, 35(1): 152-163. DOI: 10.1148/rg.351140050.
[20] CHANG J M, LEE H J, LEE S E, et al. Pictorial review: Unusual tumours involving the prostate: Radiological-pathological findings[J]. The British Journal of Radiology, 2008, 81(971): 907-915. DOI: 10.1259/bjr/68294775.
[21] SHARMA P, AJJIKUTTIRA A A, MCLEAN K, et al. Small cell carcinoma of the prostate: Pathological and magnetic resonance imaging findings[J]. Journal of Clinical Urology, 2024, 17(1): 22-25. DOI: 10.1177/20514158221081415.
[22] APARICIO A, TZELEPI V. Neuroendocrine (small-cell) carcinomas: Why they teach us essential lessons about prostate cancer[J]. Oncology, 2014, 28(10): 831-838.
[23] 李宜泽, 陈子琦, 张璐瑶, 等. 双能CT在前列腺病变中的研究和应用进展[J]. CT理论与应用研究(中英文), 2025, 34(1): 65-72. DOI: 10.15953/j.ctta.2024.114. LI Y Z, CHEN Z Q, ZHANG L Y, et al. Research and application progress of dual-energy CT in prostate lesions[J]. CT Theory and Applications, 2025, 34(1): 65-72. DOI: 10.15953/j.ctta.2024.114. (in Chinese).
[24] MENA E, LINDENBERG L M, CHOYKE P L. New targets for PET molecular imaging of prostate cancer[J]. Seminars in Nuclear Medicine, 2019, 49(4): 326-336. DOI: 10.1053/j.semnuclmed.2019.02.001.
[25] TAHER A, JENSEN C T, YEDURURI S, et al. Imaging of neuroendocrine prostatic carcinoma[J]. Cancers, 2021, 13(22): 5765. DOI: 10.3390/cancers13225765.
[26] 李卓琳, 毕国力, 包颜明, 等. 前列腺小细胞神经内分泌癌1例[J]. 实用放射学杂志, 2008, 24(2): 220, 260. [27] 蔡国烽, 邓君鹏, 李权, 等. 前列腺小细胞神经内分泌癌1例并文献复习[J]. 国际泌尿系统杂志, 2020, 40(2): 319-320. DOI: 10.3760/cma.j.issn.1673-4416.2020.02.034. [28] KIM K H, KIM Y B, LEE J K, et al. Pathologic results of radical prostatectomies in patients with simultaneous atypical small acinar proliferation and prostate cancer[J]. Korean Journal of Urology, 2010, 51(6): 398. DOI: 10.4111/kju.2010.51.6.398.
[29] SPETSIERIS N, BOUKOVALA M, PATSAKIS G, et al. Neuroendocrine and aggressive-variant prostate cancer[J]. Cancers, 2020, 12(12): 3792. DOI: 10.3390/cancers12123792.
[30] ABIDA W, CHENG M L, ARMENIA J, et al. Analysis of the prevalence of microsatellite instability in prostate cancer and response to immune checkpoint blockade[J]. JAMA Oncology, 2019, 5(4): 471. DOI: 10.1001/jamaoncol.2018.5801.
[31] YOSHIDA T, YAEGASHI H, TORIUMI R, et al. Long response duration to pembrolizumab in metastatic, castration-resistant prostate cancer with microsatellite instability-high and neuroendocrine differentiation: A case report[J]. Frontiers in Oncology, 2022, 12: 912490. DOI: 10.3389/fonc.2022.912490.
[32] ANTONARAKIS E S, PIULATS J M, GROSS-GOUPIL M, et al. Pembrolizumab for treatment-refractory metastatic castration-resistant prostate cancer: Multicohort, open-label phase Ⅱ KEYNOTE-199 study[J]. Journal of Clinical Oncology, 2020, 38(5): 395-405. DOI: 10.1200/JCO.19.01638.



 下载:
下载:




