Study on the Value of CT Enhanced Long Delayed Scan in PCI Scoring of Pseudomyxoma Peritonei
-
摘要:
目的:探讨CT增强长时间延迟扫描在腹膜假黏液瘤(PMP)患者CT腹膜癌指数(CT-PCI)评分中的价值研究。方法:回顾性分析2022年10月至2023年12月航天中心医院黏液瘤科102例经手术病理证实为腹膜假黏液瘤患者的术前CT图像,分别进行门脉期及长时间延迟期CT-PCI评分与术中的PCI评分对照,进行一致性分析。结果:使用Kappa系数评价CT-PCI与术中评分的一致性,CT增强扫描,PMP患者13个区CT-PCI评分与术中PCI评分的一致性的Kappa值长时间延迟期均高于或等于门脉期;13个区长时间延迟期和门脉期CT-PCI评分与术中评分一致性平均Kappa值分别为(0.669±0.101)和(0.509±0.121),CT-PCI评分与术中PCI评分的一致性长时间延迟期显著高于门脉期。门脉期CT-PCI评分与术中PCI评分的一致性:1区,一致性较差;2、3、4、5、7、8、9、10和12区,一致性中等;0、6和11区,一致性较好。长时间延迟期CT-PCI评分与术中PCI评分的一致性:5、9、10和12区,一致性中等;0、1、2、4、7、8和11区,一致性较好;3区和6区,一致性非常好。门脉期、长时间延迟期的CT-PCI评分与术中PCI评分的一致性的对比,1区和3区差异显著;0、2、4、5、6、7和8区差异中等;9、10、11和12区一致性无明显差异。结论:通过CT增强的长时间延迟扫描方式,可有效提高术前CT-PCI评分的准确性。
-
关键词:
- CT增强长时间延迟扫描 /
- 腹膜假黏液瘤 /
- CT /
- 腹膜癌指数
Abstract:Objective: To explore the value of computed tomography (CT) enhanced long delayed scan in the CT peritoneal cancer index (CT-PCI) score of patients with pseudomyxoma peritonei (PMP). Methods: The preoperative CT images of 102 patients with confirmed peritoneal pseudomyxoma through surgery and pathology in the Mucinous Tumor Department of Aerospace Center Hospital from October 2022 to December 2023 were retrospectively analyzed. The CT-PCI scores of the portal venous and long-delayed phases with intraoperative PCI scores were separately compared and a consistency analysis was performed. Results: The consistency between CT-PCI and intraoperative scores was evaluated using the Kappa coefficient. The Kappa values for the consistency between CT-PCI scores in 13 zones of PMP patients during CT-enhanced long-delayed scans and intraoperative PCI scores of the long-delayed phase were higher than or equal to those of the portal venous phase. The average Kappa values for the consistency between CT-PCI and intraoperative scores in 13 zones of the long-delayed and portal venous phases were (0.669±0.101) and (0.509±0.121), respectively. The consistency between CT-PCI and intraoperative PCI scores was significantly higher in the long-delayed phase than that in the portal phase. The consistencies between the CT-PCI and intraoperative PCI scores in the portal venous phase are as follows: zone 1: poor consistency; zones 2, 3, 4, 5, 7, 8, 9, 10, and 12: moderate consistency; zones 0, 6, and 11: good consistency. The consistencies between the CT-PCI and intraoperative PCI scores in the long-delayed phase are as follows: zones 5, 9, 10, and 12: moderate consistency; zones 0, 1, 2, 4, 7, 8, and 11: good consistency; zones 3 and 6: very good consistency. The consistencies between the CT-PCI and intraoperative PCI scores in the portal venous and delayed phases are as follows: zones 1 and 3: significant difference; zones 0, 2, 4, 5, 6, 7, and 8: moderate difference; zones 9, 10, 11, and 12: no significant difference. Conclusion: The CT-enhanced delayed scanning method can effectively improve the accuracy of preoperative CT-PCI scoring.
-
Keywords:
- CT enhanced long delayed scan /
- pseudomyxoma peritonei /
- CT /
- peritoneal cancer index
-
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一种肿瘤细胞通过播散种植的方式在腹腔内大量生长,同时伴随大量黏液或胶冻样腹水为主要特征的少见病[1-2]。PMP的概念是1884年由Werth首次提出[3]。Weaver[4]曾在1937年提出PMP假说,当阑尾黏液囊肿破裂后,进入腹腔的黏液细胞在腹腔内种植,继续分泌黏液,导致PMP。PMP发病率大概在每年3/100万~4/100万[5],主要来源于阑尾,也可来源于卵巢、结肠、直肠等[6-11]。肿瘤细胞减灭术(cytore ductive surgery,CRS)与腹腔热灌注化疗(hyperther mic intraperitoneal chemotherapy,HIPEC)联合治疗的模式,使部分PMP患者的10年生存率可由30%提高至60%以上[12-14],治疗效果取决于能否实现肿瘤细胞的完全减灭。
腹盆腔增强CT扫描是PMP术前诊断及术后随访最常用的检查方式。CT可显示病变的分布范围,腹盆腔各脏器的受累情况,既往有研究表明[15-16]通过CT-腹膜癌指数(computed tomography-peritoneal cancer index,CT-PCI)评分可评估肿瘤负荷,即肿瘤的分布位置及大小。因此提高术前CT-PCI评分的准确性影响患者术前治疗方案的准确制定,对于肿瘤的可切除程度及手术能否实现完全性的CRS有更为准确的预判。
腹膜假黏液瘤患者腹腔内通常存在大量血性及黏液性腹水,CT值在平扫时与黏液肿瘤大体一致,无法区分;在增强扫描门脉期,部分黏液肿瘤轻度强化,可与周围血性及黏液性腹水进行区别,但仍有部分病灶未显影或未清晰显示,使得门脉期CT-PCI评分与术中PCI评分存在一定的差距。如何进一步提高CT-PCI评分的准确性,仍是尚待研究的难题。鉴于患者腹腔内病灶较多,临床医生术前需要明确输尿管及膀胱情况,因此在PMP患者常规增强扫描后增加了8~20 min的泌尿系延迟扫描,即长时间延迟期,以此替代常规延迟扫描。基于此背景,回顾性分析PMP患者常规增强扫描的门脉期与长时间延迟扫描图像发现部分PMP患者的黏液性肿瘤呈不同程度的渐进性强化,长时间延迟期病灶显示更清晰,部分病灶显示范围增大或出现门脉期未显示的病灶,对于病灶大小的测量更为准确。
因此,本研究通过增强CT扫描的长时间延迟期与门脉期分别进行CT-PCI评分,以术中的PCI评分为金标准,探讨增强CT长时间延迟期扫描对比门脉期扫描能否有效提高CT-PCI评分与术中PCI评分的一致性。为临床医生术前对PMP患者病情评估提供更为有效的影像学帮助。
1. 材料与方法
1.1 研究对象
收集2022年10月至2023年12月航天中心医院黏液瘤科102例经手术病理证实为PMP患者的术前CT图像及手术资料,其中男性48例,女性54例,年龄31~76岁,中位年龄58岁。
纳入标准:①术前进行腹盆腔平扫、增强扫描动脉期、门脉期及8~20 min长时间延迟期CT扫描(即泌尿系增强扫描);②有完整的术中PCI评分记录;③有术后病理结果。排除标准:①CT图像伪影明显,无法准确测量评估的;②术前增强CT检查时间与手术时间间隔超过2周。
1.2 检查方法
CT检查前的肠道准备:检查前需空腹8 h,前一日晚上21:00、当日检查前2 h及上机前分3次口服胃肠道造影显像剂(碘影比乐),每次500 mL。
采用SOMATOM Siemens Force CT或GE LightSpeed CT(VCT)设备扫描。扫描范围自膈顶至耻骨联合水平,采用高压注射器经肘前静脉注射非离子型造影剂碘佛醇(100 mL:35 g)或碘克沙醇(100 mg:32 g)60~80 mL,注射速度2.3~3.0 mL/s;管电压120 kV,管电流200~250 mA,矩阵512×512,螺距1.0,层厚及层距均为5 mm,图像后期进行1.25 mm轴位薄层重建;动脉期及门脉期分别于注射开始后25~30 s、65~70 s进行扫描,长时间延迟期为8~20 min。
1.3 资料整理与图像分析
CT-PCI评分方法[17-18]。根据CT图像腹部及盆腔分成0~12个区,0区为中腹部,1区为右侧季肋部,2区为上腹部,3区为左侧季肋部,4区为左腰部,5区为左髂部,6区为下腹部,7区为右髂部,8区为右腰部,9区为空肠上段,10区为空肠下段,11区为回肠上段,12区为回肠下段。按照病灶的大小进行评分,0分为无肉眼可见肿瘤,1分为肿瘤≤0.5 cm,2分为肿瘤0.5~5.0 cm,3分为肿瘤>5.0 cm或有融合性病变。各区评分相加后总和即PCI总分,最高为39分,分区方法可参照(图1)。
由两名经验丰富的影像科诊断医师分别对腹部0~12区的病灶大小进行测量,测量结果取两者的均值,通常病灶的CT值大于20 HU,CT值为20 HU以下的低密度病变,被认定为黏液腹水,伴或不伴血性腹水。根据均值进行PCI等级评分,该区域多发病灶时,以最大病灶直径为评分依据,不能病灶直径叠加。
1.4 数据分析
采用SPSS 22.0软件进行统计学分析。PCI评分以术中评分为金标准,对术前腹盆腔增强CT扫描的门脉期与长时间延迟期腹盆腔13个区域的病灶进行CT-PCI评分。采用Kappa检验分析,诊断一致性使用Kappa系数评价,0~0.20一致性极差;0.21~0.40,一致性较差;0.41~0.60,一致性中等;0.61~0.80,一致性较好;0.81~1.00,一致性非常好。进行统计学评价。P<0.05为差异有统计学意义。
2. 结果
2.1 典型CT表现
PMP是一种分化较好的低度恶性肿瘤性疾病,大多数起源于阑尾,常见CT表现具有一定的特征[19-23]:腹盆腔内散在或弥漫分布的黏液性肿瘤、腹水;肝脏和/或脾脏周围病变导致扇贝状压迹;不均匀增厚的大网膜饼;受累小肠系膜的不规则形增厚;小肠的受压、移位、聚集;腹腔低密度病变边缘或内部的网状分隔;部分病灶边缘点状钙化;增强扫描部分病灶边缘或分隔呈轻度强化。
本研究发现,部分黏液性肿瘤在动脉期、门脉期与长时间延迟期呈持续渐进性强化,并通过图2的病例进行详细说明。
病例1,女,56岁。1区(黄色箭头指示肝周区域)病变,在门脉期(图2(a))显示为多发病灶,最大病灶直径不超过5 cm,CT-PCI评分为2分;长时间延迟期(图2(b))病灶显示完全融合为一个较大病灶,直径超过5 cm,CT-PCI评分为3分,术中PCI评分为3分,长时间延迟期CT-PCI评分与术中PCI评分一致。
病例2,女,49岁。1区(橘色箭头指示肝周区域)、2区(绿色箭头指示区域)、3区(蓝色箭头指示区域)病灶,长时间延迟期(图2(d))较门脉期(图2(c))进一步强化,显示更清晰,门脉期CT值50 HU(图2(e)),长时间延迟期CT值63 HU(图2(f)),长时间延迟病灶呈持续强化。
病例3,女,65岁。0区(红色圈内)病灶在门脉期(图2(g))不明显,长时间延迟期(图2(h))进一步强化后病灶大小轮廓显示清晰;1区(蓝色圈内)肝脏边缘病灶门脉期(图2(g))未见显影,长时间延迟期(图2(h))强化后显示;3区(绿色圈内)脾周病灶门脉期(图2(g))显示不清,长时间延迟期(图2(h))显示清晰。门脉期CT值35 HU(图2(i)),长时间延迟期CT值49 HU(图2(j))。
病例4,男,57岁。4区病灶门脉期(图2(k)黄色箭头指示区域)未见显影,CT-PCI评分为0分;长时间延迟期(图2(l)蓝色箭头指示区域)显示清晰,直径大于5 cm,CT-PCI评分3分,术中PCI评分3分,长时间延迟期CT-PCI评分与术中PCI评分一致。
病例5,女,55岁。3区病变,门脉期(图2(m)黄色箭头指示区域)显示欠清,CT-PCI评分为2分,长时间延迟期(图2(n)蓝色箭头指示区域)病灶强化,边缘显示清晰,直径大于5 cm,CT-PCI评分为3分,术中PCI评分为3分,长时间延迟期CT-PCI评分与术中PCI评分一致。
病例6,女,52岁。1区(黄色箭头指示区域)、3区(蓝色箭头指示区域)病灶,门脉期(图2(o))显示不清,长时间延迟期(图2(p))较门脉期进一步强化,显示更清晰。
2.2 统计结果
102例患者在术中0~12区病灶PCI评分概况统计表(表1)。
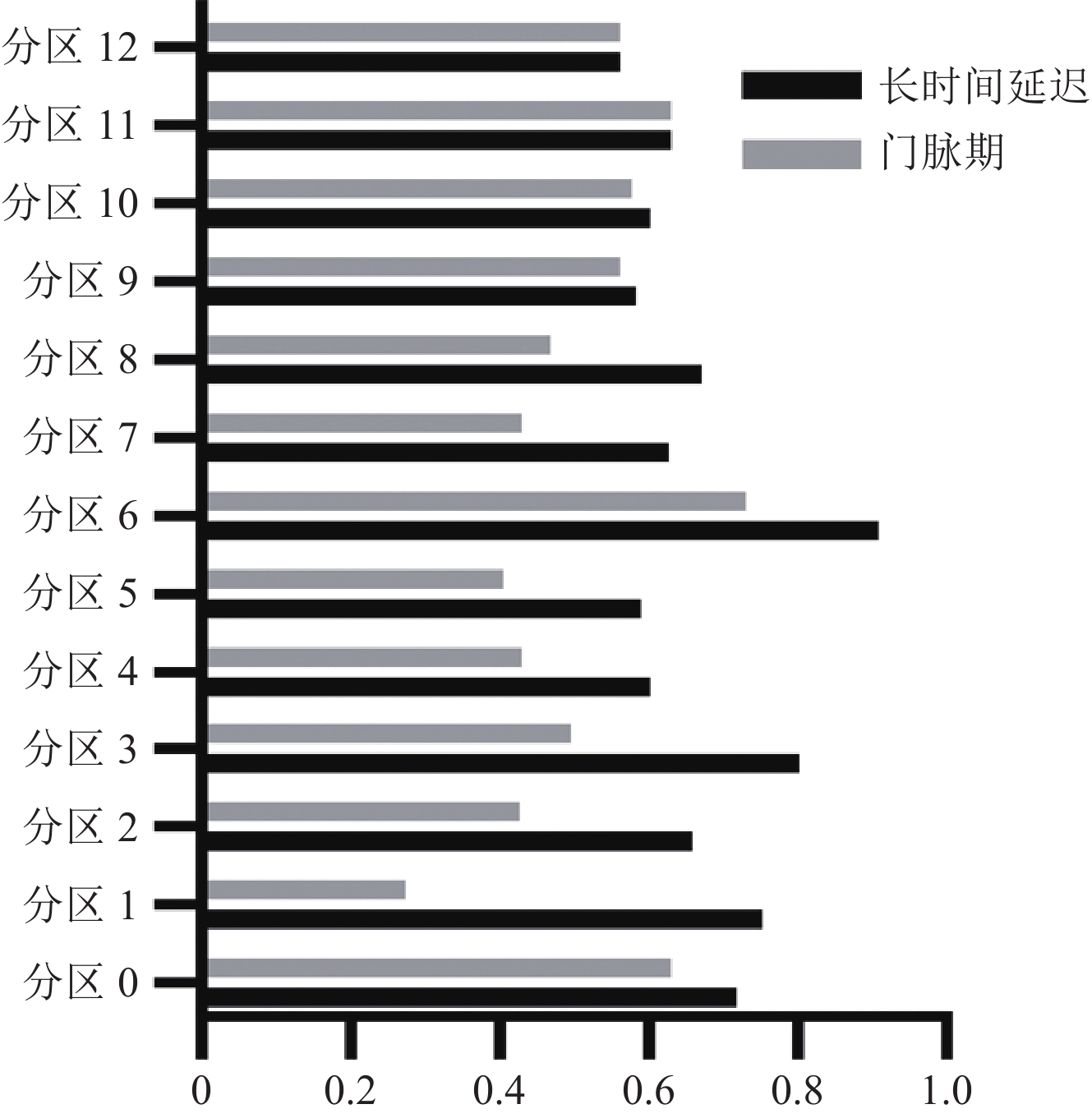
表 1 术中0~12区病灶PCI评分概况统计表Table 1. Table 1 Statistical Table of PCI Scores for Intraoperative Lesions in Zones 0–12分区 术中评分 评分=0 评分=1 评分=2 评分=3 分区0 9(8.8) 2(2.0) 11(10.8) 80(78.4) 分区1 16(15.7) 0(0.0) 9(8.8) 77(75.5) 分区2 15(14.7) 1(1.0) 11(10.8) 75(73.5) 分区3 18(17.6) 5(4.9) 17(16.7) 62(58.8) 分区4 20(19.6) 3(2.9) 19(18.6) 60(58.8) 分区5 12(11.8) 4(3.9) 19(18.6) 67(65.7) 分区6 7(6.9) 0(0.0) 5(4.9) 90(88.2) 分区7 2(2.0) 2(2.0) 14(13.7) 84(82.4) 分区8 12(11.8) 3(2.9) 23(22.5) 64(62.7) 分区9 28(27.5) 21(20.6) 20(19.6) 63(61.8) 分区10 28(27.5) 19(18.6) 19(18.6) 36(35.3) 分区11 20(19.6) 21(20.6) 23(22.5) 38(37.3) 分区12 17(16.7) 18(17.6) 17(16.7) 50(49.0) 采用Kappa检验分析,得出长时间延迟期13个分区CT-PCI评分与术中评分的一致性Kappa均高于或等于门脉期,长时间延迟期和门脉期13个区的CT-PCI评分与术中评分的一致性平均Kappa分别为(0.669±0.101)和(0.509±0.121),长时间延迟期CT-PCI评分与术中PCI评分的一致性显著高于门脉期(表2和图3)。
表 2 CT-PCI与术中PCI的一致性评价Table 2. Consistency evaluation of CT-PCI and intraoperative PCIKappa系数 分区 0 1 2 3 4 5 6 7 8 9 10 11 12 Kappa 长时间延迟期vs.术中 0.718 0.752 0.658 0.802 0.601 0.588 0.909 0.627 0.672 0.585 0.600 0.629 0.561 Kappa 门脉期vs.术中 0.630 0.274 0.427 0.495 0.429 0.406 0.731 0.409 0.467 0.561 0.576 0.629 0.561 根据Kappa系数评价,门脉期CT-PCI评分与术中PCI评分的一致性:1区,一致性较差;2、3、4、5、7、8、9、10和12区,一致性中等;0、6和11区,一致性较好。长时间延迟期CT-PCI评分与术中PCI评分的一致性:5、9、10和12区,一致性中等;0、1、2、4、7、8和11区,一致性较好;3区和6区,一致性非常好。
3. 讨论
PMP主要来源于穿孔的阑尾黏液性肿瘤,其生物学行为呈惰性生长,进展缓慢,早期缺乏特异性临床表现,部分患者可能出现类似急性阑尾炎表现的右下腹疼痛,随着疾病的进展,腹腔内黏液及黏液性病灶的不断增加,逐渐出现腹胀、腹痛、腹腔积液、腹部包块等表现[24-25]。PMP与腹腔恶性肿瘤不同[26],与部分黏液性囊性肿瘤类似[27],部分PMP患者的黏液性病灶在增强CT扫描的长时间延迟期呈不同程度的渐进性强化。
CT增强扫描门脉期的CT-PCI评分与术中PCI评分对比,1区一致性较差,其原因示肝周病灶在门脉期强化不明显,大部分区域CT值与平扫一致,因此低估了该区域的PCI评分;2、3、4、5、7、8、9、10和12区,一致性中等,其原因是这些区域通常有腹水干扰存在;0、6和11区,一致性较好,0区主要是大网膜病变区域,而6区为盆腔,是PMP主要受累区域,加之两区干扰因素较少,故一致性较好。
PMP患者0~12区长时间延迟期CT-PCI评分与术中评分的一致性均高于或等于门脉期CT-PCI评分与术中评分的一致性。其中1区和3区Kappa值差异显著,即肝周、脾周区域。在CT增强扫描门脉期的图像中,肝周及脾周的病灶通常呈低密度,门脉期CT值在15~20 HU左右,我们把低密度区域判定为血性腹水或黏液,未计入或低估了肿瘤的PCI评分。在长时间延迟扫描中黏液肿瘤病灶逐渐明显强化,使得病灶大小的显示更真实,边缘更清晰,与术中病灶的大小更为一致,长时间延迟期PCI评估更为精确。
0、2、4、5、6、7和8区Kappa值差异性中等,即中腹部、肝脾之间、左腰部、左髂部、盆腔、右髂部、右腰部区域。这些区域由于许多中晚期患者会存在大量的血性或粘液性腹水,在腹水的衬托下,在门脉期扫描时通常病灶已经可以部分显示。在长时间延迟扫描时部分患者的黏液肿瘤病灶在持续增强的情况下,较前范围增大或出现病灶,基于门脉期病灶已经有所显示,以上区域长时间延迟期PCI评分较门脉期PCI评分差异值中等。
9、10、11和12区域Kappa值无明显差异,即小肠系膜区域,由于小肠系膜上的病灶在大多数患者均较小的特点,PCI评分通常0~1为主,2~3分很少,受血性腹水及黏液性腹水干扰较小,有系膜周围脂肪的衬托,大部分病灶在门脉期即可显示,因此对于小肠系膜区域,长时间延迟期PCI评估较门脉期PCI评估无明显差异。
本研究存在的局限性。①本研究102例患者其中79例的黏液性肿瘤存在长时间延迟期渐进性强化,23例的黏液性肿瘤在长时间延迟期未见明确渐进性强化,目前原因尚不明确,未见相关文献报道,有待后续进一步研究。②本研究基于现有数据,只做了现有的泌尿系(即长时间延迟期)与门脉期的对比研究,未采集2~3 min延迟扫描(即常规延迟期)图像,因此未能进行门脉期、常规延迟期与长时间延迟期三者的对比研究,考虑到再增加一次扫描会极大的增加患者的辐射剂量,我们今后尝试用MRI检查来进行PMP患者门脉期、常规延迟期和长时间延迟期的对比研究。
综上所述,通过增强CT长时间延迟扫描,可有效提高PMP患者腹盆腔大部分区域CT-PCI评分的准确性。PMP作为一种罕见病,相关的影像学研究极少,我们在为临床提供影像支持的同时,也在不断的总结经验,希望通过今后不断的科研探索,能为临床医生在术前提供更为有效的影像学帮助。
-
表 1 术中0~12区病灶PCI评分概况统计表
Table 1 Table 1 Statistical Table of PCI Scores for Intraoperative Lesions in Zones 0–12
分区 术中评分 评分=0 评分=1 评分=2 评分=3 分区0 9(8.8) 2(2.0) 11(10.8) 80(78.4) 分区1 16(15.7) 0(0.0) 9(8.8) 77(75.5) 分区2 15(14.7) 1(1.0) 11(10.8) 75(73.5) 分区3 18(17.6) 5(4.9) 17(16.7) 62(58.8) 分区4 20(19.6) 3(2.9) 19(18.6) 60(58.8) 分区5 12(11.8) 4(3.9) 19(18.6) 67(65.7) 分区6 7(6.9) 0(0.0) 5(4.9) 90(88.2) 分区7 2(2.0) 2(2.0) 14(13.7) 84(82.4) 分区8 12(11.8) 3(2.9) 23(22.5) 64(62.7) 分区9 28(27.5) 21(20.6) 20(19.6) 63(61.8) 分区10 28(27.5) 19(18.6) 19(18.6) 36(35.3) 分区11 20(19.6) 21(20.6) 23(22.5) 38(37.3) 分区12 17(16.7) 18(17.6) 17(16.7) 50(49.0) 表 2 CT-PCI与术中PCI的一致性评价
Table 2 Consistency evaluation of CT-PCI and intraoperative PCI
Kappa系数 分区 0 1 2 3 4 5 6 7 8 9 10 11 12 Kappa 长时间延迟期vs.术中 0.718 0.752 0.658 0.802 0.601 0.588 0.909 0.627 0.672 0.585 0.600 0.629 0.561 Kappa 门脉期vs.术中 0.630 0.274 0.427 0.495 0.429 0.406 0.731 0.409 0.467 0.561 0.576 0.629 0.561 -
[1] MITTAL R, CHANDRAMOHAN A, MORAN B. Pseudomyxoma peritonei: Natural history and treatment[J]. International Journal of Hyperthermia, 2017, 33(5): 511-519. DOI: 10.1080/02656736.2017.1310938.
[2] RIZVI S A, SYED W, SHERGILL R. Approach to pseudomyxoma peritonei[J]. World Journal of Gastrointestinal Surgery, 2018, 10(5): 49-56. DOI: 10.4240/wjgs.v10.i5.49.
[3] WERTH R. Klinische und anatomische Untersuchungen zur Lehre von den Bauchgeschwülsten undder Lapara-tomie[J]. Archiv Für Gynä Kologie, 1884, 24: 100-118.
[4] WEAVER C H. Mucocele of appendix with pseudomucinousdegeneration[J]. The Ametican Journal of Surgery, 1937, 36: 523-526. DOI: 10.1016/S0002-9610(37)90763-3.
[5] PATRICK-BROWN T D J H, CARR N J, SWANSON D M, et al. Estimating the prevalence of pseudomyxoma peritonei in europe using a novel statistical method[J]. Annals of Surgical Oncology, 2021, 28(1): 252-257. DOI: 10.1245/s10434-020-08655-8.
[6] YAN F, SHI F, LI X, et al. Clinicopathological characteris tics of pseudomyxoma peritonei originated from ovaries[J]. Cancer Management and Research, 2020, 12: 7569-7578. DOI: 10.2147/CMAR.S264474.
[7] KATAOKA A, ITO K, TAKEMURA N, et al. Immunohistochemical staining as supportive diagnostic tool for pseudomyxo ma peritonei arising from intraductal papillary mucinous neoplasm: A report of two cases and literature review[J]. Pancreatology, 2020, 20(6): 1226-1233. DOI: 10.1016/j.pan.2020.06.008.
[8] GOHDA Y, NOGUCHI R, HORIE T, et al. Pseudomyxoma peritonei of a mature ovarian teratoma caused by mismatch repair deficiency in a patient with Lynch syndrome: A case report[J]. BMC Medical Genetics, 2016, 17(1): 94. DOI: 10.1186/s12881-016-0356-5.
[9] LIANG L, ZHOU N, XU H, et al. Urachal mucinous adeno carcinoma with pseudomyxoma peritonei: A case report[J]. Medicine (Baltimore), 2017, 96(35): e7548. DOI: 10.1097/MD.0000000000007548.
[10] GONG Y, WANG X, ZHU Z. Pseudomyxoma peritonei originating from transverse colon mucinous adenocarcinoma: A case report and literature review[J]. Gastroenterology Research and Practice, 2020, 2020: 5826214.
[11] WAMBURA C, JUSABANI A, SHERMAN O, et al. Pseudomyxoma pleurii and peritonei secondary to sigmoid colon adeno carcinoma: A rare clinico-pathologico-radiological presen tation[J]. Oxford Medical Case Reports, 2018, 2018(10): omy057.
[12] CHUA T C, MORAN B J, SUGARBAKER P H, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. Journal of Clinical Oncology, 2012, 30(20): 2449-2456. DOI: 10.1200/JCO.2011.39.7166.
[13] ANSARI N, CHANDRAKUMARAN K, DAYAL S, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours[J]. European Journal of Surgical Oncology, 2016, 42(7): 1035-1041. DOI: 10.1016/j.ejso.2016.03.017.
[14] 夏奥, 马瑞卿, 翟喜超, 等. 细胞减灭术+腹腔热灌注化疗治疗腹膜假黏液瘤—单中心854例经验总结[J]. 中国肿瘤临床, 2020, 47(3): 145-151. DOI: 10.3969/j.issn.1000-8179.2020.03.609. XIA A, MA R Q, ZHAI X C, et al. Cytoreductive surgery combined with hyperthermic intraperitoneal chemotherapy for pseudomyxoma peritonei: A single-center experience with 854 patients[J]. Chinese Journal Clinical Oncology, 2020, 47(3): 145-151. DOI: 10.3969/j.issn.1000-8179.2020.03.609. (in Chinese).
[15] 贾红敏, 王志群, 卫宏江, 等. CT 腹膜癌指数对腹膜假黏液瘤可切除性价值研究[J]. CT 理论与应用研究, 2021, 30(3): 323-330. DOI: 10.15953/j.1004-4140.2021.30.03.05. JIA H M, WANG Z Q, WEI H J, et al. Value study of CT peritoneal carcinoma index in resectability of pseudomyxoma peritonei[J]. CT Theory and Applications, 2021, 30(3): 323-330. DOI: 10.15953/j.1004-4140.2021.30.03.05. (in Chinese).
[16] HAN X, ZHANG Q, ZHOU N, et al. Combined ultrasonography and CT for prognosis and predicting clinical outcomes of patients with pseudomyxoma peritonei[J]. European Radiology, 2023, 33: 2800-2808.
[17] LIANG L, WANG W, ZHOU N, et al. Value of preoperative ultrasound in evaluating the peritoneal cancer index of pseudomyxoma peritonei[J]. World Journal of Surgical Oncology, 2019, 17(1): 192. DOI: 10.1186/s12957-019-1730-5.
[18] HARMON R L, SUGARBAKER P H. Prognostic indicators in peritoneal carcinomatosis from gastrointestinal cancer[J]. International Seminars in Surgical Oncology, 2005, 2(1): 3. DOI: 10.1186/1477-7800-2-3.
[19] TAKAHASHI M, TAKEKAWA S, SUZUKI K, et al. CT findings of pseudomyxoma peritonei[J]. Rinsho Hoshasen. Clinical Radiography, 1989, 34(12): 1453-1457.
[20] 姚丹, 刘玉良, 祝安惠, 等. 腹膜假性黏液瘤的CT分型初探[J]. 中国临床医学影像杂志, 2012, 23(2): 122-124. DOI: 10.3969/j.issn.1008-1062.2012.02.016. YAO D, LIU Y L, ZHU A H, et al. Preliminary research on CT types of peritonei pseudomyxoma[J]. Journal of China Clinic Medical Imaging, 2012, 23(2): 122-124. DOI: 10.3969/j.issn.1008-1062.2012.02.016. (in Chinese).
[21] 贾红敏, 翟喜超, 王志群, 等. 小肠袢聚集对预测腹膜假黏液瘤患者小肠系膜挛缩的CT价值研究[J]. CT理论与应用研究, 2021, 30(2): 183-191. DOI: 10.15953/j.1004-4140.2021.30.02.05. JIA H M, ZHAI X C, WANG Z Q, et al. CT value study of small intestinal loop aggregation in predicting mesenteric contracture in patients with pseudomyxoma peritonei[J]. CT Theory and Applications, 2021, 30(2): 183-191. DOI: 10.15953/j.1004-4140.2021.30.02.05. (in Chinese).
[22] HOMEAG M, ENACHESCU V, PAVEL L E, et al. Pseudomyxoma peritonei[J]. Current Health Sciences Journal, 2009, 35(3): 193-196.
[23] NARASIMHAN V, WILSON K, BRITTO M, et al. Outcomes following cytoreduction and HIPEC for pseudomyxoma peritonei: 10-year experience[J]. Journal of Gastrointestinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract, 2020, 24(4): 899-906.
[24] ESQUIVEL J, SUGARBAKER P H. Clinical presentation of the pseudomyxoma peritonei syndrome[J]. The British Journal of Surgery, 2000, 87(10): 1414-1418. DOI: 10.1046/j.1365-2168.2000.01553.x.
[25] LIU Y, ISHIBASHI H, HIRANO M, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy for pseu domyxoma peritonei arising from urachus[J]. Annals of Surgical Oncology, 2015, 22(8): 2799-2805. DOI: 10.1245/s10434-014-4336-8.
[26] 陈小勇, 徐敬慈, 李芹芹, 等. CT 征象对胰腺神经内分泌肿瘤侵袭性行为的预测价值[J]. CT 理论与应用研究, 2022, 31(3): 399-407. DOI: 10.15953/j.ctta.2021.082. CHEN X Y, XU J C, LI Q Q, et al. The predictive value of CT findings in invasive behavior of pancreatic neuroendocrine tumors[J]. CT Theory and Applications, 2022, 31(3): 399-407. DOI: 10.15953/j.ctta.2021.082. (in Chinese).
[27] 任阿红, 刘军, 杨大为, 等. 肝囊型包虫病与粘液性囊性肿瘤的影像学鉴别诊断[J]. 放射学实践, 2022, 37(9): 1080-1084. REN A H, LIU J, YANG D W, et al. Imaging differential diagnosis of hepatic cystic echinococcosis and mucinous cystic neoplasm[J]. Radiologic Practice, 2022, 37(9): 1080-1084. (in Chinese).




 下载:
下载: