Models Developed Based on Baseline Gastric Cancer and Metastatic Lymph Node CT Radiomics and Clinical Features for Predicting Early Postoperative Lymph Node Recurrence
-
摘要:
目的:基于原发肿瘤及转移性淋巴结的基线CT影像组学及临床特征构建胃癌根治术后淋巴结早期复发的预测模型,并对比其预测效能。方法:回顾性收集来自中心1和中心2的确诊为胃癌伴淋巴结转移并接受根治术的连续性200例患者的基线CT及临床资料,将医疗中心1的病例按7∶3随机分配到训练组(n=110)和内部验证组(n=48),将医疗中心2纳入的病例分配到外部验证组(n=42)。对原发肿瘤、转移性淋巴结,分别在CT图像上勾画感兴趣区,并提取其相应特征。采用独立样本t检验或U检验,筛选出具有统计学意义的影像组学特征及临床病理特征,通过Lasso回归分析获取建模的核心特征,分别构建影像学模型、临床特征模型以及影像组学-临床特征联合模型。采用受试者工作特征曲线下面积(AUC)、敏感性、特异性、DeLong检验及校准曲线评价模型的预测效能。结果:筛选出原发肿瘤影像组学特征14个,转移性淋巴结影像组学特征12个、临床特征3个。临床特征包括转移性淋巴结数目、淋巴结形态及肿瘤标志物。基于原发肿瘤建立的影像组学模型AUC、敏感性、特异性在训练组分别为0.844、0.868和0.706,在内部验证组分别为0.802、0.879和0.600,在外部验证组分别为0.791、0.714和0.786。基于转移淋巴结建立的影像组学模型AUC、敏感性、特异性在训练组分别为0.898、0.753和0.941,在内部验证组分别为0.842、0.879和0.667,在外部验证组分别为0.825、0.828和0.769。在训练组、内部验证组及外部验证组的DeLong检验显示,原发肿瘤影像组学-临床特征联合模型AUC分别为0.970、0.961和0.976,转移淋巴结影像组学−临床特征联合模型AUC分别为0.943、0.957和0.977;在训练组、内部验证组及外部验证组在原发肿瘤影像组学模型、转移性淋巴结影像组学模型、临床模型以及原发肿瘤、转移性淋巴结影像组学分别与临床的联合模型的AUC之间,差异均具有统计学意义。结论:基线转移性淋巴结CT影像组学模型在预测胃癌根治术后淋巴结早期复发方面的效能优于原发肿瘤模型。
Abstract:Objective: To develop models based on baseline clinical and computed tomography (CT) radiomic features of primary tumors and metastatic lymph nodes to predict early lymph node recurrence after radical gastrectomy in patients with gastric cancer. Methods: The preoperative computed tomography (CT) and clinical data of 200 consecutive patients diagnosed with gastric cancer and lymph node metastasis who underwent radical surgery at Medical Centers 1 and 2 were collected retrospectively. Cases from Medical Center 1 were randomly assigned to a training group (n=110) and an internal validation group (n=48) in a 7:3 ratio. Cases from Medical Center 2 were assigned to an external validation group (n=42). The regions of interest of the primary tumors and metastatic lymph nodes were marked on the CT images, and their corresponding features were extracted. Using an independent sample t-test or U-test, statistically significant radiomics and clinical features were selected. LASSO regression analysis was used to obtain the core features of the primary tumors and metastatic lymph nodes. Subsequently, a clinical model, radiomic models of the primary tumors and metastatic lymph nodes, and radiomic models for the primary tumors and metastatic lymph nodes individually combined with clinical features were constructed. The predictive performance of the models was evaluated and compared using the area under the receiver operating characteristic (ROC) curve, sensitivity, specificity, DeLong’s test, and calibration curve. Results: Fourteen radiomic features of the primary tumor, 12 radiomic features of metastatic lymph nodes, and three clinical features were selected to construct individual prediction models. The clinical features included the number of metastatic lymph nodes, lymph node morphology, and tumor markers. The AUC, sensitivity, and specificity of the radiomics model established based on the primary tumor were 0.844, 0.868, and 0.706 in the training group; 0.802, 0.879, and 0.600 in the internal validation group; and 0.791, 0.714, and 0.786 in the external validation group, respectively. The AUC, sensitivity, and specificity of the radiomics model based on metastatic lymph nodes were 0.898, 0.753, and 0.941 in the training group, 0.842, 0.879, and 0.667 in the internal validation group, and 0.825, 0.828, and 0.769 in the external validation group, respectively. In the training, internal validation, and external validation groups, the DeLong test showed that the AUC values of the combined model integrating primary tumor radiomic features and clinical features were 0.970, 0.961, and 0.976, respectively. The AUC values of the combined model integrating metastatic lymph node radiomic features and clinical features were 0.943, 0.957, and 0.977, respectively. In the training, internal validation, and external validation groups, there were significant differences in the AUC between the primary tumor radiomics model, metastatic lymph node radiomics model, clinical model, and the combined models by integrating the primary tumor radiomics features or the metastatic lymph node radiomics features with clinical features. Conclusion: The preoperative metastatic lymph node CT radiomics model was more effective than the primary tumor radiomics model in predicting early lymph node recurrence after radical gastrectomy for gastric cancer.
-
Keywords:
- prediction model /
- gastric cancer /
- metastatic lymph node /
- lymph node recurrence /
- risk factors
-
胃癌(gastric cancer,GC)在所有癌症发生率排第5位,是第3大最常见的癌症死亡原因,男性发病率是女性的两倍[1],约70%的病例发生在亚洲,其中中国占比超过一半[2]。早期胃癌预后较好,但确诊率较低,绝大多数患者就诊时已处于进展期,5年生存率极低[3]。胃癌早期淋巴结转移率约10%,而胃癌晚期淋巴结转移率则高达70%以上,即使根治性切除,其术后复发率仍可达90%[4]。
影像组学是一种新兴、无创方法,能将影像转换为可挖掘的数据,并产生成千上万个定量特征,提供肿瘤的生物学特征和内部异质性潜在信息,从而提高疾病的诊断和预后效能[5]。增强CT目前已常规用于基线评估胃癌原发灶、淋巴结转移及术后复发的判断[6]。同时,CT被美国国家综合癌症网络推荐为评估淋巴结转移(lymph node metastasis,LNM)及淋巴结复发(lymph node recurrence,LNR)的一线成像技术。文献报道,影像组学特征与临床特征构建的联合模型能提高GC患者LNM及LNR在癌症中的预测准确性[7]。
目前,通过原发肿瘤影像组学特征预测LNM的研究较多,预测GC根治术后LNR的亦有相关报道;通过基线转移淋巴结影像组学特征预测LNM的研究较少,但未见预测根治术后LNR的相关报道[8-11]。本研究旨在基于原发肿瘤和转移淋巴结基线增强CT分别构建预测模型,并对比评价其预测效能。
1. 资料与方法
1.1 一般资料
本研究回顾性收集2016年11月至2022年5月川北医学院附属医院(中心1)及2017年1月至2021年6月本地另一家大型三甲医院(中心2)收治的连续性胃腺癌患者200例,结合临床、肿瘤指标及影像学检查,将病例分为淋巴结复发组和未复发组。
本研究已通过本院伦理委员会的审查(审批号:2024 ER264-1),并豁免知情同意。
1.2 纳入及排除标准
纳入标准:①有完整的基线及术后腹部CT平扫及增强扫描影像数据,直接手术治疗患者CT检查与手术治疗前的时间间隔,转化治疗患者CT检查与术前新辅助化疗前的时间间隔均在两周内;②基线CT显示无其他脏器转移;③手术方式为胃腺癌切除术+D2淋巴结清除术;④术后病理学确诊为胃腺癌,伴区域淋巴结转移;⑤术后随访时间为2年。
排除标准:①合并其他恶性肿瘤病史;②CT显示胃腔充盈不佳或存在运动伪影;③患者临床资料不完整。
将医疗中心1的病例按照7∶3比例随机分配到训练组(n=110)和内部验证组(n=48),将医疗中心2纳入的病例分配到外部验证组(n=42),收集的临床资料如表1所示。
表 1 胃癌术后淋巴结复发与未复发组的临床资料Table 1. Clinical data of groups with lymph node recurrence and non-recurrence after gastric cancer surgery变量 未复发组(n=137) 复发组(n=63) 性别(男vs.女) 99 vs. 38 50 vs. 13 年龄 ≤63 62 30 >63 75 33 解剖分布 贲门 47 24 胃体 33 18 胃窦 26 11 贲门-胃体 29 7 胃窦-胃体 2 3 T分期 T1 6 1 T2 15 6 T3 46 14 T4 70 42 N分期 N1 72 24 N2 50 24 N3 15 15 肿瘤最大径 <5 cm 85 40 ≥5 cm 52 23 脉管浸润 否 81 29 是 56 34 神经浸润 否 77 28 是 60 35 累及淋巴结站数 1站 63 11 2站 39 18 3站 26 20 4站 9 14 最大淋巴结短径/mm 6<短径≤10 96 33 10<短径≤15 28 16 短径>15 13 14 转移淋巴结数目/枚 数目≤7 82 3 7<数目<15 48 35 数目≥15 7 25 淋巴结形态 规则、清楚 121 11 不规则、模糊 8 26 融合、坏死 8 26 手术方式 部分切除 62 26 全部切除 75 37 辅助治疗 无 23 10 新辅助化疗 5 4 新辅助化疗+术后化疗 18 14 术后化疗 88 33 术后化疗+免疫治疗 3 2 肿瘤标志物 阴性 110 18 阳性 37 45 特别说明,表1中淋巴结分站,采用的是日本胃癌学会《胃癌处理规约》[12]中淋巴结编号和分站及《胃癌淋巴转移》[13]中胃癌胃周围淋巴结分组与分站,将淋巴结分为4站16组,第1站包括第1~6组,第2站包括第7~9组,第3站包括第10~13组,第4站包括第14~16组。
1.3 仪器设备及扫描参数
中心1纳入患者采用GE LightSpeed VCT 64层CT进行全腹部增强扫描。每次扫描在一次屏气中完成。扫描参数:管电压120 kV,管电流200 mA,准直器宽度0.6×64 mm,球管转速0.5 s/r,螺距=0.9∶1,扫描层厚1 mm,矩阵512×512。
中心2纳入患者采用Siemens SOMATOM Definition Flash CT进行全腹部增强扫描。扫描参数:管电压120 kV,管电流320 mA,准直器宽度0.6×64 mm,球管转速0.5 s/r,螺距0.6∶1,扫描层厚1 mm,矩阵512×512。
所有患者在行腹部CT增强扫描时,动脉期图像采集在开始注射对比剂25~30 s后进行,门静脉期图像采集在开始注射对比剂60~65 s后进行。
1.4 胃癌术后淋巴结复发的判断标准
胃癌术后淋巴结复发的诊断,根据日本胃癌学会《胃癌处理规约》15版[12]及《胃癌治疗指南》5版[14],结合金元贞等[15]及李彦磊[16]的研究,联合CT特征及肿瘤标志物。
判断标准为:①随访过程中新发现增大淋巴结;②淋巴结融合或坏死;③淋巴结形态为球形或不规则形,边缘清楚或分叶;④淋巴结均匀强化或环形强化;⑤肿瘤标志物CEA、CA19-9检测阳性或明显升高。符合①~③中至少2项,或满足④~⑤中任1项,则判定为淋巴结复发。
1.5 感兴趣区勾画和影像组学特征提取
本研究选取增强扫描门静脉期CT横断面图像,应用3D Slicer(Version 5.2.2)软件对感兴趣区(region of interest,ROI)进行勾画及影像组学特征提取,采用手动方式分别勾画原发肿瘤及转移淋巴结的轮廓,勾画时尽量避开空气、水、胃内容物及胃周脂肪(图1)。
观察者1勾画所有病例,观察者2在不知道患者资料的情况下随机抽取训练组连续性50例进行勾画,随后观察者1对观察者2随机抽取的50例再次进行勾画,重建肿瘤立体图,并提取出影像组学特征。
1.6 组内及组间一致性检验
观察者1首先勾画所有病例,之后由观察者1和观察者2分别对观察者2随机抽取的连续性50例患者ROI进行勾画,并提取特征。
采用组内及组间相关系数(intraclass correlation coefficient,ICC)评估观察者1和观察者2对特征提取的一致性。当ICC<0.5,表示一致性较差;0.5≤ICC<0.75,表示一致性中等;0.75≤ICC<0.9,表示一致性良好;ICC≥0.90,表示一致性极佳[17]。
本研究中选取ICC≥0.75的特征用于后续统计分析。
1.7 特征降维与筛选
为避免维数灾难,减少影像组学特征提取偏倚,我们将通过以下步骤来筛选出最优的影像组学特征。
第1步,将所提取出的影像组学特征应用Z-score进行标准化预处理,所得到的数据均以7∶3的比例,随机分为训练组和验证组。第2步,独立样本通过t检验或U检验,从训练组中选择出具有潜在意义的特征。第3步,采用最小绝对收缩和选择算子法(Lasso)对高维数据进行降维分析,筛选出核心影像组学特征。最后,运用最小准则(1-SE),采用10倍交叉验证法以调整筛选的特征的正则化参数λ。
1.8 模型的构建与评估
在训练组中,应用Logistic回归分析,将所得到的原发肿瘤及转移性淋巴结核心影像组学特征,分别构建其影像组学模型,并建立临床模型,进一步将原发肿瘤及转移性淋巴结影像组学特征分别与临床特征联合,构建相应的影像组学−临床特征联合模型,再用验证组分别对上述模型的预测效能进行验证,接着通过计算受试者工作特征曲线下面积(area under the receiver operating characteristic curve,AUC)、敏感性、特异性,以评估上述模型在训练组和验证组的预测效能。
通过DeLong检验比较模型分别在训练组、内部验证组及外部验证组再预测效能差异的显著性。最后采用校准曲线评估模型的效能。
2. 结果
2.1 一般临床特征
本研究纳入胃腺癌患者共200例,包括训练组110例、内部验证组48例、外部验证组42例。
经过单因素Logistic回归分析,转移性淋巴结数目、淋巴结形态及肿瘤标志物在3组间均具有统计学差异(P<0.05),而性别、年龄、肿瘤解剖分布、T分期、N分期、肿瘤最大径、脉管浸润、神经浸润、累及淋巴结站数、最大淋巴结短径及辅助治疗在3组间不具有统计学差异(P>0.05)(表2)。
表 2 临床病理因素的单因素Logistic回归分析筛选出独立危险因素Table 2. Univariate logistic regression analysis of clinicopathological factors to screen independent risk factors变量 训练组(n=110) P 内部验证组(n=48) P 外部验证组(n=42) P 未复发组 (n=76) 复发组(n=34) 未复发组 (n=33) 复发组(n=15) 未复发组 (n=28) 复发组(n=14) 转移淋巴结
数目/枚数目≤7 36(47.4) 19(55.9) < 0.001 22(66.7) 6(40.0) 0.005 25(86.2) 7(53.8) < 0.001 7<数目<15 3(8.8) 4(5.3) 3(20.0) 3(9.1) 0(0.0) 0(0.0) 数目≥15 36(47.4) 12(35.3) 8(24.2) 6(40.0) 4(13.8) 6(46.2) 淋巴结形态 规则、清楚 69(90.8) 17(50.0) < 0.001 28(84.8) 5(33.3) < 0.001 22(78.6) 9(64.3) 0.004 不规则、模糊 8(23.5) 4(5.3) 2(13.3) 3(9.1) 4(28.6) 2(7.1) 融合、坏死 3(3.9) 9(26.5) 2(6.1) 8(53.3) 4(14.3) 1(7.1) 肿瘤标志物 阴性 63(82.9) 13(17.1) < 0.001 26(78.8) 7(21.2) < 0.001 21(75.0) 7(25.0) 0.017 阳性 12(35.3) 22(64.7) 3(20.0) 12(80.0) 5(35.7) 9(64.3) 2.2 影像组学特征提取的一致性检验
本研究中,原发肿瘤与转移性淋巴结分别提取出
1223 个影像学特征预测胃癌术后淋巴结复发。原发肿瘤影像组学特征中,观察者内一致性检验显示,ICC≥0.75的特征共有
1187 个,ICC<0.75的特征有36个;观察者间一致性检验显示,ICC≥0.75的影像组学特征有1177 个,ICC<0.75的特征有46个。经过一致性分析共排除52个原发肿瘤的影像组学特征,剩余的
1171 个一致性较好的影像组学特征纳入下一步分析(图2)。转移性淋巴结影像组学特征中,观察者内一致性检验显示,ICC≥0.75的影像组学特征共有
1138 个,ICC<0.75的影像组学特征有85个;观察者间一致性检验显示,ICC≥0.75的影像组学特征有938个,ICC<0.75的影像组学特征有285个。经过一致性分析共排除298个转移性淋巴结影像组学特征,剩余的925个一致性较好的影像组学特征纳入下一步分析(图2)。
2.3 影像组学特征降维与筛选
对于原发肿瘤与转移性淋巴结,经过一致性检验所得到的影像组学特征,采用独立样本t检验或 Mann-Whitney U检验,剔除掉无统计学差异的影像组学特征,将具有统计学差异的影像组学特征纳入下一步Lasso回归分析,其中原发肿瘤共筛选出14个核心影像组学特征,转移性淋巴结共筛选出12个核心影像组学特征,然后应用10倍交叉验证,在1-SE准则下选择最佳的正则化参数λ(图3)。
![]() 图 3 使用最小绝对收缩和选择算子(Lasso)回归筛选预测胃腺癌术后淋巴结复发的影像组学特征注:(a)和(b)分别为原发肿瘤及转移性淋巴结影像组学特征的Lasso系数分布收敛图。(c)和(d)采用10倍交叉验证法调整筛选的特征的正则化参数(λ),左右虚线分别表示最小准则和1标准误差(1-SE)准则。Figure 3. Feature selection using the least absolute shrinkage and selection operator (LASSO) regression to predict lymph node recurrence after gastric cancer surgery
图 3 使用最小绝对收缩和选择算子(Lasso)回归筛选预测胃腺癌术后淋巴结复发的影像组学特征注:(a)和(b)分别为原发肿瘤及转移性淋巴结影像组学特征的Lasso系数分布收敛图。(c)和(d)采用10倍交叉验证法调整筛选的特征的正则化参数(λ),左右虚线分别表示最小准则和1标准误差(1-SE)准则。Figure 3. Feature selection using the least absolute shrinkage and selection operator (LASSO) regression to predict lymph node recurrence after gastric cancer surgery2.4 影像组学模型构建及预测效能的评估与验证
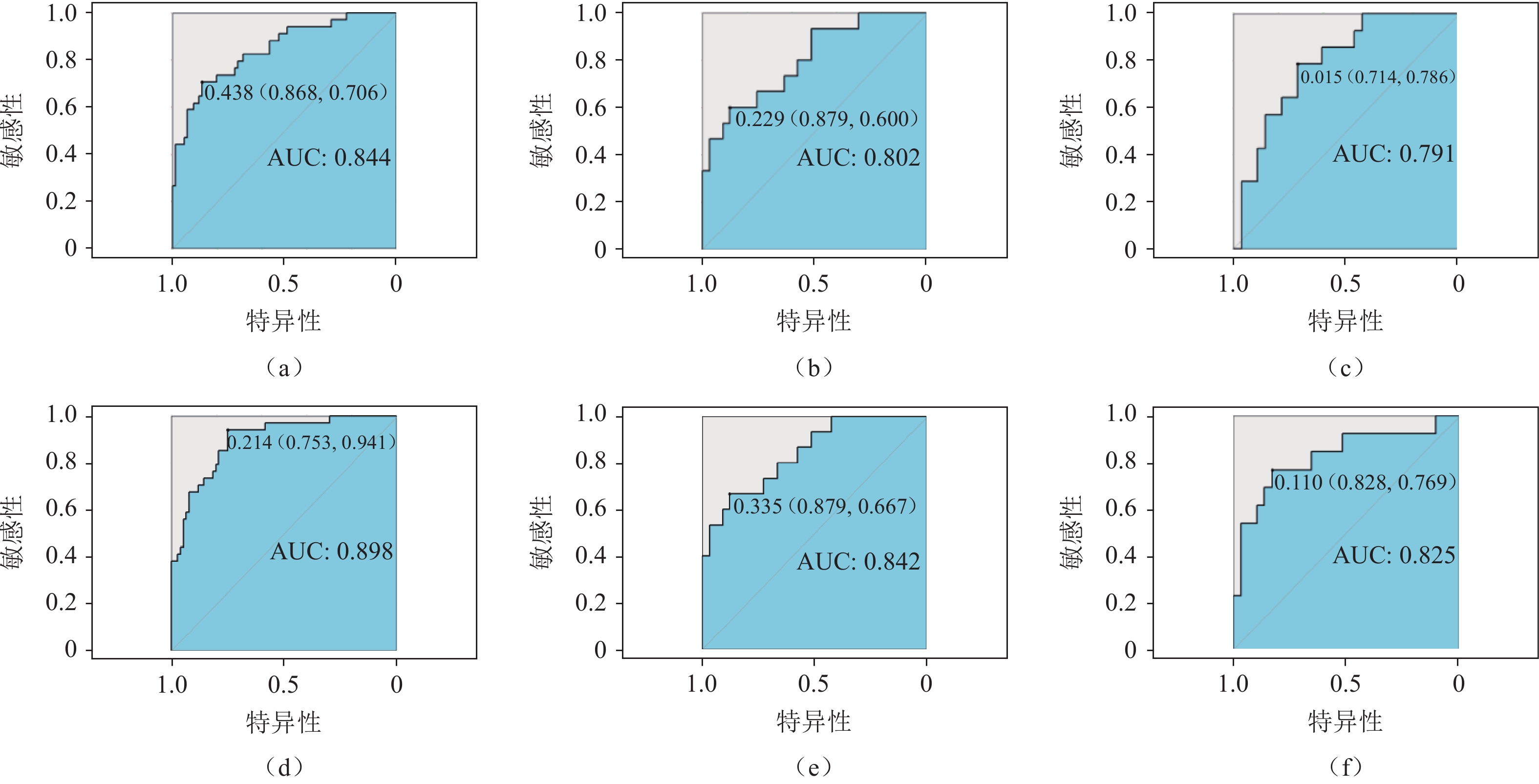
对原发肿瘤构建的影像组学模型,AUC、敏感性、特异性,在训练组分别为0.844、0.868、0.706,在内部验证组分别为0.802、0.879、0.600,在外部验证组分别为0.791、0.714、0.786;对转移性淋巴结构建的影像组学模型,AUC、敏感性、特异性,在训练组分别为0.898、0.753、0.941,在内部验证组分别为0.842、0.879、0.667,在外部验证组分别为0.825、0.828、0.769(图4)。
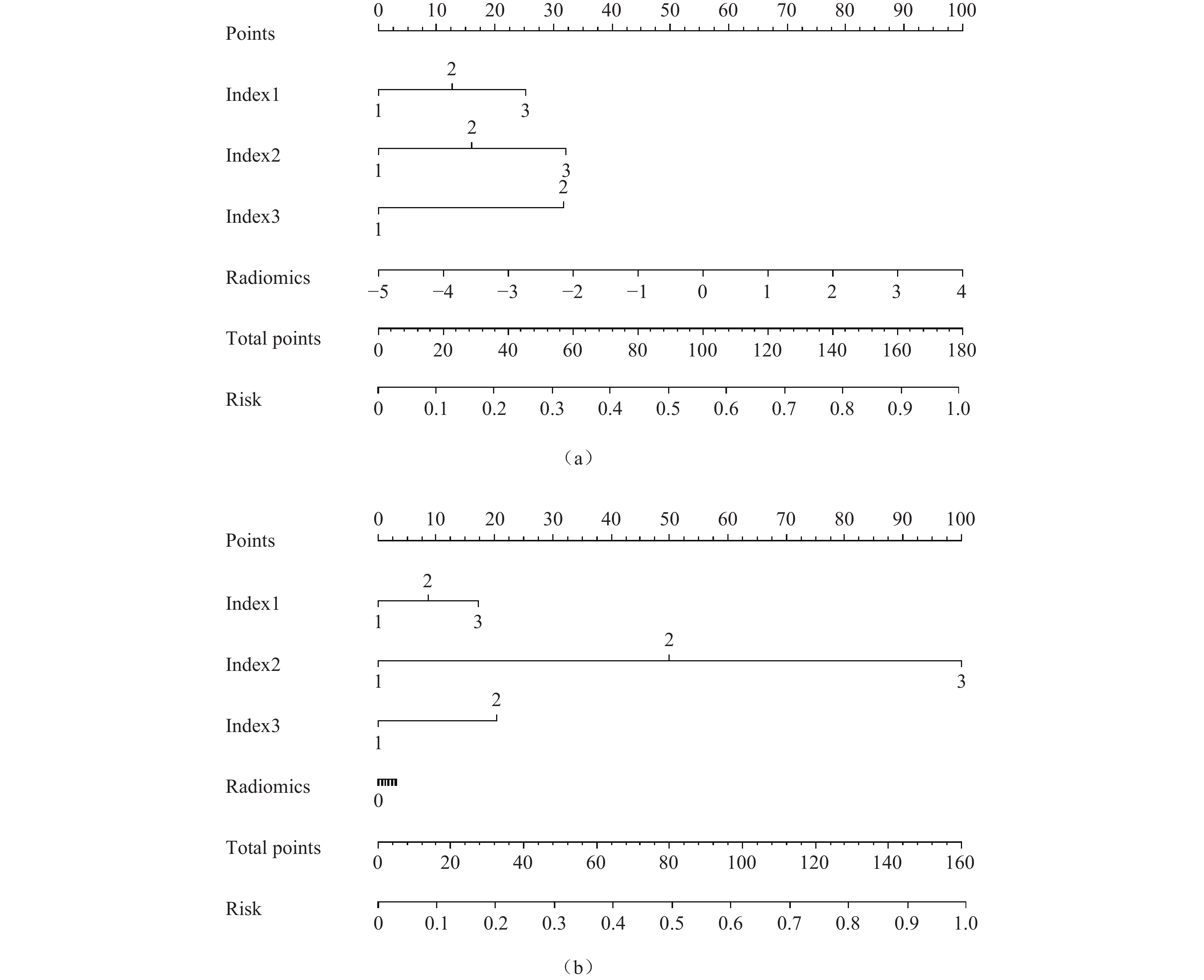
基于原发肿瘤的影像组学特征、转移性淋巴结的影像组学特征,分别联合有统计学意义的临床特征,绘制诺莫图(图5),分别构建原发肿瘤、转移性淋巴结影像组学−临床特征联合模型,通过DeLong检验来比较模型预测效能的差异性。
![]() 图 5 原发肿瘤影像组学−临床特征联合模型(a)及转移性淋巴结影像组学−临床特征联合模型(b)诺莫图注:从评分标尺上分别找到患者index1(转移淋巴结数目)、index2(淋巴结形态)、index3(肿瘤标志物)及radiomics特征对应的分数,将其相加得到评分,再根据总评分在概率预测标尺上找到患者出现淋巴结复发的预测概率。Figure 5. Nomogram for the combined model of primary tumor radiomics and clinical features (a). The combined model of metastatic lymph node radiomics and clinical features (b)
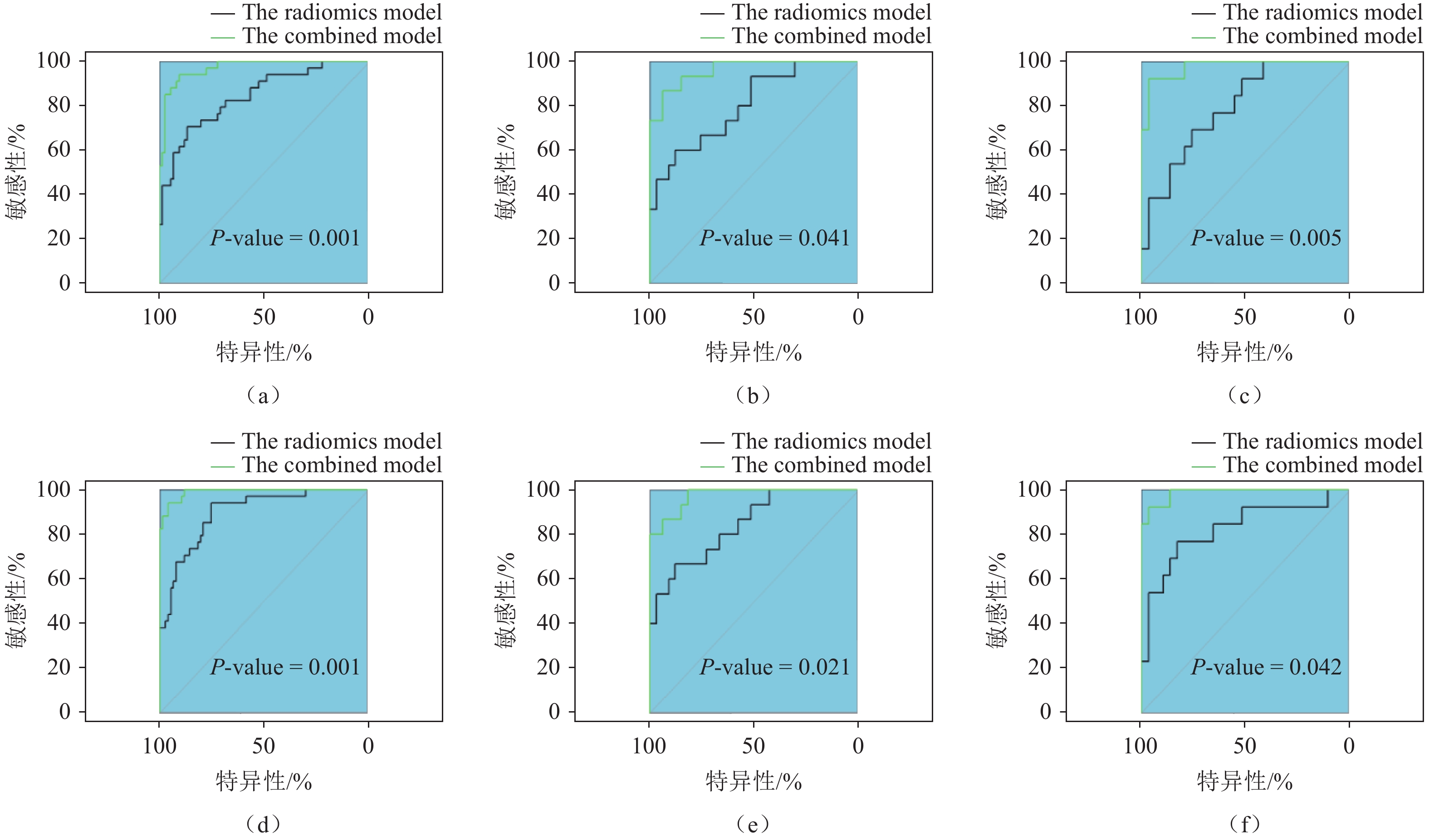
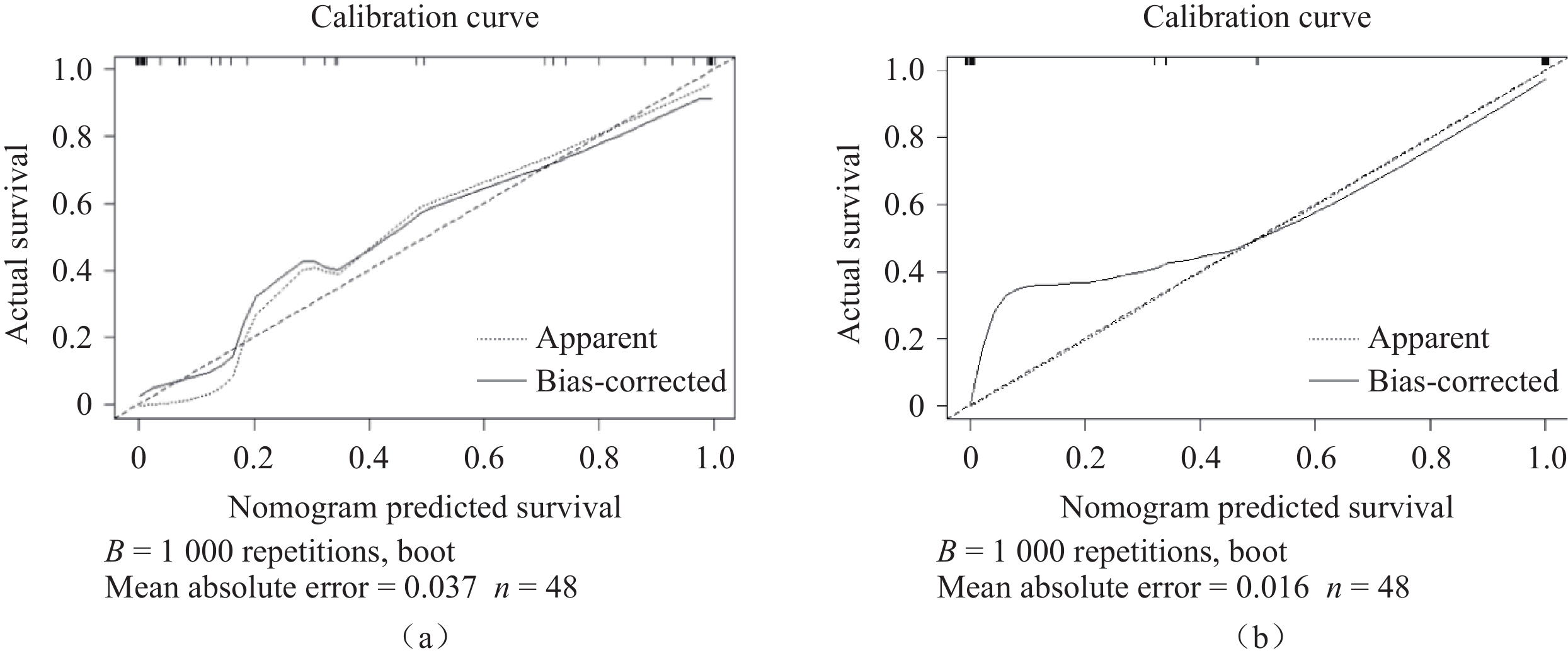
图 5 原发肿瘤影像组学−临床特征联合模型(a)及转移性淋巴结影像组学−临床特征联合模型(b)诺莫图注:从评分标尺上分别找到患者index1(转移淋巴结数目)、index2(淋巴结形态)、index3(肿瘤标志物)及radiomics特征对应的分数,将其相加得到评分,再根据总评分在概率预测标尺上找到患者出现淋巴结复发的预测概率。Figure 5. Nomogram for the combined model of primary tumor radiomics and clinical features (a). The combined model of metastatic lymph node radiomics and clinical features (b)对于原发肿瘤,影像组学−临床特征联合模型的预测效能高于单一原发肿瘤影像组学模型,且差异具有统计学意义(训练组P=0.001,内部验证组P=0.041,外部验证组P=0.005)。对于转移性淋巴结,影像组学−临床特征联合模型优于单一转移性淋巴结影像组学模型的预测效能,且差异具有统计学意义(训练组P=0.001、内部验证组P=0.021、外部验证组P=0.042)(图6和表3)。通过校准曲线分析显示,转移性淋巴结影像组学−临床特征联合模型优于原发肿瘤影像组学−临床特征联合模型(图7)。
![]() 图 6 原发肿瘤影像组学−临床特征联合模型及转移性淋巴结影像组学−临床特征联合模型DeLong检验注:原发肿瘤影像组学−临床特征联合模型在训练组(a)、内部验证组(b)及外部验证组(c)的预测效能;转移性淋巴结影像组学−临床特征联合模型在训练组(d)、内部验证组(e)及外部验证组(f)的预测效能。Figure 6. DeLong test for the combined model of primary tumor radiomics and clinical features and the combined model of metastatic lymph node radiomics and clinical features表 3 原发肿瘤及转移性淋巴结预测模型DeLong检验AUC值对比Table 3. Comparison of AUC values of the DeLong test for primary tumor and metastatic lymph node models
图 6 原发肿瘤影像组学−临床特征联合模型及转移性淋巴结影像组学−临床特征联合模型DeLong检验注:原发肿瘤影像组学−临床特征联合模型在训练组(a)、内部验证组(b)及外部验证组(c)的预测效能;转移性淋巴结影像组学−临床特征联合模型在训练组(d)、内部验证组(e)及外部验证组(f)的预测效能。Figure 6. DeLong test for the combined model of primary tumor radiomics and clinical features and the combined model of metastatic lymph node radiomics and clinical features表 3 原发肿瘤及转移性淋巴结预测模型DeLong检验AUC值对比Table 3. Comparison of AUC values of the DeLong test for primary tumor and metastatic lymph node models项目 模型类别 训练组 内部验证组 外部验证组 原发肿瘤 影像组学模型 0.844 0.802 0.791 临床模型 0.897 0.831 0.962 影像组学−临床特征联合模型 0.970 0.961 0.976 转移性淋巴结 影像组学模型 0.897 0.842 0.825 临床模型 0.943 0.957 0.977 影像组学−临床特征联合模型 0.990 0.973 0.987 3. 讨论
转移性淋巴结的影像组学特征有助于预测GC患者的预后和指导决策,但大多数都局限于形态学特征(如大小、形状等)。
本研究开发并验证了基于转移性淋巴结影像学模型来预测GC术后LNR,通过DeLong检验及校准曲线与原发肿瘤模型进行比较,并于基于原发肿瘤影像学模型进行了对比,进一步阐明了基于转移性淋巴结影像学模型预测GC术后LNR的优势。
3.1 临床模型分析
由于转移性淋巴结免疫抑制性细胞上调(如MDSCs,Tregs),而免疫效应细胞下调(如CD8+以及CD8+CD28+细胞等),导致胃癌转移性淋巴结内微环境的免疫状态普遍受到抑制,因而癌细胞能够在淋巴结中适应并生长,这一点不同于原发肿瘤[18-20]。韩国高等科学技术研究院的研究人员在《Science》杂志报道称,淋巴结中的癌细胞能够促进与脂肪酸氧化分解相关的基因表达,而脂肪酸氧化蛋白YAP可以刺激淋巴结中的肿瘤细胞发生脂肪酸氧化,这是淋巴结复发的关键代谢特征[21]。而在本研究中筛选出的3个临床病理特征中,2个是淋巴结特征(淋巴结数目、形态),1个是病理特征(肿瘤标志物),这也从侧面印证了转移性淋巴结对胃癌术后淋巴结复发的重要性。
N分期是GC术后LNR的重要指标,淋巴结转移数目和胃癌患者根治术后生存时间有关,不同分站检取的淋巴结数量不同也会影响预后。在朱志等[22]的研究中,转移性淋巴结越多,则反映原发肿瘤生物学特性越恶劣,循环中游离的肿瘤细胞和脏器微转移的可能性越大。本研究中,在训练组、内部验证组及外部验证组中,复发组的转移淋巴结数目明显高于未复发组转移性淋巴结数目,与前述研究一致。
关于肿瘤转移性淋巴结坏死机制目前尚无统一定论,其可能原因是,肿瘤刺激巨细胞释放α-TNF、干扰素,刺激自然杀伤淋巴细胞,并作用于淋巴肿瘤组织从而造成组织坏死。淋巴细胞是肿瘤免疫的主要细胞,效应细胞主要是T淋巴细胞和NK细胞。主要效应细胞−Ts细胞通过释放穿孔素(Perforin)及颗粒酶来促使细胞凋亡从而杀伤肿瘤细胞;而Th细胞可以分泌大量的细胞因子如,穿孔素、丝氨酸酯酶、肿瘤坏死因子、干扰素及白介素等,引起靶细胞崩解坏死。NK细胞是非抗原依赖性免疫效应细胞,可直接杀伤肿瘤细胞。Haugen[23]的研究中认为,淋巴结数目与转移性淋巴结坏死关系密切,而淋巴结数目又与术后淋巴结复发相关,因此转移性淋巴结坏死与术后复发存在一定的相关性。我们的研究中,复发组中转移淋巴结坏死比例较未复发组转移性淋巴结比例高出将近一倍。
肿瘤浸润淋巴细胞是LNR的潜在预测因子[24],肿瘤细胞一旦进入淋巴管内,则可通过淋巴回流途径发生淋巴结复发。在本研究中,淋巴结转移站数在训练组及验证组中均具有统计学差异,但在外部验证组中则不具有,可能是不同地区、不同医院手术清除淋巴结的范围存在差异导致。
有研究指出,不同组织学分型、不同解剖部位淋巴结诊断采取不同的阈值,淋巴结大小(短径)与肿瘤细胞是否浸润淋巴结没有必然联系[25]。本研究中,淋巴结大小(短径)未能进入模型,与研究结果一致。
有研究提出,随着原发肿瘤直径增大,淋巴结复发风险亦随之增加[26];也有研究认为,肿瘤直径大小与淋巴结复发并无相关性[27]。游佳等[28]的研究则认为,肿瘤最大径、浸润深度、与淋巴系统的接触面积,均与淋巴结复发相关。
既往研究表明,脉管及神经浸润是GC术后LNR的独立影响因素,对预后有着重要影响[29]。但在我们的研究中,可能是由于在进行肿瘤分割提取影像组学特征时已包含在影像组学特征内,而未单独纳入模型。T分期主要依据肿瘤解剖特征进行评估,并未包含肿瘤异质性及患者相关个体化预测信息,难以做到精准评估[30],亦未能单独纳入模型。国外研究认为辅助治疗能有效改善术后复发[31-32]。但在我们的研究中,可能与地区间的手术及辅助治疗标准差异有关,辅助治疗未能纳入模型。
3.2 影像组学模型分析
国外有研究提出[6, 33-34],原发肿瘤和淋巴结的影像组学特征均可预测LNR,因此在构建影像组学模型时,我们也要考虑到转移性淋巴结对术后LNR的影响。目前已发表的预测LNR的非侵入性预测因子的影像组学研究中,主要使用原发肿瘤影像组学特征,在本研究中,我们创新性的开发了基于转移性淋巴结影像组学模型来预测GC术后LNR。
本研究选取腹部增强CT门脉期图像进行ROI勾画并提取特征,经过一致性检验、特征降维及筛选,得到14个原发肿瘤影像组学特征和12个转移性淋巴结影像组学特征,分别与具有统计学差异的临床特征结合,构建原发肿瘤影像组学−临床特征联合模型和转移性淋巴结影像组学−临床特征联合模型。
DeLong检验结果表明,两种联合模型在训练组、内部验证组及外部验证组均具有统计学差异,AUC值表明联合模型在训练组、内部验证组及外部验证组中均高于对应的单一模型,与黄列彬等[35]的研究一致。
转移性淋巴结影像组学−临床特征联合模型,在训练组、内部验证组及外部验证组的AUC值均高于原发肿瘤影像组学−临床特征模型,表明转移性淋巴结影像组学−临床特征联合模型优于原发肿瘤影像组学−临床特征联合模型。校准曲线也显示,转移性淋巴结影像组学−临床特征联合模型的预测效能优于原发肿瘤影像组学−临床特征联合模型。
3.3 本研究局限性
本研究也存在一些局限性。①在本研究只选取了门静脉期进行ROI勾画,但根据Gao等[36]的研究,双期增强图像能提高模型预测性能,但由于CT动脉期图像的层厚较厚且不均匀,因此我们未提取动脉期影像组学特征。②本研究关注的是原发肿瘤及转移性淋巴结影像组学特征,未将瘤周脂肪组织作为感兴趣区进行勾画。③本研究没有考虑更多的基因组学、代谢等特征。
多维度数据可提高GC患者LNR的预测能力,并提供更多的临床决策支持。在未来的研究中,我们将逐步解决以上问题,构建一个更优的预测模型。
4. 结论
本研究中,转移性淋巴结数目、淋巴结形态及肿瘤标志物为预测胃癌术后LNR的独立临床危险因素,将这3个危险因素与原发肿瘤、转移性淋巴结影像组学特征联合并分别构建相应的联合模型,绘制诺莫图,通过DeLong检验,显示转移性淋巴结影像组学−临床特征联合模型预测效能优于原发肿瘤影像组学−临床特征联合模型,而校准曲线也显示转移淋巴结模型的效能更好,将对临床预测胃癌术后淋巴结复发提供更优的模型。
-
图 3 使用最小绝对收缩和选择算子(Lasso)回归筛选预测胃腺癌术后淋巴结复发的影像组学特征
注:(a)和(b)分别为原发肿瘤及转移性淋巴结影像组学特征的Lasso系数分布收敛图。(c)和(d)采用10倍交叉验证法调整筛选的特征的正则化参数(λ),左右虚线分别表示最小准则和1标准误差(1-SE)准则。
Figure 3. Feature selection using the least absolute shrinkage and selection operator (LASSO) regression to predict lymph node recurrence after gastric cancer surgery
图 5 原发肿瘤影像组学−临床特征联合模型(a)及转移性淋巴结影像组学−临床特征联合模型(b)诺莫图
注:从评分标尺上分别找到患者index1(转移淋巴结数目)、index2(淋巴结形态)、index3(肿瘤标志物)及radiomics特征对应的分数,将其相加得到评分,再根据总评分在概率预测标尺上找到患者出现淋巴结复发的预测概率。
Figure 5. Nomogram for the combined model of primary tumor radiomics and clinical features (a). The combined model of metastatic lymph node radiomics and clinical features (b)
图 6 原发肿瘤影像组学−临床特征联合模型及转移性淋巴结影像组学−临床特征联合模型DeLong检验
注:原发肿瘤影像组学−临床特征联合模型在训练组(a)、内部验证组(b)及外部验证组(c)的预测效能;转移性淋巴结影像组学−临床特征联合模型在训练组(d)、内部验证组(e)及外部验证组(f)的预测效能。
Figure 6. DeLong test for the combined model of primary tumor radiomics and clinical features and the combined model of metastatic lymph node radiomics and clinical features
表 1 胃癌术后淋巴结复发与未复发组的临床资料
Table 1 Clinical data of groups with lymph node recurrence and non-recurrence after gastric cancer surgery
变量 未复发组(n=137) 复发组(n=63) 性别(男vs.女) 99 vs. 38 50 vs. 13 年龄 ≤63 62 30 >63 75 33 解剖分布 贲门 47 24 胃体 33 18 胃窦 26 11 贲门-胃体 29 7 胃窦-胃体 2 3 T分期 T1 6 1 T2 15 6 T3 46 14 T4 70 42 N分期 N1 72 24 N2 50 24 N3 15 15 肿瘤最大径 <5 cm 85 40 ≥5 cm 52 23 脉管浸润 否 81 29 是 56 34 神经浸润 否 77 28 是 60 35 累及淋巴结站数 1站 63 11 2站 39 18 3站 26 20 4站 9 14 最大淋巴结短径/mm 6<短径≤10 96 33 10<短径≤15 28 16 短径>15 13 14 转移淋巴结数目/枚 数目≤7 82 3 7<数目<15 48 35 数目≥15 7 25 淋巴结形态 规则、清楚 121 11 不规则、模糊 8 26 融合、坏死 8 26 手术方式 部分切除 62 26 全部切除 75 37 辅助治疗 无 23 10 新辅助化疗 5 4 新辅助化疗+术后化疗 18 14 术后化疗 88 33 术后化疗+免疫治疗 3 2 肿瘤标志物 阴性 110 18 阳性 37 45 表 2 临床病理因素的单因素Logistic回归分析筛选出独立危险因素
Table 2 Univariate logistic regression analysis of clinicopathological factors to screen independent risk factors
变量 训练组(n=110) P 内部验证组(n=48) P 外部验证组(n=42) P 未复发组 (n=76) 复发组(n=34) 未复发组 (n=33) 复发组(n=15) 未复发组 (n=28) 复发组(n=14) 转移淋巴结
数目/枚数目≤7 36(47.4) 19(55.9) < 0.001 22(66.7) 6(40.0) 0.005 25(86.2) 7(53.8) < 0.001 7<数目<15 3(8.8) 4(5.3) 3(20.0) 3(9.1) 0(0.0) 0(0.0) 数目≥15 36(47.4) 12(35.3) 8(24.2) 6(40.0) 4(13.8) 6(46.2) 淋巴结形态 规则、清楚 69(90.8) 17(50.0) < 0.001 28(84.8) 5(33.3) < 0.001 22(78.6) 9(64.3) 0.004 不规则、模糊 8(23.5) 4(5.3) 2(13.3) 3(9.1) 4(28.6) 2(7.1) 融合、坏死 3(3.9) 9(26.5) 2(6.1) 8(53.3) 4(14.3) 1(7.1) 肿瘤标志物 阴性 63(82.9) 13(17.1) < 0.001 26(78.8) 7(21.2) < 0.001 21(75.0) 7(25.0) 0.017 阳性 12(35.3) 22(64.7) 3(20.0) 12(80.0) 5(35.7) 9(64.3) 表 3 原发肿瘤及转移性淋巴结预测模型DeLong检验AUC值对比
Table 3 Comparison of AUC values of the DeLong test for primary tumor and metastatic lymph node models
项目 模型类别 训练组 内部验证组 外部验证组 原发肿瘤 影像组学模型 0.844 0.802 0.791 临床模型 0.897 0.831 0.962 影像组学−临床特征联合模型 0.970 0.961 0.976 转移性淋巴结 影像组学模型 0.897 0.842 0.825 临床模型 0.943 0.957 0.977 影像组学−临床特征联合模型 0.990 0.973 0.987 -
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca-a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[2] 郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45(3): 212-220. DOI: 10.3760/cma.j.cn112152-20220922-00647. ZHENG R S, ZHANG S W, SUN K X, et al. Cancer statistics in China, 2016[J]. Chinese Journal of Oncology, 2023, 45(3): 212-220. DOI:10.3760/cma.j.cn112152-20220922-00647. (in Chinese).
[3] SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. DOI: 10.1016/S0140-6736(20)31288-5.
[4] 陶华, 申晋疆. 64排螺旋CT对胃癌淋巴结转移的诊断价值及诊断准确率的影响[J]. 肿瘤影像学, 2020, 29(3): 314-318. DOI: 10.19732/j.cnki.2096-6210.2020.03.019. [5] LI W, ZHANG L, TIAN C, et al. Prognostic value of computed tomography radiomics features in patients with gastric cancer following curative resection[J]. European Radiology, 2019, 29(6): 3079-3089. DOI: 10.1007/s00330-018-5861-9.
[6] WANG Y, LIU W, YU Y, et al. CT radiomics nomogram for the preoperative prediction of lymph node metastasis in gastric cancer[J]. European Radiology, 2020, 30(2): 976-986. DOI: 10.1007/s00330-019-06398-z.
[7] JIANG Y, WANG W, CHEN C, et al. Radiomics signature on computed tomography imaging: Association with lymph node metastasis in patients with gastric cancer[J]. Frontiers in Oncology, 2019, 9: 340. DOI: 10.3389/fonc.2019.00340.
[8] YANG J, WU Q, XU L, et al. Integrating tumor and nodal radiomics to predict lymph nodemetastasis in gastric cancer[J]. Radiotherapy and Oncology, 2020, 150: 89-96. DOI:10-1016/j.radonc.2020.06.004. DOI: 10.1016/j.radonc.2020.06.004.
[9] GAO X, MA T, CUI J, et al. A CT-based radiomics model for prediction of lymph nodemetastasis in early stage gastric cancer[J]. Academic Radiology, 2021, 28(6): e155-e164. DOI: 10.1016/j.acra.2020.03.045.
[10] SHIN J, LIM J S, HUH Y M, et al. A radiomics-based model for predicting prognosis of locally advanced gastric cancer in the preoperative setting[J]. Scientific Reports, 2021, 11(1): 1879. DOI: 10.1038/s41598-021-81408-z.
[11] 洪晴, 荆明, 林姗, 等. 胃癌根治术后淋巴结阳性患者的复发转移分析及Nomogram预测模型的建立[J]. 河南医学研究, 2022, 31(10): 1729-1734. HONG J, JING M, LIN S, et al. Analysis of recurrence and metastasis of patients with positive lymph nodes after radical operation of gastric cancer and establishment of nomogram prediction model[J]. Henan Medical Research, 2022, 31(10): 1729-1734. (in Chinese).
[12] 日本胃癌学会. 胃癌处理规约[M]. 15版. 东京: 金原出版株式会社, 2017. [13] 何裕隆. 胃癌淋巴转移[M]. 北京: 人民卫生出版社, 2011. [14] 日本胃癌学会. 胃癌治疗指南[M]. 5版. 东京: 金原出版株式会社, 2018. [15] 金元贞, 仝开军, 舒荣宝, 等. 胃癌区域淋巴结转移的CT征象分析[J]. 中国CT和MRI杂志, 2020, 18(5): 14-17. JIN Y Z, TONG K J, SHU R B, et al. Analysis of CT signs of gastric cancer with extraserosal infiltration[J]. Chinese Journal of CT and MRI, 2020, 18(5): 14-17. (in Chinese).
[16] 李彦磊. 胃癌根治术后CT诊断复发转移区域的研究[D]. 青岛: 青岛大学, 2011. DOI: 10.7666/d.y2043916. [17] KOO T K, LI M Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research[J]. Journal of Chiropractic Medicine, 2016, 15(2): 155-163. DOI: 10.1016/j.jcm.2016.02.012. (in Chinese).
[18] KUMAR V, RAMNARAYANAN K, SUNDAR R, et al. Single-cell atlas of lineage states, tumor microen-vironment and subtype-specific expression programs in gastric cancer[J]. Cancer Discovery, 2022, 12(3): 670-691. DOI: 10.1158/2159-8290.CD-21-0683.
[19] WANG B, ZHANG Z, LIU W, et al. Targeting regulatory T cells in gastric cancer: Pathogenesis, immunotherapy, and prognosis[J]. Biomedicine & Pharmacotherapy, 2023, 158: 114180. DOI: 10.1016/j.biopha.2022.114180.
[20] NEGURA I, PAVEL-TANASA M, DANCIU M. Regulatory T cells in gastric cancer: Key controllers from pathogenesis to therapy[J]. Cancer Treatment Reviews, 2023, 120: 102629. DOI: 10.1016/j.ctrv.2023.102629.
[21] LEE C K, JEONG S H, JANG C, et al. Tumor metastasis to lymph nodes requires YAP-dependent metabolic adaptation[J]. Science, 2019, 363(6427): 644-649. DOI: 10.1126/science.aav0173.
[22] 朱志, 杜雨薇, 刘福囝, 等. 淋巴结转移在胃癌预后中的评价[J]. 腹部外科, 2021, 34(3): 179-183, 188. ZHU Z, DU Y W, LIU F J, et al. Prognostic evaluations of gastric cancer with lymph node metastasis[J]. Journal of Abdominal Surgery, 2019, 363(6427): 644-649. DOI:10.1126/science.aav0173. (in Chinese).
[23] HAUGEN B R. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: What is new and what has changed?[J]. Cancer, 2017, 123(3): 372-381. DOI: 10.1002/cncr.30360.
[24] KIM I H, PARK S S, LEE C M, et al. Efficacy of adjuvant S-1 versus XELOX chemotherapy for patients with gastric cancer after D2 lymph node dissection: A retrospective, multi-center observational study[J]. Annals of Surgical Oncology, 2018, 25(5): 1176-1183. DOI: 10.1245/s10434-018-6375-z.
[25] 赵建溪, 任刚, 蔡嵘, 等. 多排螺旋CT诊断早期胃癌淋巴结转移的准确性研究[J]. 诊断学理论与实践, 2016, 15(2): 174-179. DOI: 10.16150/j.1671-2870.2016.02.020. ZHAO J X, REN G, CAI R, et al. Accuracy of multidetector-row CT in diagnosing lymph node metastasis in patients with early gastric cancer[J]. Journal of Diagnostics Concepts & Practice, 2016, 15(2): 174-179. DOI: 10.16150/j.1671-2870.2016.02.020. (in Chinese).
[26] WANG J, WANG L, LI S, et al. Risk factors of lymph node metastasis and its prognostic significance in early gastric cancer: A multicenter study[J]. Frontiers in Oncology, 2021, 11: 649035. DOI: 10.3389/fonc.2021.649035.
[27] 余磊, 赵亚军, 宁忠良. 早期胃癌淋巴结转移的相关危险因素分析[J]. 中国普外基础与临床杂志, 2018, 25(10): 1190-1193. YU L, ZHAO Y J, NING Z L. Risk factors of lymphatic metastasis in early gastric cancer[J]. Chinese Journal of Bases and Clinics in General Surgery, 2018, 25(10): 1190-1193. (in Chinese).
[28] 游佳, 李颖慧, 吴泽航, 等. 能谱CT动静脉期碘含量差值对胃癌淋巴结转移的预测价值[J]. 国际医学放射学杂志, 2021, 44(4): 408-414. DOI: 10.19300/j.2021.L18683. YOU J, LI Y H, WU Z H, et al. The predictive value of iodine content difference between arterial and venous phases of energy spectrum CT for lymph node metastasis of gastric cancer[J]. International Journal of Medical Radiology, 2021, 44(4): 408-414. DOI: 10.19300/j.2021.L18683. (in Chinese).
[29] ZHAO B, HUANG X, ZHANG J, et al. Clinicopathologic factors associasted with recurrence and long-term survival in node-negative advanced gastric cancer patients[J]. Revista Espanola de Enfermedades Digestivas, 2018, 111(2): 111-120. DOI: 10.17235/reed.2018.5829/2018.
[30] JIANG Y, LI T, LIANG X, et al. Association of adjuvant chemotherapy with survival in patients with stage Ⅱ or Ⅲ gastric cancer[J]. Jama Surgery, 2017, 152(7): e171087. DOI: 10.1001/jamasurg.2017.1087.
[31] SHITARA K, CHIN K, YOSHIKAWA T, et al. Phase Ⅱ study of adjuvant chemotherapy of S-1 plus oxaliplatin for patients with stage Ⅲ gastric cancer after D2 gastrectomy[J]. Gastric Cancer, 2017, 20(1): 175-181. DOI: 10.1007/s10120-015-0581-1.
[32] BOKU N, RYU M H, KATO K, et al. Safety abd efficacy of nivolunab in combination with S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable advanced, or recurrent gastric/gastroesophageal junction cancer: Interim results of a randomized, phase Ⅱ trial (ATTRACTION-4)[J]. Annals of Oncology, 2019, 30(2): 250-258. DOI: 10.1093/annonc/mdy540.
[33] CHAI R, MA H, XU M, et al. Differentiating axillary lymph node metastasis in invasive breast cancer patients: A comparison of radiomic signatures from multiparametric breast MR sequences[J]. Journal of Magnetic Resonance Imaging, 2019, 50(4): 1125-1132. DOI: 10.1002/jmri.26701.
[34] KAN Y, DONG D, ZHANG Y, et al. Radiomic signature as a predictive factor for lymph nodemetastasis in early-stage cervical cancer[J]. Journal of Magnetic Resonance Imaging, 2019, 49(1): 304-310. DOI: 10.1002/jmri.26209.
[35] 黄列彬, 刘昱, 黄文斯, 等. CT纹理分析联合临床病理信息预测进展期胃癌术后复发的价值[J]. 放射学实践, 2022, 37(2): 214-219. DOI: 10.13609/j.cnki.1000-0313.2022.02.013. HUANG L B, LIU Y, HUANG W S, et al. The value of CT texture analysis combined with clinicopathological information in predicting postoperative recurrence of advanced gastric cancer[J]. Radiologic Practice, 2022, 37(2): 214-219. DOI:10.13609/j.cnki.1000-0313.2022.02.013. (in Chinese).
[36] GAO X, MA T, CUI J, et al. A radiomics-based model for prediction of lymph node metastasis in gastric cancer[J]. European Journal of Radiology, 2020, 129: 109069. DOI: 10.1016/j.ejrad.2020.109069.



 下载:
下载: