Feasibility of opportunistic osteoporosis screening using an artificial intelligence-based bone density measurement on chest CT scans
-
摘要:
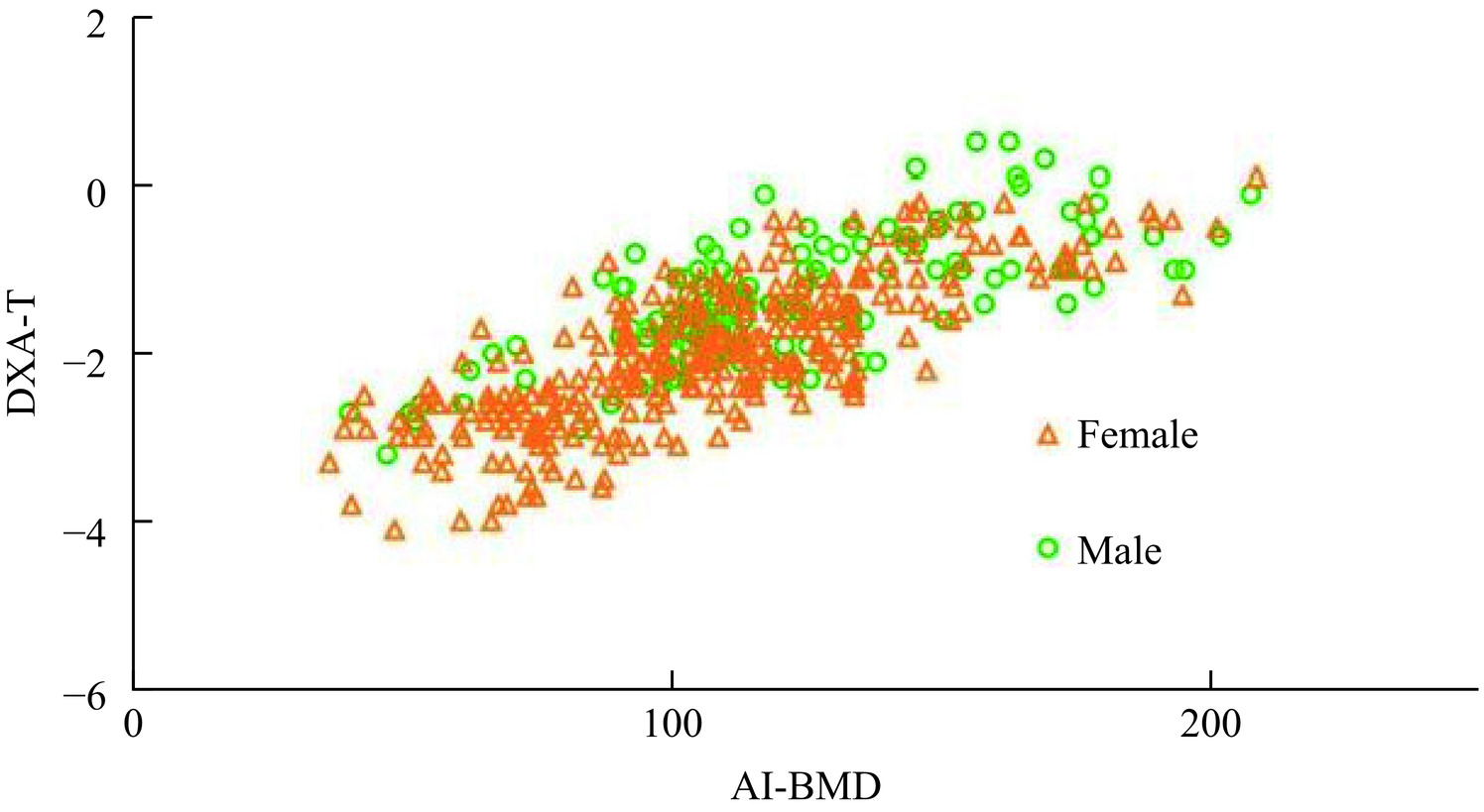
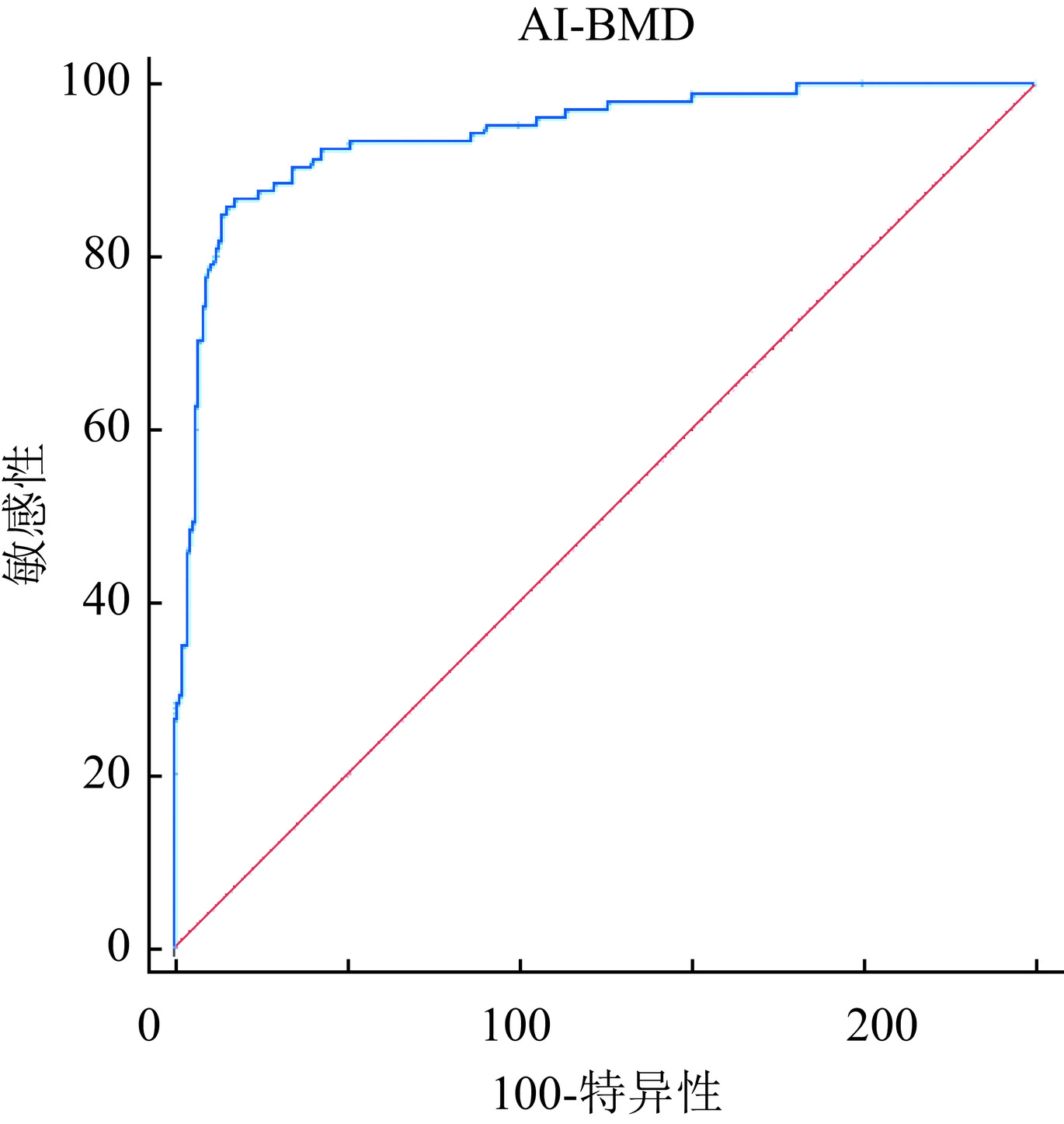
探讨基于胸部CT的人工智能(AI)骨密度测量系统机会性筛查骨质疏松症的可行性。回顾性分析于我科2023年8月至2024年7月同时行双光能X线吸收测定法(DXA)和胸部CT的462名患者的资料,其中绝经后的女性317例、50岁以上的男性145例。比较两种方法测量骨密度之间的差异;以DXA测量的T值为参考标准,分析基于胸部CT的AI系统与DXA测量结果的一致性和相关性。绝经后女性和50岁以上男性的身高、体重、DXA T值及AI BMD有统计学差异;AI测量的BMD与DXA T值之间的相关系数为0.767;二者的κ值为0.697;AI诊断骨质疏松的ROC曲线下面积为0.941(95%CI 0.914~0.968),敏感性85.71%,特异性93.84%。AI骨密度测量系统与DXA测定骨密度具有高度相关性及良好一致性,可以帮助机会性筛查骨质疏松症。
Abstract:This study explores the feasibility of opportunistic osteoporosis screening using an artificial intelligence (AI)-based bone mineral density (BMD) measurement system on chest computed tomography (CT) scans. A retrospective analysis was conducted on 462 patients who underwent both dual-energy X-ray absorptiometry (DXA) and chest CT in our department between August 2023 and July 2024. The cohort included 317 postmenopausal women and 145 men aged > 50 years. BMD measurements from the AI system and DXA were compared. Using the T-value measured by DXA as the reference standard, the consistency and correlation between AI-based and DXA-measured BMD were analyzed. Significant differences in height, weight, DXA T-value, and AI-derived BMD were observed between men aged > 50 years and postmenopausal women. The AI-derived BMD showed a correlation coefficient of 0.767 with DXA T-values and a κ value of 0.697. The area under the ROC curve for AI-based diagnosis of osteoporosis was 0.941(95% CI 0.914–0.968), with a sensitivity of 85.71% and a specificity of 93.84%. The AI-based BMD measurement system demonstrates strong correlation and good agreement with DXA, supporting its feasibility for opportunistic osteoporosis screening.
-
Keywords:
- CT /
- Artificial intelligence /
- Bone density /
- osteoporosis
-
低剂量胸部CT在常规健康体检中应用越来越广泛,是肺癌筛查最常用的检查方式之一,能显著降低受检者的辐射剂量[1]。特别是在2019年新冠疫情爆发之初,由于低剂量CT操作简便,辐射剂量低等特点,已作为新冠病毒影像学筛查的重要检查方式。同时,骨质疏松逐渐成为一个全球性的公共卫生问题,严重威胁到了人类健康。骨质疏松症主要表现为因骨量下降而引起的慢性骨代谢系统疾病,其主要并发症脆性骨折会直接导致患者身体致残,并严重影响患者生活和工作质量[2-4]。
随着我国人民健康意识的提高,要求同时做胸部CT肺癌筛查和CT椎体骨密度检测人群日益增多[5],很多体检者考虑到两次CT检查带来的辐射剂量较大因而导致腰椎定量CT(quantitative computed tomography,QCT)筛查推广受限。本文讨论通过一站式胸部低剂量CT联合QCT骨密度筛查在体检者中的意义,以求在不影响临床诊断的前提下最大限度的降低辐射剂量。
1. 资料与方法
1.1 一般资料
收集我院2020年5月至11月因体检需求同时做胸部CT和腰椎QCT检查受检者共100例,其中50例胸部CT扫描采用低剂量一站式扫描,扫描范围胸廓入口至L2层面。腰椎QCT检查范围参照指南扫描LI至L2锥体[5]。
记录患者的身高、体重并测量胸部低剂量组中L1、L2的平均骨密度,以及常规腰椎QCT扫描L1、L2的平均骨密度并分析结果;记录两组扫描辐射剂量:有效剂量(effective dose,ED)和剂量长度乘积(dose length product,DLP)。
1.2 扫描方法
胸部低剂量组扫描采用GE Revolution CT机,范围胸廓入口至L2层面水平。采用自动管电流调制技术,管电流范围20~200 mA,管电压120 kVp,预设噪声指数(noise index,NI=14),螺距0.992︰1,旋转时间0.5 s/r,ASIR权重设置70%。常规胸部CT扫描噪声指数NI=8.5、ASIR权重设置为50%,其余同上。
QCT腰椎扫描选用GE Revolution CT机,扫描范围L1-L2。扫描参数:管电压120 kV,管电流范围80~350 mA,预设噪声指数(NI=8.5),螺距0.992︰1,旋转时间0.5 s/r,ASIR权重设置为50%,重建层厚0.625 mm。其中低剂量组中QCT扫描采用胸部低剂量组中L1、L2的范围重建。重建方式:标准算法,重建层厚0.625 mm。
1.3 骨密度测量
将0.625 mm重建数据传送到QCT工作站,运用QCT Pro 6.1软件骨密度测量工具进行测量。自动设置兴趣区(ROI)轴、冠、失三方定位。感兴趣区ROI尽量放置于椎体中部松质骨区,避开骨岛、椎体后中央沟等影响骨密度值区域[6]。
按标准操作流程测量L1、L2椎体松质骨的骨密度,计算L1、L2的平均骨密度[7]。若遇骨折或有病变的椎体,则选取相邻正常椎体进行测量[7]。
1.4 图像主观评价
将低剂量组(噪声指数NI=14,ASIR权重70%)及常规剂量组(噪声指数NI=8.5,ASIR权重50%)所得原始数据0.625 mm重建后传入PACS工作站。在肺窗(窗宽1600 HU、窗位 -600 HU)图像上观察肺内结构;在纵隔窗(窗宽350 HU、窗位40 HU)图像上观察纵隔及上腹部结构。由两名具有5年以上诊断经验放射科高级职称医师诊断,采用双盲法对轴位图像质量进行阅读、评价并记录结果。若两名医师意见不同,择协商一致。
评价标准 [8]:①5分:优秀。肺纹理走行清楚,图像无运动伪影,纵隔大血管对比度清晰。②4分:良好。肺纹理走行较清楚,图像轻微运动伪影,纵隔大血管结构对比度较清晰。③3分:中等。肺纹理走行欠清楚,图像中度运动伪影,纵隔大血管结构对比度欠清晰。④2分:较差。肺纹理走行模糊,图像运动伪影重,纵隔大血管结构对比度较模糊。⑤1分:差。肺纹理走行不清,图像运动伪影严重;纵隔大血管结构对比度模糊,显示不清。临床认为≥3分图像可用于临床诊断,≤2分为不能满足临床诊断[9]。
1.5 有效剂量(ED)
记录NI值分别为14和8.5的条件下不同组的剂量长度乘积(DLP),计算有效辐射剂量(ED)。ED=DLP·k,其中k为不同部分的转换因子,根据欧洲CT质量标准指南规定胸部k为0.014[10-11]。
1.6 统计学方法
胸部图像质量评价采用SPSS 20.0统计分析软件。骨密度及其测量值误差定量资料先进行正态性和方差齐性检验,如果数据满足正态分布且方差齐则以均数±标准差(
$\bar x $ ±s)表示,否则采用中位数(四分位间距)表示;定性资料采用频数(百分数)表示。服从正态分布的定量资料采用t检验分析,否则采用秩和检验;定性资料采用卡方检验进行分析。所有分析结果认为P<0.05为差异有统计学意义。
2. 结果
2.1 基本信息及辐射剂量对比
不同NI值下两组受检者的年龄、身高、体重、体质量指数(BMI)差异均无统计学意义,两组扫描方式DLP、ED差异均有明显统计学意义(表1),低剂量组降低约80%辐 射剂量。
表 1 患者基本信息及辐射剂量Table 1. Basic information of two groups and radiation dose项目 噪声指数 统计检验 NI=14 NI=8.5 t P 年龄 53.82±16.19 55.96±15.89 -0.67 0.506 身高 162.06±7.11 160.92±7.92 0.76 0.451 体重 60.10±9.27 57.67±9.75 1.28 0.205 BMI 22.87±3.11 22.19±2.85 1.14 0.257 DLP 73.18±16.25 387.60±73.03 -29.72 0.000 ED 1.02±0.23 5.1±0.96 -29.19 0.000 2.2 两组不同条件下骨密度结果
胸部低剂量组中L1、L2以及其腰椎常规剂量组中L1、L2的平均骨密度分别123.65、119.71,无明显差异(表2)。
表 2 不同NI值扫描条件下两组受检者椎体骨密度结果(mg/cm3)Table 2. Bone mineral density of the two groups were scanned under different NI conditions噪声指数 锥体 平均骨密度 标准差 统计检验 t P NI=14 L1-L2 123.65 45.74 0.43 0.670 NI=8.5 L1-L2 119.71 46.32 2.3 图像主观评分
两名医师针对高低剂量不同条件下的两组胸部图像评分诊断Kappa值分别为0.877,说明两名医师对于图像的质量评分一致性很好(表3)。
表 3 图像质量主观评分Table 3. Objective evaluation of image quality项目 噪声指数 统计检验 NI=14 NI=8.5 Z P 重建方式 70% ASIR-V 50% ASIR-V -0.456 0.64 主观评分(1/2/3/4/5) (0/0/4/14/32) (0/0/3/13/34) 3. 讨论
随着CT技术的发展,胸部低剂量CT越来越多的应用到常规的体检人群中,同时骨质疏松症作为一种与年龄密切相关的骨骼疾病,发病率逐年提高[2,12]。早期诊断是预防和治疗骨质疏松症的关键因素能够大大提高患者的生活质量。
目前腰椎QCT扫描是诊断骨质疏松的有效途径之一,但很多患者顾虑腰椎CT检查带来的二次辐射伤害,往往选择避开腰椎QCT这方面的骨质疏松筛查,所以腰椎QCT扫描没有像低剂量胸部CT那样广泛的应用,这使得那些因为疾病原因需要准确评估骨密度的患者在腰椎QCT骨密度这方面的筛查做的还远远不够,在很大程度上会影响疾病的治疗以及预防。
骨密度(bone mineral density,BMD)值可反映75%以上的骨强度[12-14],也是评价骨质疏松最特异和最敏感的方法[12,15]。目前临床上测量骨密度常用方法主要有双能X线法(DXA)。DXA因辐射剂量低、经济,使用较为广泛[16],但因二维成像容易受周边组织的影响,如血管钙化、骨质增生、体位重叠等因素会使测量值不够精确,实际测量的骨密度值会增高[12]。
定量CT采用的是图像扫描的原始数据进行重建以及骨密度测量,测量的是真正本质上的锥体体积骨密度[7],以mg/cm3表示。与以往常规测量二维的锥体面积骨密度不同,腰椎QCT扫描后所得的图像空间分辨率高,并且可以完整的显示骨结构及其形态,可通过多部位感兴趣区的选择测量松质骨的骨密度值[12]。
这些锥体体积骨密度不会随椎体大小、形状改变以及骨质增生和血管钙化的影响[7,12],是唯一目前能够测得接近真正意义上的体积性骨密度定量测量的有效方法[17]。目前国际临床骨密度学会(ISCD)2007推荐测量L1、L2椎体骨密度并取均值来评估全身骨密度[6]。
临床上筛查肺癌和骨质疏松往往要做两次检查,胸部CT以及腰椎QCT检查,但因为剂量相对偏大,因而运用起来较受限。以往常规减少辐射的方法有:单一的降低管电流、降低管电压、增大螺距、减少扫描时间、增加图像噪声[18],但这些方法往往不适用于高BMI指数的受检者个性化扫描。体重指数BMI也是影响辐射剂量的因素,同时也是测量骨密度的重要参考。
BMI个体化差异很大。由于X线的穿透性能力会随着被检者肥胖程度的提高而有所减弱。因此BMI越大患者受检所需的管电流量也会变得更高;反之,BMI越小mA值越小。常规单一的降低管电压,管电流的方式来降低辐射剂量常常不能保证高BMI人群的胸部扫描图像质量[19],这就使得低剂量胸部筛查在高BMI值体检人群中应用比较受限。临床上常常为了保证图像的诊断效果,需要增大扫描条件因而造成辐射剂量的增加。本研究是根据不同受检者的不同BMI值,在固定管电压的条件下,自动调整不同扫描层面的管电流输出。这样既保证的图像的诊断质量又有效的减少了受检者的辐射剂量。
在腰椎骨密度检查的扫描条件中,常常要求必须有固定的千伏、毫安、重建范围、层厚以此来达到诊断要求,这就使得在单纯的通过降低管电流,管电压的等降低辐射剂量的前提下不能把两者很好的结合起来。本研究采用120 kV固定千伏,自动管电流调节应用NI结合ASIR-V重建技术能够针对受检者不同BMI值和扫描定位像胸廓大小等信息,在扫描过程中实时调整毫安输出值。在保证图像质量前提下,最大限度地降低射线剂量。同时本研究采用的是ASIR-V算法的重建方式。
ASIR-V是介于自适应统计迭代重组(ASIR)与基于模型迭代重组(MBIR)之间的一种重组方法[20],在低剂量条件下图像密度分辨率会进一步提高[21]。在降低剂量的同时能保证每层图像质量的一致性,能够真正做到低剂量扫描同时保证了图像质量,满足胸部CT图像的诊断和腰椎QCT骨密度值测量的扫描要求达到真正意义上的低剂量扫描。本研究显示两名医师针对两组不同条件:低剂量组(NI=14,ASIR 70% 迭代重建);常规剂量组(NI=8.5,ASIR 50% 迭代重建)下的图像评分结果均可以达到诊断要求。由此可见采用固定管电压,自动调节管电流技术这种方法是可行的。它既保证了图像质量又有利于观察肺部的结构;在降低辐射剂量的同时,也满足腰椎骨密度测量值的准确性。
本文研究显示:低剂量条件下L1、L2骨密度均值与常规QCT腰椎扫描L1、L2的骨密度均值无统计学差异,说明管电流对QCT骨密度测量值影响不大。目前,国内外专家共识均采用腰椎扫描条件测量L1、L2椎体骨密度来用于评估全身骨密度及预测骨折风险。而胸部低剂量CT扫描条件是否可以代替腰椎扫描条件来评估骨密度是本文研究的重点。
文献报道[6]欧洲脊柱体模(european spine phantom,ESP)作为国际公认的骨密度测量评估标准,主要用于骨密度测量仪的标准化和不同仪器间的相互校准,也适用于同一仪器不同条件间的相互校准[6,21]。有文献报道[6]采用胸部扫描条件与标准腰椎扫描条件针对欧洲体膜ESP反复扫描,结果两组间ESP不同椎体骨密度准确度误差均呈正态性分布,准确度误差均无统计学差异,说明管电流对骨密度的测量值结果并不影响。
鉴于此,本文胸部采用低剂量一站式扫描,范围下缘部分包至L2下缘层面,无需再额外增加腰椎QCT的检查范围。如结果表1所示辐射剂量减少了约80%。减少的不仅是低剂量中少于常规胸部剂量的那一部分,还有一次常规QCT腰椎检查辐射剂量。我们只需一次的胸部低剂量扫描就可以得到临床所需的椎体骨密度测量以及低剂量胸部CT肺癌筛查。
本文不足之处。本研究搜集受检者体重均小于80 kg,且BMI均小于30,对于BMI值较大者未在考虑之中,本研究是一个单中心研究,在条件允许情况下我们会增加更多样本研究。
综上所述,胸部结合腰椎QCT低剂量一站式扫描,既能同时完成肺部筛查及评估全身骨密度,又可以降低辐射剂量。大大节约医疗成本,在临床上具有应用前景。
-
表 1 462名受试者基本资料
Table 1 Demographic data from 462 subjects
变量 全部(n=462) 女性(n=317) 男性(n=145) P值 年龄(岁) 64.94±8.547 64.99±8.221 64.81±9.249 0.837 身高(cm) 162.98±7.278 159.35±4.855 170.90±5.065 <0.001 体重(kg) 65.91±11.065 62.52±9.609 73.34±10.412 <0.001 BMI(kg/m2) 24.75±3.385 24.60±3.492 25.08±3.125 0.160 DXA T值 −1.79±0.855 −1.98±0.839 −1.36±0.726 <0.001 AI BMD(mg/cm3) 111.33±33.522 106.66±32.886 121.53±32.732 <0.001 表 2 DXA和AI诊断类型的分布
Table 2 Distributions of DXA and AI diagnostic types
AI 骨量正常 骨量减少 骨质疏松 总计 DXA 骨量正常 67(14.5%) 23(5.0%)a 1(0.2%)b 91(19.7%) 骨量减少 21(4.5%)a 225(48.7%) 20(4.3%)a 266(57.6%) 骨质疏松 0(0%)b 16(3.5%)a 89(19.3%) 105(22.7%) 总计 88(19.0%) 264(57.1%) 110(23.8%) 462(100%) 注:黑体字为一致;a为轻度不一致:一种方法显示骨密度正常,而另一种则显示骨量减少或一种方法显示骨量减少,而另一种则显示骨质疏松;b为重度不一致:一种方法显示骨密度正常,而另一种则显示骨质疏松。 -
[1] LIU F, ZHU H, MA J, et al. Performance of iCare quantitative computed tomography in bone mineral density assessment of the hip and vertebral bodies in European spine phantom[J]. Journal of Orthopaedic Surgery and Research, 2023, 18(1): 777. DOI: 10.1186/s13018-023-04174-w.
[2] CUI Z, MENG X, FENG H, et al. Estimation and projection about the standardized prevalence of osteoporosis in mainland China[J]. Archives of Osteoporosis, 2019, 15(1): 2. DOI: 10.1007/s11657-019-0670-6.
[3] SI L, WINZENBERG T M, JIANG Q, et al. Projection of osteoporosis-related fractures and costs in China: 2010-2050[J]. Osteoporosis International, 2015, 26(7): 1929-1937. DOI: 10.1007/s00198-015-3093-2.
[4] DE MARGERIE-MELLON C, CHASSAGNON G. Artificial intelligence: A critical review of applications for lung nodule and lung cancer[J]. Diagnostic and Interventional Imaging, 2023, 104(1): 11-17. DOI: 10.1016/j.diii.2022.11.007.
[5] 孙安, 樊荣荣, 孙瑶, 等. CT重组算法对低剂量胸部CT筛查冠状动脉钙化积分准确性影响研究[J]. 临床放射学杂志, 2022, 41(5): 881-885. DOI: 10.13437/j.cnki.jcr.2022.05.025. SUN A, FAN R, SUN Y, et al. The effect of CT reconstruction kernel on the accuracy of low-dose chest CT screening for coronary artery calcification scores[J]. Journal of Clinical Radiology, 2022, 41(5): 881-885. DOI: 10.13437/j.cnki.jcr.2022.05.025.
[6] 赵宇, 张晓岚, 郑超, 等. 基于低剂量胸部CT深度学习模型自动测量骨密度研究[J]. 放射学实践, 2024, 39(2): 262-266. DOI: 10.13609/j.cnki.1000-0313.2024.02.019. ZHAO Y, ZHANG X L, ZHENG C, et al. Bone densitometry measurement based on low-dose chest CT with deep learning model[J]. Radiol Practice, 2024, 39(2): 262-266. DOI: 10.13609/j.cnki.1000-0313.2024.02.019.
[7] 赵君禄, 刘斋, 韩康, 等. 基于定量CT的机会性骨质疏松诊断: 2种定量CT骨密度测量软件临床应用比较分析[J]. 河北医科大学学报, 2024, 45(1): 17-23. DOI: 10.3969/j.issn.1007-3205.2024.01.005. ZHAO J L, LIU Z, HAN K, et al. Computed tomography—based opportunistic osteoporosis diagnosis: A comparison of clinical applications of two quantitative CT softwares[J]. Journal of Hebei Medical University, 2024, 45(1): 17-23. DOI: 10.3969/j.issn.1007-3205.2024.01.005.
[8] SIRIS E S, ADLER R, BILEZIKIAN J, et al. The clinical diagnosis of osteoporosis: a position statement from the National Bone Health Alliance Working Group[J]. Osteoporosis International, 2014, 25(5): 1439-1443. DOI: 10.1007/s00198-014-2655-z.
[9] BUDOFF M J, HAMIRANI Y S, GAO Y L, et al. Measurement of thoracic bone mineral density with quantitative CT[J]. Radiology, 2010, 257(2): 434-440. DOI: 10.1148/radiol.10100132.
[10] KENDRICK J, FRANCIS R J, HASSAN G M, et al. Prognostic utility of RECIP 1.0 with manual and AI-based segmentations in biochemically recurrent prostate cancer from [(68)Ga]Ga-PSMA-11 PET images[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2023, 50(13): 4077-4086. DOI: 10.1007/s00259-023-06382-2.
[11] GERETY E L, HOPPER M A, BEARCROFT P W. The reliability of measuring the density of the L1 vertebral body on CT imaging as a predictor of bone mineral density[J]. Clinical Radiology, 2017, 72(2): 177-179. DOI: 10.1016/j.crad.2016.09.022.
[12] YAN L, WANG X, YU T, et al. Characteristics of the gut microbiota and serum metabolites in postmenopausal women with reduced bone mineral density[J]. Frontiers in Cellular and Infection Microbiology, 2024, 14: 1367325. DOI: 10.3389/fcimb.2024.1367325.
[13] WU X, ZHANG M. Effects of androgen and progestin on the proliferation and differentiation of osteoblasts[J]. Experimental and Therapeutic Medicine, 2018, 16(6): 4722-4728. DOI: 10.3892/etm.2018.6772.
[14] KIM Y W, KIM J H, YOON S H, et al. Vertebral bone attenuation on low-dose chest CT: Quantitative volumetric analysis for bone fragility assessment[J]. Osteoporosis International, 2017, 28(1): 329-338. DOI: 10.1007/s00198-016-3724-2.
[15] SAVAGE R H, van ASSEN M, MARTIN S S, et al. Utilizing Artificial Intelligence to Determine Bone Mineral Density Via Chest Computed Tomography[J]. Journal of Thoracic Imaging, 2020, 35 Suppl 1: S35-S39. DOI: 10.1097/RTI.0000000000000484.
[16] LIN W, HE C, XIE F, et al. Quantitative CT screening improved lumbar BMD evaluation in older patients compared to dual-energy X-ray absorptiometry[J]. Bmc Geriatrics, 2023, 23(1): 231. DOI: 10.1186/s12877-023-03963-6.
[17] 王盟盟, 张磊, 周凤云, 等. 双层光谱CT、QCT及DXA在骨质疏松诊断中的精确性与效能比较[J]. CT理论与应用研究, 2024, 33(6): 717-724. DOI: 10.15953/j.ctta.2024.086. WANG M M, ZHANG L, ZHOU F Y, et al. Comparative Study of the Accuracies and Efficiencies of Dual-layer Spectral CT, QCT, and DXA for Osteoporosis Diagnosis[J]. CT Theory and Applications, 2024, 33(6): 717-724. DOI: 10.15953/j.ctta.2024.086.
[18] EBBESEN E N, THOMSEN J S, BECK-NIELSEN H, et al. Vertebral bone density evaluated by dual-energy X-ray absorptiometry and quantitative computed tomography in vitro[J]. Bone, 1998, 23(3): 283-290. DOI: 10.1016/s8756-3282(98)00091-x.
[19] WONG M, PAPA A, LANG T, et al. Validation of thoracic quantitative computed tomography as a method to measure bone mineral density[J]. Calcified Tissue International, 2005, 76(1): 7-10. DOI: 10.1007/s00223-004-0020-5.
[20] 张羽, 张宗军, 刘许慧, 等. 胸椎定量CT和腰椎双能X线吸收检测仪对绝经后女性骨质疏松症的诊断差异[J]. 放射学实践, 2022, 37(10): 1205-1210. DOI: 10.13609/j.cnki.1000-0313.2022.10.003. ZHANG Y, ZHANG Z J, LIU X H, et al. Diagnosis difference of thoracic spine quantitative CT and lumbar spine DXA for osteoporosis in postmenopausal women[J]. Radiol Practice, 2022, 37(10): 1205-1210. DOI: 10.13609/j.cnki.1000-0313.2022.10.003.
-
期刊类型引用(4)
1. 吴伟智,方挺松,梁振华,祝翠玲,周静仪. 佛山市成年居民骨密度CT定量研究. CT理论与应用研究. 2024(02): 213-220 .  本站查看
本站查看
2. 王然,杨健,陈玥,王威,兰九钧,陈君蓉. 膝骨关节炎患者MRI变化与骨密度的相关性研究. CT理论与应用研究. 2024(05): 601-608 .  本站查看
本站查看
3. 易梅玲,易芳玲. 双层探测器光谱CT智能剂量调控技术在低剂量胸部体检中的应用价值. 中国医疗器械信息. 2024(22): 8-10+81 .  百度学术
百度学术
4. 王旭,刘磊,刘义军,李贝贝,童小雨,陈安良. 不同剂量下重建矩阵对定量CT椎体骨密度测量值的影响. 放射学实践. 2023(12): 1593-1598 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: