Correlation between Dual-Phase Quantitative Parameters from Dual-Layer Spectral Detector Computed Tomography and Ki-67 Expression in Non-Small Cell Lung Cancer
-
摘要:
目的:研究双层探测器光谱CT(DLSCT)双期定量参数对非小细胞肺癌Ki-67表达的预测价值。方法:回顾性分析我院自2022年8月至2024年12月进行DLSCT双期增强扫描且经病理证实的非小细胞肺癌患者77例,按免疫组化结果分为低表达组(Ki-67≤30%)、高表达组(Ki-67>30%)。使用Spectral CT viewer软件测量、计算、分析两组病例动脉期和静脉期的双层光谱CT定量参数,包括碘密度(IC)、标准化碘密度(NIC)、有效原子序数(Zeff)、能谱曲线斜率(K40-100 keV,简称K)、MonoE(单能量光谱结果)间隔10 keV的CT40 keV-CT100 keV。统计学方法:采用独立样本t检验方法比较组间差异;用Spearman相关分析评价DLSCT双期定量参数和Ki-67表达水平间的相关性;绘制受试者工作曲线(ROC),获得曲线下面积(AUC),约登指数、敏感度、特异度衡量DLSCT各定量参数评估Ki-67表达水平的效能。结果:静脉期低表达组IC、NIC、Zeff、K40-100 keV、CT40 keV-CT70 keV(间隔10 keV)均高于高表达组,动脉期低表达组K40-100 keV、CT40 keV高于高表达组,差异均具有统计学意义。静脉期IC、NIC、Zeff、K40-100 keV、CT40 keV-CT60 keV(间隔10 keV)、动脉期K40-100 keV、CT40 keV与Ki-67表达水平呈负相关。绘制ROC,静脉期K40-100 keV评估非小细胞肺癌Ki-67表达水平最佳。结论:DLSCT双期定量参数是预测非小细胞肺癌 Ki-67 表达水平的有效工具,研究证据表明静脉期能谱曲线斜率 (K) 是其中最具预测价值的指标。
Abstract:Objective: We investigated the predictive value of dual-phase quantitative parameters of dual-layer spectral detector computed tomography (DLSCT) combined with Ki-67 expression in non-small-cell lung cancer (NSCLC). Methods: Seventy-seven patients with pathologically confirmed non-small cell lung cancer who underwent dual-phase enhanced scanning at our hospital between August 2022 and December 2024 were retrospectively analyzed. According to immunohistochemical results, they were divided into low (Ki-67≤30%) and high (Ki-67>30%) Ki-67 expression groups. Spectral CT viewer software was used to measure, calculate, and analyze the quantitative parameters obtained with dual-layer spectral CT in the arterial and venous phases in both groups, including iodine density (IC), standardized iodine density (NIC), effective atomic number (Zeff), and energy spectrum curve slope (K, P < 0.05) (referred to as K and MonoE [monochromatic energy spectroscopy]) results, and CT40 keV-CT100 keV at 10 keV intervals. An independent samples t-test was used to compare differences between groups. Spearman’s correlation analysis was used to evaluate the correlation between the quantitative parameters of DLSCT and Ki-67 expression. A receiver-operating characteristic (ROC) curve was constructed to obtain the area under the curve (AUC). Youden index, sensitivity, and specificity were used to measure the efficacy of each quantitative parameter of DLSCT in predicting Ki-67 expression. Results: IC, NIC, Zeff, K40-100 keV, CT40 keV-CT70 keV (interval 10 keV) were higher in the low expression group than in the high expression group in venous phase, and K40-100 keV and CT40 keV were higher in the low expression group than in the high expression group in arterial phase. The differences were statistically significant (P<0.05). IC, NIC, Zeff, K40-100 keV, CT40 keV-CT60 keV (interval 10 keV) in venous phase, and K40-100 keV, CT40 keV in arterial phase correlated negatively with Ki-67 expression level (|r| < 0.40,P < 0.05). The ROC curve showed that K40-100 keV in venous phase was the best parameter for predicting Ki-67 expression in NSCLC (AUC=0.750). Conclusion: Dual-phase quantitative parameters of DLSCT are effective tools for predicting Ki-67 expression in non-small cell lung cancer, and research evidence shows that the slope (K) of the spectral curve in the venous phase is the most valuable index.
-
Keywords:
- spectral CT /
- carcinoma non-small-celllung /
- Ki-67 proliferation.
-
癌症是全球第二大死亡原因,目前肺癌发病率和致死率仍居全球第一[1-2]。非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)是肺癌中最常见的病理亚型,在肺癌中占比85%[3]。Ki-67是一种由MKi-67编码的核蛋白,在细胞周期和增殖发挥重要作用的神经元标志物[4],已被确定为NSCLC生存的不良预后因素[5]。Ki-67高表达是导致肺癌治疗反应欠佳的危险因素。免疫组织化学是诊断NSCLC Ki-67表达水平的金标准。目前,获取组织样本主要通过侵入性检查,易引发出血、气胸等一系列风险[6]。同时传统染色制片费时、费力且容易出错,导致部分患者无法准确评估Ki-67表达。双层探测器光谱CT(dual-layer spectral detector computed tomography,DLSCT)成像技术可生成40-200 keV虚拟单能和物质分解图像,提供肿瘤组织一定功能和代谢信息,为非侵入性评估肿瘤生物学行为提供新途径[7]。笔者检索文献发现,中文期刊仅见DLSCT静脉期定量参数与Ki-67相关性分析。本文观察DLSCT双期定量参数与非小细胞肺癌Ki-67表达情况,评估二者之间的关系。
1. 资料与方法
1.1 一般资料
本文选取自2022年8月-2024年12月在山西医科大学第二医院经手术或病理活检证实为NSCLC且进行了胸部DLSCT双期增强扫描的病例资料。其中男性59例,女性18例,平均年龄64岁;鳞癌29例,腺癌46例,腺鳞癌2例;手术证实10例,病理穿刺活检证实67例。
纳入标准:①原发性NSCLC临床诊断明确的初诊患者;②术前DLSCT双期增强检查与病理检查时间间隔小于1个月;③病灶最大径>10 mm的实性结节或肿块(本文选取病灶最大径均在4.65±0.46 cm围内);④图像分辨率清晰,可满足病灶观察及分析要求的患者资料。排除标准:①临床病理资料不完整,如未完成免疫组化Ki-67检测的病例;②合并其他恶性肿瘤且有任何治疗史;③病灶存在大范围坏死、囊变未达到画圈要求的病例;④存在CT增强扫描禁忌症的病例。
1.2 检查方法
患者胸部双期增强扫描采用Philips IQon Spectral CT 扫描仪。扫描参数:管电压120 kVp,自动管电流(30-200 mAs),准直器64×0.625 mm,矩阵512×512,螺距1.23,转速0.4,FOV>220 mm。扫描范围:患者采取仰卧位,双手抱头,扫描自胸廓入口至膈肌下缘(包全肺上下缘)。扫描方法:护士操作SyncRight 注射器以3.5 ml/s流速向右肘静脉注射21 ml生理盐水,而后注射碘克沙醇60 ml,最后再注射40 ml生理盐水。采用胸部增强固定阈值触发法,触发方式选择bolus tracking,监测线放至气管隆突层面,注射对比剂后延迟时间设置为8 s,触发阈值设置为120 HU,触发后延迟8 s开始扫描动脉期图像,扫描完毕后延迟30 s开始静脉期扫描。
1.3 DLSCT图像后处理与分析
将重建的光谱图像(层厚=1 mm)传输至后处理专用工作站,用Spectral CT viewer软件在胸部双期增强、碘密度、有效原子序数图上进行勾画、测量及分析。圆形感兴趣区(ROI)勾画选取病灶连续4个层面,尽可能避开液化坏死、血管、气液平面等非实性成分,ROI面积均在100±2 mm2范围内,计算4个层面均值。最后由3个高年资放射科医师独立诊断与分析。获得的ROI值包括:胸部双期增强40-100 keV(间隔10 keV)之间的单能CT值;动脉期及静脉期的IC值及Zeff值;与病灶同一层面降主动脉归一化后的NIC值,NIC=IC病灶/IC降主动脉;K40-100 keV=( CT40 keV−CT100 keV)/(100−40)。
1.4 Ki-67检测与分组
根据病理科免疫组化结果,将Ki-67≥30% 病例归为高表达组,Ki-67<30%为低表达组[8]。
1.5 统计学分析
采用SPSS 27.0统计软件进行数据分析。本文均为连续变量资料,用K-S检验方法检验正态性,结果用均值±标准差(
$ \bar{x} \pm s$ )表示,两组采用独立样本t检验比较差异性;采用Spearman相关性分析评估DLSCT定量参数与Ki-67表达水平的相关性,以上统计学方法中P<0.05差异有统计学意义。将获得的有统计意义的数据绘制ROC曲线,计算AUC、约登指数、截断值及对应的特异度、敏感度来衡量DLSCT定量参数评估Ki-67表达的效能,AUC>0.5认为该试验具有一定的诊断效能。2. 结果
2.1 DLSCT定量参数比较
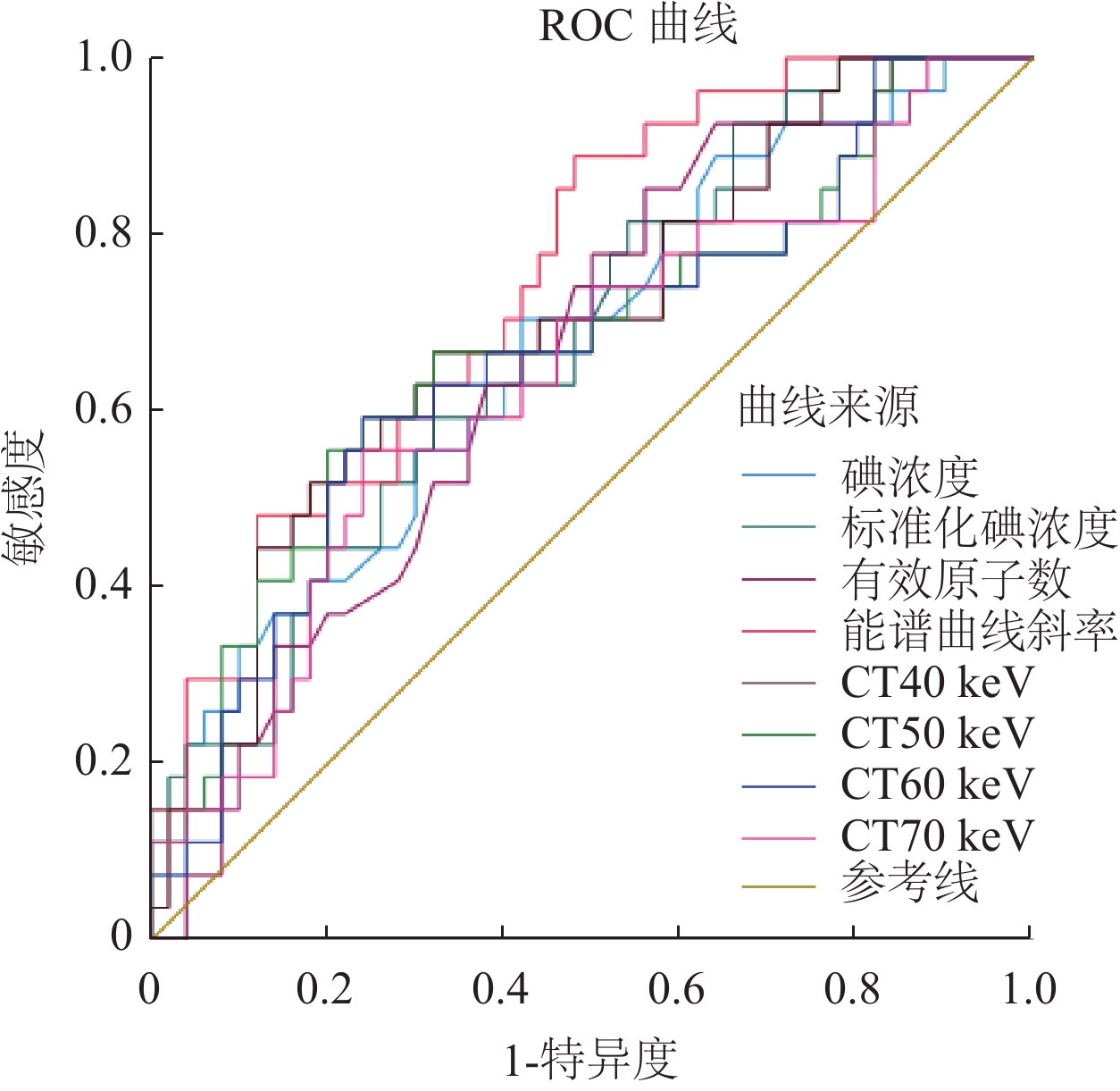
静脉期低表达组与高表达组IC、NIC、Zeff、K、CT40 keV-CT70 keV(间隔10 keV),动脉期K40-100 keV、CT40 keV比较,差异均具有统计学意义(P<0.05)。低表达组静脉期CT80 keV-CT100 keV(间隔10 keV)、动脉期IC、NIC、Zeff、CT50 keV-CT100 keV(间隔10 keV)均高于高表达组,但差异均无统计学意义(P>0.05),上述结果见表1、表2及图1、图2。
表 1 Ki-67高、低表达组静脉期光谱CT各参数比较Table 1. Comparison of spectral CT parameters in venous phase from high and low Ki-67 expression groups参数 组别 统计检验 低表达组 高表达组 t值 P值 n 27 50 IC/(mg/mL) 1.37±0.39 1.12±0.36 2.9 0.01 NIC 0.31±0.08 0.25±0.08 3.27 <0.01 Zeff 8.08±0.18 7.95±0.26 2.3 0.02 K40-100 keV 1.87±0.44 1.43±0.48 3.93 <0.01 CT40 keV/HU 164.68±32.27 137.72±34.98 3.31 <0.01 CT50keV/HU 121.38±26.42 103.3±25.39 2.94 <0.01 CT60 keV/HU 93.03±17.37 81.84±17.87 2.65 0.01 CT70 keV/HU 75.8±13.62 68.37±13.14 2.34 0.02 CT80 keV/HU 63.86±12.76 60.71±11.53 1.1 0.28 CT90 keV/HU 56.6±12.92 55.38±9.96 0.46 0.65 CT100 keV/HU 52.68±11.97 51.78±9.02 0.37 0.71 表 2 Ki-67高、低表达组动脉期光谱CT各参数比较Table 2. Comparison of arterial phase spectral CT parameters from high and low Ki-67 expression groups参数 组别 统计检验 低表达组 高表达组 t值 P值 n 27 50 IC/(mg/mL) 1.31±0.39 1.15±0.36 1.5 0.14 NIC 0.11±0.03 0.09±0.04 1.75 0.08 Zeff 7.99±0.24 7.95±0.26 0.66 0.51 K40-100 keV 1.61±0.45 1.33±0.50 2.42 0.02 CT40 keV/HU 150.30±31.75 132.03±35.03 2.26 0.03 CT50keV/HU 109.08±21.23 100.58±24.32 1.53 0.13 CT60 keV/HU 86.11±15.43 80.42±16.98 1.45 0.15 CT70 keV/HU 72.69±12.37 68.32±12.50 1.47 0.15 CT80 keV/HU 63.54±10.60 60.60±9.96 1.21 0.23 CT90 keV/HU 57.66±9.72 55.51±8.26 1.03 0.31 CT100 keV/HU 53.54±9.23 52.01±7.19 0.81 0.42 2.2 Spearman 相关分析
静脉期IC、NIC、Zeff、K40-100 keV、CT40 keV-CT60 keV(间隔10 keV)、动脉期K40-100 keV 及动脉期CT40 keV与Ki-67表达水平呈负相关。静脉期CT70 keV-CT100 keV(间隔10 keV) 与Ki-67表达无明显相关性(P>0.05),具体分析结果见表3及表4。
表 3 静脉期光谱CT各参数与Ki-67表达水平的相关性分析Table 3. Correlation analysis between Ki-67 expression and parameters from venous phase spectral CTr值 P值 分组 1 IC(mg/ml) −0.267 0.02 NIC −0.297 0.01 Zeff −0.251 0.03 K40-100 keV −0.398 <0.01 CT40 keV(HU) −0.315 0.01 CT50keV(HU) −0.278 0.01 CT60 keV(HU) −0.243 0.03 CT70 keV(HU) −0.194 0.10 CT80 keV(HU) −0.062 0.60 CT90 keV(HU) −0.007 −0.95 CT100 keV(HU) −0.007 0.95 表 4 动脉期光谱CT各参数与Ki-67表达水平的相关性分析Table 4. Correlation analysis between Ki-67 expression and parameters from arterial phase spectral CT分组 K40-100 keV CT40 keV(HU) r值 1 −0.225 −0.225 P值 0.05 <0.05 2.3 DLSCT定量参数ROC曲线分析
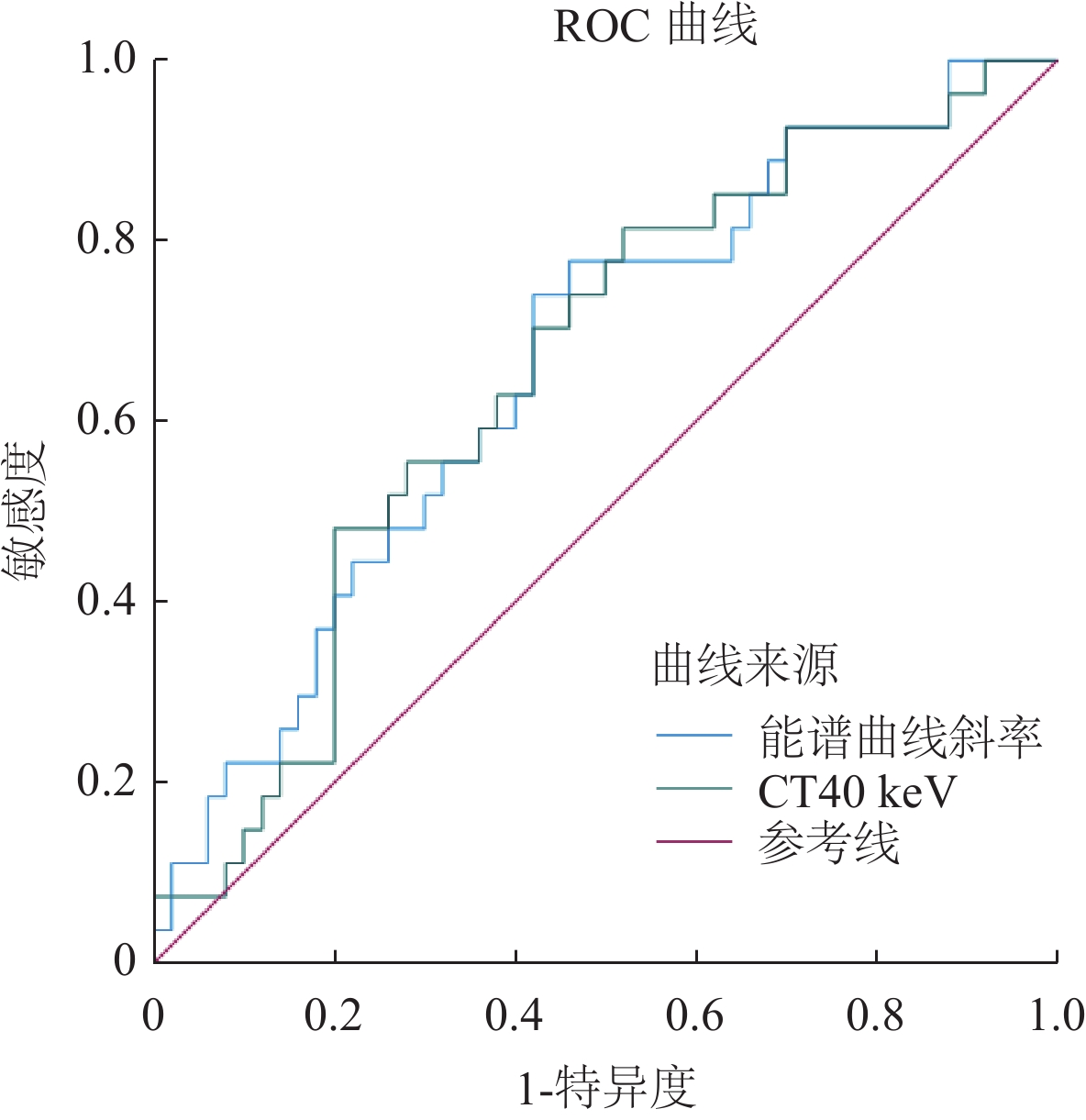
ROC曲线分析,见表5及图3所示。静脉期IC、NIC、Zeff、K40-100 keV、CT40 keV-CT70 keV(间隔10 keV)、动脉期K40-100 keV 及动脉期CT40 keV评估非小细胞肺癌Ki-67表达水平均具有一定的参考价值。静脉期K40-100 keV评估非小细胞肺癌Ki-67表达水平最佳(AUC=0.750),敏感度为88.9%,特异度为52%,截断值为1.366。
表 5 光谱CT各参数诊断Ki-67高表达组与非高表达组肺癌病灶的效能Table 5. Efficacy of spectral CT parameters in diagnosis of lung cancer lesions in the high Ki-67 group and the low Ki-67 group指标 约登指数 临界值 敏感度(%) 特异度(%) AUC 95%CI IC (V) 0.284 1.145 70.4 58.0 0.674 0.549-0.799 NIC(V) 0.275 0.245 81.5 46.0 0.683 0.561-0.804 Zeff(V) 0.292 7.925 85.2 44.0 0.660 0.538-0.782 K40-100 keV(V) 0.409 1.366 88.9 52.0 0.750 0.641-0.859 CT40 keV(V) 0.347 150.772 66.7 68.0 0.698 0.575-0.820 CT50 keV(V) 0.356 116.921 55.6 80.0 0.679 0.549-0.809 CT60 keV(V) 0.353 89.047 59.3 76.0 0.666 0.536-0.796 CT70 keV(V) 0.316 74.610 55.6 76.0 0.644 0.513-0.776 K40-100 keV(A) 0.321 1.407 74.1 58.0 0.662 0.537-0.788 CT40 keV(A) 0.295 130.264 81.5 48.0 0.657 0.531-0.783 注:AUC:曲线下面积;CT40 keV(V)、CT40 keV(A):分别代表静脉期CT40 keV、动脉期CT40 keV,余数据以此类推。 3. 讨论
传统的胸部CT 采用单一能量技术在一定的管电压水平下进行,产生多色图像。常规胸部CT主要依靠病变形态学诊断,定量参数少,诊断效率有限[9]。DLSCT工作原理是在不增加额外对比剂和不改变常规工作流程的前提下,基于探测器的双能量分离技术,通过两层探测器同步获取低能和高能数据,采用空间投影分解技术,生成光谱基底图像(Spetral Base Images,SBI),实现“三同”的光谱功能成像[10-11]。SBI大小是相对应传统DICOM图像的三倍,SBI除含传统CT图像外,还包括 MonoE(单能量光谱结果)、Z Effective、Iodine密度、电子密度(%DEW)等光谱信息图像,无须在扫描仪上重建单独序列。DSLCT扫描实现了束流硬化校正、物质分解和图像去噪,提升了 CT值测量的准确性。
MonoE是一种虚拟单能量图像,范围为40~200 keV,可显示病灶每个单能量序列对应的CT值。K反映ROI内组织结构随着keV值能量水平增加而发生的动态变化,所以CT值的衰减变化可反映不同组织病变的衰减规律,不同组织形成的CT光谱曲线特征不同。鉴于100 keV以上能谱曲线趋于平缓且相互重叠,本文选择40 keV和100 keV作为K的单能量节点[12-14]。
IC可反映组织内碘沉积,间接反映肿瘤新生血管生成和血供情况[15]。NIC较IC减小了个体间的血流动力学差异,在不同组别间可比性更强。本研究非小细胞肺癌病灶静脉期Iodine密度(IC)、标准化Iodine密度(NIC)、K、CT40 keV-60 keV(间隔10 keV)及动脉期K、CT40 keV与Ki-67表达呈负相关,以上结果与田双凤[16]、周潋滟[17]等人的研究结果相符。本文所得结果原因可能是:Ki-67表达水平高肿瘤侵袭性增强,进而肿瘤细胞增殖活跃导致肿瘤细胞生长的微环境缺血、缺氧,微血管形成密度低,肿瘤区血供相对不足;与病灶边缘相比,病灶中央的血供更少,坏死概率增加;从而导致Ki-67高表达组病灶CT值和衰减幅度较小。
Zeff反映了络合物或混合物的总原子序数,与元素的基本性质有密切关系。本研究静脉期有效原子序数Zeff与Ki-67表达呈现负相关,此结果与周潋滟[17]等人研究结果相悖;动脉期有效原子序数Zeff差异无统计学意义。这些可能与有效原子序数Zeff未与同层面动脉进行归一化,存在血流动力学的个体差异有关[18];或者在肿瘤组织中某些微量元素含量低于正常组织。
两组数据静脉期CT80-100 keV、动脉期CT50-100 keV(间隔10 keV)差异无统计学意义(P>0.05),可能原因在于较高keV值时肿瘤组织对x射线的吸收不依赖于碘对比剂的增强[19]。动脉期Iodine密度(IC)、标准化Iodine密度(NIC)差异无统计学意义(P>0.05),与Wu[20]等人分析结果不符,可能的原因:所选样本数量有限且病例分化程度构成比不同,导致分析变量难以达到显著性。
本研究静脉期光谱参数均高于动脉期,与Dou[21]等人结果相符;ROC曲线分析静脉期K40-100 keV评估非小细胞肺癌Ki-67表达水平最佳(AUC=0.750),约登指数为0.409,敏感度为88.9%,可能原因是K能更直观反应病变的衰减规律;在静脉期,碘对比剂浓度达到峰值,碘对比剂在病变内部被最大限度地填充,从而使病变内部组织成分在静脉期获得最佳的对比显影[22];但静脉期K40-100 keV特异度仅为52%,CT50-70 keV范围内特异度均≥76%,可能提示这个范围内连续测量单能量CT值可提高Ki-67诊断的准确性。另外,动静脉期光谱参数评估非小细胞肺癌Ki-67表达水平的诊断效能AUC均<0.8、双期约登指数均<0.5且动静脉约登指数大小差异不著,推测原因是本文增强扫描未使用个体化阈值触发法,此方法基于卷积算法,从对比剂注射剂量和监测测量信息自动推导出个体化的触发阈值及扫描时间。多项研究表明,此方法可克服患者间的心输出量差异,在不增加对比剂前提下提高动脉期实质器官和大血管的衰减幅度和显著改善图像对比噪声比[23-25],进一步提高肿瘤的可见性;或本文样本量有限,低估了研究结果的显著性。
局限性:本文为回顾性研究,病例分组非完全随机,可能存在无意识的选择偏倚;本文中部分样本是穿刺活检,由于肿瘤组织的异质性,所取样本可能以偏概全导致Ki-67测定偏倚;本文未对NSCLC各亚型DLSCT参数进行探究分析;本文样本数量有限,可能夸大了结果的相关性;本试验管电压和对比剂方案固定,未因患者体重等因素进行个体化调整;未联合研究光谱参数对其他肺癌预后生物标志物(如TTF-1、EGFR等)的预测价值;由于NSCLC患者生存时间有限,未能探究Ki-67高、低表达组患者的预后及结局。
综上所述,DLSCT双期定量参数对非小细胞肺癌Ki-67表达具有一定的预测价值,为患者确定治疗方案和预后提供了更多的个体化信息。
-
表 1 Ki-67高、低表达组静脉期光谱CT各参数比较
Table 1 Comparison of spectral CT parameters in venous phase from high and low Ki-67 expression groups
参数 组别 统计检验 低表达组 高表达组 t值 P值 n 27 50 IC/(mg/mL) 1.37±0.39 1.12±0.36 2.9 0.01 NIC 0.31±0.08 0.25±0.08 3.27 <0.01 Zeff 8.08±0.18 7.95±0.26 2.3 0.02 K40-100 keV 1.87±0.44 1.43±0.48 3.93 <0.01 CT40 keV/HU 164.68±32.27 137.72±34.98 3.31 <0.01 CT50keV/HU 121.38±26.42 103.3±25.39 2.94 <0.01 CT60 keV/HU 93.03±17.37 81.84±17.87 2.65 0.01 CT70 keV/HU 75.8±13.62 68.37±13.14 2.34 0.02 CT80 keV/HU 63.86±12.76 60.71±11.53 1.1 0.28 CT90 keV/HU 56.6±12.92 55.38±9.96 0.46 0.65 CT100 keV/HU 52.68±11.97 51.78±9.02 0.37 0.71 表 2 Ki-67高、低表达组动脉期光谱CT各参数比较
Table 2 Comparison of arterial phase spectral CT parameters from high and low Ki-67 expression groups
参数 组别 统计检验 低表达组 高表达组 t值 P值 n 27 50 IC/(mg/mL) 1.31±0.39 1.15±0.36 1.5 0.14 NIC 0.11±0.03 0.09±0.04 1.75 0.08 Zeff 7.99±0.24 7.95±0.26 0.66 0.51 K40-100 keV 1.61±0.45 1.33±0.50 2.42 0.02 CT40 keV/HU 150.30±31.75 132.03±35.03 2.26 0.03 CT50keV/HU 109.08±21.23 100.58±24.32 1.53 0.13 CT60 keV/HU 86.11±15.43 80.42±16.98 1.45 0.15 CT70 keV/HU 72.69±12.37 68.32±12.50 1.47 0.15 CT80 keV/HU 63.54±10.60 60.60±9.96 1.21 0.23 CT90 keV/HU 57.66±9.72 55.51±8.26 1.03 0.31 CT100 keV/HU 53.54±9.23 52.01±7.19 0.81 0.42 表 3 静脉期光谱CT各参数与Ki-67表达水平的相关性分析
Table 3 Correlation analysis between Ki-67 expression and parameters from venous phase spectral CT
r值 P值 分组 1 IC(mg/ml) −0.267 0.02 NIC −0.297 0.01 Zeff −0.251 0.03 K40-100 keV −0.398 <0.01 CT40 keV(HU) −0.315 0.01 CT50keV(HU) −0.278 0.01 CT60 keV(HU) −0.243 0.03 CT70 keV(HU) −0.194 0.10 CT80 keV(HU) −0.062 0.60 CT90 keV(HU) −0.007 −0.95 CT100 keV(HU) −0.007 0.95 表 4 动脉期光谱CT各参数与Ki-67表达水平的相关性分析
Table 4 Correlation analysis between Ki-67 expression and parameters from arterial phase spectral CT
分组 K40-100 keV CT40 keV(HU) r值 1 −0.225 −0.225 P值 0.05 <0.05 表 5 光谱CT各参数诊断Ki-67高表达组与非高表达组肺癌病灶的效能
Table 5 Efficacy of spectral CT parameters in diagnosis of lung cancer lesions in the high Ki-67 group and the low Ki-67 group
指标 约登指数 临界值 敏感度(%) 特异度(%) AUC 95%CI IC (V) 0.284 1.145 70.4 58.0 0.674 0.549-0.799 NIC(V) 0.275 0.245 81.5 46.0 0.683 0.561-0.804 Zeff(V) 0.292 7.925 85.2 44.0 0.660 0.538-0.782 K40-100 keV(V) 0.409 1.366 88.9 52.0 0.750 0.641-0.859 CT40 keV(V) 0.347 150.772 66.7 68.0 0.698 0.575-0.820 CT50 keV(V) 0.356 116.921 55.6 80.0 0.679 0.549-0.809 CT60 keV(V) 0.353 89.047 59.3 76.0 0.666 0.536-0.796 CT70 keV(V) 0.316 74.610 55.6 76.0 0.644 0.513-0.776 K40-100 keV(A) 0.321 1.407 74.1 58.0 0.662 0.537-0.788 CT40 keV(A) 0.295 130.264 81.5 48.0 0.657 0.531-0.783 注:AUC:曲线下面积;CT40 keV(V)、CT40 keV(A):分别代表静脉期CT40 keV、动脉期CT40 keV,余数据以此类推。 -
[1] KIRI S, RYBA T. Cancer, metastasis, and the epigenome[J]. Molecular Cancer, 2024, 23(1): 154. DOI: 10.1186/s12943-024-02069-w.
[2] SIEGEL R L, GIAQUINTO A N, JEMAL A. Cancer statistics, 2024[J]. CA: a cancer journal for clinicians, 2024, 74(1). DOI: 10.3322/caac.21820
[3] LEITER A, VELUSWAMY R R, WISNIVESKY J P. The global burden of lung cancer: current status and future trends[J]. Nature reviews Clinical oncology, 2023, 20(9): 624-639. DOI: 10.1038/s41571-023-00798-3.
[4] MROUJ K, ANDRéS-SáNCHEZ N, DUBRA G, et al. Ki-67 regulates global gene expression and promotes sequential stages of carcinogenesis[J]. Proceedings of the National Academy of Sciences, 2021, 118(10): e2026507118. DOI: 10.1073/pnas.2026507118.
[5] LUO X, ZHENG R, ZHANG J, et al. CT-based radiomics for predicting Ki-67 expression in lung cancer: a systematic review and meta-analysis[J]. Frontiers in Oncology, 2024, 14: 1329801. DOI: 10.3389/fonc.2024.1329801.
[6] DENG L, YANG J, ZHANG M, et al. Whole-lesion iodine map histogram analysis versus single-slice spectral CT parameters for determining novel International Association for the Study of Lung Cancer grade of invasive non-mucinous pulmonary adenocarcinomas[J]. Diagnostic and Interventional Imaging, 2024, 105(5): 165-173. DOI: 10.1016/j.diii.2023.12.001.
[7] MA Y, LI S, HUANG G, et al. Role of iodine density value on dual-energy CT for detection of high tumor cell proportion region in lung cancer during CT-guided transthoracic biopsy[J]. European Journal of Radiology, 2023, 160: 110689. DOI: 10.1016/j.ejrad.2023.110689.
[8] LIN L, CHENG J, TANG D, et al. The associations among quantitative spectral CT parameters, Ki-67 expression levels and EGFR mutation status in NSCLC.[J]. Sci Rep, 2020, 1: 3436. DOI: 10.1038/s41598-020-60445-0.
[9] ZHU T, XIE K, WANG C, et al. Diagnostic Effectiveness of Dual Source Dual Energy Computed Tomography for Benign and Malignant Thyroid Nodules[J]. Evidence‐Based Complementary and Alternative Medicine, 2022, 2022(1): 2257304. DOI: 10.1155/2022/2257304.
[10] 中华放射学杂志双层探测器光谱CT临床应用协作组. 双层探测器光谱CT临床应用中国专家共识(第一版)[J]. 中华放射学杂志, 2020, 54(7): 635-643. DOI: 10.3760/cma.j.cn112149-20200513-00679. CHINESE JOURNAL OF RADIOLOGY DUAL-LAYER SPECTRAL DETECTOR CT CLINICAL APPLICATION COLLABORATIVE GROUP. Chinese expert consensus on clinical application of dual-layer spectral detector CT (first edition)[J]. Chinese Journal of Radiology, 2020, 54(7): 635-643. DOI: 10.3760/cma.j.cn112149-20200513-00679.
[11] FULTON N, RAJIAH P. Abdominal applications of a novel detector-based spectral CT[J]. Current Problems in Diagnostic Radiology, 2018, 47(2): 110-118. DOI: 10.1067/j.cpradiol.2017.05.001.
[12] ZHANG Z, ZOU H, YUAN A, et al. A Single Enhanced Dual-Energy CT Scan May Distinguish Lung Squamous Cell Carcinoma From Adenocarcinoma During the Venous phase.[J]. Acad Radiol, 2020, 5: 624-629. DOI: 10.1016/j.acra.2019.07.018.
[13] 薛莉雅, 赵卫东, 苏琳, 等. 双层探测器光谱CT多参数成像在不同病理类型肺癌中的应用[J]. 中国CT和MRI杂志, 2023, 21(12): 52-55. DOI: 10.3969/j.issn.1672-5131.2023.12.016. XUE L Y, ZHAO W D, SU L, et al. Application of multi-parameter imaging of dual-layer spectral detector CT in different pathological types of lung cancer[J]. Chinese journal of CT and MRI, 2023, 21(12): 52-55. DOI: 10.3969/j.issn.1672-5131.2023.12.016.
[14] 刘秀丽, 张戟风, 刘景旺, 等. 能谱CT在中央型肺癌伴阻塞性肺不张诊断及放疗定位中应用价值[J]. CT理论与应用研究, 2023, 32(4): 509-514. DOI: 10.15953/j.ctta.2022.164. LIU X L, ZHANG J F, LIU J W, et al. The value of Spectral CT in differential diagnosis and ra-diotherapy localiation of central lung cancer with obstructive atelectasis[J]. CT Theory and App-lications, 2023, 32(4): 509-514. DOI: 10.15953/j.ctta.2022.164.
[15] WU J, LV Y, WANG N, et al. The value of single-source dual-energy CT imaging for discriminating microsatellite instability from microsatellite stability human colorectal cancer.[J]. Eur Radiol, 2019, 7: 3782-3790. DOI: 10.1007/s00330-019-06144-5.
[16] 田双凤, 杨萌, 夏建国, 等. 实性肺癌能谱CT参数与Ki-67表达水平的相关性研究[J]. 影像诊断与介入放射学, 2021, 30(1): 20-24. DOI: 10.3969/j.issn.1005-8001.2021.01.004. TIAN S F, YANG M, XIA J G, et al. Correlation between spectral CT parameters and Ki-67 expression in solid lung cancer [J]. The imaging diagnosis and interventional radiology, 2021, 30 (1) : 20 to 24. DOI: 10.3969 / j.i SSN. 1005-8001.2021.01.004.
[17] 周潋滟, 张浩荡, 殷世武. 双层光谱CT评估非小细胞肺癌Ki-67表达水平的可行性[J]. 中国介入影像与治疗学, 2023, 20(2): 107-111. DOI: 10.13929/j.issn.1672-8475.2023.02.011. ZHOU L Y, ZHANG H D, YIN S W. Feasibility of assessing Ki-67 expression level in non-small cell lung cancer using dual-layer spectral CT[J]. Chinese interventional imaging and therapy, 2023, 20(2): 107-111. DOI: 10.13929/j.issn.1672-8475.2023.02.011.
[18] MAO L T, CHEN W C, LU J Y, et al. Quantitative parameters in novel spectral computed tomography: Assessment of Ki-67 expression in patients with gastric adenocarcinoma[J]. World Journal of Gastroenterology, 2023, 29(10): 1602. DOI: 10.3748/wjg.v29.i10.1602.
[19] ZEGADŁO A, ŻABICKA M, RóŻYK A, et al. A new outlook on the ability to accumulate an iodine contrast agent in solid lung tumors based on virtual monochromatic images in dual energy computed tomography (DECT): Analysis in two phases of contrast enhancement[J]. Journal of Clinical Medicine, 2021, 10(9): 1870. DOI: 10.3390/jcm10091870.
[20] WU Y, LI J, DING L, et al. Differentiation of pathological subtypes and Ki-67 and TTF-1 expression by dual-energy CT (DECT) volumetric quantitative analysis in non-small cell lung cancer[J]. Cancer Imaging, 2024, 24(1): 146. DOI: 10.1186/s40644-024-00793-6.
[21] DOU P, LIU Z, XIE L, et al. The predictive value of energy spectral CT parameters for assessing Ki-67 expression of lung cancer[J]. Translational Cancer Research, 2020, 9(7): 4267. DOI: 10.21037/tcr-19-2769a.
[22] 窦沛沛, 赵恒亮, 曹爱红. 能谱CT联合肿瘤标志物预测肺腺癌Ki-67表达[J]. CT理论与应用研究, 2023, 32(6): 753-760. DOI: 10.15953/j.ctta.2022.172. DOU P P, ZHAO H L, CAO A H. Spectral CT combined with tumor markers to predict Ki-67 expression in lung adenocarcinoma[J]. CT Theory and Applications, 2023, 32(6): 753-760. DOI: 10.15953 / j.carol carroll tta. 2022.172. DOI: 10.15953/j.ctta.2022.172.
[23] YU J, LIN S, LU H, et al. Optimize scan timing in abdominal multiphase CT: Bolus tracking with an individualized post-trigger delay. [J]. Eur J Radiol, 2022: 110139. DOI: 10.1016/j.ejrad.2021.110139
[24] QI K, LI L, YUAN D, et al. Optimized contrast enhancement and homogeneity in aortic CT angiography: bolus tracking with personalized post-trigger delay[J]. Quantitative Imaging in Medicine and Surgery, 2024, 15(1): 709. DOI: 10.21037/qims-24-624.
[25] YUAN D, LI L, ZHANG Y, et al. Image quality improvement in head and neck CT angiography: Individualized post-trigger delay versus fixed delay. [J]. Eur J Radiol, 2023, 111142. DOI: 10.1016/j.ejrad.2023.111142



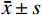
 下载:
下载: