Deep Learning Reconstruction Algorithm Combined with “Double Low” Dose for Liver CT Enhancement
-
摘要:
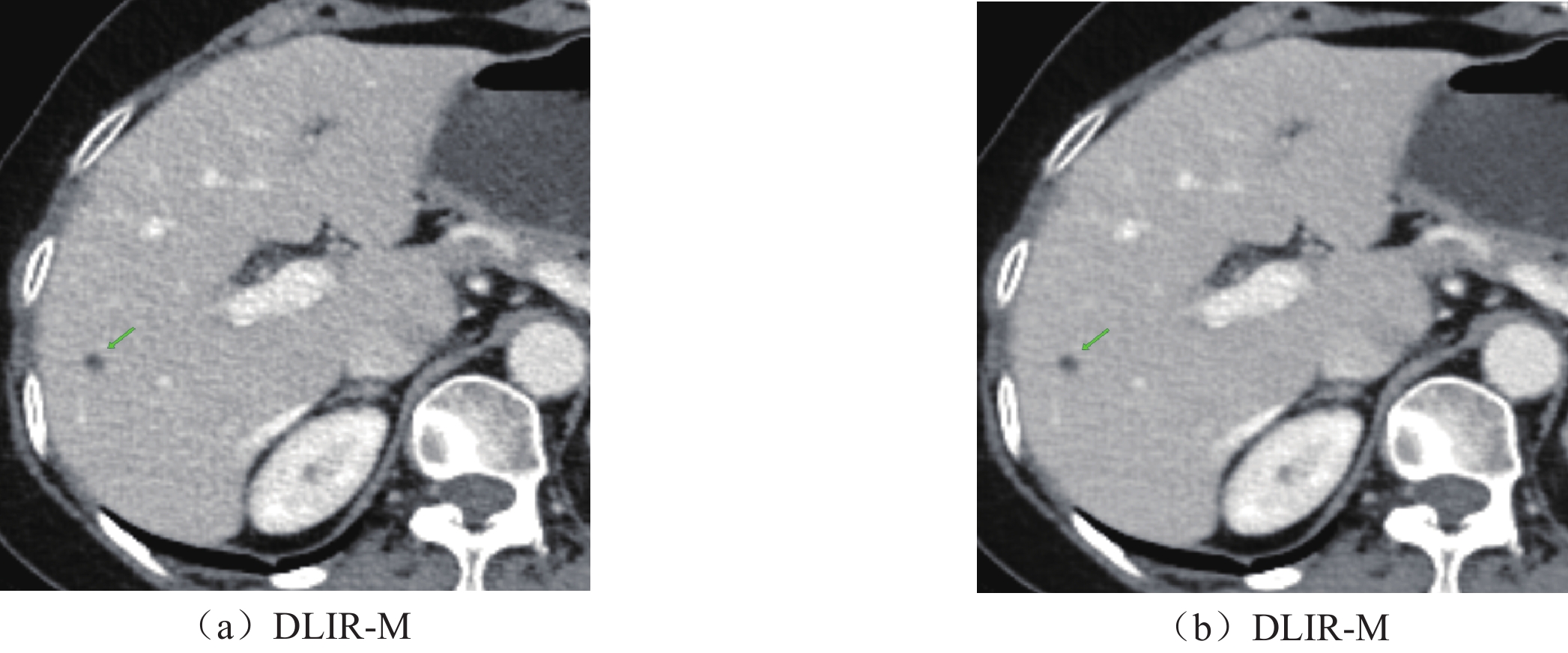
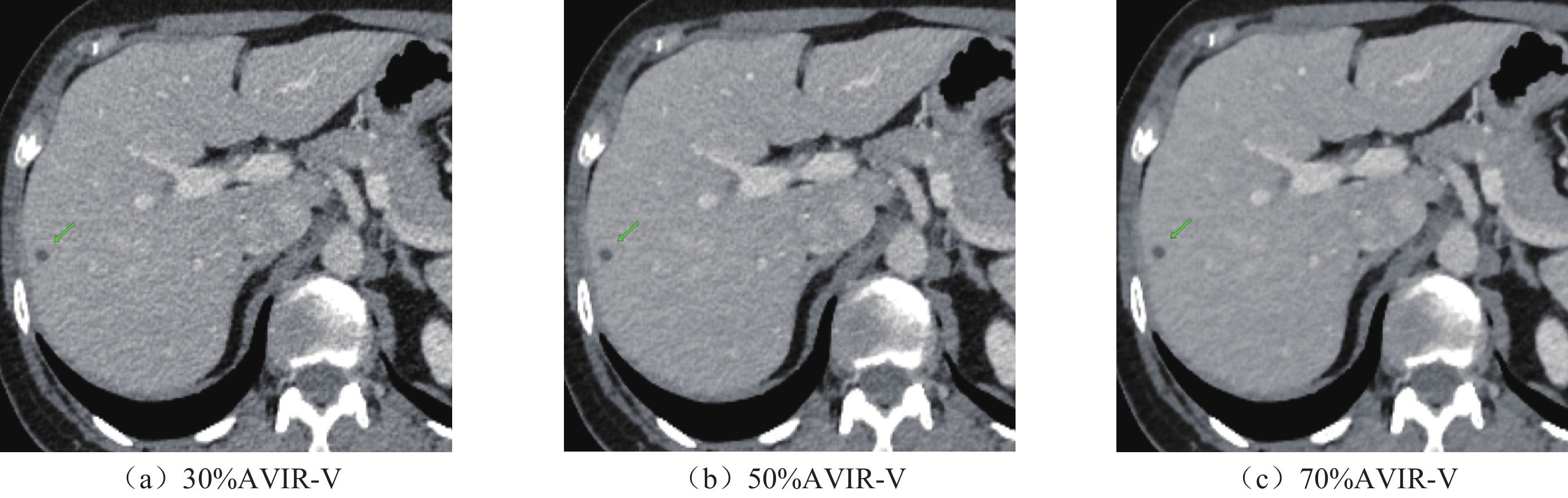
目的:探讨在肝脏CT增强中结合低辐射剂量和低碘对比剂,深度学习重建算法(DLIR)与自适应统计迭代重建(ASIR-V)的应用效果。方法:前瞻性收集行腹部增强CT的患者82例,随机分成A组和B组,A组(对照组)常规剂量(管电压120kVp,碘对比剂85mL)下门静脉期采用30%、50%、70% ASIR-V(AV30、AV50、AV70)进行图像重建。B组(实验组)双低剂量(管电压80kVp;碘对比剂65 mL)下门静脉期采用中、高强度深度学习(DLIR-M,DLIR-H)进行图像重建。计算了图像噪声(SD)、信噪比(SNR)、对比噪声比(CNR)、病灶对比噪声比(LLR)、品质因数(FOM)、有效辐射剂量(ED)及碘摄入量。两名诊断医生评估不同剂量下不同重建方式的主观图像质量。结果:A组和B组的性别、年龄、体重指数BMI差异均无统计学意义。在有效剂量降低38.40%,对比剂用量降低23.53%下,DLIR-M与AV50、DLIR-H与AV70肝实质、门静脉SD值差异均无统计学意义,肝实质、门静脉SNR中仅DLIR-M与AV50不具有统计学意义,肝实质、门静脉CNR中仅DLIR-M与AV70差异无统计学意义,病灶对比噪声比(LLR)与品质因数(FOM)中,仅DLIR-M与AV70差异无统计学意义。在各项主观图像质量评估中,双低剂量下的DLIR表现优于常规剂量的AVIR-V,尤其是DLIR-H表现最佳。结论:与常规剂量下ASIR-V相比,DLIR在“双低”(低辐射剂量低对比剂)剂量下可以提高图像质量和肝脏低对比度病灶的检测能力。
Abstract:Objective: Exploration of the application of a deep-learning reconstruction algorithm (DLIR) and adaptive statistical iterative reconstruction (ASIR-V) based on the combination of low radiation dose and low iodine contrast agent in liver CT enhancement. Methods: A total of 82 patients who underwent abdominal enhanced CT were prospectively selected and randomly separated into groups A and B. Group A (control group) received a conventional dose (tube voltage 120 kVp; iodine contrast 85mL) and inferior portal image reconstruction was applied using 30%, 50%, and 70% ASIR-V (AV 30, AV 50, AV 70). In Group B (experimental group), image reconstruction was based on medium- and high-intensity deep learning (DLIR-M, DLIR-H). Image noise (SD), signal-to-noise ratio (SNR), contrast-to-noise ratio (CNR), lesion contrast-to-noise ratio (LLR), quality factor (FOM), effective radiation dose (ED), and iodine intake were calculated. Subjective image quality results were obtained for different reconstruction methods at different doses. No significant differences in gender, age, and BMI between groups A and B were found. For 38.40% effective dose and 23.53% reduction in the contrast agent dosage, no significant SD differences were found between DLIR-M and AV 50, DLIR-H and liver parenchyma and AV 70. Only DLIR-M and AV 50 in the portal SNR were not statistically significant. No significant differences were found between DLIR-M and AV 70 in liver parenchyma and portal CNR. Concerning LLR and FOM, no significant differences were found between DLIR-M and AV 70. For various subjective image quality assessments, DLIR at double low doses outperformed AVIR-V, especially DLIR-H. Conclusions: DLIR can improve image quality and the ability to detect liver low contrast lesions at “double low” (low radiation dose low contrast) compared to ASIR-V.
-
Keywords:
- upper abdominal enhanced CT /
- liver /
- deep learning /
- double low dose
-
-
表 1 主观图像评价标准
Table 1 Subjective image evaluation criteria
评分 主观图像噪声 图像清晰度 病灶显著度 诊断置信度 1 不可接受的噪声 模糊 无法识别 无法诊断 2 高于平均水平 差于平均水平 显示差,识别困难 低 3 平均水平 平均 显示一般,可识别 平均 4 低于平均水平 优于平均水平 显示较好,易识别 高 5 极小 极好 显示明显,容易识别 极好 表 2 两组一般资料
Table 2 Two groups of general information
组别 例数/n 男/女(n/(%)) 年龄/岁 BMI/(kg/m2) 常规剂量 A组41 19(46.34)/22(53.66) 54.12±14.43 22.95±5.71 双低剂量 B组41 24(58.54)/17(41.46) 56.49±14.00 22.48±2.79 X2/t 1.222 0.754 0.474 P 0.269 0.453 0.637 表 3 不同重建方式图像客观指标比较结果
Table 3 Comparison results of image objective indexes for different reconstruction methods
参数 A组重建方式 B组重建方式 F P AV30 AV50 AV70 DLIR-M DLIR-H SD值 肝实质 16.00±3.54 12.54±3.18 9.45±2.09 13.47±1.99 9.10±1.58 50.06 < 0.001 门脉 21.94±5.11 17.43±4.49 14.1±4.51 18.01±2.40 13.19±2.66 31.27 < 0.001 SNR值 肝实质 7.79±2.74 10.16±4.46 12.84±3.09 10.03±2.23 14.87±3.35 29.19 < 0.001 门脉 8.37±2.67 10.57±2.96 13.17±3.26 11.76±2.02 16.21±2.80 45.86 < 0.001 CNR值 肝实质 2.96±1.31 3.72±1.54 4.52±1.59 4.17±1.37 6.18±2.00 23.39 < 0.001 门脉 5.98±2.20 7.63±2.50 9.41±2.72 9.3±2.66 13.79±3.84 43.14 < 0.001 LLR值 病灶 5.68±1.45 7.24±2.16 9.28±2.65 7.72±2.25 10.97±3.63 15.91 < 0.001 FOM值 2.67±1.80 4.25±2.68 6.22±2.34 7.19±2.39 15.95±5.53 104.76 < 0.001 表 4 不同重建方式进行主观图像分析
Table 4 Subjective image analysis for different reconstruction methods
分组 主观图像噪声 图像清晰度 病灶显著度 诊断置信度 reader l reader 2 reader l reader 2 reader l reader 2 reader l reader 2 常规剂量A组 AV30 2.56±0.5 2.61±0.49 2.46±0.51 2.54±0.51 2.59±0.55 2.66±0.53 2.51±0.51 2.61±0.49 AV50 3.05±0.31 3.02±0.27 3.32±0.47 3.34±0.48 3.24±0.44 3.29±0.46 3.17±0.38 3.27±0.45 AV70 3.63±0.49 3.63±0.49 3.76±0.58 3.85±0.53 3.71±0.6 3.61±0.49 3.85±0.62 3.98±0.57 双低剂量B组 DLIR-M 3.85±0.36 3.9±0.44 4.02±0.69 4.05±0.63 4.1±0.63 4±0.55 4.07±0.57 4.17±0.54 DLIR-H 4.34±0.48 4.39±0.49 4.44±0.5 4.46±0.51 4.56±0.5 4.49±0.51 4.49±0.51 4.54±0.51 k 0.824* 0.829 0.798* 0.822* 注:*表示kappa检验中的P < 0.05,差异具有统计学意义。 表 5 不同重建方式下主观评分差异性比较(Bonferroni校正P值)
Table 5 Comparison of subjective scores for different reconstruction methods (Bonferroni correction P value )
指标 主观图像噪声 图像清晰度 病灶显著度 诊断置信度 AV30 vs. AV50 0.025 < 0.001 0.003 0.004 AV30 vs. AV70 < 0.001 < 0.001 < 0.001 < 0.001 AV30 vs. DLIR-M < 0.001 < 0.001 < 0.001 < 0.001 AV30 vs. DLIR-H < 0.001 < 0.001 < 0.001 < 0.001 AV50 vs. AV70 < 0.001 0.01 0.007 < 0.001 AV50 vs. DLIR-M < 0.001 < 0.001 < 0.001 < 0.001 AV50 vs. DLIR-H < 0.001 < 0.001 < 0.001 < 0.001 AV70 vs. DLIR-M 0.118 0.166 0.034 0.216 AV70 vs. DLIR-H < 0.001 < 0.001 < 0.001 0.001 DLIR-M vs. DLIR-H 0.012 0.025 0.019 0.036 -
[1] MAYO-SMITH W W, HARA A K, MAHESH M, et al. How I do it: Managing radiation dose in CT[J]. Radiology, 2014, 273(3): 657-672. DOI: 10.1148/radiol.14132328.
[2] HYOJIN K, MIN J L, CHULKYUN A, et al. Low dose of contrast agent and low radiation liver computed tomography with deep-learning-based contrast boosting model in participants at high-risk for hepatocellular carcinoma: prospective, randomized, double-blind study[J]. European Radiology, 2023, 33(5): 3660-3670. DOI: 10.1007/s00330-023-09520-4.
[3] HAUBOLD J, HOSCH R, UMUTLU L, et al. Contrast agent dose reduction in computed tomography with deep learning using a conditional generative adversarial network[J]. European Radiology, 2021, 31(8): 1-9.
[4] SAE-JIN P, DONG-YOON K, KYOUNG-HEE S, et al. Immediate Mild Reactions to CT with Iodinated Contrast Media: Strategy of Contrast Media Readministration without Corticosteroids[J]. Radiology, 2018, 288(3): 710-716. DOI: 10.1148/radiol.2018172524.
[5] KUN K H, SEOK K C, KYOUNG N J, et al. Cardiac CTA image quality of adaptivestatistical iterative reconstruction-V versus deep learning reconstruction “TrueFidelity” in children with congenital heart disease[J]. Medicine, 2022, 101(42): e31169-e31169. DOI: 10.1097/MD.0000000000031169.
[6] LE C, XIANG L, JIANYING L, et al. A study of using a deep learning image reconstructionto improve the image quality of extremely low dose contrast-enhanced abdominal CT for patients with hepatic lesions[J]. The British Journal of Radiology, 2020, 94(1118): 20201086-20201086.
[7] 汪琴, 严伟杰, 袁元, 等. 深度学习重建算法在上腹部能谱CT小血管显示中的研究[J]. CT理论与应用研究, 2025, 34(1): 37-43. DOI: 10.15953/j.ctta.2024.168. WANG Q, YAN W J, YUAN Y, et al. Study of deep learning reconstruction algorithmin the display of CT[J]. Research on CT Theory and Applied Technology, 2025, 34(1): 37-43. DOI: 10.15953/j.ctta.2024.168.
[8] TAEHEE L, HEE J Y, YOUNG J P, et al. Deep learning-based iodine contrast-augmenting algorithm for low-contrast-dose liver CT to assess hypovascular hepatic metastasis[J]. Abdominal radiology (New York), 2023, 48(11): 3430-3440. DOI: 10.1007/s00261-023-04039-0.
[9] PEIJIE L, ZHEN L, YAN C, et al. Deep learning reconstruction CT for liver metastases: Low-dose dual-energy vs standard-dose single-energy[J]. European Radiology, 2023, 34(1): 28-38. DOI: 10.1007/s00330-023-10033-3.
[10] 温德英, 杨杰尹, 汪琴, 等. 深度学习重建算法在上腹部CT成像中的应用[J]. CT理论与应用研究, 2022, 31(3): 329-336. DOI: 10.15953/j.ctta.2021.005. WEN D Y, YANG J Y, WANG Q, et al. Application of a deep learning reconstructionalgorithm in CT imaging of the upper abdomen[J]. CT Theory and Applied Research, 2022, 31(3): 329-336. DOI: 10.15953/j.ctta.2021.005.
[11] 褚冰倩, 沈艺, 宋建, 等. 深度学习重建提高腹部能谱CT图像质量和病灶诊断的可行性研究[J]. 中国CT和MRI杂志, 2024, 22(6): 154-157. DOI: 10.3969/j.issn.1672-5131.2024.06.049. CHU B Q, SHEN Y, SONG J, et al. Feasibility study of deep learning reconstruction to improve CT image quality of abdominal energy spectrum and lesion diagnosis[J]. Chinese Journal of CT and MRI, 2024, 22(6): 154-157. DOI: 10.3969/j.issn.1672-5131.2024.06.049.
[12] 魏巍, 杨旭, 童小雨, 等. 深度学习重建算法联合低剂量增强CT对肝脏低对比度病灶显示的影响[J]. 中国医学计算机成像杂志, 2024, 30(3): 333-337. DOI: 10.3969/j.issn.1006-5741.2024.03.013. WEI W, YANG X, TONG X Y, et al. Effect of deep learning reconstruction algorithm combined with low dose enhanced CT on liver low contrast focus display[J]. Chinese Journal of Medical Computer Imaging, 2024, 30(3): 333-337. DOI: 10.3969/j.issn.1006-5741.2024.03.013.
[13] MARIN D, NELSON R C, SCHINDERA S T, et al. Low-tube-voltage, high-tube-current multidetector abdominal CT: improved image quality and decreased radiation dose with adaptive statistical iterative reconstruction algorithm--initial clinical experience[J]. Radiology, 2010, 254(1): 145-53.
[14] DAMIANO C, DOMENICO S D, ANTONELLA G D, et al. Low-dose liver CT: Image quality and diagnostic accuracy of deep learning image reconstruction algorithm[J]. European Radiology, 2023, 34(4): 2384-2393. DOI: 10.1007/s00330-023-10171-8.
[15] JIUMING J, LEI M, XIN L, et al. The value of deep learning image reconstruction in improving the quality of low-dose chest CT images[J]. Diagnostics, 2022, 12(10): 2560-2560. DOI: 10.3390/diagnostics12102560.
[16] YIFAN B, SHUO Y, XINGCHAO L, et al. Impact of deep learning-based image reconstruction on image quality and lesion visibility in renal computed tomographyat different doses[J]. Quantitative Imaging in Medicine and Surgery, 2023, 13(4): 2197-2207. DOI: 10.21037/qims-22-852.
[17] 姜宁宁. 多层螺旋CT双低剂量和常规剂量在结肠癌肿瘤侵犯、肠系膜血管分布中准确率的效果对比[J]. 中外医学研究, 2024, 22(24): 83-86. JIANG N N. Comparison of the accuracy of multi-layer spiral CT double low dose andconventional dose in tumor invasion and mesenteric vascularity of colon cancer[J]. Chinese and Foreign Medical Research, 2024, 22(24): 83-86.
[18] 胡淑敏, 祁冬, 乔晓春, 等. “双低”(低对比剂、低管电压)技术结合多模型迭代重建算法在肾脏双期CT增强扫描中的可行性[J]. 吉林医学, 2021, 42(9): 2123-2125. HU S M, QI D, QIAO X C, et al. The feasibility of "double low" (low contrastagent, low tube voltage) technology combined with multi-model iterative reconstruction algorithm in kidney dual-stage CT enhanced scan[J]. Jilin Medical, 2021, 42(9): 2123-2125.
[19] MENG B, CONG W, XI Y, et al. Model and reconstruction of a K-edge contrast agent distribution with an X-ray photon-counting detector[J]. Optics Express, 2017, 25(8): 9378-9392. DOI: 10.1364/OE.25.009378.
[20] CHUNG E Y, YOU S J, LEE H, et al. Possible contrast media reduction with low kev monoenergetic images in the detection of focal liver lesions: A dual-energy CT animal study[J]. PLoS ONE, 2017, 10(7): e0133170.
[21] PEIJIE L, NANA L, BRIAN H, et al. Is it possible to use low-dose deep learning reconstruction for the detection of liver metastases on CT routinely?[J]. European Radiology, 2022, 33(3): 1629-1640. DOI: 10.1007/s00330-022-09206-3.
[22] JUNE P, JAESEUNG S, KYUNG I M, et al. Image quality and lesion detectability of lower-dose abdominopelvic CT obtained using deep learning image reconstruction[J]. Korean journal of radiology, 2022, 23(4):
[23] XIE, Y R, WANG Y C, SHAN H, et al. Application of deep-learning reconstruction algorithm for enhanced CT scan of upper abdomen under different radiation doses: focus on noise, contrast-to-noise ratio and image quality[J]. Chinese Journal of Academic Radiology, 2022, 5(2): 107-121. DOI: 10.1007/s42058-021-00086-y.
[24] ZHOU Z, GONG H, HSIEH S, et al. Image quality evaluation in deep-learning-based CT noise reduction using virtual imaging trial methods: Contrast-dependent spatial resolution[J]. Medical Physics, 2024, 51(8): 5399-5413. DOI: 10.1002/mp.17029.
[25] SOLOMON J, LYU P, MARIN D, et al. Noise and spatial resolution properties of a commercially available deep learning based CT reconstruction algorithm[J]. Medical Physics, 2020, 47(9): 3961-3971. DOI: 10.1002/mp.14319.



 下载:
下载: