Clinicopathological and CT Findings of Cystic Lung Cancer
-
摘要: 目的:囊腔型肺癌是一种少见的、具有特殊形态学表现的肺癌,在影像学上尚未被充分认识,本研究通过分析其CT特征及临床病理,以提高对该类特殊类型肺癌的认识及诊断能力。方法:回顾性总结分析本院2015年1月至2021年6月期间确诊的囊腔型肺癌患者的临床信息、病理类型及CT图像特征。结果:病理类型:腺癌44例(86.27%),其中微浸润性腺癌7例(13.73%),浸润性腺癌35例(68.63%)(组织学类型:贴壁为主型11例(21.57%)、乳头状为主型8例(15.69%)、腺泡为主型15例(29.41%)且其中2例(3.92%)含微乳头成分占比大于20%,1例(1.96%)未分型),1例(1.96%)化疗后手术病理提示腺癌,1例(1.96%)淋巴结穿刺活检提示肺转移性腺癌;鳞癌5例(9.80%),其中角化性鳞状细胞癌3例(5.89%),非角化性鳞状细胞癌2例(3.92%);大细胞癌1例(1.96%),高级别粘液表皮样癌1例(1.96%)。病灶以外周分布为主40例(80.30%);平均直径为(4.7±2.7)cm,主体成分:囊腔伴磨玻璃成分20例(39.22%)、囊腔伴实性成分22例(43.14%)、囊腔伴混合成分9例(17.65%);Mario分型Ⅰ型24例(47.06%)、Ⅱ型8例(15.69%)、Ⅲ 型9(17.65%)、Ⅳ型10例(19.61%);囊腔壁不均匀42例(82.35%);病灶边缘分叶状28例(54.90%)、毛刺征14例(27.45%);病灶内分隔33例(64.71%)、内壁光滑36例(70.59%);与胸膜关系:胸膜牵拉24例(47.06%)、紧贴胸膜11例(21.57%);周围血管情况:血管穿行于病灶内8例(15.69%)、血管紧贴/走向于病灶边缘16(31.37%);周围支气管情况:支气管穿行于病灶内8例(15.69%)、支气管紧贴/走向于病灶边缘21例(41.18%)。结论:囊腔型肺癌的CT表现有一定的特征性,掌握其特征表现可做出肺癌的提示性诊断。Abstract: Objective: Cystic lung cancer is a rare type of lung cancer with special morphological manifestations on imaging that have not been completely recognized. This study aimed to improve the understanding and diagnosis of this lung cancer by analyzing its computed tomography (CT) features and clinicopathological findings. Methods: The clinical data, pathological types, and CT features of patients with cystic lung cancer who were diagnosed at our hospital between January 2015 and June 2021 were analyzed retrospectively. Results: We identified 44 cases (86.27%) of adenocarcinomas; these included 7 (13.73%) and 35 (68.63%) cases of microinvasive adenocarcinomas and invasive adenocarcinomas, respectively. Regarding the histological type, 11 (21.57%), 8 (15.69%), and 15 (29.41%) cases were of the adjoint, papillary, and acinar types, respectively. Two cases (3.92%) contained micropapillary components that accounted for more than 20% . Furthermore, one case (1.96%) was not classified, and in another case (1.96%), pathological examination after chemotherapy suggested an adenocarcinoma. Lymph node biopsy in one case (1.96%) suggested a metastatic lung adenocarcinoma. Squamous cell carcinoma was observed in five cases (9.80%); these included three (5.89%) and two (3.92%) cases of keratinizing and non-keratinizing squamous cell carcinomas, respectively. A large cell carcinoma and a high-grade mucoepidermoid carcinoma were observed in one case each (1.96%). A peripheral distribution was observed in 40 cases (80.30%). The mean diameter was 4.7± 2.7 cm. A cystic cavity with ground glass, cystic cavity with solid components, and cystic cavity with mixed components were observed in 20 (39.22%), 22 (43.14%), and 9 (17.65%) cases, respectively. According to the Mario classification, 24 (47.06%), 8 (15.69%), 9 (17.65%), and 10 (19.61%) cases were of types I, II, III, and IV, respectively. The cyst wall was uneven in 42 cases (82.35%); furthermore, a lobular lesion edge and the burr sign were observed in 28 (54.90%) and 14 (27.45%) cases, respectively. Moreover, 33 cases (64.71%) showed a separation within the lesions, while 36 cases (70.59%) had a smooth inner lesion wall. Regarding the relationship with the pleura, pleural traction and closed pleura were observed in 24 (47.06%) and 11 (21.57%) cases, respectively. The peripheral blood vessels passed through the lesion in eight cases (15.69%) and adhered closely to the edge of the lesion in 16 cases (31.37%). The surrounding bronchi passed through the lesion in eight cases (15.69%) and moved toward the edge of the lesion in 21 cases (41.18%). Conclusion: Cystic lung cancer has certain features on CT that can allow its suggestive diagnosis.
-
Keywords:
- computed tomography /
- lung cancer /
- cystic cavity
-
-
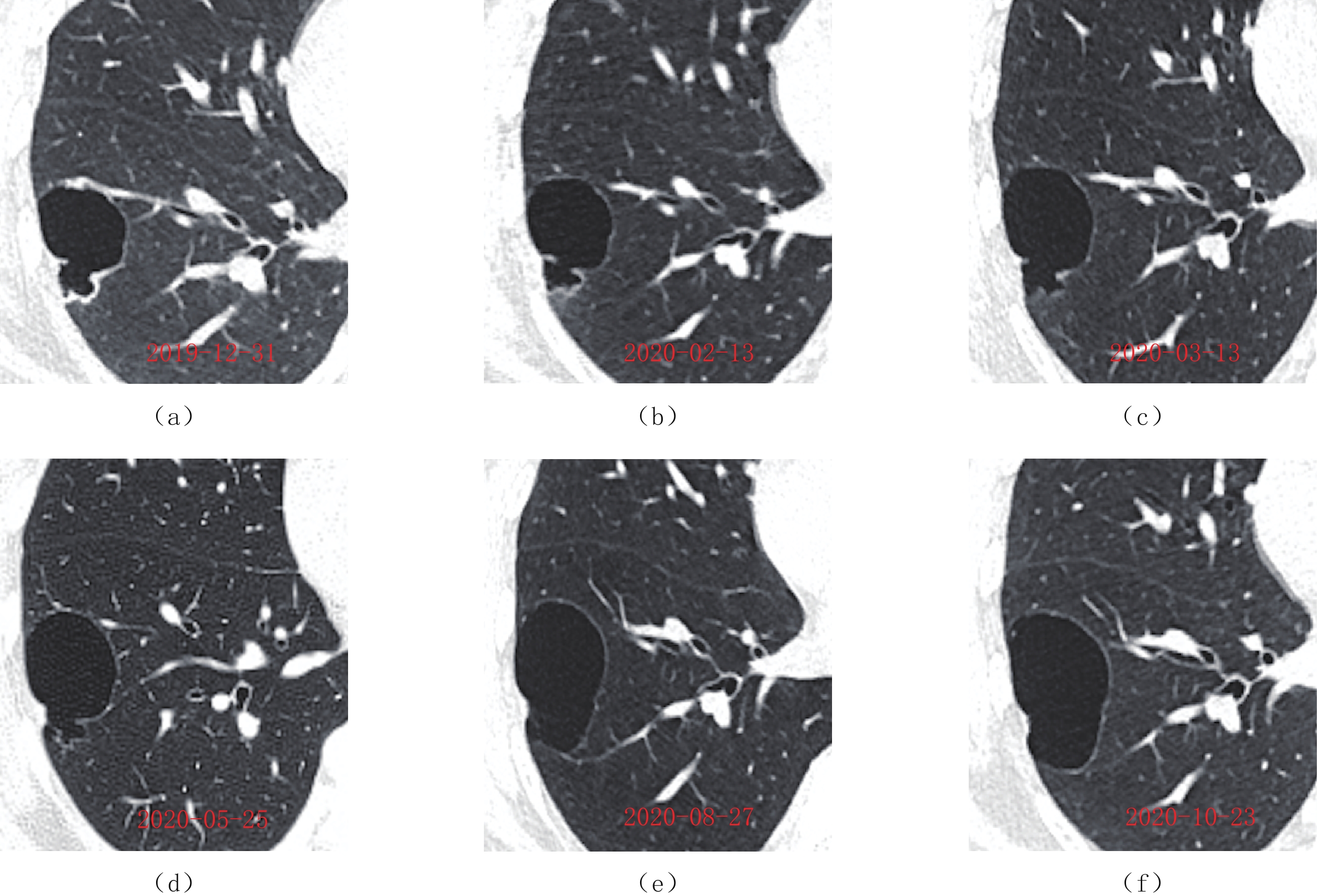
图 3 一例囊腔型肺癌接受化疗后的病灶改变
(a)~(f)分别于2020-01-17、02-01、03-13、04-08、05-06、05-26执行AP方案(力比泰+顺铂)第1~6疗程化疗。(a)患者化疗前的CT图像,可见右肺下叶前基底段一囊腔病变伴囊壁不均匀增厚;(b)~(e)分别为第2、3、5、6次化疗后CT图像,可见囊壁较前逐渐变薄,囊腔较前增大;(f)第6次化疗后的第2次CT图像,与第6次化疗后的初次图像相比,囊腔进一步增大且薄而均匀,边界清晰。
Figure 3. Changes in a lesion after chemotherapy in a case of cystic lung cancer
表 1 囊腔型肺癌多排螺旋CT征像分析
Table 1 Analysis of the signs of cystic lung cancer on multi-slice spiral CT
CT征像 类别 数量 构成比/% 形态 圆形/类圆形 29 56.86 不规则 22 43.14 病灶主体成分 囊腔伴磨玻璃成分 20 39.22 囊腔伴实性成分 22 43.14 囊腔伴混合成分 9 17.65 Mario分型 Ⅰ型(结节位于腔外) 24 47.06 Ⅱ型(结节位于腔内) 8 15.69 Ⅲ 型(环壁生长) 9 17.65 Ⅳ 型(多房囊腔与结节混合者) 10 19.61 囊腔壁厚度 均匀 9 17.65 不均匀 42 82.35 有无分隔 有分隔 33 64.71 无分隔 18 35.29 内壁 光整 36 70.59 毛糙 15 29.41 病灶边缘 分叶状 28 54.90 毛刺征 14 27.45 与胸膜关系 胸膜牵拉 24 47.06 紧贴胸膜 11 21.57 周围血管情况 血管穿行于病灶内 8 15.69 血管紧贴/走向于病灶边缘 16 31.37 周围支气管情况 支气管穿行于病灶内 8 15.69 支气管紧贴/走向于病灶边缘 21 41.18 -
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209−249. doi: 10.3322/caac.21660
[2] RAMPINELLI C, CALLONI S F, MINOTTI M, et al. Spectrum of early lung cancer presentation in low-dose screening CT: A pictorial review[J]. Insights Imaging, 2016, 7(3): 449−59. doi: 10.1007/s13244-016-0487-4
[3] ANDERSON H J, PIERCE J W. Carcinoma of the bronchus presenting as thin-walled cysts[J]. Thorax, 1954, 9(2): 100−105. doi: 10.1136/thx.9.2.100
[4] 吴光耀, 伍建林. 肺部囊腔类肺癌的分型及其CT表现[J]. 放射学实践, 2016,31(10): 902−907. [5] SNOECKX A, REYNTIENS P, CARP L, et al. Diagnostic and clinical features of lung cancer associated with cystic airspaces[J]. Journal of Thoracic Disease, 2019, 11(3): 987−1004. doi: 10.21037/jtd.2019.02.91
[6] SHEARD S, MOSER J, SAYER C, et al. Lung cancers associated with cystic airspaces: Underrecognized features of early disease[J]. Radiographics, 2018, 38(3): 704−717. doi: 10.1148/rg.2018170099
[7] MASCALCHI M, ATTINÀ D, BERTELLI E, et al. Lung cancer associated with cystic airspaces[J]. Journal of Computer Assisted Tomography, 2015, 39(1): 102−108. doi: 10.1097/RCT.0000000000000154
[8] GUO J, LIANG C, SUN Y, et al. Lung cancer presenting as thin-walled cysts: An analysis of 15 cases and review of literature[J]. Asia-Pacific Journal of Clinical Oncology, 2016, 12(1): e105−112. doi: 10.1111/ajco.12126
[9] ARONBERG D J, SAGEL S S, LEFRAK S, et al. Lung carcinoma associated with bullous lung disease in young men[J]. American Journal of Roentgenology, 1980, 134(2): 249−252. doi: 10.2214/ajr.134.2.249
[10] 于晶, 王亮, 伍建林, 等. 周围型肺癌伴薄壁空腔的CT表现与征象分析[J]. 中华放射学杂志, 2015, (2): 99-102. YU J, WANG L, WU J L, et al. CT features in peripheral lung cancer with thin-walled cavity[J]. Chinese Journal of Radiology, 2015, (2): 99-102. (in Chinese).
[11] WANG X, TAO Y X, ZHANG M, et al. Solitary thin-walled cystic lung cancer with extensive extrapulmonary metastasis: A case report and review of the literature[J]. Medicine (Baltimore), 2018, 97(43): e12950. doi: 10.1097/MD.0000000000012950
[12] MENDOZA D P, HEEGER A, MINO-KENUDSON M, et al. Clinicopathologic and longitudinal imaging features of lung cancer associated with cystic airspaces: A systematic review and meta-analysis[J]. American Journal of Roentgenology, 2021, 216(2): 318−329. doi: 10.2214/AJR.20.23835
[13] 李媛, 谢惠康, 武春燕. WHO胸部肿瘤分类中肺肿瘤部分解读[J]. 中国癌症杂志, 2021,31(7): 574−580. LI Y, XIE H K, WU C Y, et al. Interpretation of lung tumours in the WHO classification of thoracic tumours[J]. China Oncology, 2021, 31(7): 574−580. (in Chinese).
[14] 王翅鹏, 程少容, 黄文才, 等. 囊腔型肺癌的CT表现及18F-FDG代谢特征分析[J]. 华南国防医学杂志, 2018, 32(7): 477-480, 485. WANG C P, CHENG S R, HUANG W C, et al. CT findings and analysis of 18F-FDG metabolism in cavitary lung cancer[J]. Military Medical Journal of South China, 2018, 32(7): 477-480, 485. (in Chinese).
[15] 俞霞, 金利, 顾梁瑞, 等. MSCT对含囊腔型肺癌的诊断价值[J]. 影像诊断与介入放学, 2019,28(4): 243−246. YU X, JIN L, GU L R, et al. Diagnostic value of multi-slice CT in cystic lung cancer[J]. Diagnostic Imaging & Interventional Radiology, 2019, 28(4): 243−246. (in Chinese).
[16] FINTELMANN F J, BRINKMANN J K, JECK W R, et al. Lung cancers associated with cystic airspaces: Natural history, pathologic correlation, and mutational analysis[J]. Journal of Thoracic Imaging, 2017, 32(3): 176−188. doi: 10.1097/RTI.0000000000000265
-
期刊类型引用(1)
1. 杨谨旭,陈颖,雷玉洁,黄云超. 囊腔型肺癌的诊疗进展. 中国肺癌杂志. 2023(10): 774-781 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: