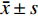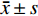Quantitative CT Analysis of Body Composition in Maintenance Hemodialysis Patients
-
摘要: 目的:分析维持性血液透析患者的体成分信息,探讨QCT技术的应用价值。方法:选取本院维持性血液透析患者共62例,根据不同的透析时长分为3组,运用定量CT技术测定患者的骨密度值、腹部脂肪及肌肉含量,同时选取性别及年龄相匹配的健康体检人群62例进行对比分析。结果:透析组骨质疏松者占17.70%(11例),骨量减少者占30.60%(19例),而在健康对照组中,骨质疏松及骨量减少者分别占6.50%(4例)和16.10%(10例),两组间的差异具有统计学意义;透析组的腹内脂肪和皮下脂肪含量分别为(113.70±63.29)cm<sup<2</sup<、(80.65±59.67)cm<sup<2</sup<,均低于健康对照组(135.90±58.80)cm<sup<2</sup<、(122.26±54.94)cm<sup<2</sup<,透析组L3-SMA<对照组 L3-SMA,(107.00±30.70)cm<sup<2</sup<<(121.37±32.87)cm<sup<2</sup<,均具有统计学差异;在不同性别透析患者中,男性透析患者的腰椎骨密度值为(156.11±51.94)(mg/cm<sup<3</sup<),与女性(124.29±50.89)(mg/cm<sup<3</sup<)比较,差异有统计学意义;女性患者的皮下脂肪含量要高于男性,而男性和女性的腹腔内脂肪含量差异无统计学意义;透析组的骨密度值和L3-SMA变化与透析时间长短无差异。结论:维持性血液透析患者的骨质疏松症发病率高于健康人群,腹部脂肪及肌肉含量低于健康人群,定量CT对体质成分监测的准确性和敏感性较高。Abstract: This study analyzes body composition information in patients on maintenance hemodialysis and explores the application value of QCT technology. Methods: A total of 62 patients on maintenance hemodialysis were selected and divided into three groups according to different dialysis durations. The bone density value, abdominal fat, and muscle content of patients were determined by quantitative CT technology and 62 cases of the health examination population matched by sex and age were selected for comparative analysis. Results: In the dialysis group, osteoporosis accounted for 17.70% (11 cases) and bone loss accounted for 30.60% (19 cases), while in the healthy control group, osteoporosis and bone loss accounted for 6.50% (4 cases) and 16.10% (10 cases), respectively. The difference between these two groups was statistically significant. Moreover, the intra-abdominal and subcutaneous fat content in the dialysis group were (113.70±63.29)cm² and (80.65±59.67)cm², respectively, which were lower than that of the healthy control group ((135.90±58.80)cm² and (122.26±54.94)cm², respectively). Additionally, the dialysis group had a significantly lower L3-SMA (107.00±30.70)cm² than the control group (121.37±32.87)cm², and the lumbar vertebral bone density value was significantly lower in male dialysis patients (156.11±51.94)mg/cm³ than in female dialysis patients (124.29±50.89)mg/cm³. Moreover, the subcutaneous fat content was significantly higher in females than in males; however, the difference in intraperitoneal fat content between males and females was not statistically significant. Additionally, the difference between bone density values and L3-SMA changes in the dialysis group and the length of dialysis time were not statistically significant. Conclusion: The incidence of osteoporosis is higher in patients on maintenance hemodialysis than in healthy people, and the amount of abdominal fat and muscle content are lower than that in healthy people. Moreover, quantitative CT body composition monitoring has high accuracy and sensitivity.
-
Keywords:
- quantitative CT /
- hemodialysis /
- bone mineral density /
- abdominal fat
-
冠状动脉粥样硬化性心脏病,简称冠心病,其主要病因是动脉粥样硬化[1]。动脉粥样硬化不稳定期的斑块主要为易损性斑块,易破裂和形成血栓。血栓的形成和易损斑块的破裂是发生主要不良心血管事件(major adverse cardiovascular event,MACE)的主要原因[2]。
冠状动脉CTA(coronary computed tomography angiography,CCTA)作为一种无创的影像学检查方法,不仅可以获得冠状动脉的狭窄情况,还可获得基于斑块多个维度的定量信息,包括斑块位置、范围和构成,以及特异性高风险斑块(high-risk plaque,HRP),与传统心血管危险因素相比,高风险斑块会出现更多的心血管不良事件[3-5]。国内已有很多研究证明进展性斑块与长期死亡率有较高的相关性[6]。但鲜有基于斑块定性和定量参数预测狭窄进展以及不良事件发生的相关研究。
随着技术的发展,基于辅助诊断软件的冠状动脉斑块半自动分析功能和易损斑块特征不仅可提供更多参数,还具有较好的可重复性,使斑块的定性和定量评估得以在临床及科研中广泛应用[7-9]。
本研究拟探讨基于辅助诊断软件的冠状动脉CTA斑块定性、定量特征在预测冠状动脉管腔狭窄程度进展的价值。
1. 资料与方法
1.1 临床资料
回顾性分析济宁市第一人民医院2018年5月至2023年8月行2次CCTA检查的患者66例(斑块87个)。狭窄程度(diameterstenosis,DS)变化率:DS变化率=(随访DS − 基线DS)/基线DS×100%。将66例患者按是否存在斑块狭窄进展(DS > 10%)分为:有斑块狭窄进展(28例)和无狭窄进展(38例)[10]。87个斑块中DS > 10%为进展组(40个),反之为非进展组(47个)。
纳入标准:①所有患者行CCTA检查的次数≥2次;②两次CCTA检查间隔时间>6个月;③所有患者临床资料及病史齐全。
排除标准:①随访期间行腔内支架或冠状动脉旁路移植术;②合并其他病变如:主动脉夹层、瓣膜病变、先天性心脏病、心肌病、大动脉炎等;③CT不能明确显示病灶或图像质量不佳,不能用于分析。
一般临床资料包括:性别、年龄、BMI、高血压、糖尿病、高血脂、吸烟史、临床症状。
进行预后情况随访,随访途径包括:电话、电子医疗记录随访,了解患者身体状况。随访站点事件为MACE,包括:心源性死亡、脑卒中、非致死性心肌梗死、不稳定心绞痛或心力衰竭再入院、非计划血运重建发生情况。
1.2 CT检查方法
采用第2代双源CT(SOMATOM Definition Flash,Siemens Healthcare)或第3代双源CT(OMATOM Definition Force,Siemens Healthcare)。患者仰卧于检查床,上抬双手并置于头顶,采取前瞻性心电门控扫描,扫描范围为气管分叉处下1 cm至心底水平,吸气相屏气后扫描。
扫描参数:固定120 kV管电压,开启CARE Dose4 D,自动管电流。视野(FOV)180~250 mm。重建层厚0.75 mm,重建间隔0.5 mm。以患者体重为基准,使用BAYER MeDRaD双筒高压注射器以流速4.0~5.0 mL/s经肘正中静脉注射碘海醇(350 mgI/mL)50~80 mL,后相同速率跟注生理盐水40 mL。
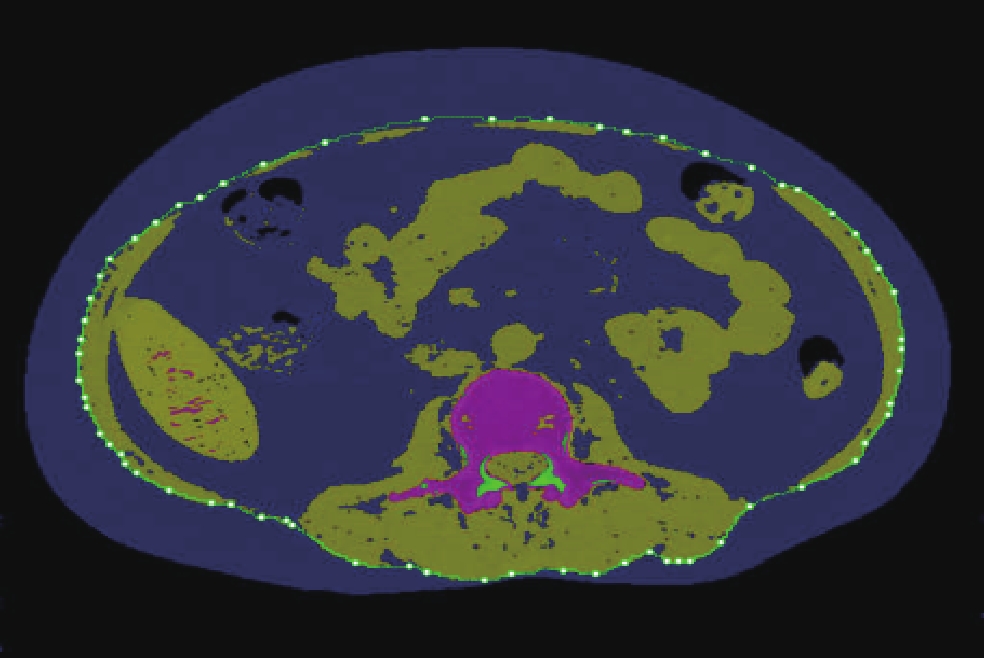
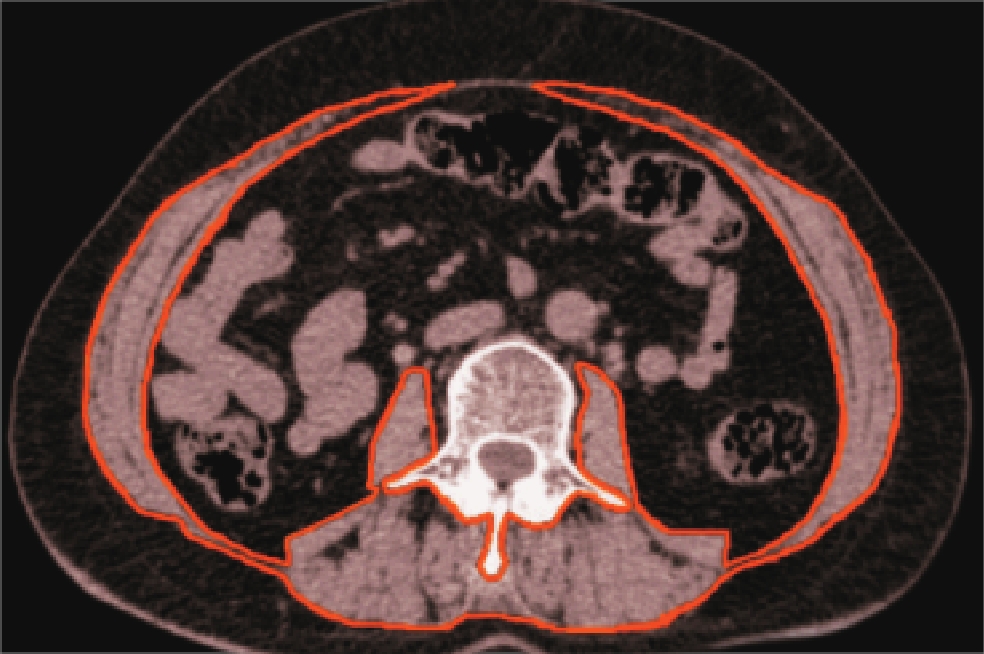
运用对比剂追踪触发技术,选择胸主动脉层面为ROI,对比剂CT值超过100 HU时延迟5 s自动触发扫描。重建图像均上传图像存档与传输系统(picture archiving and communication system,PACS)。
1.3 CCTA斑块特征分析
冠状动脉CTA图像传输至联影智能冠状动脉辅助诊断软件(uAI-Coronary CTA),单支血管存在多处狭窄时选取最狭窄处斑块。观察斑块智能识别情况,遇自动分析中心线及斑块勾画不准的情况,手动校正后再进行自动分析。
特征定量参数包括:斑块性质、狭窄范围、斑块长度、钙化成分CT值及体积、非钙化成分CT值及体积、低密度成分CT值及体积、斑块总体积、总钙化积分、钙化斑块等效质量、重构指数。上述参数均进行两次测量取平均值。
易损斑块特征CT表现:①低密度斑块,斑块中3个随机感兴趣区(region of interest,ROI)的平均密度≤30 HU;②正性重构,病变段的最大血管直径与斑块近端和远端的平均直径之间的比值;③“餐巾环征”,具有中央低密度部分的周围高衰减组织环状包绕;④点状钙化:冠状动脉管壁内局灶性钙化病变在任意方位测量最大径 < 3 mm且平均密度 > 130 HU的高密度灶。
同一病变中至少同时存在两个高危斑块特征被认为是易损斑块[11]。由两名分别具有8年和15年以上冠状动脉CT诊断经验的医师在未知随访结果情况下分析图像,定性参数意见有分歧者经协商达成一致。
1.4 统计学处理
应用SPSS 26.0统计软件进行数据处理。
连续变量用Kolmogorow-Smirnov检验进行正态性检验,正态分布的计量资料以平均值±标准差
$ (\bar x \pm s)$ 表示,若不符合正态分布则以中位数(P25,P75)的形式呈现。分类变量表示为数值和百分率(%)。适当时,使用独立样本t检验或Mann-Whitney U检验比较连续变量,对于分类变量比较采用卡方检验。非参数检验适用于非正态分布的数据。应用校准曲线及受试者操作特征(receiver operating characteristic,ROC)曲线来评价各参数的预测效能。将单因素分析具有统计学意义的变量均纳入二元Logistic回归模型,采用逐步法(向前)确定预测狭窄进展的独立影响因素。用Kaplan-Meier法评估无MACE事件生存率。P < 0.05为差异具有统计学意义。
2. 结果
2.1 临床资料
66例患者中,冠状动脉斑块87个。其中59个分布于左主干和左前降支,9个分布于左回旋支,19个分布于右侧冠状动脉。
进展组糖尿病、易损斑块比例高于非进展组,总钙化积分低于非进展组,以上差异有统计学意义。两组年龄、BMI、高血压、高血脂、吸烟史、临床症状差异无显著统计学意义(表1)。
表 1 进展组与非进展组之间基线临床特征的比较Table 1. Comparison of baseline clinical features between the progressive and non-progressive groups临床特征 组别 统计检验 无狭窄进展(n=38) 狭窄进展(n=28) t/x2/z P 年龄/(岁,$\bar x\pm s $) 55.6±8.2 56.5±7.3 −1.12 0.236 BMI 24.6(22.1,28.6) 24.9(22.9,27.7) −0.18 0.859 性别/(例,%) 男 25(65.8) 15(53.6) 1.01 0.227 女 13(34.2) 13(46.4) 高血压/(例,%) 有 21(55.3) 20(71.4) 1.79 0.140 无 17(44.7) 8(28.6) 糖尿病/(例,%) 有 16(42.1) 20(71.4) 5.59 0.017 无 22(57.9) 8(28.6) 高血脂/(例,%) 有 14(36.8) 12(42.9) 0.24 0.405 无 24(63.2) 16(57.1) 吸烟史/(例,%) 有 18(47.4) 7(25.0) 3.43 0.054 无 20(52.6) 21(75.0) 症状/(例,%) 心绞痛 16(42.1) 12(42.9) - 0.652* 不典型的心绞痛胸痛 8(21.1) 9(32.1) 胸闷或心悸 7(18.4) 5(17.9) 无症状 6(15.8) 2(7.1) 易损斑块/(例,%) 有 10(26.3) 16(57.1) 6.42 0.021 无 28(73.7) 12(42.9) 总钙化积分 145.6(13.4,270.7) 43.3(4.6,101.3) −2.38 0.017 2.2 CT特征参数
进展组斑块钙化成分体积、钙化成分占比、钙化斑块等效质量低于非进展组,而点状钙化发生率高于非进展组,差异均有统计学意义。
两组斑块性质、狭窄范围、钙化成分CT值、钙化成分体积、非钙化成分CT值、非钙化成分体积、非钙化成分占比、低密度成分CT值、低密度成分体积、低密度成分占比、重构指数、低密度斑块、正性重构、“餐巾环征”差异无显著统计学意义(图1和表2)。
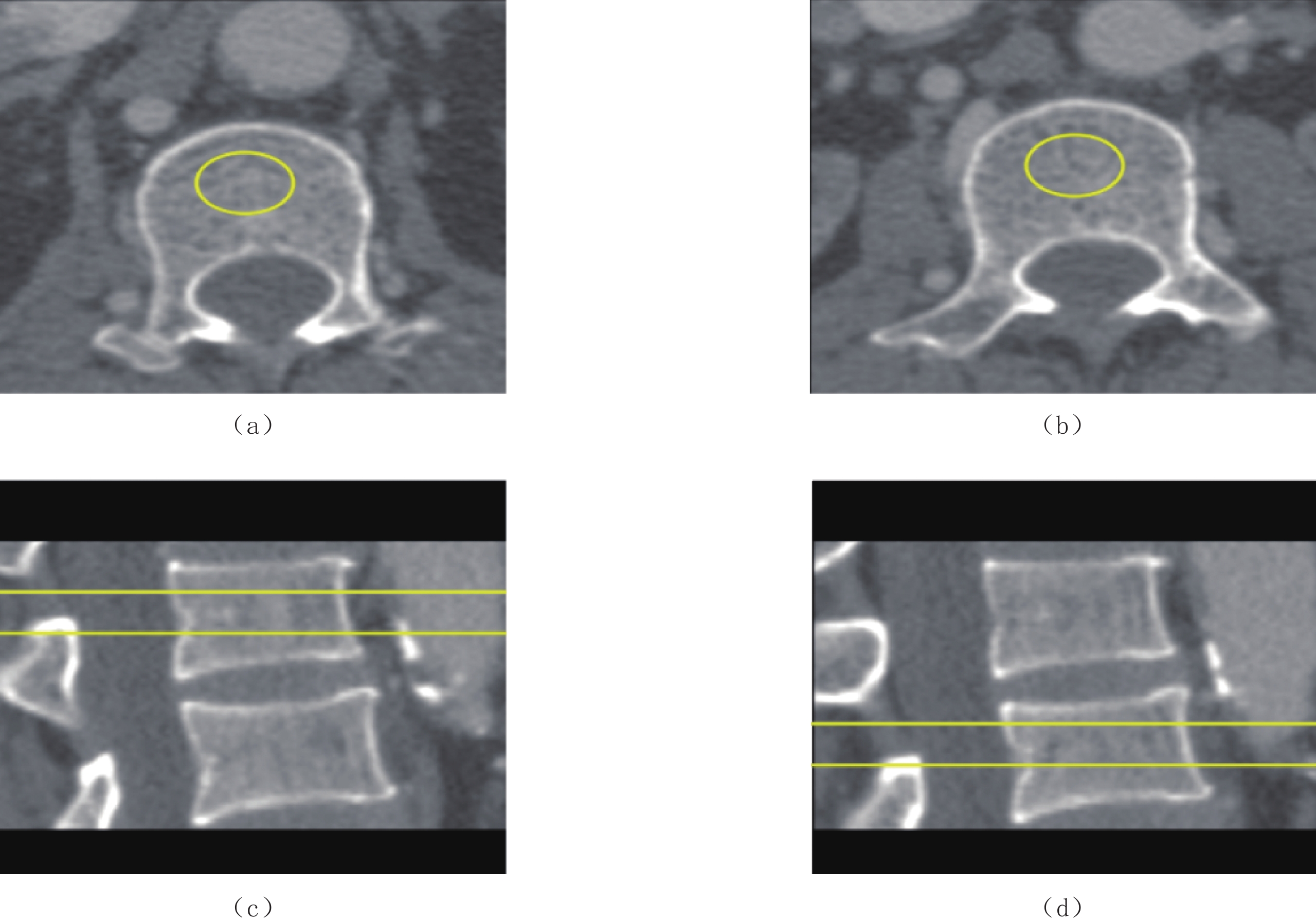
![]() 图 1 男性,50岁。(a)为基线CCTA显示管腔轻度狭窄。(b)为12个月后随访CCTA显示管腔中度狭窄。对比两次检查该斑块狭窄进展变化率为55.5%,其中长度增加7.8 mm,斑块体积增加49.4 mm3Figure 1. A 50-year-old man. (a) baseline CCTA demonstrates mild luminal stenosis. (b) CCTA indicates that moderate lumen stenosis is present after 12 months.The plaque stenosis has progressed by 55.5%, increasing in length by 7.8 mm and in volume by 49.4 mm表 2 进展组与非进展组之间基线CT特征的比较Table 2. Comparison of baseline CT features between the progressive and non-progressive groups
图 1 男性,50岁。(a)为基线CCTA显示管腔轻度狭窄。(b)为12个月后随访CCTA显示管腔中度狭窄。对比两次检查该斑块狭窄进展变化率为55.5%,其中长度增加7.8 mm,斑块体积增加49.4 mm3Figure 1. A 50-year-old man. (a) baseline CCTA demonstrates mild luminal stenosis. (b) CCTA indicates that moderate lumen stenosis is present after 12 months.The plaque stenosis has progressed by 55.5%, increasing in length by 7.8 mm and in volume by 49.4 mm表 2 进展组与非进展组之间基线CT特征的比较Table 2. Comparison of baseline CT features between the progressive and non-progressive groupsCT特征 组别 统计检验 非进展组(n=47) 进展组(n=40) t/x2/z P 斑块性质/例 非钙化斑块 4 4 混合斑块 32 29 − 0.782* 钙化斑块 11 7 狭窄范围/例 局限性狭窄 12 13 节段性狭窄 24 21 1.16 0.601 弥漫性狭窄 11 6 斑块长度/mm 19.2(10.8,30.3) 15.8(9.4,24) −1.32 0.190 钙化成分CT值/HU 432.0±146.6 389.5±121.9 −1.45 0.148 钙化成分体积/mm3 51.4(12.7,89.4) 17.2(6.7,35.1) −2.44 0.014 钙化成分占比(%) 0.5(0.3,0.8) 0.3(0.1,0.7) −2.04 0.042 非钙化成分CT值/HU 103.4±28.5 98.9±33.3 −0.84 0.407 非钙化成分体积/mm3 41.7(14.9,91.7) 40.3(19.1,90) −0.38 0.712 非钙化成分占比(%) 0.5(0.3,0.8) 0.7(0.4,0.9) −1.80 0.072 低密度成分CT值/HU 8(0,15) 8(0,13) −0.68 0.498 低密度成分体积/mm3 1.8(0,16.7) 3.6(0.2,20.6) −0.66 0.510 低密度成分占比(%) 0.03(0,0.1) 0.05(0.003,0.2) −1.03 0.305 斑块总体积/mm3 106.2(45.6,224.6) 64.4(39.1,168.5) −1.39 0.167 钙化斑块等效质量 9.5(1.6,28.1) 5.1(0.7,12.1) −2.08 0.037 重构指数 0.9(0.8,1.1) 0.9(0.8,1) −0.19 0.850 低密度斑块/(例,%) 有 11(23.4) 4(10.0) - 0.154* 无 36(76.6) 36(90.0) 正性重构/(例,%) 有 9(19.1) 7(17.5) 0.039 1.000 无 38(80.9) 33(82.5) 餐巾环征/(例,%) 有 8(17.0) 9(22.5) 0.410 0.593 无 39(83.0) 31(77.5) 点状钙化/(例,%) 有 23(48.9) 33(82.5) 10.610 0.002 无 24(51.1) 7(17.5) 注:*采用Fisher检验。 2.3 临床及CT特征预测狭窄进展的ROC分析及多因素logistic回归结果
经ROC分析,糖尿病、钙化成分体积、钙化成分占比、钙化斑块等效质量、点状钙化、易损斑块的曲线下面积分别为0.647、0.653、0.627、0.630、0.668和0.658 (图2和表3)。
表 3 不同参数对冠状动脉病变进展的预测价值Table 3. Predictive values of different parameters for the progression of coronary artery disease特征 曲线下面积 标准误 P 95% CI 最佳截断值 敏感度 特异度 糖尿病 0.65 0.069 0.043 0.512~0.781 有 0.579 0.714 易损斑块 0.66 0.070 0.031 0.521~0.795 有 0.615 0.700 总钙化积分 0.67 0.067 0.018 0.540~0.804 106.985 0.605 0.821 钙化成分体积 0.65 0.059 0.015 0.537~0.768 50.225 0.511 0.850 钙化成分占比 0.63 0.060 0.042 0.509~0.745 0.385 0.681 0.575 钙化斑块等效质量 0.63 0.060 0.038 0.513~0.746 17.345 0.468 0.850 点状钙化 0.67 0.058 0.007 0.554~0.782 有 0.825 0.511 多因素Logistic回归显示糖尿病、易损斑块、点状钙化为狭窄进展的独立危险因素,钙化成分体积为狭窄进展的独立保护因素 (表4)。
表 4 采用逐步法Logistic回归筛选出预测狭窄进展的独立影响因素Table 4. Stepwise Logistic regression was used to screen independent factors influencing stenosis progression危险因素 β值 标准误 OR值 95% CI P lower upper 糖尿病 1.300 0.565 3.668 1.211 11.110 0.022 易损斑块 1.379 0.562 3.973 1.321 11.944 0.014 钙化成分体积 −0.014 0.005 0.986 0.976 0.997 0.009 点状钙化 1.745 0.530 5.727 2.028 16.174 0.001 注:β值为回归系数,OR值为优势比,CI为可信区间。 2.4 预后分析
非进展组心源性死亡、脑卒中、非计划血运重建各1例,不稳定心绞痛或心力衰竭再入院4例。进展组中脑卒中3例、不稳定心绞痛或心力衰竭再入院9例。在中位随访时间2.93年,共有19例发生MACE,发生率为28.8%,年发生率为9.83%。
非进展组发生率为18.4%,年发生率为6%;进展组发生率为42.9%,年发生率为17.1%。Kaplan-Meier生存曲线显示,非进展组无MACE生存率高于进展组,非易损斑块组无MACE生存率高于易损斑块组(图3)。
3. 讨论
动脉粥样硬化斑块进展是冠状动脉粥样硬化性心脏病急性事件发生的重要机制,斑块快速进展是心肌梗死的独立危险因素之一[12]。
本研究通过对66例患者的连续CCTA分析显示,近1/2患者出现狭窄进展,结果提示冠状动脉粥样硬化患者定期复查CCTA的必要性。
本研究显示进展组糖尿病比例高于非进展组,且为狭窄进展的独立危险因素,与相关研究结果一致[13],可能与高血糖状态导致血管功能障碍和晚期糖基化终产物的堆积,促进炎性反应,进而加快动脉粥样硬化的发展有关。
本研究中进展组具有较小的钙化成分体积、钙化成分占比、钙化斑块等效质量,Jian等[14]在研究Ⅱ型糖尿病患者斑块快速进展中得出的,基线钙化斑块体积是Ⅱ型糖尿病患者冠状动脉粥样硬化快速进展的独立保护因素与本研究结果相符。
钙化斑块反映了非钙化和晚期斑块的愈合,斑块钙化越多提示越稳定[15]。另有相关研究表明[16],在钙化程度较低的斑块中,更容易出现急性心肌梗死死亡或急性冠状动脉综合征。
在我们的研究中,钙化体积较大的患者不容易发生冠状动脉狭窄的进展,显示了钙化成分对斑块的保护作用。本研究中的发现与Nicholls等[17]在研究血管内超声评估的钙化斑块对斑块总体积的改变和进展更具耐受性的结果相一致。
本研究中进展组点状钙化发生比例较高,为狭窄进展的独立危险因素之一。点状钙化、低密度斑块均是非阻塞性冠状动脉发生进展的独立危险因素。既往研究指出[18]点状钙化不是广泛的钙化斑块,是斑块内含有长度<3 mm的钙化灶,其可能通过额外的促炎反应引起斑块的稳态变化[19]。
本研究进展组非MACE发生率显著低于非进展组。与Shi等[20]的结果一致,进展组脑卒中、不稳定心绞痛或心力衰竭再入院发生率更高。多项基于连续CCTA扫描的研究表明,基线定量斑块特征和定量斑块的变化是预测斑块进展和MACE发生的重要指标[21]。Yu等[22]的研究表明病变进展组的MACE发生率高于病变非进展组(56.25%(9/16)和4.84%(6/124)),与本研究MACE发生率相近。本研究中易损斑块无MACE事件生存率显著低于非易损斑块,与罗玮等[23]的研究一致。
上述结论证明斑块狭窄进展和易损斑块均可以预测MACE事件发生风险,据此提示连续冠状动脉CTA随访在冠心病诊断治疗方面的亦存在一定价值,后续研究可以加入连续CCTA斑块变化量用以预测MACE和/或斑块进展,进一步指导冠心病及其并发症的防治。
本研究局限性。①本研究样本量偏少,可能存在选择偏倚;②本次研究患者复查时间跨度较大,后续会增加病例数量并进行不同复查时间段的亚组分析;③仅研究了病变区域狭窄程度进展,后续可以加入斑块负荷的相关研究,以更全面的分析冠状动脉粥样硬化的变化;④本次研究为回顾性研究,未选择冠状动脉造影结果作为金标准。
本研究显示冠状动脉CTA斑块定性、定量特征结合临床特征,不仅可在冠状动脉CTA随访检查时预测管腔狭窄程度进展,而且在预测心脏不良事件发生方面具有重要价值,为冠心病患者的诊疗提供更精准科学的指导。
-
表 1 健康人群与透析患者骨量状况比较
Table 1 Comparison of bone mass status between the healthy population and dialysis patients
组别 骨量状况 总计 骨量正常 骨量减少 骨质疏松 对照组 48(77.40%) 10(16.10%) 4(6.5%) 62(100%) 透析组 32(51.60%) 19(30.60%) 11(17.70%) 62(100%) 表 2 健康人群与透析患者腹部脂肪及L3水平横断面肌肉面积比较(
$\bar x \pm s $ )Table 2 Comparison of abdominal fat and L3-SMA between the healthy population and dialysis patients(
$\bar x \pm s $ )项目 透析组 对照组 P 腹内脂肪/cm2 113.70±63.29 135.90±58.80 <0.05 皮下脂肪/cm2 80.65±59.67 122.26±54.94 <0.05 L3水平横断面肌肉面积/cm2 107.00±30.70 121.37±32.87 <0.05 表 3 不同性别血透患者骨密度及腹部脂肪比较(
$\bar x \pm s $ )Table 3 Comparison of bone density and abdominal fat in hemodialysis patients of different sexes (
$\bar x \pm s $ )组别 骨密度/(mg/cm3) 腹内脂肪/cm2 皮下脂肪/cm2 男(n=33) 156.11±51.94 100.97±58.81 63.47±54.02 女(n=29) 124.29±50.89 128.18±66.07 100.20±60.34 P <0.05 >0.05 <0.05 表 4 透析患者骨密度及L3水平横断面肌肉面积与透析时间的变化规律(
$\bar x \pm s $ )Table 4 Variation of bone density, L3-SMA, and dialysis time in dialysis patients (
$\bar x \pm s $ )项目 透析时间 <2年(n=19) 2~5年(n=23) >5年(n=20) 骨密度/(mg/cm3) 132.17±52.21 134.14±58.36 157.99±47.10 L3水平横断面肌肉面积/cm2 115.91±42.16 103.10±23.65 103.03±24.07 -
[1] ZAYOUR D, DAOUK M, MEDAWAR W, et al. Predictors of bone mineral, density in patients on hemodialysis[J]. TranspIanlation Proceedings, 2004, 36(5): 1297−1301. doi: 10.1016/j.transproceed.2004.05.069
[2] WU C C, LIOU H H, SU P F, et al. Abdominal obesity is the most significant metabolic syndrome component predictive of cardiovascular events in chronic hemodialysis patients[J]. Nephrol Dial Transplant, 2011, 26: 3689−3695. doi: 10.1093/ndt/gfr057
[3] 程晓光, 王亮, 曾强, 等. 中国定量CT (QCT)骨质疏松症诊断指南(2018)[J]. 中国骨质疏松杂志, 2019,25(6): 733−737. CHENG X G, WANG L, ZENG Q, et al. The China guideline for the diagnosis criteria of oste oporosis with quantitative computed tomography (QCT) (2018)[J]. Chinese Journal of Osteoporosis, 2019, 25(6): 733−737. (in Chinese).
[4] 夏维波, 章振林, 林华, 等. 原发性骨质疏松症诊疗指南(2017)[J]. 中国骨质疏松杂志, 2019,25(3): 281−309. doi: 10.3969/j.issn.1006-7108.2019.03.001 XIA W B, ZHANG Z L, LIN H, et al. Guidelines for the diagnosis and management of primary osteoporosis (2017)[J]. Chinese Journal of Osteoporosis, 2019, 25(3): 281−309. (in Chinese). doi: 10.3969/j.issn.1006-7108.2019.03.001
[5] 胡耀, 黄朝莉, 徐秀蓉. 维持性血液透析患者骨密度测定与相关指标分析[J]. 现代临床医学, 2012,38(1): 13−14. doi: 10.3969/j.issn.1673-1557.2012.01.005 HU Y, HUANG Z L, XU X R. To analysis bone mineral density and related indicators in patients of maintaining hemodialysis[J]. Journal of Modern Clinical Medicine, 2012, 38(1): 13−14. (in Chinese). doi: 10.3969/j.issn.1673-1557.2012.01.005
[6] MOSCOVICI A, SPRAGUE S M. Osteoprosis and chronic kidney disease[J]. Seminars in Dialysis, 2007, 20(5): 423−430. doi: 10.1111/j.1525-139X.2007.00319.x
[7] 刘铁滨, 王维. 长期血液透析患者腰椎骨密度定量CT的检测及意义[J]. 实用放射学杂志, 2004,20(12): 1104−106. doi: 10.3969/j.issn.1002-1671.2004.12.014 LIU T B, WANG W. Measurement of lumbar bone mineral density with quantitative computed tomography in hemodialysis patients[J]. Journal of Practical Radiology, 2004, 20(12): 1104−106. (in Chinese). doi: 10.3969/j.issn.1002-1671.2004.12.014
[8] MIRFAKHRAEE S, SAKHAEE K, ZERWEKH J, et al. Risk factors for diminished bone mineral density among male hemodialysis patients: A cross-sectional study[J]. Arch Osteoporos, 2012, 7(1/2): 283−290. doi: 10.1007/s11657-012-0110-3
[9] SHEU Y, MARSHALL L M, HOLTON K F, et al. Abdominal body composition measured by quantitative computed tomography and risk of non-spine fractures: The osteoporotic fractures in men (MrOS) study[J]. Osteoporosis International, 2013, 24(8): 2231−2241. doi: 10.1007/s00198-013-2322-9
[10] CHENG X, ZHANG Y, WANG C, et al. The optimal anatomic sitefor a single slice to estimate the total volume of visceraladipose tissue by using the quantitative computed tomography (QCT) in Chinese population[J]. European Journal of Clinical Nutrition, 2018, 72(11): 1567−1575. doi: 10.1038/s41430-018-0122-1
[11] 丁奕, 田娜, 周晓玲, 等. 肥胖与IgA肾病患者独立肾脏风险因子的相关性分析[J]. 中华肾脏病杂志, 2017,33(5): 321−326. doi: 10.3760/cma.j.issn.1001-7097.2017.05.001 DING Y, TIAN N, ZHOU X L, et al. Correlation analysis of obesity with independent renal risk factors in patients with IgA nephropathy[J]. Chinese Journal of Nephrology, 2017, 33(5): 321−326. (in Chinese). doi: 10.3760/cma.j.issn.1001-7097.2017.05.001
[12] 刘建强, 贾冶, 许钟镐, 等. 肥胖与慢性肾脏疾病: 脂肪组织与肾脏炎症及纤维化的关系[J]. 中华肾脏病杂志, 2017, 33(12): 956-960. LIU J Q, JIA Y, XU Z H, et al. Obesity and chronic kidney disease: The relationship between adipose tissue and kidney inflammation and fibrosis[J]. Chinese Journal of Nephrology, 2017, 33(12): 956-960. (in Chinese).
[13] 罗文荣, 姚书东, 孙梅琴. 血液透析对肾病肥胖女性患者内分泌相关指标的影响[J]. 中国妇幼保健, 2021,36(14): 3195−3198. DOI: 10.19829/j.zgfybj.issn.1001-4411.2021.14.009. LUO W R, YAO S D, SUN M Q. Effect of hemodialysis on endocrine-related indicators in obese women with kidney disease[J]. Maternal and Child Health Care of China, 2021, 36(14): 3195−3198. DOI: 10.19829/j.zgfybj.issn.1001-4411.2021.14.009. (in Chinese).
[14] 晏乘曦, 唐光才, 程晓光. 肌少症的定量测量现状及研究进展[J]. 中国骨质疏松杂志, 2018,24(6): 814−819. doi: 10.3969/j.issn.1006-7108.2018.06.021 YAN C X, TANG G C, CHENG X G. State of the art of quantitative me asurement of sarcopenia[J]. Chinese Journal of Osteoporosis, 2018, 24(6): 814−819. (in Chinese). doi: 10.3969/j.issn.1006-7108.2018.06.021
[15] 耿楠, 孔明, 陈煜, 等. 第三腰椎骨骼肌指数在终末期肝病营养诊断中的应用价值[J]. 临床肝胆病杂志, 2021,37(10): 2493−2496. doi: 10.3969/j.issn.1001-5256.2021.10.050 GENG N, KONG M, CHENG Y, et al. Value of L3 skeletal muscle index in nutritional diagnosis of end-stage liver disease[J]. Journal of Clinical Hepatology, 2021, 37(10): 2493−2496. (in Chinese). doi: 10.3969/j.issn.1001-5256.2021.10.050
[16] FAHAL I H. Uraemic sareopenia: Aetiology and implications[J]. Nephml Dial Transplant, 2014, 29(9): 1655−1665. doi: 10.1093/ndt/gft070
[17] PRADO C M, LIEFFERS J R, MCCARGAR L J, et al. Prevalence andclinical implications of sarcopenic obesity in patients with solidtumours of the respiratory and gastrointestinal tracts: Apopulation-based study[J]. Lancet Oncology, 2008, 9(7): 629. doi: 10.1016/S1470-2045(08)70153-0




 下载:
下载: