Clinical Imaging Characteristics and Pathological Features of Sarcomatoid Hepatocellular Carcinoma
-
摘要: 目的:探讨肝脏肉瘤样癌(SHC)的影像学表现及临床病理特征。方法:回顾性分析7例SHC患者的临床、CT/MRI表现及病理特征,并对其一致性进行评价。结果:SHC在CT平扫上表现为病灶边界不清,呈低密度,大小范围从4.2 cm×4.7 cm至14.0 cm×11.0 cm不等。增强CT扫描显示病灶呈环形或早期强化,多见大片坏死区。MRI上T1WI及T2WI病变实质信号不均匀,可见囊性变和坏死区,DWI呈明显的弥散限制性改变;增强扫描表现为病灶边缘及实性成分渐近性强化并可见假包膜出现延迟强化,6例病灶中心出现不同程度坏死;5例有淋巴结转移。病理特征:SHC细胞呈多角型和梭形,肿瘤组织内可见广泛坏死及出血;免疫组化染色Vimentin、CK为阳性。结论:SHC的影像表现与病理学特征具有较好一致性,有助于深入了解SHC特征性影像学表现,有益于肝脏肿瘤的诊断和鉴别诊断。Abstract: Objective: To explore the imaging manifestations and clinical-pathological features of sarcomatoid hepatocellular carcinoma (SHC). Methods: The clinical data, CT/MRI findings and pathological features of 7 patients with SHC were retrospectively analyzed and the consistency was evaluated. Results: SHC showed unclear boundary and low density by plain CT images, with the size ranging from 4.2 cm×4.7 cm–14.0 cm×11.0 cm. By enhanced CT images, SHC showed ring or early enhancement with large areas of necrosis. SHC showed heterogeneous signal intensity on T1WI and T2WI with visible cystic degeneration and necrotic area while DWI displayed obvious diffusion restricted changes. On enhanced MRI, the tumor showed progressive enhancement of peripheral and solid components with delayed enhanced pseudo-capsule. 6 cases had different degree of necrosis in the center of lesion, and lymph node metastasis in the livers hilar was found in 5 patients. Pathological features polygonal and fusiform tumor cells with extensive necrosis and hemorrhage were found on HE staining. Vimentin and CK were positive by immunohistochemical staining. Conclusions: The imaging findings of SHC were consistent with the pathological features, which was helpful to deep understanding of specific imaging manifeatations, and the diagnosis and differential diagnosis of liver tumors.
-
肝脏肉瘤样癌(sarcomatoid hepatocellular carcinoma,SHC)是一种肝脏少见的原发性恶性肿瘤,预后较差,据报道中位生存时间为8个月[1]。SHC影像表现缺乏特异性,与肝脏其他恶性肿瘤影像表现有重叠,尤其是与肝脓肿的临床和影像学表现有相似之处,极容易混淆,所以术前诊断困难,确诊主要依靠病理学和免疫组化检查。
本文回顾性分析7例经手术病理证实的肝脏肉瘤样癌的患者,探讨其CT和MRI表现特征,并对其临床病理特征进行分析,旨在加深对本病的认识并提高鉴别诊断水平。
1. 资料与方法
1.1 一般资料
收集2013年1月至2020年4月经手术病理证实的肝脏肉瘤样癌患者7例,其中男性5例,女性2例;年龄49~58岁,中位年龄54岁。所有患者均有体重明显减轻、右上腹疼痛及发热病史,其中2例患者有糖尿病史,2例有乙肝及肝硬化病史。
1.2 检查方法
(1)CT检查:采用GE Lightspeed Ultra多层螺旋CT,患者取仰卧位,扫描范围由右膈顶至双肾下极平面,层厚1.25 mm,重建层厚度5 mm,螺距0.875︰1,电压120 kV,电流230 mA。所有患者均行增强扫描,用高压注射器以3 mL/s的速度经肘静脉注射非离子型造影剂(300 mgI/mL)100 mL,于注药后25 s、55~60 s、90 s扫描,获得肝动脉期、门静脉期、平衡期图像,同时在GE AW4.4工作站上进行多平面重建(MPR)。
(2)MRI检查:采用Siemens Magneton Trio 3.0 T磁共振进行检查,行腹部常规快速自旋回波(fast spin echo,FSE)序列扫描,包括横轴面T1WI、T2WI扫描和冠状面T2WI。参数如下:T1WI:TR/TE=220~350/5.1~7 ms,T2WI:TR/TE=1600/70 ms,层厚6 mm,层间隔1.0 mm,矩阵256×256,扫描野FOV 300~380 mm。DWI:b值为50/400/800 s/mm2,TR/TE=4000/70 ms,横断位,层厚6 mm,层间隔1.5 mm,矩阵138×128,扫描野FOV 300~380 mm。
增强扫描经静脉注射Gd-DTPA,剂量0.1 mmol/kg,流速3 mL/s,注入对比剂后25~30 s、60~70 s、2 min分别行3次三维容积插值屏气序列(three-dimensional volume interpolated breath-hold examination,3D-VIBE);TR/TE=3.68/1.22 ms,层厚2 mm,FOV 350 mm,翻转角10°,矩阵256×256,扫描时间21 s。横轴面扫描获得动脉期、门脉期、延迟期图像,然后进行冠状面或矢状面扫描。
1.3 图像分析
所有图像资料由两名从事10年以上腹部影像诊断工作的放射科高年资医师对CT/MRI图像共同阅片,评价内容:①SHC病灶部位、形态,按照肝脏 Ⅷ 段分法对肿物进行定位,以圆形、椭圆形或不规则形对病灶形态进行描述;②病灶边界是否清晰;③病灶是否形成假包膜;④病灶密度、信号及强化特征有无出血、坏死,病灶强化程度及方式;⑤周围组织是否有门静脉癌栓和淋巴结转移;⑥周围正常肝实质的情况,有无脂肪肝、肝硬化、有无肝内转移灶等。
1.4 病理及免疫组化染色
手术切除标本行HE染色后观察,并进行免疫组织化学检查,包括上皮细胞膜抗原(EMA)、细胞角蛋白(CKPan)、间叶性标记物波形蛋白(Vimentin)、血管内皮细胞(CD34、CD31)、细胞增殖标记(Ki67指数)、肝原性(Hapetocyte)、AFP、胆管上皮(CK8、18、l9)检查、SMA,G-3、D2-40、Elastic等。
2. 结果
2.1 临床及实验室资料
所有7名患者均主诉腹痛及发热(37.9~39.2 ℃)、无寒战,2例乙肝、肝硬化病史,1例患者有肝癌家族史,另2例仅乙肝核心抗体阳性。
实验室检查:白细胞计数及中性粒细胞百分比增加5例,C反应蛋白增加4例,13.1~23 mg/dL(正常值0~0.8 mg/dL);4例检测到肿瘤标记物,13例AFP升高,13.4~47.7 ng/mL(正常值<8.1 ng/mL);2例CA19-9升高,94.34~604.91 U/mL(<37 U/mL);2例CA125升高,214.4~556.5 U/mL(<30.2 U/mL)。
2.2 影像表现
CT表现:SHC肿瘤位于肝右叶6例,肝左叶1例,肿瘤巨大通常累及肝脏多个分段;最大径4.2 cm×4.7 cm~14.0 cm×11.0 cm,CT平扫病灶边界不清,呈低密度,内部可见更低密度区,增强扫描动脉期轻度强化(4例)或明显强化(3例),门脉期及延迟期呈渐进性强化,内部均可见明显大片状无强化坏死区,6例可见环形强化假包膜。
MRI表现:SHC肿瘤边界不清,T1WI呈不均匀低信号,1例出血呈混合性稍高信号,T2WI呈稍高信号,内部信号不均;DWI出现明显的弥散受限变化,平均ADC值为0.826 mm2/s(0.815~0.923 mm2/s),周围正常肝实质ADC值为1.27~1.424 mm2/s;增强扫描3例呈动脉期明显强化,门脉期及延迟期呈持续性强化,4例呈边缘及实性成分渐近性强化,6例可见延迟强化假包膜,所有患者内部均出现不同程度坏死。6例患者侵犯肝包膜或膈肌,1例出现门静脉瘤栓,1例可见下腔静脉瘤栓,2例出现肝内转移,1例CT及MRI可见肝硬化改变,5例肝门区出现淋巴结转移(表1、图1和图2)。
表 1 SHC的CT及MRI表现Table 1. Imaging characteristics on CT/MRI of sarcomatoid hepatocellular carcinoma病例 部位 大小/cm CT表现 MRI表现 坏死 出血 包膜 膈肌
受侵门静脉
瘤栓肝内
转移肝硬化
背景淋巴结
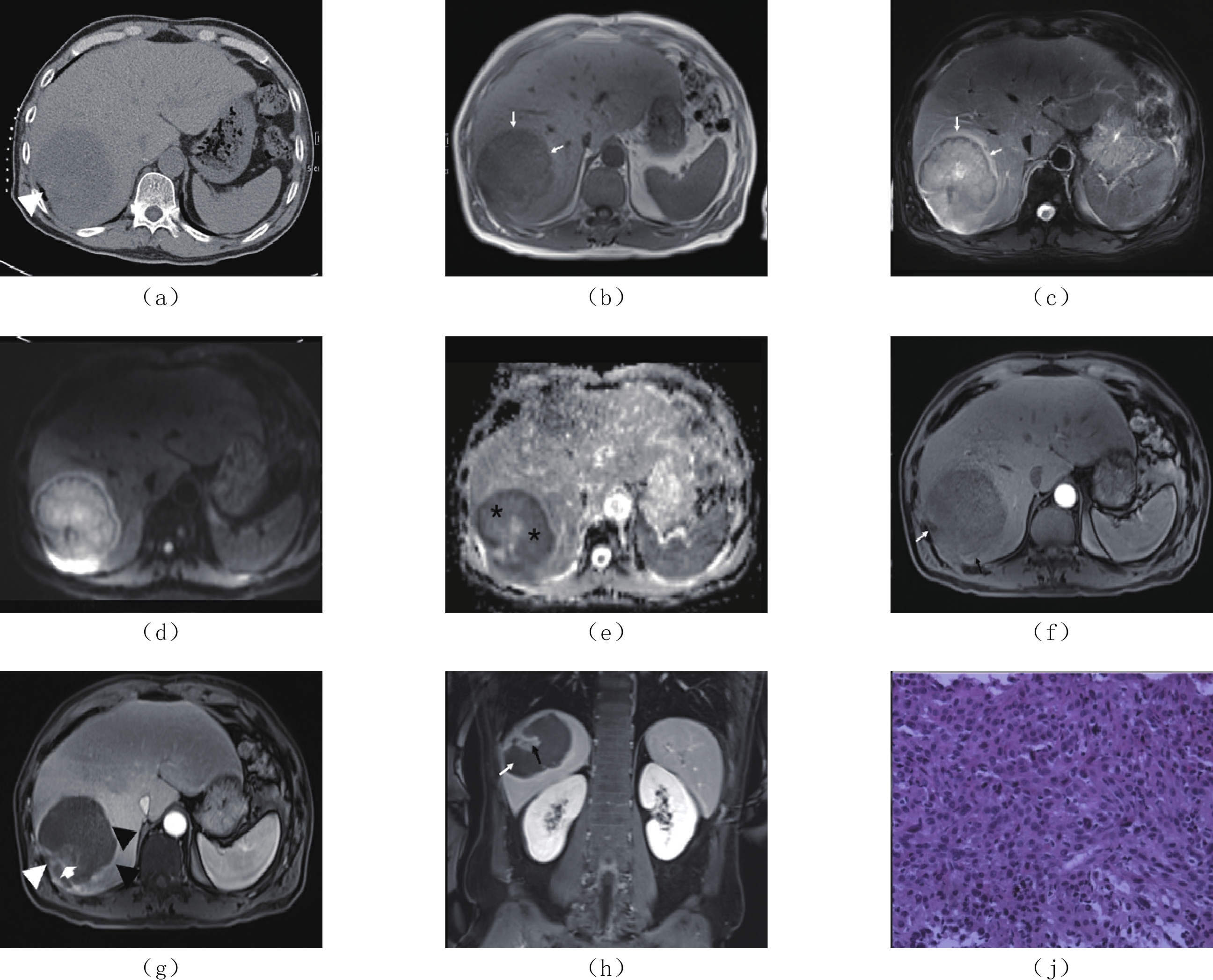
转移边界 平扫 增强扫描 T1 WI T2 WI DWI 动态增强 1 Ⅷ段 10.0×8.0 不清 低密度 渐进性边缘厚环状强化 低信号 不均匀稍高信号 扩散受限改变 渐进性强化 有 无 有 有 无 无 无 有,内部伴坏死 2 Ⅷ段 14.0×11.0 不清 低密度 渐进性边缘厚环状强化 低信号 不均匀稍高信号 明显扩散受限改变 渐进性强化 有 有 有 有 无 无 无 无 3 V、Ⅵ段 10.0×9.0 不清 低密度 边缘环形强化 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 无 有 无 无 无 有,内部伴坏死 4 Ⅶ~Ⅷ段 7.6×5.0 不清 低密度 边缘渐进性强化,坏死区无强化 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 有 有 无 无 无 有,内部伴坏死 5 Ⅶ~Ⅷ段 11.6×13.2 不清 低密度 动脉期强化,门脉期及延迟期呈低密度 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 有 有 有,下腔静脉瘤栓 有 无 有 6 Ⅵ~Ⅷ段 10.0×7.0 较清晰 低密度 动脉期明显强化,门脉期及延迟期持续强化 — — — — 有 无 有 有 无 无 无 无 7 Ⅲ 4.2×4.7 较清晰 低密度 动脉期局部明显强化,门脉期及延迟期持续强化 低信号 不均匀稍高信号 扩散受限改变 渐进性强化 有 无 有 无 有,胆管内肿瘤侵犯 有 有 有 ![]() 图 1 男,58岁,肝右叶SHC(a)CT平扫,肝右叶低密度肿物,肝包膜皱缩(白箭头),最大径约7.6 cm×5.0 cm;(b)MRI T1WI轴面示肝右叶肿物呈长T1信号(白箭);(c)T2WI轴面脂肪抑制序列,肿瘤边界不清,呈不均匀稍高信号,边缘可见环带状高信号(白箭);(d)DWI图,病灶呈明显弥散受限改变;(e)ADC图,病灶呈轻度扩散受限改变(黑*),ADC值为0.835 mm2/s;(f)MRI轴面增强(动脉期),肝右叶肿物边缘轻度强化(黑箭),局部包膜皱缩增厚(白箭),内部可见大片状无强化区坏死区;(g)MRI轴面增强(门脉期),肝右叶肿物呈边缘渐进性环形强化(黑箭头)及实性成分强化(短箭),内部可见大片状无强化区坏死区,肝右叶局部包膜皱缩增厚(白箭头),膈肌受侵;(h)MRI冠状面增强(延迟期),肝右叶肿物内实性成分强化(黑箭),大片状无强化区坏死区(白箭);(j)HE染色(×200)肿瘤细胞呈实巢状生长,细胞异型性明显,细胞呈腺泡状排列,部分呈梭形,核分裂像。Figure 1. Male, 58 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver
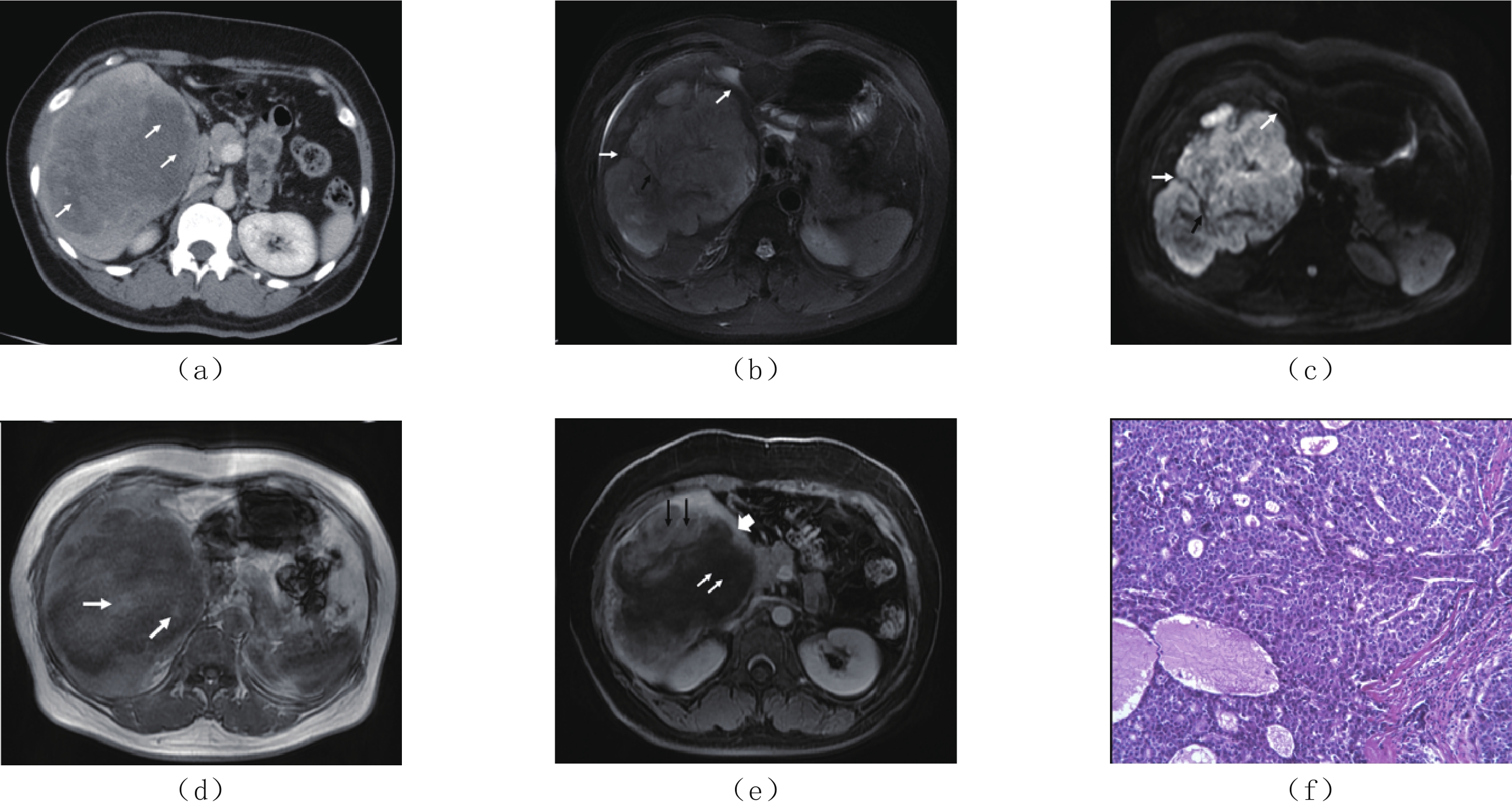
图 1 男,58岁,肝右叶SHC(a)CT平扫,肝右叶低密度肿物,肝包膜皱缩(白箭头),最大径约7.6 cm×5.0 cm;(b)MRI T1WI轴面示肝右叶肿物呈长T1信号(白箭);(c)T2WI轴面脂肪抑制序列,肿瘤边界不清,呈不均匀稍高信号,边缘可见环带状高信号(白箭);(d)DWI图,病灶呈明显弥散受限改变;(e)ADC图,病灶呈轻度扩散受限改变(黑*),ADC值为0.835 mm2/s;(f)MRI轴面增强(动脉期),肝右叶肿物边缘轻度强化(黑箭),局部包膜皱缩增厚(白箭),内部可见大片状无强化区坏死区;(g)MRI轴面增强(门脉期),肝右叶肿物呈边缘渐进性环形强化(黑箭头)及实性成分强化(短箭),内部可见大片状无强化区坏死区,肝右叶局部包膜皱缩增厚(白箭头),膈肌受侵;(h)MRI冠状面增强(延迟期),肝右叶肿物内实性成分强化(黑箭),大片状无强化区坏死区(白箭);(j)HE染色(×200)肿瘤细胞呈实巢状生长,细胞异型性明显,细胞呈腺泡状排列,部分呈梭形,核分裂像。Figure 1. Male, 58 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver![]() 图 2 女,55岁,肝右叶SHC(a)CT增强扫描门脉期,肝右叶巨大肿物,14.0 cm×11.0 cm,边界不清,呈不均匀稍低强化,内部散在大片状坏死区(白箭)。(b)T2WI肿物呈长不均匀高信号,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(c)DWI肿物呈明显弥散受限,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(d)T1WI肿物呈不均匀混合信号,内部似可见片絮样稍高信号(白箭)。(e)MRI动态增强扫描门脉期,病灶内部散在斑片状轻度强化(黑箭)及无强化坏死区(白箭),边缘可见强化假包膜(短箭)。(f)HE染色(×200),肿瘤细胞呈实性巢状及腺管状生长,细胞呈多角形和梭形,内部可见广泛出血及坏死。Figure 2. Female, 55 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver
图 2 女,55岁,肝右叶SHC(a)CT增强扫描门脉期,肝右叶巨大肿物,14.0 cm×11.0 cm,边界不清,呈不均匀稍低强化,内部散在大片状坏死区(白箭)。(b)T2WI肿物呈长不均匀高信号,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(c)DWI肿物呈明显弥散受限,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(d)T1WI肿物呈不均匀混合信号,内部似可见片絮样稍高信号(白箭)。(e)MRI动态增强扫描门脉期,病灶内部散在斑片状轻度强化(黑箭)及无强化坏死区(白箭),边缘可见强化假包膜(短箭)。(f)HE染色(×200),肿瘤细胞呈实性巢状及腺管状生长,细胞呈多角形和梭形,内部可见广泛出血及坏死。Figure 2. Female, 55 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver2.3 病理及免疫组化染色结果
5例患者术后大体结果显示右半肝或左半肝较大肿物,切面可见出血及坏死,4例侵犯肝被膜或膈肌。
镜检显示(图1(j),图2(f)):肝低分化肝细胞癌,部分呈肉瘤样变,肿瘤细胞部分呈多角型,部分呈梭形;肿瘤组织出现广泛坏死及出血(图2(f))。
免疫组化染色:Vimentin及CK均为(+),CK8(+)/CK18(+)3例,CK19(+)2例,G-3(+)3例,D2-40/Elastict提示脉管瘤栓及血管浸润3例,Hapetocyte(+)1例,AFP(+)1例,CD34(血管内皮细胞+)3例,Bcl-2(-)3例,CD31(+)2例,Ki67指数增高20%~40%。
2.4 预后及转归
2例穿刺活检后于当地支持治疗,1年内因并发症死亡。5例均有短期复发或腹腔及淋巴结转移(34~90天)。5例患者均于MRI检查后一周之内进行手术,4例为肝叶或肝段切除术,1例为肝移植手术,其他2例行穿刺活检术。
3. 讨论
3.1 SHC发病机制及临床表现
SHC也称肝癌肉瘤样变,指肿瘤的部分或全部被肉瘤样纺锤形或类圆形肿瘤细胞替代,是肝原发性恶性肿瘤中罕见且预后极差的恶性肿瘤[1-4],大部分需要手术切除且极容易短期复发[5]。本组5例手术患者均在3个月内出现局部复发或淋巴结转移。本病临床表现无特征性.短期内可出现体重明显减轻。与原发性肝癌不同,多数SHC患者无乙肝、肝硬化等病史,与肝脓肿症状相似[6]。本组4例均有腹痛、发热及白细胞增高,C反应蛋白明显增高。2例患者糖尿病且控制不良,因此2例误诊为肝脓肿,其中1例外院CT误诊为肝脓肿后穿刺检查未引流出脓液,考虑与肿瘤生长迅速出现明显的坏死、出血并累及肝被膜及膈肌有关。肿瘤标记物检查AFP结果对SHC无特异性,仅4例轻度升高,CA19-9和CA125不同程度升高外,对肿瘤来源提示作用不大。
SHC的发病机制目前多数研究者倾向于肉瘤样成分源于普通肝细胞癌的间变去分化[7],尤其是低分化肝癌细胞更容易出现肉瘤样变,本组4例均为低分化肝细胞癌出现肉瘤样变,免疫组织化学染色显示Vimentin和CK均阳性及Ki67指数升高也提示肿瘤来自上皮细胞成分的肉瘤样变[8]。
3.2 SHC影像表现与病理对照
SHC生长迅速,因症状不典型,往往就诊时病灶较大,有文献报道[9-14]肿瘤最大径可达21.7 cm。本组研究中,肿瘤的最大直径为14.0 cm,与文献报道相符。
CT平扫显示不均匀低密度肿块,增强扫描显示动脉期边缘“厚环状”强化,门静脉期及延迟期环形强化、假包膜及实性成分强化,与病理对照,肿瘤边缘为存活的肿瘤组织,而中心非强化区为低分化肿瘤细胞快速生长形成的坏死或粘液样基质变性。
MRI平扫由于内部坏死、粘液变性和出血的存在,T1WI和T2WI呈不均匀信号,增强扫描动脉期呈边缘实质部分及分隔不规则强化,门脉期及延迟期呈渐进性强化,且可见渐进性强化的完整或不完整的包膜组织及存活肿瘤组织,反映了病灶周围生长活跃的肿瘤组织伴纤维化的特征,3例局部明显强化提示部分病灶为肝动脉供血,这些表现与Koo等[15]报道的强化表现相符;DWI呈明显扩散受限改变,ADC值明显减低(值平均0.826 mm2/s),与肝脓肿难以区分,诊断中需结合动态增强扫描表现综合考虑。
本组肿瘤因病灶较大,多数累及肝被膜及膈肌,肝内转移、静脉瘤栓及淋巴结转移均比较常见,考虑与肿瘤恶性程度高、生长迅速、发现时分期较晚有关,且转移的淋巴结内部容易出现坏死区,与原发肿瘤表现类似。
3.3 鉴别诊断
(1)细菌性肝脓肿:一般症状为高热寒战,白细胞及中性粒细胞百分比明显升高,肝脓肿早期边界不清,增强扫描周围可见环形低密度水肿带及肝实质炎症反应,而SHC病灶边缘存活的肿瘤组织伴纤维组织呈渐进性强化并可见包膜,SHC淋巴结转移常见。
(2)肝细胞肝癌:乙肝及肝硬化病史常见,肿瘤标记物检查AFP多数升高,CT及MRI检查可出现典型的快进-快出型强化方式,门静脉瘤栓在较大病灶或弥漫性肝癌患者中常见,通常伴发腹腔及腹膜后静脉曲张,而SHC的CT及MRI强化方式不出现典型的流出型曲线,腹腔及腹膜后静脉曲张少见。
(3)肝内胆管细胞癌:因肿瘤内含有较多纤维成分,CT及MRI增强扫描表现为渐进性强化,伴临近肝包膜皱缩及远端胆管扩张,而SHC渐进性强化程度低于肝内胆管细胞癌,且肿瘤快速生长导致内部坏死非常明显,因此渐进性强化区域即存活的肿瘤组织主要集中于肿瘤边缘。
本文的局限性,由SHC于是少见病,本文搜集病例数有限,且为单中心回顾性研究,样本量较少。未来需要多中心积累更多病例,进一步加深认识并加以验证。
综上所述,SHC是一种肝脏极其少见且侵袭性高的恶性肿瘤,术后易早期复发和转移,加深对其了解和认识,对于临床肝脏病变的诊断和鉴别诊断至关重要,在肝脏恶性肿瘤鉴别诊断疾病谱中,应该考虑到SHC的可能,并且该病与肝脓肿的临床和影像表现有相似之处,两者的鉴别诊断有重要临床意义,所以尤其要重视与肝脓肿的鉴别诊断。
-
图 1 男,58岁,肝右叶SHC
(a)CT平扫,肝右叶低密度肿物,肝包膜皱缩(白箭头),最大径约7.6 cm×5.0 cm;(b)MRI T1WI轴面示肝右叶肿物呈长T1信号(白箭);(c)T2WI轴面脂肪抑制序列,肿瘤边界不清,呈不均匀稍高信号,边缘可见环带状高信号(白箭);(d)DWI图,病灶呈明显弥散受限改变;(e)ADC图,病灶呈轻度扩散受限改变(黑*),ADC值为0.835 mm2/s;(f)MRI轴面增强(动脉期),肝右叶肿物边缘轻度强化(黑箭),局部包膜皱缩增厚(白箭),内部可见大片状无强化区坏死区;(g)MRI轴面增强(门脉期),肝右叶肿物呈边缘渐进性环形强化(黑箭头)及实性成分强化(短箭),内部可见大片状无强化区坏死区,肝右叶局部包膜皱缩增厚(白箭头),膈肌受侵;(h)MRI冠状面增强(延迟期),肝右叶肿物内实性成分强化(黑箭),大片状无强化区坏死区(白箭);(j)HE染色(×200)肿瘤细胞呈实巢状生长,细胞异型性明显,细胞呈腺泡状排列,部分呈梭形,核分裂像。
Figure 1. Male, 58 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver
图 2 女,55岁,肝右叶SHC
(a)CT增强扫描门脉期,肝右叶巨大肿物,14.0 cm×11.0 cm,边界不清,呈不均匀稍低强化,内部散在大片状坏死区(白箭)。(b)T2WI肿物呈长不均匀高信号,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(c)DWI肿物呈明显弥散受限,内部似可见条形低信号分隔(黑箭),边缘为不规则环形低信号带(白箭)。(d)T1WI肿物呈不均匀混合信号,内部似可见片絮样稍高信号(白箭)。(e)MRI动态增强扫描门脉期,病灶内部散在斑片状轻度强化(黑箭)及无强化坏死区(白箭),边缘可见强化假包膜(短箭)。(f)HE染色(×200),肿瘤细胞呈实性巢状及腺管状生长,细胞呈多角形和梭形,内部可见广泛出血及坏死。
Figure 2. Female, 55 Y, sarcomatoid hepatocellular carcinoma in right lobe of the liver
表 1 SHC的CT及MRI表现
Table 1 Imaging characteristics on CT/MRI of sarcomatoid hepatocellular carcinoma
病例 部位 大小/cm CT表现 MRI表现 坏死 出血 包膜 膈肌
受侵门静脉
瘤栓肝内
转移肝硬化
背景淋巴结
转移边界 平扫 增强扫描 T1 WI T2 WI DWI 动态增强 1 Ⅷ段 10.0×8.0 不清 低密度 渐进性边缘厚环状强化 低信号 不均匀稍高信号 扩散受限改变 渐进性强化 有 无 有 有 无 无 无 有,内部伴坏死 2 Ⅷ段 14.0×11.0 不清 低密度 渐进性边缘厚环状强化 低信号 不均匀稍高信号 明显扩散受限改变 渐进性强化 有 有 有 有 无 无 无 无 3 V、Ⅵ段 10.0×9.0 不清 低密度 边缘环形强化 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 无 有 无 无 无 有,内部伴坏死 4 Ⅶ~Ⅷ段 7.6×5.0 不清 低密度 边缘渐进性强化,坏死区无强化 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 有 有 无 无 无 有,内部伴坏死 5 Ⅶ~Ⅷ段 11.6×13.2 不清 低密度 动脉期强化,门脉期及延迟期呈低密度 低信号 不均匀高信号 扩散受限改变 渐进性强化 有 无 有 有 有,下腔静脉瘤栓 有 无 有 6 Ⅵ~Ⅷ段 10.0×7.0 较清晰 低密度 动脉期明显强化,门脉期及延迟期持续强化 — — — — 有 无 有 有 无 无 无 无 7 Ⅲ 4.2×4.7 较清晰 低密度 动脉期局部明显强化,门脉期及延迟期持续强化 低信号 不均匀稍高信号 扩散受限改变 渐进性强化 有 无 有 无 有,胆管内肿瘤侵犯 有 有 有 -
[1] LIAO S H, SU T H, JENG Y M, et al. Clinical manifestations and outcomes of patients with sarcomatoid hepatocellular carcinoma[J]. Hepatology (Baltimore, Md), 2019, 69(1): 209−221. DOI: 10.1002/hep.30162.
[2] YOSHIDA N, MIDORAKAWA Y, KAJIWARA T, et al. Hepatocellular carcinoma with sarcomatoid change without anticancer therapies[J]. Case Reports in Gastroenterology, 2013, 7(1): 169−174. DOI: 10.1159/000350558.
[3] WANG J P, YAO Z G, SUN Y W, et al. Clinicopathological characteristics and surgical outcomes of sarcomatoid hepatocellular carcinoma[J]. World Journal Gastroenterology, 2020, 26(29): 4327−4342. DOI: 10.3748/wjg.v26.i29.4327.
[4] KAN A, GUO R P. The prognosis of subsequent surgical treatment in patients with sarcomatoid carcinoma in the liver: A retrospective study[J]. International Journal of Surgery, 2018, 55: 145−151. DOI: 10.1016/j.ijsu.2018.05.736.
[5] 李琛, 王华颖, 李琳琳, 等. 消化系统肉瘤样癌22例临床病理分析[J]. 临床与实验病理学杂志, 2020,36(10): 108−111. doi: 10.13315/j.cnki.cjcep.2020.10.026 [6] YANG Z, LV K, ZHAO Y, et al. Sarcomatoid hepatocellular carcinoma mimicking hepatic abscess: A case report[J]. Medicine, 2020, 99(39): e22489. DOI: 10.1097/MD.0000000000022489.
[7] ERIGUCHI N, AOYAGI S, OKUDA K, et al. Unusual liver carcinomas with sarcomatous features: Analysis of four cases[J]. Surgery Today, 2001, 31(6): 530−533. DOI: 10.1007/s005950170116.
[8] WANG Q B, CUI B K, WENG J M, et al. Clinicopathological characteristics and outcome of primary sarcomatoid carcinoma and carcinosarcoma of the liver[J]. Journal of Gastroin-testinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract, 2012, 16(9): 1715−1726. DOI: 10.1007/s11605-012-1946-y.
[9] 贺亚琼, 姚景江, 刘建滨, 等. 肝肉瘤样癌的病理及影像表现[J]. 中华放射学杂志, 2014,048(011): 956−958. doi: 10.3760/cma.j.issn.1005-1201.2014.11.019 [10] SHI D, SUN J, MA L, et al. Clinical and imaging characteristics of primary hepatic sarcomatoid carcinoma and sarcoma: A comparative study[J]. BMC Cancer, 2020, 20(1): 977. DOI: 10.1186/s12885-020-07475-z.
[11] 徐莹莹, 谢道海. 原发性肝肉瘤样癌的影像表现与临床病理特征[J]. 实用放射学杂志, 2019,35(10): 1698−1701. DOI: 10.3969/j.issn.1002-1671.2019.10.037. XU Y Y, XIE D H. Imaging findings and clinical pathological features of primary hepatic sarcomatoid carcinoma[J]. Journal of Practical Radiology, 2019, 35(10): 1698−1701. DOI: 10.3969/j.issn.1002-1671.2019.10.037. (in Chinese).
[12] 王亚龙, 郭华, 蔡明珠. 肝肉瘤样癌的多层螺旋CT与病理特征[J]. 实用放射学杂志, 2019,35(5): 756−785, 802. DOI: 10.3969/j.issn.1002-1671.2019.05.017. WANG Y L, GUO H, CAI M Z. The MSCT and pathological features of sarcomatoid hepatocellular carcinoma[J]. Journal of Practical Radiology, 2019, 35(5): 756−785, 802. DOI: 10.3969/j.issn.1002-1671.2019.05.017. (in Chinese).
[13] 翁燕香, 陈正华, 陈少珍. 肉瘤样肝细胞癌的影像学表现[J]. 实用放射学杂志, 2016,(2): 314−316. DOI: 10.3969/j.issn.1002-1671.2016.02.045. WENG Y X, CHEN Z H, CHEN S Z. The image features of sarcomatoid hepatocellular carcinoma[J]. Journal of Practical Radiology, 2016, (2): 314−316. DOI: 10.3969/j.issn.1002-1671.2016.02.045. (in Chinese).
[14] 史东立, 马良, 赵大伟, 等. 原发性肝脏肉瘤的影像学表现[J]. 实用放射学杂志, 2018,34(10): 1538−1541, 1587. DOI: 10.3969/j.issn.1002-1671.2018.10.014. SHI D L, MA L, ZHAO D W, et al. Imaging findings of primary hepatic sarcoma[J]. Journal of Practical Radiology, 2018, 34(10): 1538−1541, 1587. DOI: 10.3969/j.issn.1002-1671.2018.10.014. (in Chinese).
[15] KOO H R, PARK M S, KIM M J, et al. Radiological and clinical features of sarcomatoid hepatocellular carcinoma in 11 cases[J]. Journal of Computer Assisted Tomography, 2008, 32(5): 745−749. DOI: 10.1097/RCT.0b013e3181591ccd.
-
期刊类型引用(2)
1. 林煜文,黄冬云,龙琳. 基于RefineNet卷积神经网络对CT颅底骨折精准诊断的应用价值. 医学影像学杂志. 2024(07): 5-8+17 .  百度学术
百度学术
2. 刘红光,张行坤,刘诚,李伟凯. 基于深度卷积神经网络的异常肺部CT图像初筛平台的设计与临床实践. 电子设计工程. 2023(23): 184-188+195 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: