Development of Motion Artifact Correction Solutions for the Cone-beam CT Images during Pancreatic Cancer Image-guided Radiotherapy
-
摘要:
基于二维平板探测器技术的锥束CT系统广泛应用于放射治疗前的摆位验证,但在以胰腺癌为代表的腹腔肿瘤放疗应用中会遇到呼吸运动和肠道蠕动导致的严重阴影与条状伪影问题,难以从CT影像中分辨病灶区域。由于胰腺等柔性脏器在呼吸运动作用下会存在非刚性形变,体表运动监测结果和实际脏器运动间存在难以量化的偏差,也难以监测以肠道蠕动为代表的不规则运动,故腹腔锥束CT运动伪影修正问题缺乏有效解决方案。本文基于生物动力学理论和人体生理学常识,提出全新的无需运动监测或体内标记物植入的放疗图像引导锥束CT运动伪影修正方法,设计基于伪影图像特征、融合各类CT图像域处理算法的伪影修正策略。将该策略应用于临床腹腔锥束CT影像处理后所得结果表明锥束CT图像质量有显著改善,典型软组织区域的平均CT数误差从90 HU降到30 HU,肠道空腔边界和周边软组织信息得到部分恢复。本文开发的伪影修正策略无需呼吸门控或增加投影数,避免标记物植入手术,可集成到现有工作流,为胰腺癌放疗图像引导提供肿瘤定位信息。
Abstract:The cone-beam CT (CBCT) system based on the two-dimensional flat-panel detector technology is widely applied in patient location verification before radiotherapy. However, during the application of intraperitoneal tumor radiotherapy, severe shading and streaking artifacts caused by respiratory movement and intestinal peristalsis make it difficult to distinguish tumor areas from the CBCT images. Due to the non-rigid deformation of flexible organs such as the pancreas under the action of respiratory motion, it is hard to quantify deviation between the body surface motion monitoring results and the actual organ motion, and it is also difficult to monitor irregular motion represented by intestinal peristalsis. There is no effective solution to motion artifact correction in CBCT. Based on theory of biodynamics and common knowledge of human physiology, in this paper we propose a brand new radiotherapy image-guided cone-beam CT motion artifact correction method without motion monitoring or implantation of in-vivo markers. The proposed artifact correction strategy is designed based on the features of the artifact images and fusion of various CT image domain processing algorithms. The results suggest that the image quality of cone beam CT has been significantly improved after the application of this strategy in the clinical abdominal CBCT image processing. The average CT number error in typical soft tissue areas reduces from 90 HU to 30 HU, and the boundary of the intestinal cavity and surrounding soft tissue information are partially recovered. The proposed artifact correction strategy does not require respiratory gating or increase of projections, which can be integrated into existing workflows without marker implantation surgery. The motion-artifact-corrected CBCT images provide more accurate tumor localization information for image-guided radiotherapy of pancreatic carcinoma. The proposed method is proved practical and efficient for clinical applications
-
在肿瘤放射治疗中,治疗计划制定一般以患者在多排螺旋CT设备上的离线扫描结果即计划CT影像为基准,因此在每个疗程剂量投放前需要确认患者及肿瘤靶区相对于加速器头及多叶光栅的位置,为实现剂量投放前患者的现场CT扫描,当代放射治疗系统中普遍集成了锥束CT设备,此时无需移动患者即可得到CT影像;该影像用于指导患者摆位,并可提供肿瘤定位信息。
锥束CT利用X射线球管发出的立体锥形束和高分辨大尺度平板探测器实现三维立体CT成像[1],保留了常规多排诊断CT解剖结构无畸变的成像特性,可真实反映肿瘤形态和位置。锥束CT相对于诊断CT具有3个显著优势:结构简单,体积小,可集成进放疗加速器治疗系统;探测器成像单元线度小,且成像系统空间分辨率高;总辐射剂量较低,可降低患者辐射损伤风险。因此,获得准确、高质量的锥束CT影像有助于提升放疗疗效,基于锥束CT的图像引导放射治疗(imaged-guided radiation therapy,IGRT)技术是放疗研究热点[2],锥束CT也成为IGRT最常用的成像手段。
患者每次接受放疗前现场锥束CT扫描获得的CT影像可提供解剖结构变化信息,包括患者体位、脏器位置及肿瘤靶区位置等;但由于锥束CT扫描速度较诊断CT慢数十倍,扫描中脏器运动不可忽略,则在锥束CT影像中会出现运动导致的伪影,影像质量受到显著影响。在胰腺癌放疗过程中胰腺等柔性脏器的运动不仅会造成术前锥束CT影像中的严重伪影问题,进而导致肿瘤区域定位精度变差,还会直接影响放疗剂量投放的精度。因此,锥束CT扫描过程中胰腺等腹腔脏器运动造成的各类伪影问题已严重限制了该技术在胰腺癌IGRT中的应用。
扫描过程中的主要运动包括周期性的肺部呼吸运动和不规则的肠道蠕动。在这些来源和特征不同的脏器运动以及柔性脏器非刚性形变的共同作用下,腹腔锥束CT影像中的伪影主要呈现为腹腔各脏器附近的条状伪影和阴影伪影。此时从锥束CT影像中难以提取消化道肿瘤的定位信息,且基于骨结构分辨和配准的放疗前患者几何摆位精度也受限。
图1对同一位患者的放疗术前锥束CT(瓦里安公司Trilogy放疗机OBI系统[3])和诊断CT(西门子公司64排Somatom Definition AS CT设备)的单层横断面图像进行比较,直观展示锥束扫描过程中腹腔脏器运动引起的图像伪影和成像质量恶化。腹腔锥束CT扫描时长受限于所采用平板探测器的读出和数据传输速率,一般需要几十秒,其中Trilogy系统的OBI设备完成患者腹腔扫描需60 s以上。伪影形态则主要呈现为肠道空腔附近的条状和阴影伪影(图1(a)中红色箭头所示),此时难以区分肌肉、脂肪及其他软组织,且无法获得脏器的准确位置和形状。相对地,诊断CT的腹腔扫描时间一般在1 s内,此时腹腔脏器可近似为准静止状态,不会出现运动引发的伪影现象(图1(b))。
CT扫描过程中腹腔脏器运动主要来源于胸腔呼吸运动和腹腔肠道蠕动,其中呼吸运动为间接影响,此时需要考虑呼吸作用下腹腔柔软脏器的非刚性形变;而肠道蠕动为非刚性、不可预测的不规则运动,此时难以找到运动规律。因此,腹腔锥束CT伪影修正的最大难点是腹腔脏器的不规则蠕动和非刚性形变情况下无法获得准确的运动参量信息。由于缺乏准确定位肿瘤靶区的方法,目前胰腺癌等放疗中会增加靶区范围[4],此时会有更大比例的正常组织受到辐照,其中可能包含小肠等危机器官(organ at risk,OAR),进而导致剂量利用率降低和术后不良反应风险增加。另外在强子治疗如质子放疗中,带电粒子的绝大部分能量沉积在布拉格峰,此时若没有准确的肿瘤靶区定位及放疗计划,绝大部分能量均会作用于正常组织,引发严重后果。
目前IGRT中脏器运动引发的锥束CT伪影的相关研究集中于解决呼吸运动造成的伪影,而针对非刚性、不规则的肠道蠕动的研究十分有限。为抑制呼吸运动,早期曾采用训练患者在诊断扫描和治疗过程中屏息的方法[5],但其临床实用性差,实际应用中一般仅能抑制最大运动幅度,即确保不会出现剧烈运动。随着光学成像技术的发展,可利用双目成像等具备三维坐标测量功能的设备对患者体表贴附的标识点进行呼吸跟踪,并以此为基础进行锥束CT投影图的呼吸时相分组,从而得到分呼吸时相的锥束CT影像[6-8]。这种相位相关方法也被称为四维锥束CT(four-dimensional cone-beam CT,4D CBCT),已逐步应用于各类肺癌放射治疗中的胸腔图像引导[9-10]。需要注意的是4D CBCT中投影数是常规锥束CT的数倍,相应辐射剂量和扫描时间有显著提升;同时分时相后相位划分不准确引发的投影图不连续性以及稀疏角度重建均会造成图像质量的显著降低[11]。另外2018年Steiner等[12]发现现有4D CBCT技术应用于肺部肿瘤定位时会低估肿瘤的实际运动幅度,该误差部分来源于体表标识点和肺部肿瘤定位的差异,但和重建算法的选取无关。
近年来,4D CBCT技术也进一步推广应用于腹腔的肝癌[13]以及胃肠道肿瘤如胃癌[14]、食管癌[15]及胰腺癌[16]放射治疗中的肿瘤辅助定位。考虑到腹腔脏器的不规则运动和在呼吸等运动作用下柔性脏器的形变,一般采用在肿瘤区域附近植入金属标识点的方式来辅助定位肿瘤。针对CT影像伪影和肿瘤定位问题,Marchant等[17]于2011年提出了基于仿射变换的投影图修正方案,该方案中首先手动提取投影图中各个标识点的定位,再设计模型计算得出无运动情况下的标识点定位,从而获得投影图修正所需的变换参数,最终锥束CT影像中伪影得到抑制,肿瘤区域定位精度提升;2012年该课题组进一步开发集成了标识点自动提取算法,提升了计算效率[18],但该方案中的有限个标识点无法准确描述肿瘤区域的复杂形状变化,同时金属标识点自身会引发CT影像中的金属伪影,另外临床实践中植入操作增加了手术风险和复杂度,且植入物可能在患者体内迁移。
为避免金属植入物问题,无需植入标识点的运动提取方法是近年的研究热点,主要包括基于配准和迭代重建的两类解决方案。Wang等[19]于2014年提出了基于4D CBCT和二维在线X射线透视图配准的肿瘤跟踪定位方法,利用4D CBCT生成二维数字重建X射线影像(digital reconstructed radiograph,DRR),再将DRR和X射线透视图做二维配准获得肿瘤定位;Zachiu等[20]于2018年设计了用于计划CT和锥束CT影像配准的Evolution算法,该算法中仅需两个输入参数,大大降低了参数优化难度,其配准结果用于在线放疗图像引导;2015年Liu等[21]建立了五维呼吸模型,并应用于4D CBCT的迭代重建,无需呼吸跟踪数据即可得到4D CBCT重建结果;2017年Zhang等[22]则将全变分方法应用于4D CBCT的迭代重建;2021年Peterlik等[23]在美国瓦里安公司最新的Halcyon放疗机上进行基于迭代优化算法的运动伪影修正算法研究,在iCBCT迭代重建中加入梯度权重,将平均CT数误差(考虑5 s内的平移运动)从136.0 HU降低至56.0 HU。目前基于配准的解决方案和植入物方案相比加入了柔性脏器非刚性形变因素的影响,有效提升了定位精度,但需要额外进行X射线透视或CT扫描,同时缺乏普适的配准参数优化方法,可以造成配准后的影像失真。而基于迭代重建的解决方案则受限于简化模型的假设是否成立以及迭代重建计算效率问题。
腹腔锥束CT影像中肠道蠕动引发的伪影修正研究可追溯到2007年Voogt等[24]在放射治疗中的计算机应用国际会议(International Conference on the Use of Computers in Radiation Therapy, ICCR)上报道的投影筛选方法,即Flatex算法[25],该算法主要解决锥束CT影像中肠道内气泡附近的条状伪影问题,其中首先筛选对应较小幅度运动的部分投影,再进行基于少量投影的解析重建;该算法的应用受限于人工筛选投影的效率,且稀疏投影重建容易引入新的条状伪影。近年来没有出现后续或者相关研究报道,无法建立准确运动模型的肠道蠕动已成为腹腔锥束CT伪影修正中的最大难题。
综上所述,目前腹腔脏器运动引发的锥束CT伪影修正方法主要包括患者屏息训练、体表呼吸跟踪、体内植入标识点辅助定位、基于图像配准的运动提取、迭代重建中运动建模、投影图筛选等方式。这些方法中脏器运动参数的获取依赖于非直接测量或数学模型假设,且未同时覆盖呼吸运动和肠道蠕动两大伪影来源,伪影消除效果受限;另外其运动测量估计或配准提取过程对诊疗方案的要求更为苛刻,且更多的投影数也对应了单次扫描中总辐射剂量的提升。
针对上述问题,本文一方面从锥束CT解析重建理论出发,挖掘重建图像中的实、频域信息,设计包含一系列信号及图像处理算法的伪影修正工作流,对包含伪影的腹腔锥束CT影像进行处理,避免运动监测的精度和复杂度问题以及运动模型估计的误差问题。另一方面,本文按照伪影的形态特征将腹腔锥束CT影像中的伪影划分为阴影和条状伪影并分别进行处理,实现来源和类型不同的呼吸运动和肠道蠕动的同时处理,避免常规伪影修正方法中无法直接获取肠道运动模型的难题。
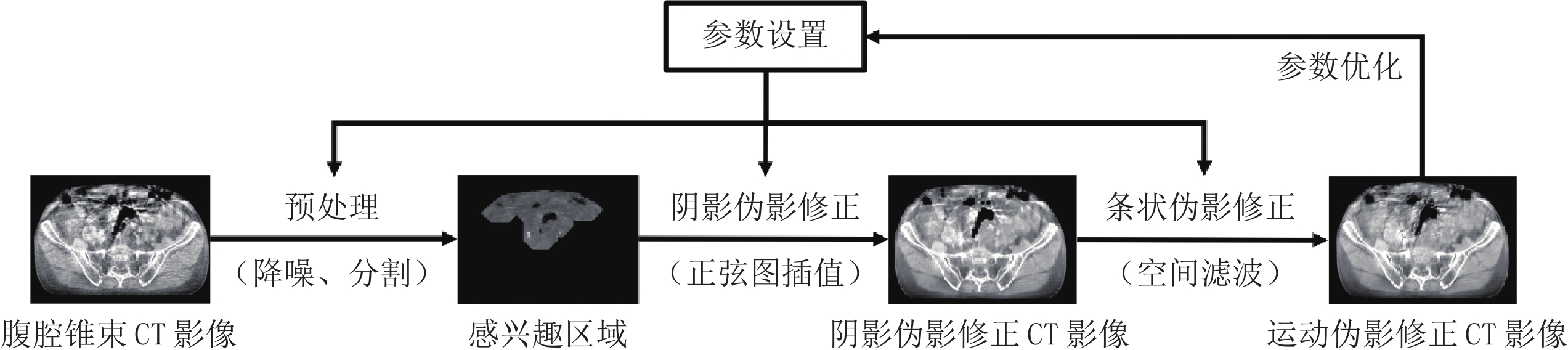
1. 运动伪影修正图像处理流程
针对胰腺癌放疗图像引导锥束CT运动伪影修正问题,本文设计的图像处理流程图如图2所示。首先进行数字模体仿真实验和临床诊断影像的特征分析,结合腹腔器官动力学和人体生理学经验知识,建立运动伪影的图像特征和运动种类及定量参数间的关系,并以此为基础选取降噪、分割、正弦图插值、空间滤波等操作的初始参数。接着对腹腔锥束CT影像进行预处理:先进行CT图像域降噪,其中注意保持边界;再进行腹腔区域分割,即在CT影像中去除病床、衣物等干扰信息。然后在经过粗分割的腹腔区域中根据各器官的一般线衰或CT值进行第2次图像分割,分离出高对比度的肠道空腔区域(最暗)和类骨结构区域(最亮);在此基础上针对肠道空腔区域邻域进行基于正弦图插值的阴影伪影修正,并针对肠道空腔和类骨结构区域的更大邻域进行基于空间滤波的条状伪影修正。另外在运动伪影已经严重影响感兴趣区域分割结果的情况下,需要从修正后的CT影像中重新提取感兴趣区域并进行上述操作。
预处理的目标是为后续感兴趣区域分割提供更高质量的CT影像,并排除病床、衣物影像等干扰因素。预处理流程主要包括降噪和分割两部分。为在降噪的同时保持感兴趣区域的边界,采用基于块匹配的滤波方法[26](block-matching 3D filtration,BM3)进行降噪。由于腹腔区域的外轮廓(皮肤)一般不会受到运动伪影影响,边界锐度较好,降噪后的CT影像利用主动轮廓法经过少量迭代运算即可快速收敛到腹腔区域轮廓(一般近似椭圆)。在预处理中如果发现锥束CT影像中散射污染严重,则需要进行基于模板图的快速图像域散射修正,这里的模板图就是上述主动轮廓法分割的结果。
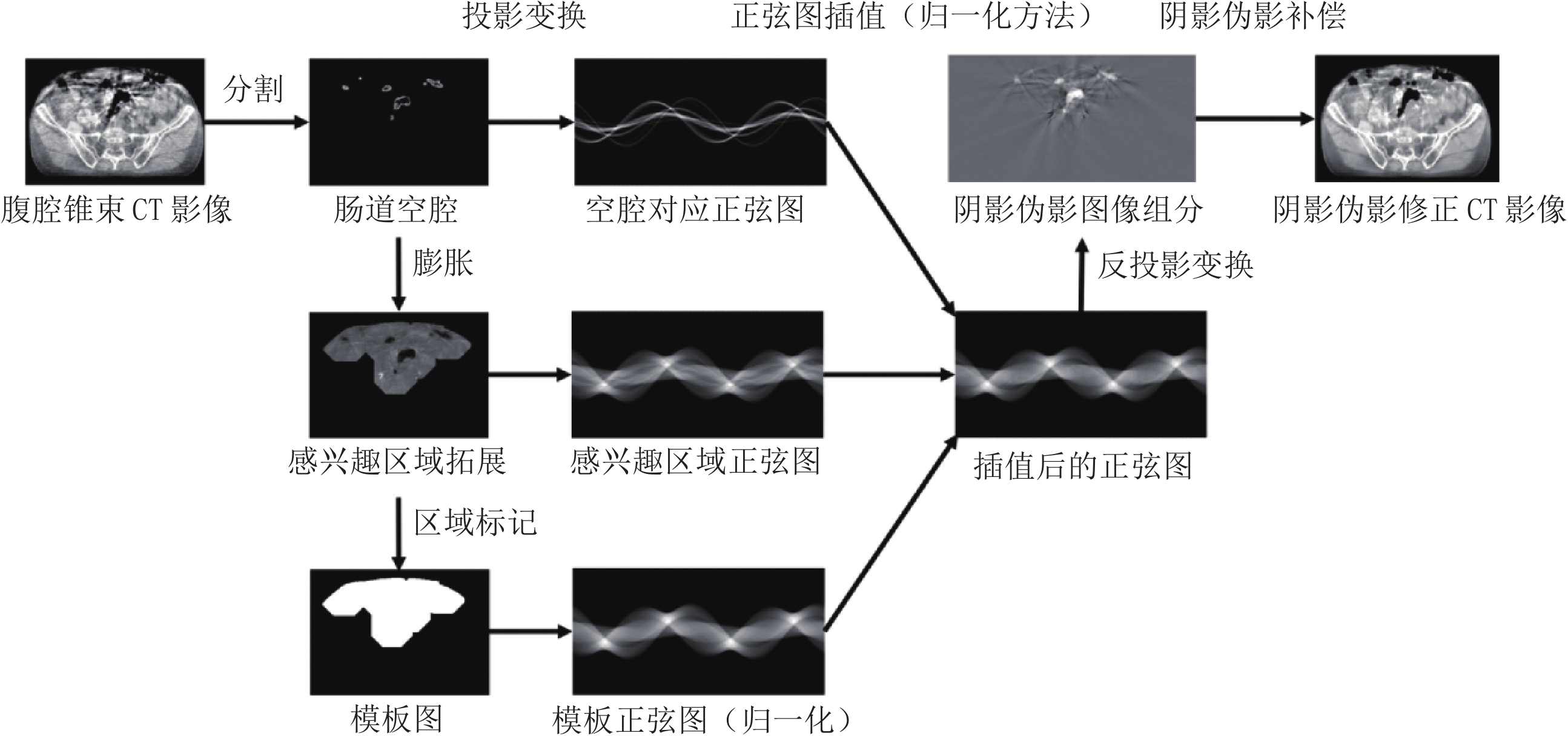
阴影伪影修正算法流程如图3所示,核心操作是归一化后的正弦图插值。首先利用阈值或分水岭等常规方法进行肠道空腔区域分割,并通过图像形态学膨胀操作获得拓展的感兴趣区域,再通过二值化操作获得区域标记,并将该区域重新赋值为常数,该常数选取为该区域所有非零像素值的中位数,得到模板图。接着通过正向投影算法获得肠道空腔区域、感兴趣区域、以及模板图对应的正弦图,在处理单层CT图像时可简化为扇束位形,直接应用Radon变换。其中考虑到正弦图上直接插值会因为数值不连续导致新的伪影出现,在插值前需要进行正弦图的逐点归一化操作,其归一化参数因子来源于模板图对应的正弦图。采用二维线性插值方法处理归一化后的正弦图,并在插值结果中补回归一化参数因子即可利用Radon逆变换或解析重建得到阴影伪影修正后的CT影像。
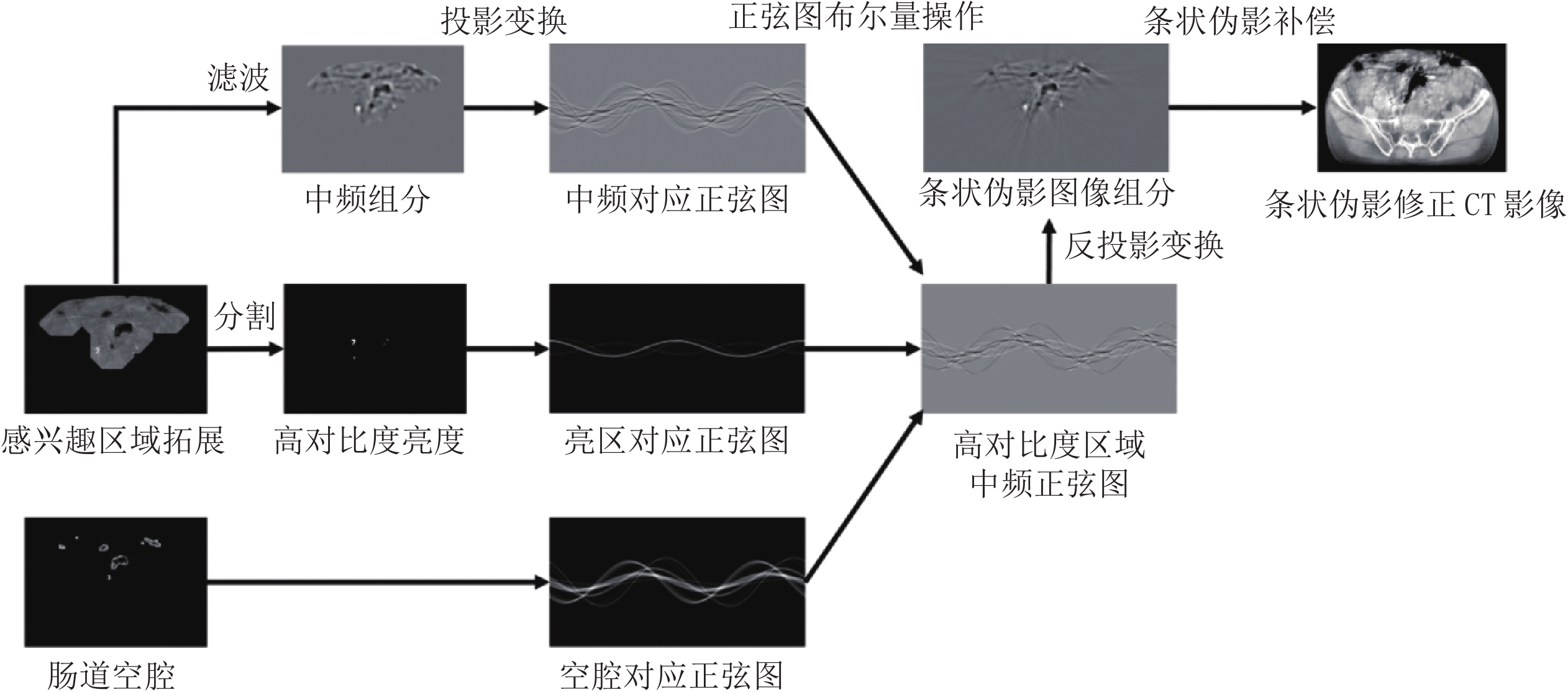
条状伪影修正算法流程如图4所示,除了获得虚拟投影数据的投影变换外,主要包括空间带通滤波以及正弦图的布尔量操作。首先需要对条状运动伪影的形态特征进行统计分析,得出其代表性的特征是在空间频率域呈现中频分布特征;接着设计空间窄带滤波器提取条状伪影对应形态图,并利用正弦图布尔量操作进一步提取条状伪影对应区域;最后在修正前图像上直接扣除条状伪影对应图像即可得到条状伪影修正结果。
2. CT图像处理结果与分析
2.1 CT影像数据来源说明
本文处理的临床CT影像数据来源于2015至2018年间浙江大学医学院附属邵逸夫医院放疗科胰腺癌患者在放疗前为辅助摆位而进行的日常锥束CT扫描,同一患者在锥束CT扫描前2天内进行的计划CT扫描获得的高质量CT影像用于参考。其中锥束CT扫描采用美国瓦里安公司Trilogy放疗机上配备的OBI锥束CT系统的胸腹腔半扇大视野模式,计划CT扫描采用德国西门子公司的Somatom系列CT机的腹腔模式。本文处理的影像数据来源包括2例患者的腹腔锥束CT和计划CT扫描数据,其中锥束CT的主要扫描参数如表1所示。
表 1 Trilogy放疗机OBI锥束CT系统的扫描参数Table 1. Scan parameters of the OBI CBCT system on Trilogy radiotherapy device扫描参数名 参数值 源到探测器距离(SID)/mm 1501 源到转轴距离(SAD)/mm 1000 探测器水平偏移量/mm 148 扫描电压/kVp 125 扫描电流/mA 80 扫描模式 腹腔、半扇 投影角数量 663 2.2 图像处理结果
经过本文设计的运动伪影修正工作流处理,阴影和条状等形态的运动伪影得到显著抑制,且噪声水平有明显改善。
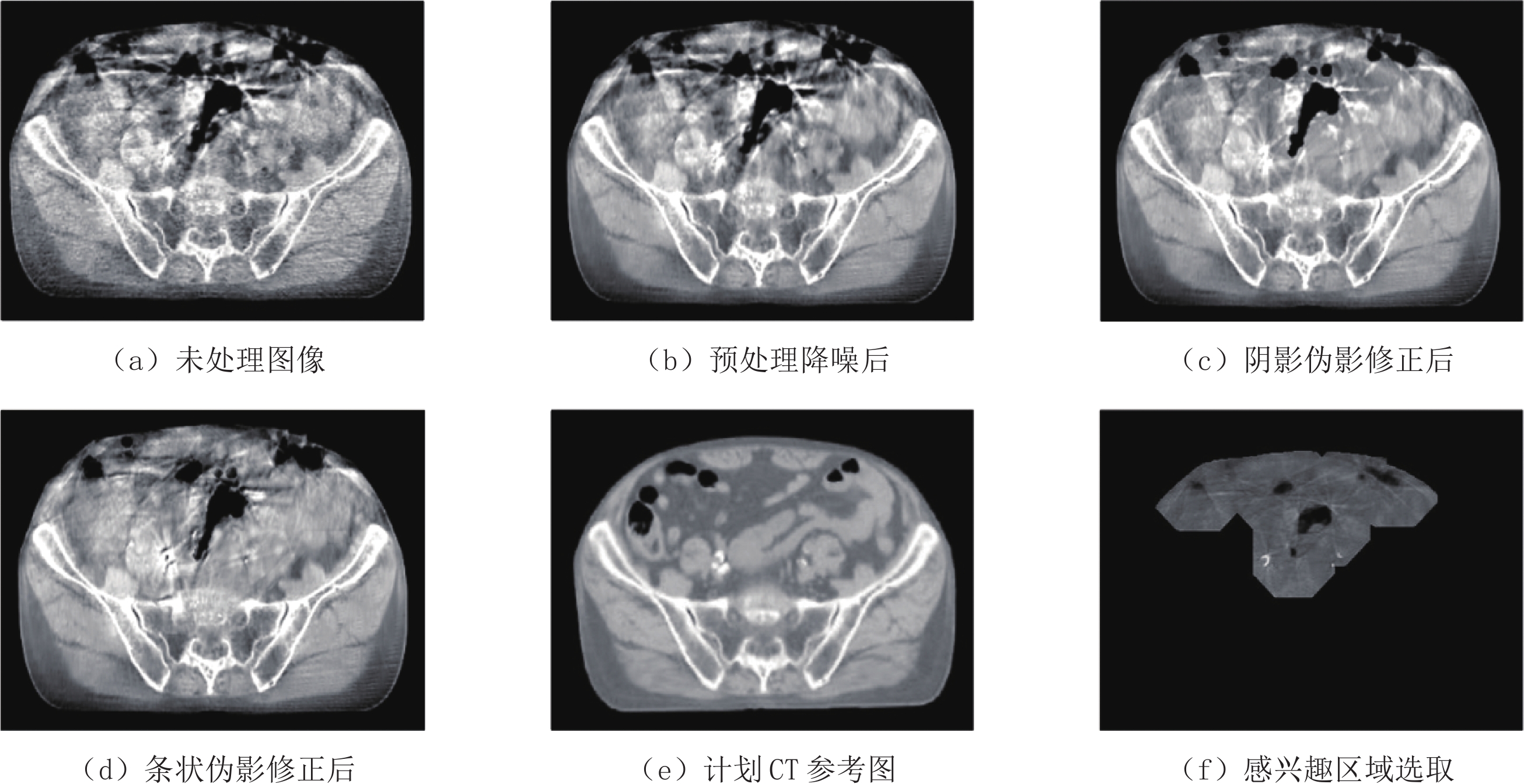
图5是锥束CT单层横断面图像经过流程处理的中间结果以及和计划CT参考图的对比。预处理降噪显著抑制噪声水平,对于图5(f)给出的感兴趣区域进行分析,发现降噪后峰值信噪比(peak signal-to-noise ratio,PSNR)提升约15 dB。进一步经过阴影伪影和条状伪影修正,相较于经过配准的计划CT参考图,结构相似性 (structural similarity,SSIM)从0.844提升至0.939,感兴趣区域CT数的平均绝对值误差(Mean absolute error,MAE)从约92 HU降低至约34 HU,而均方根误差(root mean square error,RMSE)从约99 HU降低至约43 HU。经过处理,处理前的完全淹没在噪声和伪影中的肠道空腔边界和肠道周边软组织结构得到部分恢复。表2列出了锥束CT运动伪影修正前后的关键图像指标的对比结果。
表 2 腹腔锥束CT运动伪影修正后图像质量指标变化Table 2. Changes in image quality indicators before and after abdominal CBCT motion artifact correction图像质量指标 修正前 修正后 整体图像PSNR/dB 41.562 61.110 感兴趣区域PSNR/dB 47.593 62.263 整体图像SSIM 0.844 0.939 感兴趣区域CT数MAE/HU 92.348 33.762 感兴趣区域CT数RMSE/HU 98.986 42.873 图6是同一位患者腹腔锥束CT矢状位视图中的运动伪影修正效果,红色虚线框指示了伪影问题较为严重的肠道空腔及周边区域。经过修正,肠道空腔边界清晰可见,且周边软组织中的高频条状伪影得到显著抑制。
图7是另一位患者腹腔锥束CT横断面和矢状位视图中的运动伪影修正效果,红色虚线框指示了伪影问题较为严重的肠道空腔及周边区域。降噪处理后,皮下脂肪和肌肉之间的组织边界更清晰。进一步修正后,肠道空腔边界得到部分恢复,且条状伪影得到显著抑制。
3. 讨论
经过数字模体仿真实验发现腹腔锥束CT影像中运动伪影的重要来源是肠道空腔的蠕动,包括放缩以及平移两种主要运动形式。通过模体图像和临床CT图像分析,运动伪影形态也包含阴影和条状两种,且均分布在肠道空腔周边。因此,本文设计的运动伪影修正方法的关键步骤是肠道空腔区域的准确分割,故分割操作是在预处理降噪后进行。但在运动显著、运动伪影严重的情况下,降噪后通过阈值等方法进行分割时仍可能出现较大偏差,此时需要在第1轮伪影修正操作结束后再从处理后的结果得到更为准确的肠道空腔区域分割模板,并在预处理降噪图像上重新应用新分割结果进行伪影修正。此外若不同肠道空腔间隔很近时,不同空腔运动引入的伪影将出现强耦合,也将显著影响空腔区域的分割精度,此时可先结合计划CT高质量参考图像非刚性配置到锥束CT的方式辅助判断空腔区域的实际位置、形状和数量,对空腔区域分割结果手动修正后再进行伪影修正。
本文提出的处理流程中针对阴影和条状伪影分别设计了修正操作,这两项操作的顺序不能颠倒。阴影伪影修正中主要涉及到正弦图插值操作,而条状伪影修正则是空间滤波操作。若先进行滤波操作会导致图像的高频信息缺失,影响插值操作对象的数据完整性。
正弦图插值操作中归一化是关键步骤,在正弦图插值操作中归一化方案的选取分别进行了中位数、平均值以及最大值和最小值的测试,其中利用基于中位数的模板图进行归一化后的插值修正效果最优。中位数方案中归一化正弦图中的数值相对于1的分布更为对称,有助于获得更准确的插值结果。当肠道空腔区域靠近皮肤(人体边界)时,阴影伪影修正中的关键正弦图插值修复操作中需要进行外插,则插值精度和正弦图修复效果将受到影响。此时需要对于插值操作所选用的区域进行非对称设计,即不包含皮肤以及皮肤以外的区域,而在空腔另一侧加入更多的非空腔区域。因此,通过形态学操作中的参数优化调整可以避免外插问题,保证当肠道空腔区域靠近皮肤边界时的伪影修正效果。
由于运动估计难,肠道蠕动为自发不规则运动等问题,目前仍缺乏针对腹腔锥束CT扫描中的运动伪影问题的有效修正方法,经过以腹腔锥束CT运动伪影修正为主题的文献检索,2021年Peterlik等[23]应用梯度权重迭代优化方法,对于不同幅度的运动分别将平均CT数误差从72.1 HU和136 HU降低为36.1 HU和56 HU,但难以实现肠道空腔边界的还原以及肠道周边软组织结构的恢复。本文提出的方法对于肠道周边的伪影修正效果更优,且根据针对不同腹腔锥束CT影像数据集分别的定量指标评估,对于软组织区域的平均CT数误差修正能力和Igor Peterlik的方法在同一数量级。
在上述讨论基础上,本文提出的处理流程可以满足伪影更严重、肠道空腔区域位形更复杂的情况下的伪影修正需求,有助于在胰腺癌图像引导放疗任务中提升锥束CT影像质量。
4. 结论
胰腺癌放疗图像引导锥束CT成像通常需要30 s以上的扫描时间,呼吸运动和肠道蠕动叠加到柔软脏器后造成显著的位移和非刚性形变,在锥束CT影像中对应以阴影和条状形态为主的运动伪影问题,且由于肠道蠕动无法进行准确的实时运动监测导致难以实现基于实时轨迹的伪影修正。相应地,本文建立的锥束CT运动伪影修正工作流包括:①三维 CT图像块匹配降噪;②建立正向投影模型,获得虚拟投影图;③基于肠道分割和正弦图插值的阴影伪影修正;④基于频域空间滤波和插值的条状伪影修正;⑤基于图像处理并行加速的算法效率优化;⑥修正参数优化和效果评估。
本文针对胰腺癌放疗图像引导锥束CT运动伪影修正难题,提出一种基于数字图像处理技术的高效图像域处理方案。经过本文参数优化后的预处理降噪、阴影伪影修正、条状伪影修正等一系列操作处理,伪影和噪声问题得到全面改善,肠道空腔的边缘和周边软组织解剖细节得到部分恢复,将有助于提升放疗前锥束CT扫描的图像质量,方便胰腺肿瘤的定位。由于本文提出的伪影修正方案完全在图像域进行图像处理操作,不依赖额外先验知识,且无需修改成像系统硬件、调整成像协议、或增加剂量,可直接嵌入现有临床扫描工作流中作为高效后处理方案,适应性和实用性强,将驱动锥束CT在放疗科现有摆位验证常规应用外的拓展。
-
表 1 Trilogy放疗机OBI锥束CT系统的扫描参数
Table 1 Scan parameters of the OBI CBCT system on Trilogy radiotherapy device
扫描参数名 参数值 源到探测器距离(SID)/mm 1501 源到转轴距离(SAD)/mm 1000 探测器水平偏移量/mm 148 扫描电压/kVp 125 扫描电流/mA 80 扫描模式 腹腔、半扇 投影角数量 663 表 2 腹腔锥束CT运动伪影修正后图像质量指标变化
Table 2 Changes in image quality indicators before and after abdominal CBCT motion artifact correction
图像质量指标 修正前 修正后 整体图像PSNR/dB 41.562 61.110 感兴趣区域PSNR/dB 47.593 62.263 整体图像SSIM 0.844 0.939 感兴趣区域CT数MAE/HU 92.348 33.762 感兴趣区域CT数RMSE/HU 98.986 42.873 -
[1] SIEWERDSEN J H, JAFFRAY D A. Cone-beam computed tomography with a flat-panel imager: Magnitude and effects of X-ray scatter[J]. Medical Physics, 2001, 28(2): 220−231. doi: 10.1118/1.1339879
[2] JAFFRAY D A, SIEWERDSEN J H, WONG J W, et al. Flat-panel cone-beam computed tomography for image-guided radiation therapy[J]. International Journal of Radiation Oncology, Biology, Physics, 2002, 53(5): 1337−1349. doi: 10.1016/S0360-3016(02)02884-5
[3] SABEL M. First results with the varian on-board imager (TM)[J]. Strahlentherapie und Onkologie, 2005: 181.
[4] ABBAS H, CHANG B, CHEN Z J. Motion management in gastrointestinal cancers[J]. Journal of Gastrointestinal Oncology, 2014, 5(3): 223−235.
[5] MURPHY M J, MARTIN D, WHYTE R, et al. The effectiveness of breath-holding to stabilize lung and pancreas tumors during radiosurgery[J]. International Journal of Radiation Oncology, Biology, Physics, 2002, 53(2): 475−482. doi: 10.1016/S0360-3016(01)02822-X
[6] SONKE J J, ZIJP L, REMEIJER P, et al. Respiratory correlated cone beam CT[J]. Medical Physics, 2005, 32(4): 1176−1186. doi: 10.1118/1.1869074
[7] LI T F, XING L, MUNRO P, et al. Four-dimensional cone-beam computed tomography using an on-board imager[J]. Medical Physics, 2006, 33(10): 3825−3833. doi: 10.1118/1.2349692
[8] DIETRICH L, JETTER S, TUCKING T, et al. Linac-integrated 4D cone beam CT: First experimental results[J]. Physics in Medicine and Biology, 2006, 51(11): 2939−2952. doi: 10.1088/0031-9155/51/11/017
[9] SONKE J J, ROSSI M, WOLTHAUS J, et al. Frameless stereotactic body radiotherapy for lung cancer using four-dimensional cone beam CT guidance[J]. International Journal of Radiation Oncology, Biology, Physics, 2008, 74(2): 567−574.
[10] BISSONNETTE J P, FRANKS K N, PURDIE T G, et al. Quantifying interfraction and intrafraction tumor motion in lung stereotactic body radiotherapy using respiration-correlated cone beam computed tomography[J]. International Journal of Radiation Oncology, Biology, Physics, 2009, 75(3): 688−695. doi: 10.1016/j.ijrobp.2008.11.066
[11] SHIEH C C, KIPRITIDIS J, O'BRIEN R T, et al. Image quality in thoracic 4D cone-beam CT: A sensitivity analysis of respiratory signal, binning method, reconstruction algorithm, and projection angular spacing[J]. Medical Physics, 2014, 41(4): 041912.
[12] STEINER E, SHIEH C C, CAILLET V, et al. 4-Dimensional cone beam computed tomography-measured target motion underrepresents actual motion[J]. International Journal of Radiation Oncology, Biology, Physics, 2018, 102(4): 932−940. doi: 10.1016/j.ijrobp.2018.04.056
[13] SHIMOHIGASHI Y, TOYA R, SAITO T, et al. Tumor motion changes in stereotactic body radiotherapy for liver tumors: An evaluation based on four-dimensional cone-beam computed tomography and fiducial markers[J]. Radiation Oncology, 2017, 12(1): 61.
[14] TOYA R, SAITO T, SHIMOHIGASHI Y, et al. Four-dimensional cone-beam computed tomography-guided radiotherapy for gastric lymphoma[J]. Japanese Journal of Radiology, 2018, 36(2): 159−163. doi: 10.1007/s11604-017-0698-8
[15] JIN P, HULSHOF M C C M, van WIERINGEN N, et al. Interfractional variability of respiration-induced esophageal tumor motion quantified using fiducial markers and four-dimensional cone-beam computed tomography[J]. Radiotherapy and Oncology, 2017, 124(1): 147−154. doi: 10.1016/j.radonc.2017.05.015
[16] OHIRA S, ISONO M, UEDA Y, et al. Assessment with cone-beam computed tomography of intrafractional motion and interfractional position changes of resectable and borderline resectable pancreatic tumours with implanted fiducial marker[J]. British Journal of Radiology, 2017, 90(1072): 20160815.
[17] MARCHANT T E, PRICE G J, MATUSZEWSKI B J, et al. Reduction of motion artefacts in on-board cone beam CT by warping of projection images[J]. British Journal of Radiology, 2011, 84(999): 251−264. doi: 10.1259/bjr/90983944
[18] MARCHANT T E, SKALSKI A, MATUSZEWSKI B J. Automatic tracking of implanted fiducial markers in cone beam CT projection images[J]. Medical Physics, 2012, 39(3): 1322−1334. doi: 10.1118/1.3684959
[19] WANG M J, SHARP G C, RIT S, et al. 2D/4D marker-free tumor tracking using 4D CBCT as the reference image[J]. Physics in Medicine and Biology, 2014, 59(9): 2219−2233. doi: 10.1088/0031-9155/59/9/2219
[20] ZACHIU C, de SENNEVILLE B D, TIJSSEN R H N, et al. Non-rigid CT/CBCT to CBCT registration for online external beam radiotherapy guidance[J]. Physics in Medicine and Biology, 2018, 63(1): 015027.
[21] LIU J L, ZHANG X, ZHANG X Q, et al. 5D respiratory motion model based image reconstruction algorithm for 4D cone-beam computed tomography[J]. Inverse Problem, 2015, 31(11): 115007. doi: 10.1088/0266-5611/31/11/115007
[22] ZHANG H, MA J H, BIAN Z Y, et al. High quality 4D cone-beam CT reconstruction using motion-compensated total variation regularization[J]. Physics in Medicine and Biology, 2017, 62(8): 3313−3329. doi: 10.1088/1361-6560/aa6128
[23] PETERLIK I, STRZELECKI A, LEHMANN M, et al. Reducing residual-motion artifacts in iterative 3D CBCT reconstruction in image-guided radiation therapy[J]. Medical Physics, 2021, 48(10): 6497−6507. doi: 10.1002/mp.15236
[24] VOOGT J, de BOIS J, van HERK M, et al. Cone beam CT motion artifact reduction by projection image selection[C]//University of Toronto. Proceedings of the XVth International Conference on the Use of Computers in Radiation Therapy (ICCR 2007), Toronto, Canada, 2007: 13-17.
[25] NIJKAMP J, VOOGT J, DE BOIS J, et al. Improved automatic prostate localization after cone beam CT motion artefact reduction[J]. Radiotherapy and Oncology, 2008, 88: S108−S. doi: 10.1016/j.radonc.2007.10.030
[26] MÄKINEN Y, AZZARI L, FOI A. Collaborative filtering of correlated noise: Exact transform-domain variance for improved shrinkage and patch matching[J]. IEEE Transactions on Image Processing, 2020, 29: 8339−8354. doi: 10.1109/TIP.2020.3014721
-
期刊类型引用(2)
1. 倪剑刚. 多层螺旋CT多期扫描对胰腺癌的诊断价值评价. 影像研究与医学应用. 2024(06): 128-130 .  百度学术
百度学术
2. 李牧,李倩,柯熙政,陶启婷. 基于两阶段运动伪影消除的心率检测算法. 计算机应用. 2023(S1): 333-339 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: