Analysis of Spiral CT Phenotypes and Features of Primary Intestinal Lymphoma
-
摘要: 目的:探讨原发性肠道淋巴瘤(PIL)的CT表现,以提高该病的影像诊断和鉴别水平。方法:收集北京医院从2013年3月至2022年2月的21例经病理证实的PIL患者资料,分析其CT表型及特征表现。结果:21例PIL均为非霍奇金淋巴瘤(NHL);12例为弥漫大B细胞淋巴瘤(DLBCL),3例为滤泡性淋巴瘤,2例为NK/T细胞淋巴瘤,2例为T细胞性淋巴瘤,黏膜相关淋巴组织淋巴瘤(MALT)和套细胞淋巴瘤(MCL)各1例;病变位于结肠7例,回肠5例,小肠系膜4例,回盲部2例,空肠1例,直肠1例,1例累及右半结肠和回盲部。CT检查显示,肠壁环周浸润型3例,肠壁增厚型3例,肿块型4例,动脉瘤样扩张型7例,肠系膜多发结节型4例。CT增强多表现为均匀的轻中度强化;21例患者中,2例合并肠穿孔,2例合并肠梗阻。结论:PIL的特征CT表现包括肠管多节段受累、肠壁局限性或弥漫性明显增厚、肠腔动脉瘤样扩张、偏心性密度均匀的肠腔肿块以及肠系膜“夹心面包征”,认识这些征象有助于提高对原发性肠道淋巴瘤的诊断。Abstract: Objective: To investigate the CT manifestations of primary intestinal lymphoma (PIL) so as to improve the diagnosis and differential diagnosis. Methods: 21 patients with PIL confirmed pathologically in our hospital from March 2013 to February 2022 were enrolled in this study, their CT phenotypes and features were analyzed. Results: All 21 cases of PIL were non-Hodgkin's lymphoma (NHL), 12 cases were diffuse large B-cell lymphoma (DLBCL), 3 cases were follicular lymphoma, 2 cases were NK/T-cell lymphoma, 2 cases were T-cell lymphoma, mucosa-associated lymphoid tissue lymphoma (MALT) and mantle cell lymphoma (MCL) were identified 1 case each. The lesions were located in the colon in 7 cases, ileum in 5 cases, small intestine mesentery in 4 cases, ileocecum in 2 cases, jejunum in 1 case, rectum in 1 case, and both right hemicolon and ileocecum in 1 case. CT findings showed intestinal wall infiltration in 3 cases, intestinal wall thickening in 3cases, mass in 4 cases, aneurysmal dilation in 7 cases and mesenteric multiple nodules in 4 cases. CT enhancement mostly showed homogeneous mild/moderate enhancement. Among the 21 patients, 2 case was complicated by by intestinal perforation, and 2 cases were complicated by intestinal obstruction. Conclusion: The characteristic imaging features of CT in PIL include multifocal involvement of the intestines, marked mural thickening in a focal or diffuse manner, aneurysmal dilatation of lumen, eccentric intestinal mass of uniform density and mesenteric "sandwich sign". Recognition of these signs is of diagnostic value for primary intestinal lymphoma.
-
Keywords:
- spiral CT /
- lymphoma /
- intestinal neoplasms /
- pathology
-
恶性淋巴瘤是原发于淋巴结和(或)结外组织、器官的恶性肿瘤,约占全部恶性肿瘤的5%,包括霍奇金淋巴瘤(Hodgkin's lymphoma,HL)与非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)[1]。前者发病部位以淋巴结多见,后者主要累及部位以淋巴结外组织和器官多见,胃肠道是最常见的结外淋巴瘤发生部位,占结外淋巴瘤的30%~40%,占所有NHL的10%~15%[2]。
原发性肠道淋巴瘤(primary intestinal lymphoma,PIL)起源于肠壁粘膜下淋巴组织,由于该病临床症状无特异性,易导致误诊,提高诊断的准确率,尤其早期诊断对该病的治疗和预后具有重要临床意义。临床上,常用内镜活检作为确诊PIL的方法,但因该病原发于黏膜深层,内镜活检阳性率较低[3]。近年来,螺旋CT被广泛应用于腹部病变的检查,进而成为检出、诊断胃肠道淋巴瘤的重要手段之一。
本文回顾性总结分析21例PIL临床表现及CT影像资料,探讨其影像表现特征,以提高该病的早期诊断准确性。
1. 资料与方法
1.1 临床资料
选取2013年3月至2022年2月经手术或穿刺活检及病理确诊的21例原发性肠道淋巴瘤为研究对象,其中,男性12例,女性9例;年龄34~85岁,平均(67.5±11.6)岁。12例患者行CT平扫,8例患者行CT增强扫描,1例患者同时进行了CT平扫和增强扫描。临床症状为无明显诱因右下腹痛1例、腹痛12例,其中1例伴有发热、恶心、呕吐和贫血症状,腹部包块1例,纳差1例,无明显临床症状6例。
1.2 仪器与扫描方法
采用Discovery CT 750 HD(GE宝石)64排螺旋CT机进行腹盆腔平扫或 Ⅲ 期增强扫描。患者取仰卧位,扫描范围从膈顶至耻骨联合下缘。扫描参数:采用螺旋Helical扫描,层厚5.0 mm,重建间隔5.0 mm,扫描视野Largebody,重建视野350~400 mm,采集矩阵512×512,转速0.6 s/r,准直器宽40 mm(64×0.625 mm),螺距pitch=0.984︰1,管电压120 kV,采用智能管电流技术(Smart mA=200~600 mA),噪声指数12。
增强扫描,选用20 G静脉留置针于患者右臂肘正中静脉穿刺,对比剂选择次高渗非离子型碘对比剂碘海醇(北陆药业,350 mgI/mL),采用双桶高压注射器,A桶对比剂剂量1.1 mL/kg,注射流率3.0~3.5 mL/s,随后B桶以相同速率追加生理盐水30 mL。扫描期相:分别于注射对比剂后25~30 s、60 s、180 s采集动脉晚期、门静脉期及延迟期像。图像重建:薄层重建2.5 mm,间隔2.5 mm。
由两名资深腹部放射诊断医师对CT图像进行独立分析。观察并评价患者淋巴瘤位置、累及范围、形态、密度,肠腔有无狭窄、扩张,是否合并肠梗阻或肠穿孔;测量肿瘤平扫和增强阶段CT值,评价其强化程度;观察肿瘤有无局灶或多发淋巴结肿大和是否向周围侵犯。
2. 结果
2.1 病变部位及病理类型
根据病变范围将肠道淋巴瘤分为同一节段型和多发节段型[4]。本文21例中同一节段型占20例,其中结肠7例,回肠5例,小肠系膜4例,回盲部2例,空肠1例,直肠1例;多发节段型1例,连续累及右半结肠和回盲部。
21例PIL均为非霍奇金淋巴瘤,弥漫大B细胞淋巴瘤(DLBCL)12例(57.1%),滤泡性淋巴瘤3例(14.3%),T细胞性淋巴瘤2例(9.5%),NK/T细胞淋巴瘤2例(9.5%),B细胞黏膜相关淋巴组织淋巴瘤(MALT)1例(4.8%),套细胞淋巴瘤1例(MCL)(4.8%)。
2.2 肠道淋巴瘤的螺旋CT影像表型
12例平扫显示病灶9例密度均匀,3例密度不均匀(其中1例伴坏死、溃疡合并穿孔);受累肠管的长度约50~160 mm,肠壁明显增厚,其厚约7~62 mm,平扫CT值约28~43 HU。肠壁环周浸润1例,肠壁增厚2例,肠腔肿块1例,肠系膜肿块并伴发肠梗阻1例;肠腔狭窄3例,肠腔扩张7例;淋巴结肿大,部分融合成团(1.1~8.1 cm)6例,腹水2例。
8例CT增强扫描显示病灶区或病灶全层轻度至中度强化(均匀强化6例,不均匀强化2例),其中肠壁环周弥漫增厚1例、肠腔狭窄并伴有黏膜下浸润,不均匀强化;肠壁增厚1例,均匀强化;肠腔肿块3例,均匀强化,且不伴有肠梗阻;肠系膜区多发肿大淋巴结1例,均匀强化;空肠系膜区软组织肿块1例,不均匀强化;肠系膜区多发结节及肿块影1例,均匀强化,伴发肠梗阻,并伴有腹水。1例同时进行平扫和增强扫描,表现为肠壁环周弥漫增厚,管腔不规则狭窄,增强不均匀强化,并伴有肠穿孔。
回顾国外相关文献[4,14,22,26],原发性肠道淋巴瘤(PIL)有着多种形态及影像表现。本组PIL的影像分析及CT表现:
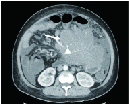
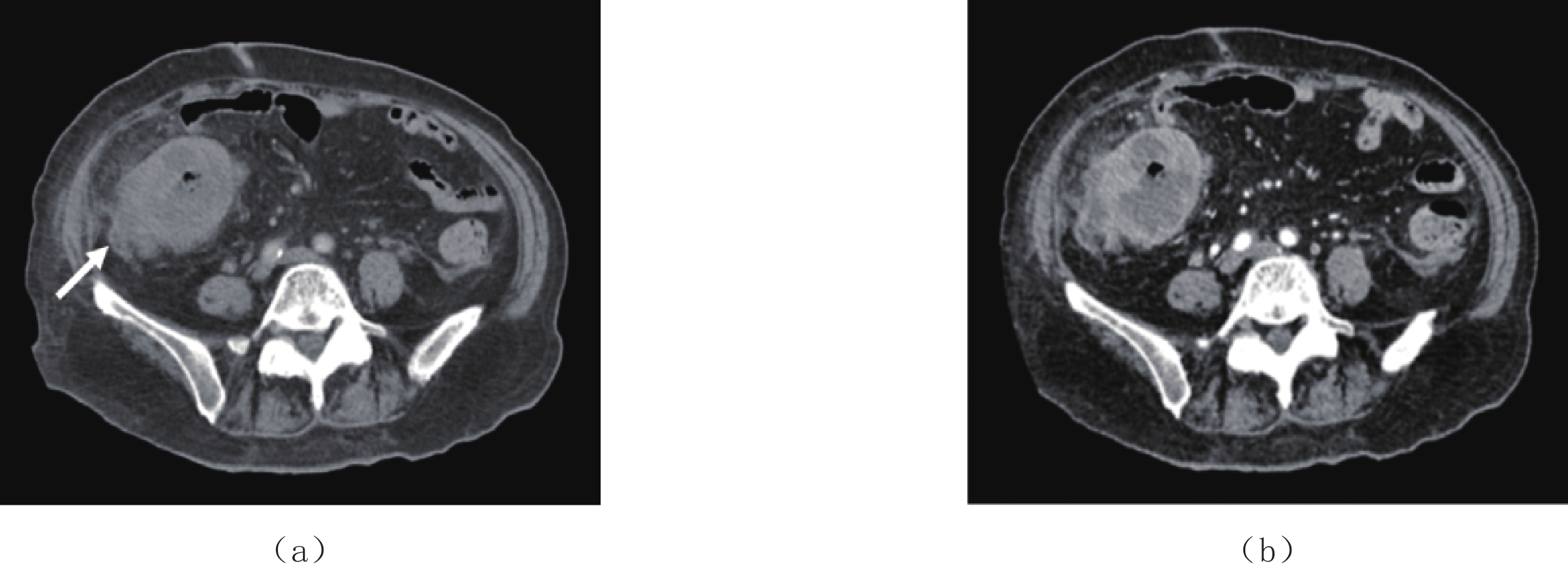
(1)肠壁浸润型或增厚型病灶,本组有6例。3例肠壁呈环周弥漫浸润生长,其中1例病变节段较长,最长累及范围为150 mm,边界清晰,密度欠均匀,伴有肠腔狭窄,周围腹腔脂肪模糊及多发条索影,伴系膜淋巴结多发肿大,周围可见少许积液征象(图1(a));CT增强可见升结肠病变肠壁环周弥漫性增厚,黏膜下浸润,呈不均匀中等强化(图1(b))。1例发生在阑尾部,阑尾肿大,全段充满软组织密度影,密度均匀,累及长度约85 mm(图2)。1例发生在回盲部,肠壁局限性增厚,黏膜线完整,累及长度为40 mm。1例发生在结肠部,升结肠中下段肠壁弥漫增厚,累及长度约160 mm,周围脂肪间隙见多发条索影伴系膜淋巴结肿大。
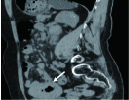
(2)肿块型病灶,本组有4例。3例位于结肠,其中1例见升结肠腔内肿块影,血管被肿瘤包绕,呈现血管穿行征(图3);1例位于直肠。
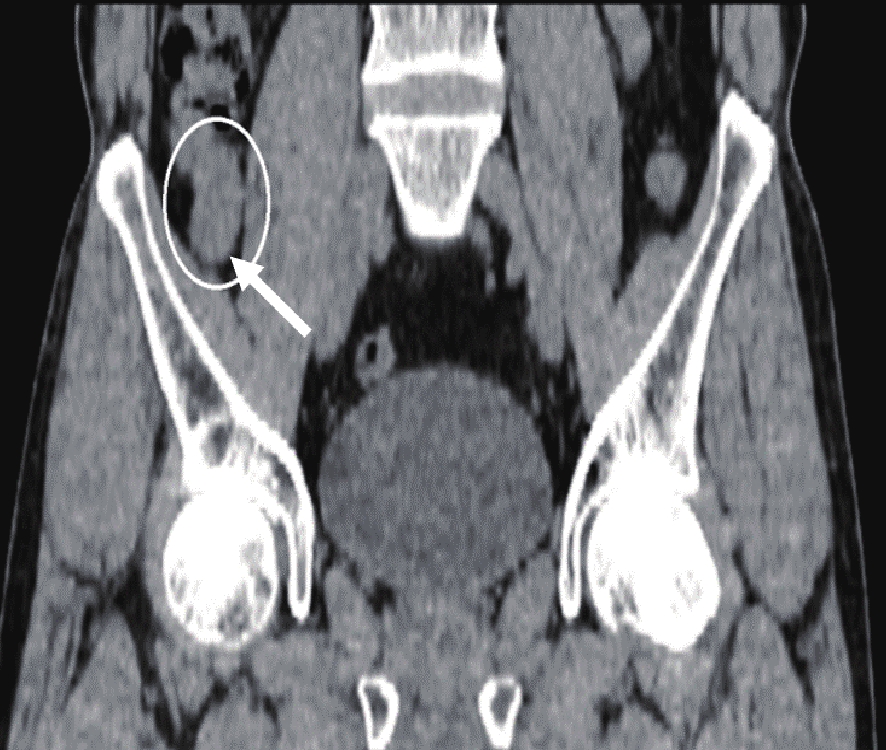
(3)动脉瘤样扩张型病灶,本组有7例。5例发生在回肠部,1例发生在空肠部,1例发生在回盲部。病变管腔呈动脉瘤样扩张,部分内可见气液平。其中1例发生于左下腹回肠部,肠壁明显增厚,呈动脉瘤样扩张,周围脂肪间隙可见少许条索影(图4)。
(4)肠系膜淋巴结型病灶,本组有4例。2例肠系膜区及腹膜后多发结节及肿块影,部分融合,密度均匀,伴有肠梗阻并发症状(图5);1例系膜区多发肿大淋巴结,最大者短径约15 mm,肠壁局限性增厚,壁外轮廓光整;1例腹腔空肠系膜区软组织肿块可见分叶、坏死和血管穿行征。
3. 讨论
3.1 原发性肠道淋巴瘤的临床与病理
不同病理亚型的淋巴瘤患者其性别比例及年龄分布是不近相同的,通常男性高于女性,发病年龄以中老年为主[5]。本组21例PIL中,平均年龄67.5岁,男女比例为1.3︰1,与近年国内外文献报道相符[6]。
PIL是起源于肠黏膜下淋巴组织的一种结外恶性淋巴瘤,其中大部分为非霍奇金淋巴瘤(NHL),少数为霍奇金淋巴瘤。文献报道[7]最常见的PIL病理类型为弥漫大B细胞淋巴瘤(DLBCL)和B细胞黏膜相关淋巴组织淋巴瘤(MALT),分别被认为是中高恶性度和低恶性度侵袭性淋巴瘤。其中,小肠最常见的病理亚型是DLBCL和MALT;大肠最常见的病理类型是MALT、MCL(套细胞淋巴瘤)、DLBCL和Burkitt(伯基特)淋巴瘤[8]。本组21个病例中DLBCL占到了57.1%,其他类型淋巴瘤则较少,与以往文献一致。
Wang等[9]对 81例原发性小肠NHL的临床症状分析显示,出现腹痛者约占75.3%,便血及腹泻次之,分别占25.9% 和16.9%,腹部包块、便秘、食欲减退较少见,穿孔罕见。Lightner等[10]对 28项有关原发性肠道非霍奇金淋巴瘤的原始研究进行系统评价,发现其临床表现中59.3% 的患者表现为腹部疼痛。本组患者以腹痛为首发症状者最多见(61.9%),与其他学者报道相符。
淋巴瘤是乳糜腹水的主要病因,其机制可能与膈下引流淋巴管和静脉侧支的淋巴瘤浸润有关[11]。累及肠道的T细胞淋巴瘤多伴有乳糜泻[7],本组有3例非霍奇金淋巴瘤伴有腹水。尽管肠穿孔是极少见的胃肠道淋巴瘤并发症,但PIL累及的肠管可见肠壁增厚、溃疡,甚至导致肠穿孔[7],最常见的穿孔部位是小肠,其次是大肠和胃[12]。本组1例穿孔发生于结肠,合并溃疡,考虑可能是由于其体积大,缺血性坏死的几率增高所致。弥漫性大B细胞淋巴瘤(DLBCL)最易于合并穿孔。与惰性B细胞淋巴瘤相比,侵袭性B细胞淋巴瘤或T 细胞的穿孔风险更高[12]。德国肠道NHL研究小组[13]同样报道了与B细胞淋巴瘤相比,T细胞淋巴瘤穿孔的发生率更高。本组各有1例T细胞淋巴瘤和弥漫大B细胞淋巴瘤患者出现肠穿孔现象。
3.2 原发性肠道淋巴瘤螺旋CT表现
结合文献[14]和本文21例患者PIL的CT表现,其主要表现特征包括肠壁弥漫浸润或肠壁增厚、肠腔内肿块、肠管扩张或狭窄、肠系膜和(或)腹膜后淋巴结肿大,继发表现则包括腹腔肠系膜脂肪密度模糊以及腹腔积液,即呈现4种CT表型:肠壁浸润型/肠壁增厚型、肿块型、动脉瘤样扩张型和肠系膜淋巴结型。
3.2.1 肠道淋巴瘤的CT表型
(1)肠壁浸润型/肠壁增厚型。是肠淋巴瘤最常见的类型,表现为节段性肠管对称或稍不对称性的环周肠壁增厚,增厚程度不一,增厚的肠壁皱襞扭曲或消失;肿瘤从黏膜层到浆膜层可扩展到整个肠壁,侵犯肠壁的深度可因粘膜下受累到跨壁延伸程度而不同[15]。同时,肿瘤累及肠壁长度的范围也较大,通常超过30 mm。增厚的肠壁外轮廓可以不规则,但内轮廓通常较光整,提示病变限于黏膜下浸润[16,22]。
(2)肿块型。病变可多发或单发,表现为肠腔内类圆形或分叶状软组织肿块,病灶密度较均匀,主体紧贴肠管一侧,可以继发肠腔变窄,但不易引起肠梗阻[5,16,22]。肿块样病变的特征性影像学表现是在黏膜下层可见一个密度均匀的实性结节,并以息肉样肿块的形式伸入管腔。通常没有壁增厚和/或淋巴结肿大,粘膜面完整[14]。
(3)动脉瘤样扩张型。肿瘤累及肠壁呈动脉瘤样扩张,近1/3的小肠淋巴瘤可见受累肠道的动脉瘤样扩张,其管腔扩张宽度大多超过4.0 cm,它通常伴随浸润型病变[15]。动脉瘤样扩张产生的机制可能是由于肌间神经丛的破坏或肌肉层的拉伸/浸润,肠壁收缩力丧失所致[17]。Korman[18]指出“动脉瘤样扩张征”是小肠淋巴瘤的特征性征象,表现为管壁不均匀明显增厚,管腔扩大,内壁光滑,形态固定,病变段肠管与上下正常肠管相通,无明显分界。
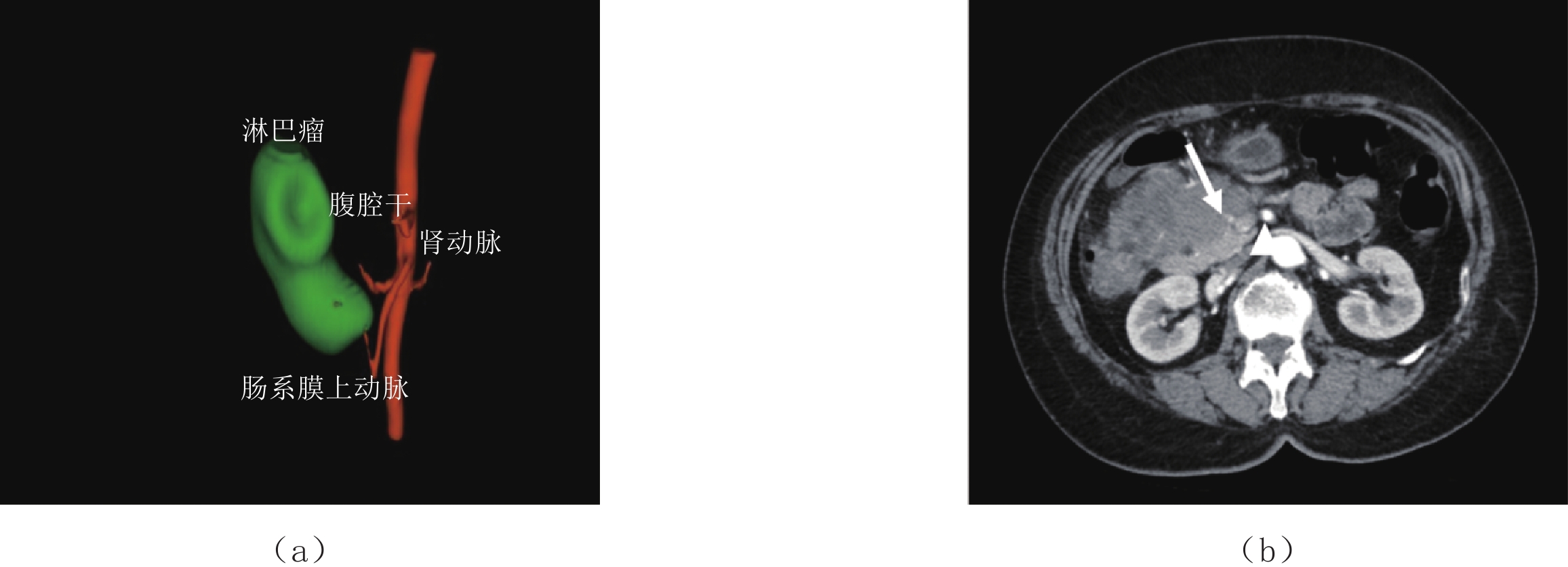
(4)肠系膜淋巴结型。起源于肠系膜淋巴结并直接侵犯小肠的淋巴瘤被归类为小肠淋巴瘤[19],其发生部位以回肠系膜最多,其次为空肠系膜及小肠系膜根部。CT表现为肠系膜区多发的、大小不等的、圆形椭圆形,或者形态不规则的均质软组织肿块或结节,少数病灶内有低密度坏死区,周围的肠系膜密度可轻度增高。CT增强检查病灶呈轻中度强化,常伴腹膜后淋巴结肿大。特别的,增强CT可显示软组织病变包埋显著强化的肠系膜血管和无强化的肠系膜脂肪,形成所谓的“三明治征”[20],为该型淋巴瘤的特征性CT表现。此外,与其他类型的PIL相比,肠系膜淋巴结型更易出现肠梗阻症状。
3.2.2 原发于不同部位的肠道淋巴瘤及其特点
(1)小肠淋巴瘤。淋巴瘤是小肠最常见的恶性肿瘤[21],占胃肠道淋巴瘤20%~30%,占所有小肠肿瘤的15%~20%[8]。回肠及回盲部被认为是小肠淋巴瘤最常发的部位,因为回肠末端含有相对更多的淋巴组织[25]。浸润型是小肠淋巴瘤最常见的影像学表型,多表现为肠壁增厚、肠袢分离、黏膜变形或消失以及管腔的狭窄或动脉瘤样扩张。对于小肠淋巴瘤来说,由于黏膜下肌间神经丛和固有肌层的浸润导致肠壁张力的丧失,故肠腔大块的扩张比狭窄更常见[22]。
(2)结直肠淋巴瘤。结直肠淋巴瘤占胃肠道淋巴瘤的6%~12%,结直肠原发性淋巴瘤占结肠所有肿瘤的0.4%[23]。原发性结直肠淋巴瘤好发于盲肠、回盲部瓣膜或直肠,而全身系统性淋巴瘤通常累及整个结肠或一长段结肠[24-25]。
原发性结直肠淋巴瘤可能以局部大的腔外肿块或肿块导致肠腔狭窄而被发现,并呈现出不同的影像学表型,这些表型包括巨大的息肉状肿块、局灶浸润性肿瘤和动脉瘤样扩张病变[26]。在CT上,大的息肉样肿块是最常见的原发性结直肠淋巴瘤表型,病变表现为直径在几毫米到20 cm之间表面光滑的孤立肿块影[22]。
结直肠淋巴瘤也可能表现为同心环周肠壁增厚病变或表现为外生性肿瘤、粘膜结节和肠壁局限性增厚;偶尔可见到局灶性管腔狭窄,动脉瘤样扩张,或溃疡伴瘘管形成[23]。结直肠淋巴瘤的环周浸润累及长段结肠,表现为肠腔的圆形变窄或局部肿块。尽管狭窄很明显,但由于缺乏促纤维增生反应和淋巴浸润导致固有肌层减弱、肠壁张力减低,故肠腔阻塞很少见[16]。不管是肿块样增厚还是不规则肿块,CT增强检查肿瘤仅呈轻-中度强化,这可能与肿瘤细胞密集堆聚于间质、血供较少有关[22]。其他CT影像学征象,包括边界清楚、脂肪平面保留、邻近结构不受累,容易伴发穿孔等,可能有助于结肠淋巴瘤的诊断[27]。
(3)阑尾淋巴瘤。结外淋巴瘤原发于胃肠道最常见,但原发于阑尾的淋巴瘤非常罕见。原发性阑尾淋巴瘤起病隐匿,缺乏早期特异性的影像学征象,常因转移性右下腹痛、压痛、反跳痛的症状和体征而误诊为阑尾炎。据统计,所有阑尾切除标本中有0.0015% 发生阑尾肿瘤,而阑尾淋巴瘤几乎都是非霍奇金型[28]。本组中只有1例阑尾非霍奇金淋巴瘤。阑尾淋巴瘤典型的CT表现为阑尾肿大,内充满均匀的软组织密度影,但阑尾的管状形态仍可见。在CT上,阑尾炎的诊断标准是直径超过6~7 mm;然而,对于其上限值并没有足够的影像数据支持。
既往文献报道[29]炎症阑尾(不合并肿瘤)在CT上的直径一般不超过15 mm,而淋巴瘤性的阑尾直径通常为30 mm或更大,依此可以对阑尾淋巴瘤做出推定诊断[30]。虽然与其他原发性阑尾肿瘤相比,阑尾淋巴瘤的CT表现特异性不高,但发现肿大的阑尾,非霍奇金淋巴瘤应考虑为主要鉴别诊断。
4. 鉴别诊断
原发性肠道淋巴瘤与以下疾病的鉴别。
(1)腺癌。腺癌CT表现为肠壁不规则增厚、管壁僵硬、管腔狭窄、常伴有坏死、溃疡形成,可有明显壁外浸润,浆膜层多受侵,增强多可见病变明显不均匀强化;而淋巴瘤肠壁虽为不规则增厚,但少见坏死,黏膜面通常较光整,并具有较好的浆膜状态[31],增强肠壁多数中等均匀强化,常伴有肠系膜和(或)腹膜后多发肿大的淋巴结;此外能谱CT在鉴别肠腺癌及肠道淋巴瘤两者之间也具有一定的参考价值。有文献提出[32]CT值测量和光谱曲线的斜率可用于区分小肠腺癌(small bowel adenocarcinoma,SBA)和原发性小肠淋巴瘤(primary small intestinal lymphoma,PSIL),SBA在光子能量40~60 keV的衰减值在AP和VP中均高于PSIL,对于鉴别诊断有一定意义。
(2)肠道间质瘤。间质瘤被视为具有恶性潜能的肿瘤,它可向腔内、腔外或腔内外同时生长。恶性者直径多大于5 cm,CT表现为肠壁偏心性类圆形或分叶状肿块,其内易坏死囊变出血;增强后,实体部分呈明显强化,部分病灶内可见明显增粗、紊乱的供血血管,极少见肠系膜或腹膜后肿大淋巴结[33]。相比之下,表现为肠腔内生长的肿块型淋巴瘤,肿块密度较均匀,增强后呈轻-中度均匀强化,其内可包绕一支较粗的血管,少见坏死、囊变,多伴有肠系膜和(或)腹膜后中等均匀强化的肿大淋巴结。
(3)肠结核。CT表现为病变区肠管不规则挛缩、变形、僵直,肠壁轻度向心性增厚伴分层;当邻近系膜区出现周边强化(提示干酪样坏死)的中空淋巴结、壁腹膜线样增厚伴强化、肠系膜污浊样改变及腹水时对肠结核的诊断具有指向作用[34]。而淋巴瘤肠壁多为单层偏心增厚,虽然病变累及范围节段长,但病变肠管仍保持一定的扩张度和柔软度,淋巴结多发肿大,常融合呈团块状,呈均匀性轻度强化。
(4)克罗恩病。CT常表现为节段性、多发性肠壁增厚;增强扫描示活动期肠壁可见分层样强化,呈“靶征”;慢性期肠壁纤维化明显,常表现为肠壁全层较均匀、规则的增厚,增强呈均匀一致的单层强化,范围较广泛,肠腔明显狭窄[34];此外,克罗恩病的肠系膜淋巴结大小一般在3~8 mm之间。而肠道淋巴瘤肠壁多见同心圆样增厚或是不规则明显增厚,累及范围相对较局限,肠腔狭窄多不明显,增强后较均匀强化,且肿大淋巴结表征突出,可作为原发性肠道淋巴瘤的鉴别点。
(5)肠道炎性纤维性息肉(inflammatory fibropolypus,IFP)。临床上,小肠是IFP的第2常见部位,结肠非常罕见。IFP多体积大、呈浸润性生长,但大多是良性的,CT表现可为边界清晰、圆形或卵圆形向腔内生长的软组织肿块,易导致肠套叠或肠梗阻[35]。而肠道淋巴瘤发生于小肠的病变主要表现为明显的壁增厚而非腔内息肉样肿块,常伴有淋巴结增大,且以肠壁增厚为主的病变少见肠梗阻。
5. 总结
综上所述,PIL具有特征性CT表现,肠壁增厚、肠腔肿块,粘膜层相对较光整、增厚的肠壁与正常肠壁逐渐移行,肠腔动脉瘤样扩张、肠系膜夹心面包征;增强CT病变肠腔内中等均匀强化肿块,累及肠壁及肿大淋巴结(轻)中度均匀强化。认识这些CT征象有利于原发性肠道淋巴瘤的正确诊断、指导治疗,具有重要的临床价值。
-
-
[1] DAWSON I, CORNES J S, MORSON B C. Primary malignant lymphoid tumours of the intestinal tract: Report of 37 cases with a study of factors influencing prognosis[J]. British Journal of Surgery, 2010: 49.
[2] BAUTISTA-QUACH M A, AKE C D, CHEN M, et al. Gastrointestinal lymphomas: Morphology, immunophenotype and molecular features[J]. Journal of Gastrointestinal Oncology, 2012, 3(3): 209−225.
[3] 汤伟, 张盛箭, 彭卫军. 原发性胃肠道淋巴瘤的多层螺旋CT表现[J]. 肿瘤影像学, 2014, 23(4): 290-293. TANG W, ZHANG S J, PANG W J. Multi-detector CT features of primary gastrointestinal lymphoma[J]. Oncoradiology, 2014, 23(4): 290-293. (in Chinese).
[4] RUBESIN S E, GILCHRIST A M, BRONNER M, et al. Non-Hodgkin lymphoma of the small intestine[J]. Radiographics a Review Publication of the Radiological Society of North America Inc, 1990, 10(6): 985−998. doi: 10.1148/radiographics.10.6.2259769
[5] 郭海东. 多层螺旋CT多平面重建技术在胃肠道淋巴瘤鉴别诊断中的应用[J]. 现代肿瘤医学, 2017,25(8): 1286−1289. DOI: 10.3969/j.issn.1672-4992.2017.08.030. GUO H D. Application of multi-slice spiral CT multi-planar reconstruction technique in the differential diagnosis of gastrointestinal lymphoma[J]. Journal of Modern Oncology, 2017, 25(8): 1286−1289. DOI: 10.3969/j.issn.1672-4992.2017.08.030. (in Chinese).
[6] 李晓光, 张蕾. MSCT对胃肠道淋巴瘤的诊断价值研究[J]. 医学影像学杂志, 2016,26(6): 1038−1041. LI X G, ZHANG L. The diagnostic value of multi-slice spiral CT plain scan and enhanced scan in the diagnosis of gastrointestinal lymphoma[J]. Journal of Medical Imaging, 2016, 26(6): 1038−1041. (in Chinese).
[7] LEWIS R B, MEHROTRA A K, RODRÍGUEZ P, et al. From the radiologic pathology archives: Gastrointestinal lymphoma: Radiologic and pathologic findings[J]. Radiographics a Review Publication of the Radiological Society of North America Inc, 2014, 34(7): 1934−1953. doi: 10.1148/rg.347140148
[8] ALVAREZ-LESMES J, CHAPMAN J R, CASSIDY D, et al. Gastrointestinal tract lymphomas[J]. Archives of Pathology & Laboratory Medicine, 2021, 145(12): 1585−1596.
[9] WANG G B, XU G L, LUO G Y, et al. Primary intestinal non-Hodgkin's lymphoma: A clinicopathologic analysis of 81 patients[J]. World Journal of Gastroenterology, 2011, 17(41): 4625−4631. doi: 10.3748/wjg.v17.i41.4625
[10] LIGHTNER A L, SHANNON E, GIBBONS M M, et al. Primary gastrointestinal non-Hodgkin's lymphoma of the small and large intestines: A systematic review[J]. Journal of Gastrointestinal Surgery, 2016, 20(4): 827−839. doi: 10.1007/s11605-015-3052-4
[11] HUFFORD S, HU E. Lymphoma and chylous ascites[J]. Western Journal of Medicine, 1988, 148(5): 581. doi: 10.1016/S0016-5085(19)35289-8
[12] VAIDYA R, HABERMANN T M, DONOHUE J H, et al. Bowel perforation in intestinal lymphoma: Incidence and clinical features[J]. Annals of Oncology Official Journal of the European Society for Medical Oncology, 2013, 24(9): 2439−2443. doi: 10.1093/annonc/mdt188
[13] DAUM S, ULLRICH R, HEISE W, et al. Intestinal non-Hodgkin's lymphoma: A multicenter prospective clinical study from the german study group on intestinal non-Hodgkin's lymphoma[J]. Journal of Clinical Oncology, 2003, 21(14): 2740−2746. doi: 10.1200/JCO.2003.06.026
[14] GIUSEPPE L R, FEDERICA V, FEDERICO M, et al. Corrigendum to "radiological features of gastrointestinal lymphoma"[J]. Gastroenterology Research and Practice, 2016, 2016: 1−9.
[15] KUMAR P, SINGH A, DESHMUKH A, et al. Imaging of bowel lymphoma: A pictorial review[J]. Digestive Diseases and Sciences, 2022, 67(4): 1187−1199. doi: 10.1007/s10620-021-06979-3
[16] LI M, ZHANG L, LIANG X, et al. Primary colorectal lymphoma: Computed tomography and double-contrast barium enema examination findings with histopathological correlation in 19 patients[J]. Annals of Translational Medicine, 2019, 7(14): 308. doi: 10.21037/atm.2019.06.32
[17] NORFRAY J, CALENOFF L, ZANON B. Aneurysmal lymphoma of the small intestine[J]. American Journal of Roentgenology: Radium Therapy & Nuclear Medicine, 1973, 119(2): 335−341.
[18] KORMAN M U. Radiologic evaluation and staging of small intestine neoplasms[J]. European Journal of Radiology, 2002, 42(3): 193−205. doi: 10.1016/S0720-048X(02)00034-7
[19] LEWIN K J, RANCHOD M, DORFMAN R F. Lymphomas of the gastrointestinal tract: A study of 117 cases presenting with gastrointestinal disease[J]. Cancer, 1978, 42(2): 693−707. doi: 10.1002/1097-0142(197808)42:2<693::AID-CNCR2820420241>3.0.CO;2-J
[20] HARDY S M. The sandwich sign[J]. Radiology, 2003, 226(3): 651−652. doi: 10.1148/radiol.2263020109
[21] SEROUR F, DONA G, BIRKENFELD S, et al. Primary neoplasms of the small bowel[J]. Journal of Surgical Oncology, 1992, 49(1): 29−34. doi: 10.1002/jso.2930490108
[22] ENGIN G, KORMAN U. Gastrointestinal lymphoma: A spectrum of fluoroscopic and CT findings[J]. Diagnostic & Interventional Radiology, 2011, 17(3): 255.
[23] CHOI D, LIM H K, LEE S J, et al. Gastric mucosa-associated lymphoid tissue lymphoma: Helical CT findings and pathologic correlation[J]. American Journal of Roentgenology, 2002, 178(5): 1117−1122. doi: 10.2214/ajr.178.5.1781117
[24] WATER J, CILLESSEN S, VISSER O J, et al. Enteropathy associated T-cell lymphoma and its precursor lesions[J]. Best Practice & Research Clinical Gastroenterology, 2010, 24(1): 43−56.
[25] RADHESHYAM D, BASU J, CHANDRA S, et al. Primary colorectal lymphoma[J]. Diseases of the Colon & Rectum, 2000, 43(9): 1277−1282.
[26] LEVINE M S, RUBESIN S E, PANTONGRAG-BROWN L, et al. Non-Hodgkin's lymphoma of the gastrointestinal tract: Radiographic findings[J]. American Journal of Roentgenology, 1997, 168(1): 165. doi: 10.2214/ajr.168.1.8976941
[27] GHAI S, PATTISON J, GHAI S, et al. Primary gastrointestinal lymphoma: Spectrum of imaging findings with pathologic correlation[J]. Radiographics, 2007, 27(5): 1371−1388. doi: 10.1148/rg.275065151
[28] 徐金娥, 石德峰, 孙吉瑞, 等. 临床表现为急腹症的阑尾套细胞淋巴瘤影像表现一例[J]. 中华放射学杂志, 2019,53(4): 319. DOI: 10.3760/cma.j.issn.1005?1201.2019.04.016. XU J E, SHI D F, SUN J R, et al. Mantle cell lymphoma of appendix presenting as acute abdomen: A case report[J]. Chinese Journal of Radiology, 2019, 53(4): 319. DOI: 10.3760/cma.j.issn.1005?1201.2019.04.016. (in Chinese).
[29] BIRNBAUM B A, WILSON S R. Appendicitis at the millennium[J]. Radiology, 2000, 215(2): 337−348. doi: 10.1148/radiology.215.2.r00ma24337
[30] PICKHARDT P J, LEVY A D, ROHRMANN C A, et al. Original report: Non-Hodgkin's lymphoma of the appendix: Clinical and CT findings with pathologic correlation[J]. American Journal of Roentgenology, 2002, 178(5): 1123−1127. doi: 10.2214/ajr.178.5.1781123
[31] 刘峰, 朱付立, 马长杰. 对比螺旋CT和MRI应用于胃淋巴瘤和肠道淋巴瘤患者中的诊断效果[J]. 影像研究与医学应用, 2020,4(21): 231−232. doi: 10.3969/j.issn.2096-3807.2020.21.132 [32] YANG C B, YU N, JIAN Y J, et al. Spectral CT imaging in the differential diagnosis of small bowel adenocarcinoma from primary small intestinal lymphoma[J]. Academic Radiology, 2019, 26(7): 878−884. doi: 10.1016/j.acra.2018.08.020
[33] 李志强, 岳贤文. 多层螺旋CT诊断胃肠道原发淋巴瘤与间质瘤的应用研究[J]. 影像研究与医学应用, 2018,2(23): 34−35. doi: 10.3969/j.issn.2096-3807.2018.23.018 [34] 陈虹燕, 杨丽. 克罗恩病肠结核及原发性肠道淋巴瘤的鉴别诊断研究进展[J]. 现代医药卫生, 2021,37(3): 432−435. doi: 10.3969/j.issn.1009-5519.2021.03.020 [35] HARNED R K, BUCK J L, SHEKITKA K M. Inflammatory fibroid polyps of the gastrointestinal tract: Radiologic evaluation[J]. Radiology, 1992, 182(3): 863−866. doi: 10.1148/radiology.182.3.1535909
-
期刊类型引用(3)
1. 卢振如,王婷. 成人肠道套细胞淋巴瘤合并回盲型肠套叠一例. 中国医学科学院学报. 2024(03): 458-461 .  百度学术
百度学术
2. 王婷,田松林,郑珂. MR小肠造影对肠道T细胞淋巴瘤与B细胞淋巴瘤的鉴别效能分析. 罕少疾病杂志. 2024(10): 95-97 .  百度学术
百度学术
3. 陈衍池. 超声诊断肠梗阻的价值分析. 中国医疗器械信息. 2023(14): 16-18+176 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: