Clinical and Multilayer Spiral CT Diagnosis of Colon Innervation Defect
-
摘要: 目的:分析结肠神经节缺乏症的多层螺旋CT(MSCT)的影像和临床表现,提高对结肠神经节缺乏症认识。方法:回顾性分析经手术病理证实的结肠神经节缺乏症患者临床以及MSCT影像资料。检查设备采用GE Discovery 750 HD宝石能谱CT和Philips Brilliance Ingenuity 128层多层螺旋,层厚1 mm,层间距1 mm,管电压120 kV,自动管电流,扫描范围自膈顶扫描至双侧耻骨联合下缘。在肠道自然状态下CT扫描(不做肠道准备,即不清洁灌肠和洗肠),扫描后在CT工作站进行MPR三维重建,在PACS系统存档分析。观察MSCT病变段肠管位置,分别测量扩张段和狭窄段肠壁厚度;对病理标本测量狭窄段(病变段)肠管长度;通过多期MSCT观察肠道蠕动情况;通过增强观察肠道血运情况;总结结肠神经节缺乏症患者的临床特征性表现。结果:结肠神经节缺乏症的临床特点表现为成年人长期的便秘和不完全性肠梗阻。本组5例成人结肠神经节缺乏症患者,病变部位分别位于结肠脾曲和降结肠,其中病变段为狭窄段肠管,扩张段结肠为次生继发性改变,病变段肠管位于降结肠3例,位于结肠脾曲2例;MSCT表现为病变段结肠相对狭窄和病变近端结肠扩张,影像特征表现为结肠扩张后狭窄;测量扩张段和狭窄段肠壁厚度:狭窄段病变区肠壁厚度正常,扩张段肠壁厚度正常或有所增厚,本组增厚的肠壁厚度小于0.9 cm;测量病变段肠管长度:本组病变段肠管长度介于4.3~8.6 cm之间;观察结肠血供和肠道功能情况:MSCT增强扫描肠系膜血管以及系膜密度均未见异常改变、病变段结肠肠壁无异常强化,提示扩张与狭窄段结肠血供正常;MSCT三期增强扫描显示病变段肠管僵直、无蠕动,提示病变段肠管蠕动功能丧失。结论:结肠神经节缺乏症具有结肠扩张后狭窄特征性的影像学表现和临床特点,MSCT结合临床资料能够在术前提示结肠神经节缺乏症的诊断。Abstract: Objective: To analyze the image performance of colon innervation defect with multilayer spiral CT (MSCT) and clinical manifestations, summarize its image characteristics and make correct diagnosis. Methods: The clinical features of colonic innervations deficiency present with prolonged constipation and incomplete ileus. MSCT imaging data using GE gem energy spectrum, CT 750 HD, and Philips MSCT. 1 mm layer thickness, 1 mm layer spacing, tube voltage, 120 kV, automatic tube current from the diaphragm to the bilateral pubic joint. Scan in the natural state of the intestine (No bowel preparation, no cleansing enema and bowel cleansing), after scanning, conduct MPR 3D reconstruction at the CT workstation, and the reconstructed data were archived and analyzed in the PACS system. Clarify the intestinal location of the diseased segment, measure intestinal wall thickness of dilated segment and narrow segment respectively; measure intestinal tube length of diseased segment (narrow segment); observe intestinal peristalsis with multiple-stage MSCT; and observe intestinal blood transport through enhancement. Results: The clinical features of colon innervations defect was constipation and incomplete ileus. In this study group, there were 5 adult patients with colon innervations defect, and the lesion site was located in the spleen and descending colon respectively, among which the diseased segment was located in 3 cases and the spleen was located in 2 cases of colon; MSCT shows relative narrowing of the colon and expansion of the proximal colon; The intestinal wall thickness was normal in the diseased area, and the intestinal wall thickness of the dilated colon section was normal or somewhat thickened, and the thickened intestinal wall in this group is less than 0.9 cm; The intestinal length of the diseased segment in this group was somewhere between 4.3~8.6 cm. The MSCT enhancement scan of mesangic vessels and mesangial density showed no abnormal changes, and no abnormal enhancement of the colon wall in the diseased section, suggesting normal blood supply; MSCT enhanced scan showed rigidity and no peristalsis in the diseased segment, suggesting loss of peristaltic function in the diseased segment. Conclusion: Colonic innervations defect has imaging findings of characteristic post dilating stenosis and clinical features of prolonged constipation and incomplete obstruction in adults, The MSCT combined with clinical data was able to indicate the diagnosis of colonic innervations defect before surgery.
-
结肠神经节缺乏症(colon innervation defect)在临床为少见病,术前诊断困难,其临床表现不典型;常以腹胀、腹痛、便秘和排便周期延长为主要临床表现;症状严重时可有恶心、呕吐症状,综合患者的病史均符合便秘和不完全性肠梗阻的临床特点;患者病程往往较长,部分患者病程长达5年;发病人群为成年人,以中老年人多见;临床误诊率较高[1-4],易误诊为缺血性肠病、中毒性巨结肠和结肠癌伴肠梗阻等疾病。
由于早期对结肠神经节缺乏症的认识不足,很多患者并没有明确诊断为结肠神经节缺乏症,也未得到恰当的临床治疗。了解肠壁神经节变性、缺乏所致成人结肠神经节缺乏症发病机制、临床表现以及影像特征,及时正确诊断以及对患者给予有效的治疗,使成人结肠神经节缺乏症患者获益。
1. 材料与方法
1.1 临床资料
收集我院2007年1月至2021年12月间手术病理证实的结肠神经节缺乏症患者5例,女性3例,男性2例,均为成年人,年龄51~78岁。收集汇总患者的临床资料、影像学资料以及手术病理结果。
1.2 MSCT检查方法
使用GE Discovery 750 HD宝石能谱CT和Philips Brilliance Ingenuity 128层多层螺旋CT,使用相同的扫描参数,层厚1 mm,层间距1 mm,管电压120 kV,自动管电流,扫描范围自膈顶扫描至双侧耻骨联合下缘。由于结肠神经节缺乏症患者结肠肠管大量食物残渣集聚,清洁灌肠效果不佳,反而导致肠腔大量积气反而影响观察效果,故建议在肠道自然状态下CT扫描(本研究组患者均未做肠道准备、不清洁灌肠和洗肠),扫描后在CT工作站进行MPR三维重建,重建资料在PACS系统存档分析。
增强扫描技术参数与平扫相同,增强扫描对比剂采用江苏省恒瑞医药生产的320 mgI/mL规格的碘佛醇,静脉注射,用量100 mL,注射流速4 mL/s,腹主动脉上端设置兴趣区自动触发扫描。
1.3 研究方法
总结结肠神经节缺乏症患者的临床表现特点;观察MSCT病变段肠管位置,分别测量扩张段和狭窄段肠壁厚度;病理医师测量狭窄段(病变段)肠管长度;多期MSCT增强扫描观察肠道蠕动、判断肠道功能情况;通过MSCT三期增强检查观察病变狭窄段和扩张段肠管的血运情况。
2. 结果
结肠神经节缺乏症的临床特点表现为成年人长期的便秘和不完全性肠梗阻。本组5例结肠神经节缺乏症患者MSCT均表现为病变段结肠肠腔相对狭窄与病变段近端结肠肠腔明显扩张(图1~图3),影像特征为结肠肠腔扩张后狭窄,扩张段结肠管壁厚度正常或不均一增厚,本组结肠肠壁厚度大于0.3 cm、小于0.9 cm,狭窄段结肠肠壁厚度正常、无增厚改变(图1~图3)。
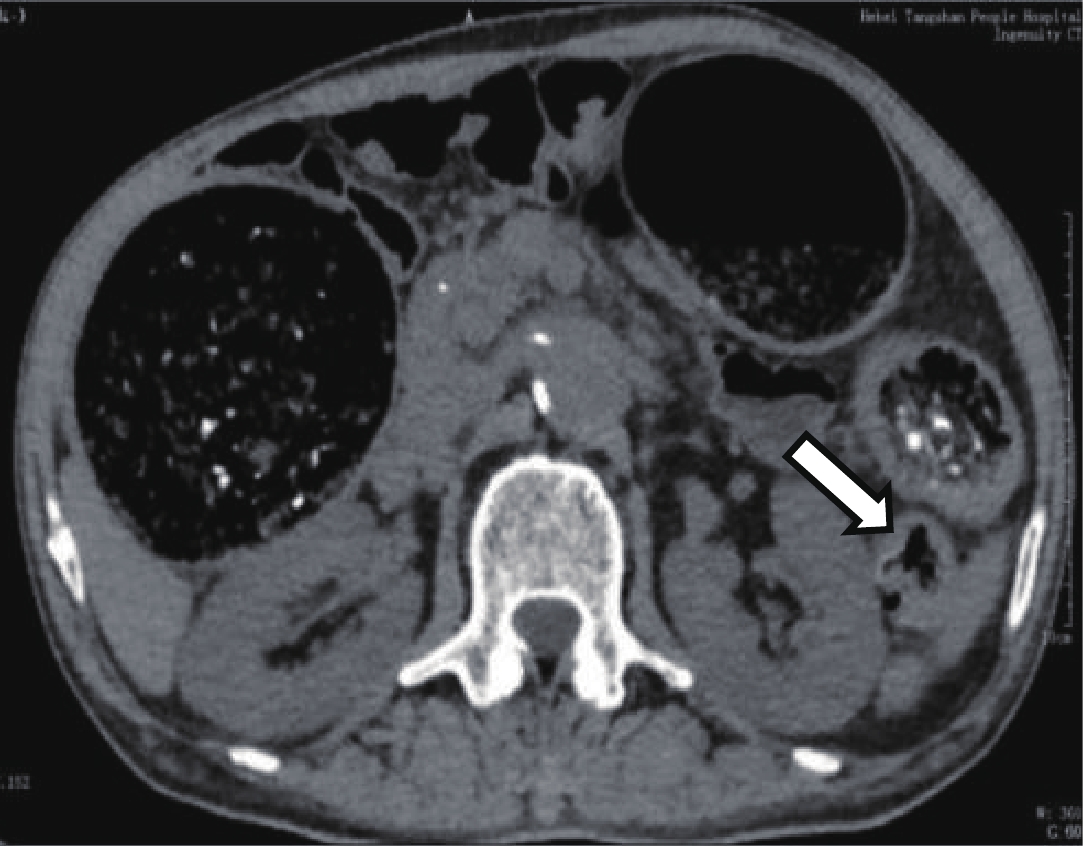
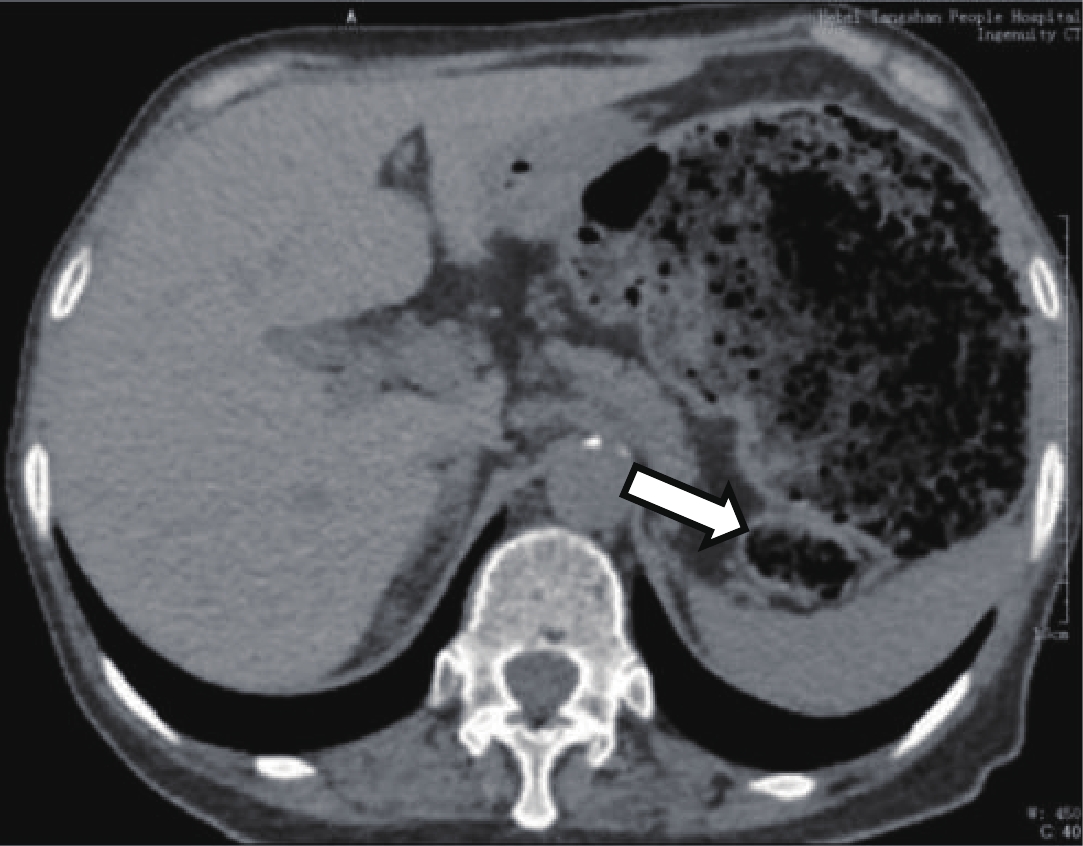
![]() 图 1 上腹CT平扫,横结肠脾曲肠腔扩张内径7 cm,肠壁均一弥漫性增厚,厚约0.5 cm,扩张肠腔内大量粪便集聚;结肠脾曲肠腔相对狭窄(空白箭),肠壁厚0.4~0.6 cmFigure 1. CT image of the abdomen,The splenic flexure of colon intestinal lumen was dilated, with an internal diameter of 6 cm, and the intestinal wall was diffuse and thickened, about 0.5 cm thick, and a large number of feces were concentrated in the dilated intestinal lumen. Colonic spleen curved intestinal lumen is relatively narrow (blank arrow), and the intestinal wall is 0.4~0.6 cm thick
图 1 上腹CT平扫,横结肠脾曲肠腔扩张内径7 cm,肠壁均一弥漫性增厚,厚约0.5 cm,扩张肠腔内大量粪便集聚;结肠脾曲肠腔相对狭窄(空白箭),肠壁厚0.4~0.6 cmFigure 1. CT image of the abdomen,The splenic flexure of colon intestinal lumen was dilated, with an internal diameter of 6 cm, and the intestinal wall was diffuse and thickened, about 0.5 cm thick, and a large number of feces were concentrated in the dilated intestinal lumen. Colonic spleen curved intestinal lumen is relatively narrow (blank arrow), and the intestinal wall is 0.4~0.6 cm thick![]() 图 2 上腹CT平扫,横结肠肠腔扩张,大部分肠壁厚度正常、局部肠壁轻微增厚,最厚约0.4 cm,扩张的肠腔内大量粪便;降结肠病变段肠管相对狭窄(空白箭),肠壁厚约0.8 cmFigure 2. CT image of the abdomen,The transverse colon lumen is dilated, with uneven thickening, the thickest intestinal wall diameter is about 0.4 cm, a large number of fees were concentrated in the dilated intestinallumen. The diseased segment of the descending colon is relatively narrow (blank arrow), the local thickness is about 0.8 cm
图 2 上腹CT平扫,横结肠肠腔扩张,大部分肠壁厚度正常、局部肠壁轻微增厚,最厚约0.4 cm,扩张的肠腔内大量粪便;降结肠病变段肠管相对狭窄(空白箭),肠壁厚约0.8 cmFigure 2. CT image of the abdomen,The transverse colon lumen is dilated, with uneven thickening, the thickest intestinal wall diameter is about 0.4 cm, a large number of fees were concentrated in the dilated intestinallumen. The diseased segment of the descending colon is relatively narrow (blank arrow), the local thickness is about 0.8 cm本组术后病变段肠管长度介于4.3~8.6 cm之间;扩张段肠管管腔内大量粪便聚集;多期增强CT显示狭窄段和扩张段肠管形态固定,提示结肠蠕动功能丧失;病变区域系膜血管和结肠肠壁MSCT增强扫描无异常强化,提示结肠肠壁血供正常;病变位置分布特点:病变肠管分布于降结肠3例,分布于结肠脾曲2例。
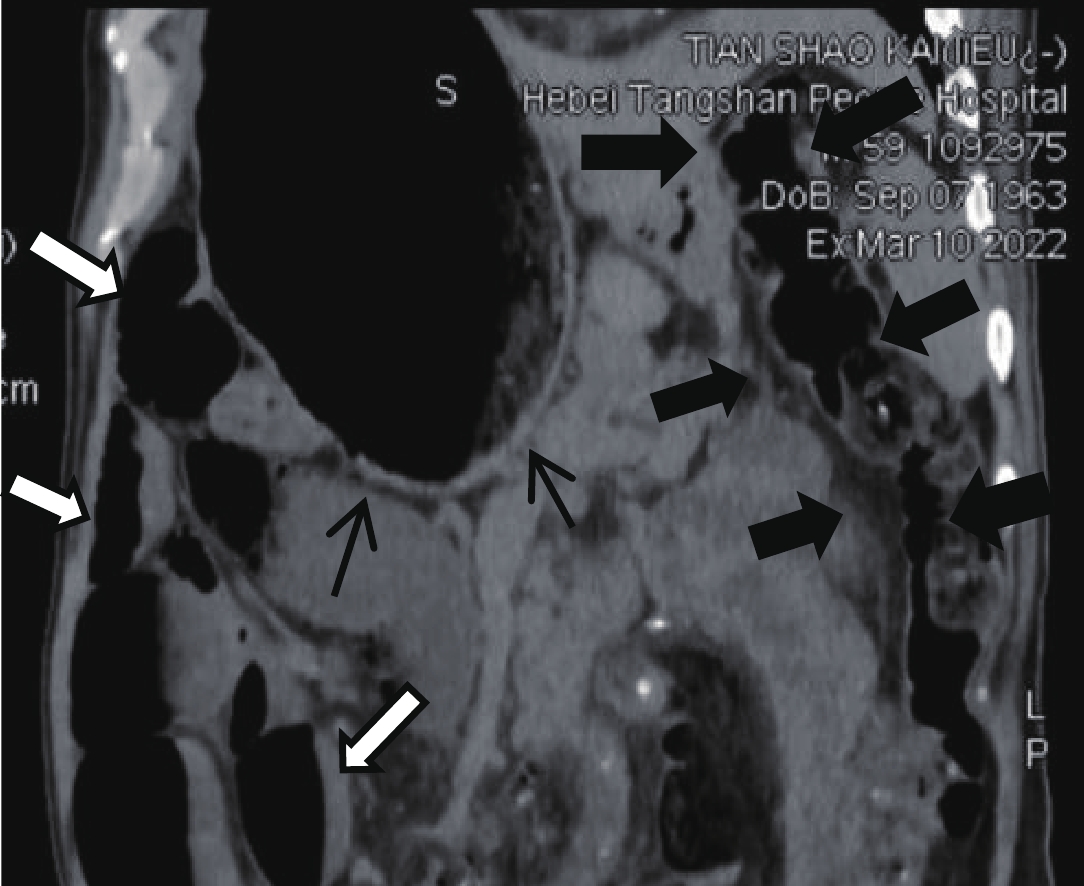
本组5例CT扫描显示病变段以远的结肠形态自然、肠腔无扩张和狭窄,肠壁无异常增厚,即病变段结肠厚度与扩张段和无病变段结肠肠壁比较无异常增厚改变(图3黑箭所示区域),提示影像学不能判断病变段肠管的范围;本组小肠扩张、肠腔内散在积气、积液2例,部分区域小肠肠腔可见内气液平形成,呈小肠梗阻改变(图3白箭所示区域)。
本组5例术后病理均诊断为结肠神经节缺乏症(图4和图5),免疫组化S-100,显示狭窄段肠粘膜下层及肌间神经节细胞数量显著减少。而在扩张段肠粘膜下层神经纤维略显增多。
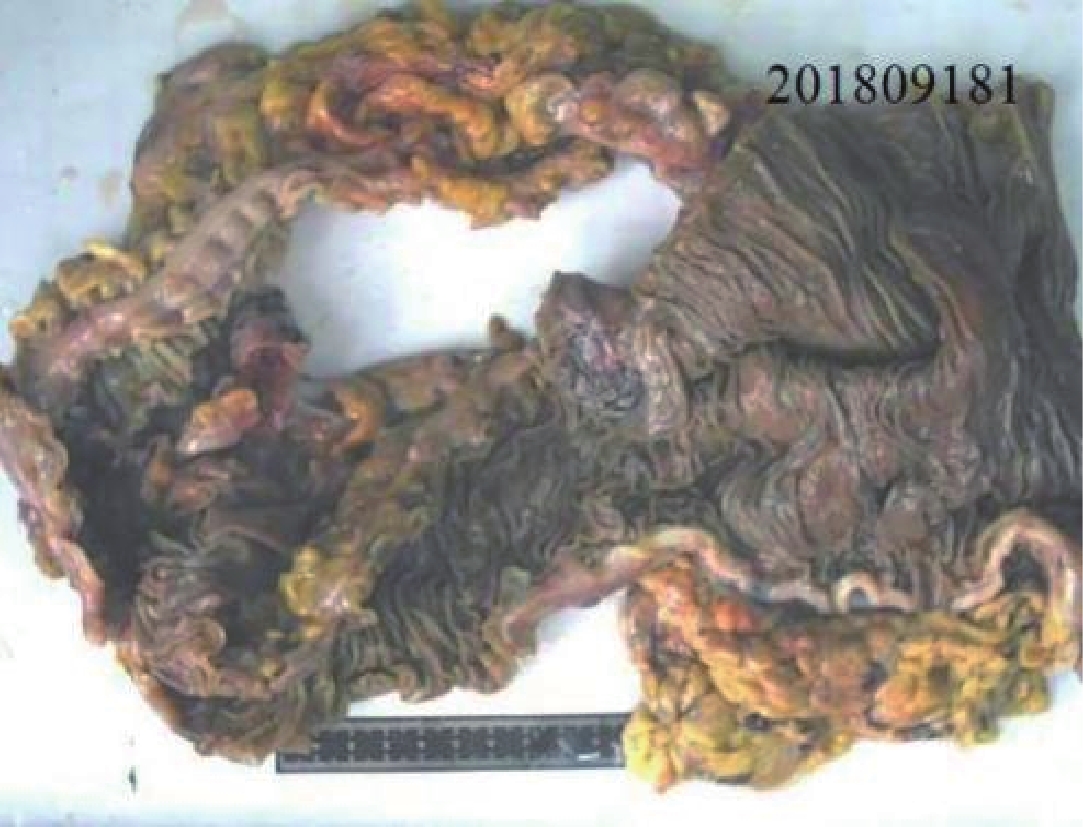
![]() 图 4 图1患者术后大体标本,肉眼所见:全结肠切除标本:结肠长68 cm,周径5~12 cm,回肠长7 cm,周径3 cm。扩张段肠管长15 cm,周径12 cm,壁厚0.5 cm,粘膜灰红色,质软,皱襞较清晰;狭窄段肠管,长5 cm,周径5 cm,壁厚0.5 cmFigure 4. The Patient of fig.1, postoperative gross specimen, as seen by the naked eye. Total colon resection specimen: The colon is 68 cm long, the peripheral diameter is 5~12 cm, The ileum was 7 cm long with a circumference diameter of 3 cm. The intestine of the dilated segment was 15 cm long, Peridiameter 12 cm, wall thickness 0.5 cm, Mucosal membrane is grey-red, soft, The wrinkles are clear; The arrow segment intestine, 5 cm long, The circumference diameter is 5 cm and the wall thickness is 0.5 cm
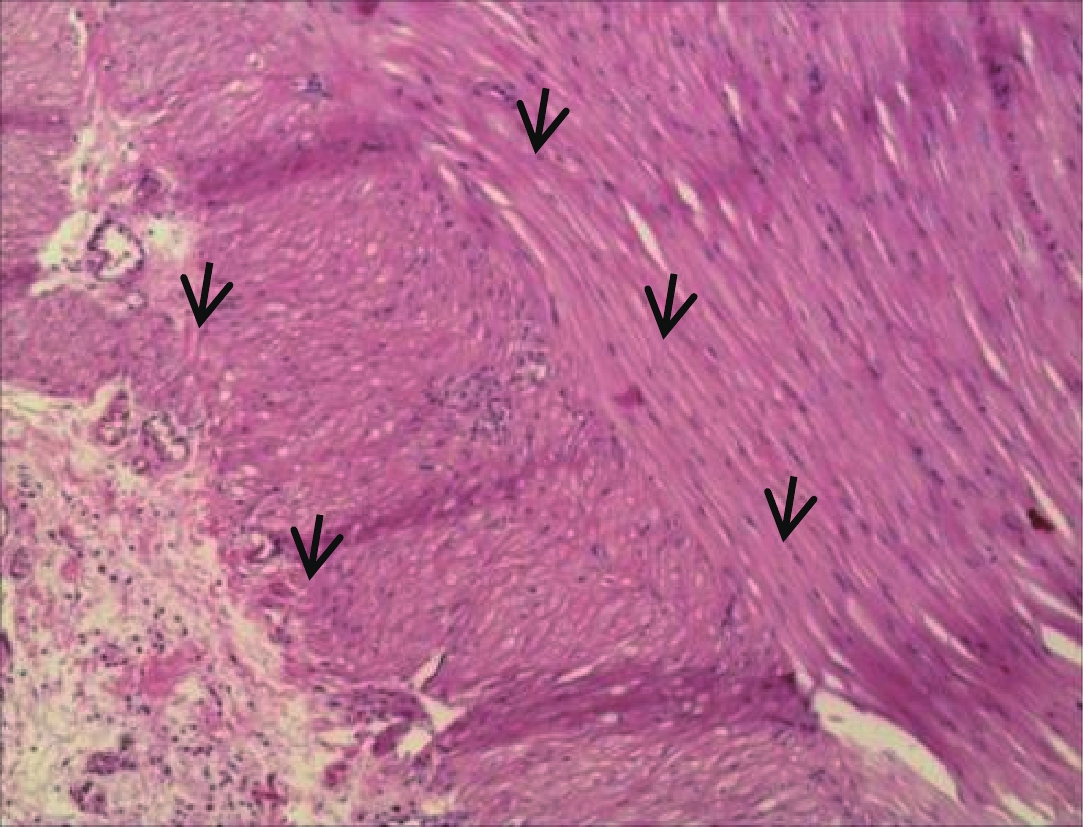
图 4 图1患者术后大体标本,肉眼所见:全结肠切除标本:结肠长68 cm,周径5~12 cm,回肠长7 cm,周径3 cm。扩张段肠管长15 cm,周径12 cm,壁厚0.5 cm,粘膜灰红色,质软,皱襞较清晰;狭窄段肠管,长5 cm,周径5 cm,壁厚0.5 cmFigure 4. The Patient of fig.1, postoperative gross specimen, as seen by the naked eye. Total colon resection specimen: The colon is 68 cm long, the peripheral diameter is 5~12 cm, The ileum was 7 cm long with a circumference diameter of 3 cm. The intestine of the dilated segment was 15 cm long, Peridiameter 12 cm, wall thickness 0.5 cm, Mucosal membrane is grey-red, soft, The wrinkles are clear; The arrow segment intestine, 5 cm long, The circumference diameter is 5 cm and the wall thickness is 0.5 cm![]() 图 5 与图1同一患者,HE染色10×10结合免疫组化S-100,显示狭窄段肠黏膜下层及肌间神经节细胞数量显著减少。病理诊断:结肠神经节缺乏症(结肠假性)Figure 5. The same patient of fig.1, HE pathological staining, 10×10 combined with immunohistochemistry S-100, a narrow segment of the intestinal mucosa is shown the number of lower and myomuscular ganglion cells was significantly reduced. Pathological diagnosis: Colonic innervation defect (Hirschsprung' Disease)
图 5 与图1同一患者,HE染色10×10结合免疫组化S-100,显示狭窄段肠黏膜下层及肌间神经节细胞数量显著减少。病理诊断:结肠神经节缺乏症(结肠假性)Figure 5. The same patient of fig.1, HE pathological staining, 10×10 combined with immunohistochemistry S-100, a narrow segment of the intestinal mucosa is shown the number of lower and myomuscular ganglion cells was significantly reduced. Pathological diagnosis: Colonic innervation defect (Hirschsprung' Disease)3. 讨论
3.1 成人巨结肠疾病流行病学
在临床,成人巨结肠疾病是一组临床疾病,包括成人先天性巨结肠、成人特发性巨结肠、结肠神经节缺乏症、中毒性巨结肠、医源性巨结肠等。成人先天性巨结肠为先天性出生缺陷性疾病,大部分患者年幼发病,在幼儿或儿童时期已经得到外科干预,仅部分短段型和超短段型幼儿期症状轻微未得到及时处理,拖延至青年时期发病或就医,导致就诊时病变肠段近端的正常肠段高度扩张、肌层代偿性增厚形成橡皮样的肠壁[1-3]。成人特发性巨结肠与成人先天性巨结肠有很多相似之处,从症状来说,两者均有排粪困难、腹痛腹胀等表现,排粪后临床症状可缓解,一般到青年时均得到手术治疗。
特发性巨结肠没有明显狭窄的肠段,其扩张的肠段即为病变肠段,该肠段的特点在于肠壁肌间神经节数量减少、变性,该病术前较难诊断,容易误诊为成人先天性巨结肠[1]。结肠神经节缺乏症与其他类型成人巨结肠在临床和MSCT表现上无明显差异,有报道指出,神经节细胞缺乏症相对发病年龄更大,且女性比例高[1,5-6]。结肠神经节缺乏症术中可以发现相对的狭窄段,狭窄段主要位于降结肠或乙状结肠,病变肠段内神经节细胞数量的明显低于正常,近端肠管明显扩张呈巨结肠样改变。
3.2 成人结肠神经节缺乏症临床特点与处理方案
成人结肠神经节缺乏症多见于中老年人,以慢性肠梗阻、便秘为临床表现,术后病理学为肠壁神经节变性、缺乏所致慢性疾病[1,7],患者病程较长,临床术前诊断困难。由于病变段肠壁神经节减少、变性与缺失,病变段肠管失去扩张与蠕动功能,导致肠内容物阻滞、近端肠管扩张形成不全肠梗阻,影像学检查表现为不全肠梗阻、肠腔扩张后狭窄影像学改变,肠壁厚度对疾病诊断无帮助[8-9]。本组病例术后病理学与相关报道相符,结肠神经节缺乏症均表现为狭窄段结肠肠壁神经丛减少或变性、缺失,扩张段肠壁神经纤维反而有所增多。
由于患者病变段肠管相对狭窄以及蠕动功能丧失,肠腔内大量粪便集聚,病变段肠管近端管腔明显扩张,肠道内容物和较多积气干扰和影响了B超和磁共振的检查效果,临床多采用MSCT作为首选的检查手段。结肠神经节缺乏症患者在CT检查前不必要做肠道清洁灌肠准备工作,在自然状态下进行检查更能够反映结肠神经节缺乏症肠道扩张、粪便集聚的本来的面貌以及影像特点。
MSCT同样也印证了扩张以及狭窄段结肠的功能情况:MSCT三期增强扫描显示狭窄段以及扩张段肠管均形态固定,提示扩张以及狭窄段肠管均无运动功能、即肠管蠕动功能丧失,由此临床手术方式也大多选择次全结肠切除[1,10-11]。关于结肠神经节缺乏症供血,MSCT三期增强扫描观察肠壁和系膜血供无异常,依据病理学提供的病变段肠管的长度,回顾性分析影像学狭窄段的肠管与其远端正常肠管在形态、密度以及MSCT平扫+增强检查的表现,均没有显著的影像学差异。值得关注的是手术时术者无法依据望诊和触诊的物理手段确定狭窄区域病变段肠管切除范围,需依靠术中快速冰冻病理确定切缘位置。
对于成人先天性巨结肠,临床多采用改良Duhamel术、金陵术、低位前切除术或者拖出式低位前切除术[1,11]。对于特发性巨结肠患者可在术前准备充分的情况下,选择一期结直肠次全切除术治疗,部分以急诊肠梗阻入院的患者可先行保守治疗或者结肠镜减压好转后行择期手术治疗。对于神经节细胞缺乏症患者,手术方式采用和特发性巨结肠一致的结直肠次全切除术,将扩张的近端肠段和狭窄的远端肠段一并切除,行回肠直肠吻合或者升结肠直肠吻合[1,10-11]。
由于成人结肠神经节缺乏症临床病例少见,本研究组样本量小,需在以后采取多中心、持续扩大样本量进一步深入研究,以提高成人巨结肠之结肠神经节缺乏症影像学研究的水平,使成人结肠神经节缺乏症患者获益。
-
图 1 上腹CT平扫,横结肠脾曲肠腔扩张内径7 cm,肠壁均一弥漫性增厚,厚约0.5 cm,扩张肠腔内大量粪便集聚;结肠脾曲肠腔相对狭窄(空白箭),肠壁厚0.4~0.6 cm
Figure 1. CT image of the abdomen,The splenic flexure of colon intestinal lumen was dilated, with an internal diameter of 6 cm, and the intestinal wall was diffuse and thickened, about 0.5 cm thick, and a large number of feces were concentrated in the dilated intestinal lumen. Colonic spleen curved intestinal lumen is relatively narrow (blank arrow), and the intestinal wall is 0.4~0.6 cm thick
图 2 上腹CT平扫,横结肠肠腔扩张,大部分肠壁厚度正常、局部肠壁轻微增厚,最厚约0.4 cm,扩张的肠腔内大量粪便;降结肠病变段肠管相对狭窄(空白箭),肠壁厚约0.8 cm
Figure 2. CT image of the abdomen,The transverse colon lumen is dilated, with uneven thickening, the thickest intestinal wall diameter is about 0.4 cm, a large number of fees were concentrated in the dilated intestinallumen. The diseased segment of the descending colon is relatively narrow (blank arrow), the local thickness is about 0.8 cm
图 4 图1患者术后大体标本,肉眼所见:全结肠切除标本:结肠长68 cm,周径5~12 cm,回肠长7 cm,周径3 cm。扩张段肠管长15 cm,周径12 cm,壁厚0.5 cm,粘膜灰红色,质软,皱襞较清晰;狭窄段肠管,长5 cm,周径5 cm,壁厚0.5 cm
Figure 4. The Patient of fig.1, postoperative gross specimen, as seen by the naked eye. Total colon resection specimen: The colon is 68 cm long, the peripheral diameter is 5~12 cm, The ileum was 7 cm long with a circumference diameter of 3 cm. The intestine of the dilated segment was 15 cm long, Peridiameter 12 cm, wall thickness 0.5 cm, Mucosal membrane is grey-red, soft, The wrinkles are clear; The arrow segment intestine, 5 cm long, The circumference diameter is 5 cm and the wall thickness is 0.5 cm
图 5 与图1同一患者,HE染色10×10结合免疫组化S-100,显示狭窄段肠黏膜下层及肌间神经节细胞数量显著减少。病理诊断:结肠神经节缺乏症(结肠假性)
Figure 5. The same patient of fig.1, HE pathological staining, 10×10 combined with immunohistochemistry S-100, a narrow segment of the intestinal mucosa is shown the number of lower and myomuscular ganglion cells was significantly reduced. Pathological diagnosis: Colonic innervation defect (Hirschsprung' Disease)
-
[1] 隋金珂, 张卫. 成人巨结肠病因分析及手术方式选择[J]. 中华胃肠外科杂志, 2021,24(12): 1054−1057. DOI: 10.3760/cma.j.cn441530-20211103-00445. SUI J K, ZHANG W. Etiological analysis and surgical method selection of adult megacolon[J]. Chinese Journal of Gastrointestinal Surgery, 2021, 24(12): 1054−1057. DOI: 10.3760/cma.j.cn441530-20211103-00445. (in Chinese).
[2] STARLING J R, CROOM R D, THOMAS C G. Hirschsprung's disease in young adults[J]. American journal of Surgery, 1986, 151(1): 104−109. DOI: 10.1016/0002-9610(86)90019-x.
[3] 戴春娟, 叶祖萍. 先天性巨结肠遗传学基础研究进展[J]. 河北医药, 2010, 53(4), 89-92. DOI:10.3969/J.issn 1002-7386.2010.04.053. DAI C J, YE Z P. Research progress on genetic basis of Hirschsprung’s disease[J], Hebei Medicine, 2010, 53(4), 89-92. DOI:10.3969/J.issn1002-7386.2010.04.053(in chinese).
[4] 张文, 武海燕, 李惠, 等. 先天性巨结肠病理诊断规范[J]. 中华病理学杂志, 2016,45(3): 149−152. DOI: 10.3760/cma.j.issn.0529-5807.2016.03.002. ZHANG W, WU H Y, LI H, et al. The guideline of pathological diagnosis of Hirschsprung's disease[J]. Chinese Journal of Pathology, 2016, 45(3): 149−152. DOI: 10.3760/cma.j.issn.0529-5807.2016.03.002. (in Chinese).
[5] Isolated hypoganglionosis: Systematic review of a rare intestinal innervation defect[J]. Pediatric Surgery Internation, 2010, 26(11): 1111-1115. DOI: 10.1007/s00383-010-2693-3.
[6] DO M Y, MYUNG S J, PARK H J, et al. Novel classification and pathogenetic analysis of hypoganglionosis and adult-onset Hirschsprung's disease[J]. Digestive Diseases and Sciences, 2011, 56(6): 1818−1827. DOI: 10.1007/s10620-010-1522-9.
[7] HUIZER V, WIJEKOON N, ROORDA D, et al. Generic and disease-specific henlth-ralated quality of life in pentints with Hirschspurung disease: A systematic review and Meta-angnlysis[J]. World Journal of Gastroenterology, 2022, 28(13): 1362−1376. doi: 10.3748/wjg.v28.i13.1362
[8] FRIEDMACHER F, PURI P. Classification and diagnostic criteria of variants of Hirschsprung's disease[J]. Pediatric Surgery Internation, 2013, 29(9): 855−872. doi: 10.1007/s00383-013-3351-3
[9] 王维林. 关于肠神经元发育异常的再思考[J]. 中华小儿外科杂志, 2014,35(7): 481−483. DOI: 10.3760/cma.j.issn.0253-3006.2014.07.001. WANG W L. Rethinking about intestinal neuronal dysplasia[J]. The Chinese Journal of Pediatric Surgery, 2014, 35(7): 481−483. DOI: 10.3760/cma.j.issn.0253-3006.2014.07.001. (in Chinese).
[10] 孙晓毅. 巨结肠同源病诊断治疗难点解析[J]. 中华实用儿科临床杂志, 2014,29(23): 1763−1768. DOI: 10.3760/cma.j.issn.2095-428X.2014.23.002. SUN X Y. A comment on difficulties in diagnosis and treatment of Hirschsprung's disease allied disorders[J]. The Chinese Clinical Journal of Practical Pediatrics, 2014, 29(23): 1763−1768. DOI: 10.3760/cma.j.issn.2095-428X.2014.23.002. (in Chinese).
[11] 朱天琦, 冯杰雄, 张文, 等. 新生儿先天性巨结肠经脐腹腔镜根治术十例报告[J]. 中华外科杂志, 2011,49(11): 1049−1051. DOI: 10.3760/cma.j.issn.0529-5815.2011.11.025. ZHU T Q, FENG J X, ZHANG W, et al. 10 case reports of neonatal Hirschsprung disease by transumbilical laparoscopic colectomy[J]. Chinese Journal of Surgery, 2011, 49(11): 1049−1051. DOI: 10.3760/cma.j.issn.0529-5815.2011.11.025. (in Chinese).



 下载:
下载: