Relationship between Tumor Burden and Early Response Time and Radiation Dose after Intraoperative Radiotherapy for Unresectable Pancreatic Cancer
-
摘要:
目的:探讨影像参数评价不可切除胰腺癌术中放疗(IORT)后60 d内肿瘤负荷的变化及与IORT照射剂量的相关性。方法:回顾性纳入2017年4月至2020年7月的四川省肿瘤医院经IORT治疗的不可切除胰腺癌32例,记录IORT前7 d及IORT后60 d内肿瘤影像参数:最长径(LA)、短径(SA)、最大横截面积(A)及各参数值绝对值变化(Δ)及变化率(Δ%),区分不同肿瘤负荷组(缩小/稳定/增大),分析各参数与IORT照射剂量及肿瘤应答时间的关系。结果:不可切除胰腺癌IORT后LA低于IORT前,差异有统计学意义;不可切除胰腺癌IORT后SA和A均低于IORT前,差异无统计学意义。基于ΔLA区分不同肿瘤负荷组:缩小组、稳定组及增大组,其IORT后对应肿瘤应答时间分别为(39.57±11.77)d、(38.08±12.87)d、(41.17±10.42)d。3组患者IORT前肿瘤的LA、SA、A比较,差异均无统计学意义。3组患者IORT后肿瘤LA、SA、A比较,差异均有统计学意义。3组患者IORT前后ΔLA均有统计学意义。不可切除胰腺癌ΔLA与IORT剂量水平呈中等水平负相关(r=-0.47)。稳定组ΔLA与增大组ΔA与IORT剂量呈中等及高度相关(r=0.66 vs. 0.90)。稳定组的ΔSA与应答时间呈中等负相关关系(r=-0.68);余组的LA、SA及A变化幅度均与应答时间无明显相关。结论:ΔLA能评价不可切除胰腺癌IORT后60 d内肿瘤负荷变化;其肿瘤负荷改变与IORT局部照射剂量相关,但不受应答时间影响。
Abstract:Objective: To investigate the correlation between changes in tumor burden and the dose of intraoperative radiation therapy (IORT) for unresectable pancreatic cancer within 60 days of treatment evaluated using imaging parameters. Methods: A total of 32 cases of unrespectable pancreatic cancer treated with IORT at the Sichuan Cancer Hospital from April 2017 to July 2020 were retrospectively included. The imaging parameters of the tumor were recorded 7 days before IORT and 60 days after IORT: the longest axis (LA), shortest axis (SA), largest cross-sectional area (A), absolute value changes of each parameter (Δ), and change rate (Δ%). Different tumor load groups (shrinking/stabilizing/increasing) were differentiated, and the relationship between each parameter, IORT radiation dose, and tumor response time was analyzed. Results: The LA of unresectable pancreatic cancer after IORT was lower than that before IORT, with significant differences observed. The SA and A values of unresectable pancreatic cancer after IORT were lower than those before IORT, with no statistical significance observed. Based on ΔLA of the pancreatic tumor, the three groups, shrinkage, stability, and enlargement, were divided, with a corresponding tumor response time of (39.57±11.77) d, (38.08±12.87) d, (41.17±42) d, respectively. There were no significant differences in LA, SA, and A among the three groups before IORT, while significant differences were observed in LA, SA, and A after IORT. The ΔLA of the three groups was statistically significant before and after IORT. There was a moderate negative correlation between ΔLA and IORT dose levels in unrespectable pancreatic cancer (r=−0.47,). There was a moderate and high correlation between ΔLA and IORT dose in the stable group and ΔA and IORT dose in the enlargement group, respectively (r=0.66 vs. 0.90). There was no significant correlation between the response time and imaging parameters in these groups, except for a moderate negative correlation between ΔSA and response time in the stability group (r=−0.68). Conclusion: ΔLA can be used to evaluate changes in tumor load within 60 days of IORT for unresectable pancreatic cancer. The efficacy of pancreatic cancer could be correlated with the IORT irradiation dose, whereas the tumor burden could not be affected by the tumor response time.
-
Keywords:
- exposure dose /
- IORT /
- tumor load /
- response time
-
术中放疗(intraoperative radiotherapy,IORT)是一种高度适形的放射治疗,它在不超过正常组织耐受剂量的情况下增加肿瘤辐射剂量[1],是局部晚期不可切除胰腺癌综合治疗的重要组成部分。但IORT照射剂量尚无统一临床标准,现有放疗模式下的IORT照射剂量与肿瘤负荷的关系缺乏明确研究结果。射线对肿瘤细胞的杀伤存在时间效应,而IORT术后反映患者是否获益的首次影像复查的最短时间窗亦尚无统计。
本研究以我院不可切除胰腺癌病例为研究对象,通过评价IORT治疗后60 d内胰腺癌影像参数变化,观察肿瘤负荷变化与应答时间及二者关系,和肿瘤负荷与IORT照射剂量的关联,初步探讨IORT后影像学检查(CT/MRI)早期肿瘤应答及影像复查最佳时间窗及剂量参考,以期尽早为不可切除胰腺癌患者后续治疗提供临床依据。
1. 资料与方法
1.1 研究对象
回顾性搜集2017年4月至2020年7月期间四川省肿瘤医院接受IORT的不可切除胰腺癌病例共74例,纳入标准:①术前未接受放、化疗等其它治疗的患者;②术后病理均为腺癌。③具有完整临床和影像资料,影像质量符合分析标准,所有影像检查时间在IORT术前7 d内及IORT术后≤60 d内。
最终纳入符合要求病例32例(其中男24例,女8例,中位年龄60岁)。所有患者均为进展期不可切除胰腺癌,均经剖腹探查病理活检确诊,病理类型均腺癌。
1.2 IORT照射
利用Mobetron移动式电子束术中放疗系统2000(Intraop Medical Corp.生产),限光筒激光定位射束中轴对准限光筒中轴(铅板和纱布隔离胰旁器官及肠管),控制电子线能量范围9~12 MeV,选择照射剂量范围9~18 Gy,照射深度2~3.5 cm。
1.3 影像扫描及研究方法
1.3.1 影像检查
①CT采用GE 64排CT机(Lightspeed VCT)容积扫描后重建。扫描参数:120 kV,220~250 mAs,层厚5 mm;增强扫描经肘前静脉注射对比剂碘海醇,总量按2 mL/kg计算,注射流率2.5 mL/s;于对比剂注射后30 s和60 s开始行动脉期和门静脉期增强扫描。②MRI扫描:Siemens Skyra 3.0 T超导MRI仪。
T1 WI横轴位平扫:TR l00 ms/TE 4.8 ms;HASTE序列T2 WI横轴位:TR 124/TE 2.5 ms,翻转角70°,FOV 400×400 mm2,矩阵256×256,带宽488 Hz/象素。
1.3.2 图像评估分析
利用锐珂PACS系统自带软件,由一位副高影像诊断医师进行影像评估:在横断位病灶最大层面测量。①缩小:肉眼可见病灶径线明显缩小或测量病灶长径缩小>5 mm;稳定:病灶长径减小或增大<5 mm;增大:肉眼可见病灶径线明显增大或测量病灶长径增大>5 mm。②在图像上在病灶处沿病灶最大截面边缘勾画感兴趣区(ROI)并记录其IORT前后面积、平均CT密度值或MRI信号值。③记录胰腺伴随征象:胰尾萎缩、主胰管扩张等。
1.3.3 驶评价方法
记录肿瘤IORT前后影像参数:短径(short axis,SA),长径(long axis,LA)及面积(area,A)值以评估IORT效果。IORT前短径为SA1,长径为LA1,面积为A1,IORT后短径为SA2,长径为LA2,面积为A2,分别计算相应参数变化值ΔSA、ΔLA、ΔA及变化率ΔSA%、ΔLA%、ΔA%,公式如下:
$$ \Delta 参数=参数_{2}-参数_{1}\text{,} $$ (1) $$ \Delta 参数变化率%=\bigg(\left(参数_{2}-参数_{1}\right) \Big/参数_{1}\bigg)×100%\text{,} $$ (2) $$ 肿瘤应答时间=检查时间_{{\rm{IORT}}后}-手术时间_{{\rm{IORT}}当日}。 $$ (3) 1.4 统计学分析
统计分析采用Graphpad Prism 7.0软件。计数资料用(n(%))表示,统计采用
$\chi^2 $ /确切概率法检验。计量资料用Shapiro-Wilk normality test及KS normality test正态性检验,符合正态分布数据用$(\bar x\pm s)$ 表示,不符合正态分布用M(Q1,Q3)表示;组内IORT前后参数对比统计用配对t检验/Wilcoxon配对符号秩和检验;不同疗效组间参数比较用单因素方差分析。用Spearman相关性检验分析IORT放射剂量与肿瘤应答时间及肿瘤负荷变化的相关性。P<0.05视为差异有统计学意义。
2. 结果
2.1 患者一般情况及肿瘤影像资料
32例不可切除胰腺腺癌均为单发病灶,32个病灶均表现为肿块、结节影。患者IORT术前一般情况及胰腺肿瘤基线影像资料见表1。
表 1 32例不可切除胰腺癌IORT术前患者一般情况及肿瘤影像资料Table 1. General information and tumor imaging data of 32 patients with unresectable pancreatic cancer before IORT项目 数值 项目 数值 年龄/(岁,x±s(范围)) 60±9(47~81) 肿瘤实质/(例,%) 性别(男/女(n)) 24/8 伴囊变 1(3.13) 肿瘤长径/(cm,x±s(范围)) 4.54±1.30(2.40~7.90) 伴坏死 19(59.38) 肿瘤部位/(例,%) 实性 12(37.50) 胰头 7(21.88) 影像学检查/(例,%) 钩突 3(9.38) IORT术前后均MRI 3(9.38) 胰头+钩突 1(3.13) IORT术前后均CT 16(50.00) 胰颈 2(6.25) IORT术前MRI术后CT 13(40.63) 胰颈体 10(31.25) 主胰管扩张/(例,%) 26(81.25) 胰体 4(12.50) 胰尾萎缩/(例,%) 19(59.38) 胰体尾 2(6.25) 轻度萎缩 4(12.50) 胰尾 3(9.38) 明显萎缩 15(46.88) 2.2 IORT后肿瘤负荷变化
32例不可切除胰腺癌IORT后总体LA低于IORT前,差异有统计学意义;不可切除胰腺癌IORT后总体SA和A均低于IORT前,差异均无统计学意义(表2)。基于IORT后肿瘤LA改变,将32例患者分为3组不同肿瘤负荷状态:缩小组14例(43.75%,14/32)、稳定组12例(37.50%,12/32),增大组6例(18.75%,6/32)。3组年龄、性别差异无统计意义,3组基线具备可比性。将LA缩小定义为缓解,则缓解率为43.75%(14/32),非缓解率56.25%(18/32)。
表 2 32例不可切除胰腺癌患者IORT后影像参数对比Table 2. Comparisons of imaging parameters post-IORT in 32 patients with unresectable pancreatic cancer时间点 参数对比 统计检验 IORT前 IORT后 统计量 P LA/cm 4.54±1.30 3.99±1.48 3.2 0.00a SA/cm 3.00(2.50,4.00) 2.80(1.98,3.68) - 0.12b A/mm2 841.40(480.90,1110.00) 775.80(416.10,901.90) - 0.12b 注:a-配对t检验;b-Wilcoxon符号秩检验,Graphpad prism无统计值;非正态分布计量资料用M(Q1,Q3)表示。 组内比较,3组IORT前后ΔLA差异均有统计学意义。缩小组IORT后LA、SA和A均低于IORT前,差异有统计学意义,稳定组及增大组IORT前后SA和A差异均无统计学意义(表3)。组间比较,3组患者IORT前肿瘤的LA、SA和A比较,差异均无统计学意义;3组患者IORT后肿瘤LA、SA和A比较,差异均有统计学意义。组间及两两比较结果见表3。
表 3 IORT肿瘤负荷3组间患者基本情况及影像参数比较Table 3. Comparisons of patients' basic information and imaging parameters among the three IORT tumor burden groups组别 IORT前 IORT后 统计量 P 缩小组(n=14) LA/cm 4.34±1.22 3.14±1.07 5.16 0.00d SA/cm 3.00±0.93 2.27±0.83 5.05 0.00d A/mm2 701.20±365.50 506.70±283.60 2.62 0.02d 稳定组(n=12) LA/cm 5.01±1.47 4.61±1.58 2.29 0.04d SA/cm 2.95(2.58,4.00) 3.10(2.53,4.00) - 0.69e A/mm2 952.60(644.10,1305.00) 811.70(576.6,1057) - 0.58d 增大组(n=6) LA/cm 4.08±0.99 4.75±1.23 5.82 0.00d SA/cm 3.38±1.10 3.97±1.48 1.48 0.20d A/mm2 927.40(517.40,1538.00) 1295.38(724.80,2135.00) - 0.44d 统计量 LA/cm 1.34a 5.32a SA/cm 0.35a 9.06c A/mm2 4.37c 7.60c P LA/cm 0.28 0.01 SA/cm 0.71 0.01 A/mm2 0.11 0.02 注:a-F值;b-$\chi^2 $值;c-Kruskal-Wallis检验;d-配对t检验;e-Wilcoxon符号秩检验,Graphpad prism无检验值。两两比较:缩小组LA与稳定组LA在IORT后同期比较,缩小组LA与增大组LA在IORT后同期比较,缩小组SA与增大组SA在IORT后同期比较,均P<0.05。 2.3 肿瘤负荷变化、应答时间及二者相关性
32例不可切除胰腺癌IORT术后影像中位检查时间37 d(范围15~60 d),影像检查最早可于IORT后15 d发现肿瘤明显缩小,探查肿瘤变化的平均时间范围为IORT后15~26 d(表4和图1)。影像检查最早可于IORT术后18 d发现肿瘤密度/信号降低,可在IORT后18~30 d发现肿瘤密度/信号改变(图2)。
表 4 不可切除胰腺癌IORT后肿瘤负荷变化的应答时间(天)Table 4. Response time to tumor burden changes after IORT for unresectable pancreatic cancer (day)肿瘤负荷(LA) n(%) 时间范围
(Post-IORT)中位时间
(Post-IORT)最早时间
(Post-IORT)缩小 14(43.75) 15~53 39 15 稳定 12(37.50) 18~60 35 18 增大 6(18.75) 26~53 42 26 缩小组、不变组和增大组对应IORT术后应答时间分别为(39.57±11.77)d、(38.08±12.87)d、(41.17±10.42)d,3组间时间差异无统计学意义;其中仅稳定组的ΔSA与应答时间呈中等程度负相关关系,差异具有统计学意义(r=-0.68);余稳定组、缩小组及增大组的ΔLA、ΔSA及ΔA均与应答时间无明显相关关系(表5)。
表 5 不可切除胰腺癌IORT后肿瘤负荷变化与应答时间相关性(天)Table 5. Correlation of tumor burden changes and response time after IORT for unresectable pancreatic cancer (day)组别 LA vs. 应答时间($ \bar{x}\pm s $)(范围) ΔLA($ \bar{x}\pm s $) 统计检验 r P 缩小组 (n=14) LA 39.57±11.77(15~53) -1.21±0.88 0.20 0.50 SA -0.73±0.54 0.16 0.59 A -194.54±277.91 0.27 0.34 稳定组 (n=12) LA 38.08±12.87(18~60) -0.40±0.60 -0.18 0.58 SA 0.07±0.36 -0.68 0.01 A -182.73±630.28 0.17 0.61 增大组(n=6) LA 41.17±10.42(26-53) 0.67±0.28 0.79 0.06 SA 0.58±0.96 0.40 0.43 A 217.32±453.19 -0.06 0.92 2.4 肿瘤负荷变化及与照射剂量的相关性
32例不可切除胰腺癌总体肿瘤ΔSA% 和ΔA% 均为 -6%,ΔLA% 为 -12%;各负荷组的影像参数变化(Δ及Δ%)(表6)。患者接受IORT照射剂量范围10~18 Gy,均数(13.72±2.76)Gy。胰腺肿瘤ΔLA与IORT剂量水平呈中等水平负相关(r=-0.4727)。缩小组、稳定组和增大组的肿瘤负荷与IORT剂量的相关性见表7。稳定组中ΔLA与IORT剂量呈中等相关(r=0.66),增大组中ΔA与IORT剂量呈高度相关(r=0.90);余不同肿瘤负荷组的一二维特征与IORT剂量水平无相关性(表8)。
表 6 不同肿瘤负荷组影像参数变化Table 6. Changes of imaging parameters in different tumor burden groups组别 ΔLA/% ΔLA/cm ΔSA/% ΔSA/cm ΔA/% ΔA/mm2 缩小组(n=14) -27.53 -1.21 -5.05 -0.09 -0.68 373.33 稳定组(n=12) -8.51 -0.40 3.12 0.03 -13.67 383.87 增大组(n=6) 16.14 0.67 -25.02 -0.82 -22.01 806.57 表 7 32例胰腺肿瘤影像参数变化与IORT放射剂量(Dose)的相关性Table 7. Correlation between the changes of imaging parameters and IORT radiation dose of 32 patients with pancreatic cancers相关系数及其检验 剂量 vs.ΔA% 剂量 vs.ΔA 剂量 vs.ΔLA% 剂量 vs.ΔLA 剂量 vs.ΔSA% 剂量 vs.ΔSA r 0.13 0.06 0.40 0.39 -0.26 -0.21 P 0.47 0.75 0.02 0.03 0.15 0.25 表 8 肿瘤负荷3组内变化与IORT剂量(Dose)的相关性Table 8. Correlation between the changes of imaging parameters and IORT dose within the tumor burden groups组别 相关系数
及其检验剂量 vs.ΔLA/% 剂量 vs.ΔLA 剂量 vs.ΔSA/% 剂量 vs.ΔSA 剂量 vs.ΔA/% 剂量 vs.ΔA 缩小组
(n=14)r 0.45 0.36 -0.39 -0.29 0.06 -0.19 P 0.11 0.21 0.17 0.31 0.83 0.52 稳定组
(n=12)r 0.57 0.66 -0.31 -0.10 0.16 0.30 P 0.05 0.02 0.33 0.75 0.61 0.35 增大组
(n=6)r 0.20 0.26 0.14 -0.12 0.17 0.90 P 0.71 0.61 0.80 0.82 0.75 0.01 3. 讨论
3.1 肿瘤负荷变化及临床意义
根据WHO标准[2],肿瘤负荷为计算每个可测量肿瘤最大平面上相互垂直的长径与短径的乘积,此双径测量法是最主要的影像测量方法。后来肿瘤长径被证实可用于代表肿瘤体积[3-4],是肿瘤疗效的独立预测因子[5]。Nishino等[6]用RECIST的一维最大径取代二维测量,极大简化了计算量,表明肿瘤最长径单径测量法较二维测量更简单准确。
本研究32例患者IORT术后60 d内胰腺肿瘤影像参数LA、SA和A分别较基线降低 -12%、-6% 和 -6%,证实了不可切除胰腺癌IORT术后短期(60 d内)有效性。3个指标中,LA变化最显著(-12%)且具有统计学意义,与上述一维测量最优论一致。本研究胰腺癌灶ΔSA和ΔA差异无统计学意义,原因除小样本量和统计偏倚外,还可能与IORT后肿瘤径线退缩不同步、CT软组织细节分辨率较低肿瘤轮廓模糊[7-8]相关。
3.2 肿瘤负荷改变、应答时间及临床意义
射线对肿瘤细胞的杀伤存在时间效应,肿瘤体积缩小的主要原因是放射诱导的细胞凋亡、坏死和随后的疤痕收缩形成[9]。本组IORT有效率为43.75%,而Kanamori等[10]报告影像评估不可切除胰腺癌患者在IORT术后0~2个月影像复查,IORT(PR+CR)缓解率为28%。学者Chuong等[7]证明边界可切除胰腺癌新辅放化疗后4周(11~78 d)复查CT肿瘤体积仅缩小0.42 cm3。鉴于胰腺癌间质丰富,治疗后早期肿瘤退缩程度微小,本研究疗效评价未采用RECIST实体瘤疗效评价标准,或导致有效率高于文献报道。此外,有试验[9]发现放疗后病灶水肿炎性反应时间段为7 d。
本研究最早IORT后15 d肿瘤明显缩小,大于7 d,排除了短期病灶急性炎性反应的影响。有报道[10]仅 22% 的不可切除胰腺癌IORT后能出现瘤内低密度,且出现瘤内低密度的平均时间为4个月。事实上本研究57.89% 的肿瘤密度较前降低,最早时间18 d,中位时间35 d,证明胰腺癌细胞增殖、间质增生影像表现晚于肿瘤细胞崩解所致肿瘤密度/信号降低。
3.3 IORT照射剂量与肿瘤负荷的临床意义
局部不可切除胰腺癌为晚期胰腺癌,接受放疗的主要目标之一为控制局部病灶进展[11],目前临床常规放疗方式为体外立体定向放疗,一般采用分次剂量10~25 Gy/f,体外放疗总剂量可达45~72 Gy[12-13]。相较体外放疗,IORT肿瘤剂量适形度更高,剂量强度和均匀度更优,理论上具有更佳的肿瘤控制率。但本研究中以长径缩小为标准的肿瘤缓解率为43.75%,低于部分研究胰腺癌立体定向报道局部肿瘤控制率为57%~100%[14]。原因在于本研究的限定时间窗较短(60 d),且总照射剂量低于体外放疗。
既往临床研究中IORT的X射线束平均剂量为11.1 Gy,有文献报道剂量高达25 Gy时胰腺癌患者也能耐受[15-16]。文献报道可切除胰腺癌10 Gry剂量瘤床照射的患者耐受性良好,1年局部控制率为76.4%[17-18]。但不可切除胰腺癌IORT的剂量与肿瘤负荷变化相关性尚缺乏研究资料。本研究32例胰腺癌患者接受IORT剂量范围为10~18 Gy,中位数13 Gy,与上述实验IORT剂量接近。
本研究胰腺癌ΔLA与IORT剂量水平呈中等水平负相关(r=-0.473),表明IORT辐射剂量越高,60 d内胰腺肿瘤负荷降低越明显。虽然IORT生物学有效剂量高理论上更有利于肿瘤局部控制,但需兼顾邻近十二指肠和胃的耐受性。本研究不同肿瘤负荷者组中,仅稳定组ΔLA与增大组ΔA与IORT剂量呈中等及高度相关(r=0.66 vs. 0.90),原因可能在于肿瘤内成分异质性、部分胰腺肿瘤放疗抵抗、免疫抑制肿瘤微环境的构建IROT局部照射有效生物学剂量衰落快慢以及辐射诱导的纤维化[19-20]相关。
本研究不足:样本量小,回顾性研究可能存在选择偏倚。
综上,不可切除胰腺癌影像参数ΔLA能反映不可切除胰腺癌IORT后60 d内疗效;IORT后60 d内胰腺癌肿瘤负荷减低与IORT局部照射剂量相关;IORT后60 d内肿瘤负荷变化幅度不受时间影响。
-
表 1 32例不可切除胰腺癌IORT术前患者一般情况及肿瘤影像资料
Table 1 General information and tumor imaging data of 32 patients with unresectable pancreatic cancer before IORT
项目 数值 项目 数值 年龄/(岁,x±s(范围)) 60±9(47~81) 肿瘤实质/(例,%) 性别(男/女(n)) 24/8 伴囊变 1(3.13) 肿瘤长径/(cm,x±s(范围)) 4.54±1.30(2.40~7.90) 伴坏死 19(59.38) 肿瘤部位/(例,%) 实性 12(37.50) 胰头 7(21.88) 影像学检查/(例,%) 钩突 3(9.38) IORT术前后均MRI 3(9.38) 胰头+钩突 1(3.13) IORT术前后均CT 16(50.00) 胰颈 2(6.25) IORT术前MRI术后CT 13(40.63) 胰颈体 10(31.25) 主胰管扩张/(例,%) 26(81.25) 胰体 4(12.50) 胰尾萎缩/(例,%) 19(59.38) 胰体尾 2(6.25) 轻度萎缩 4(12.50) 胰尾 3(9.38) 明显萎缩 15(46.88) 表 2 32例不可切除胰腺癌患者IORT后影像参数对比
Table 2 Comparisons of imaging parameters post-IORT in 32 patients with unresectable pancreatic cancer
时间点 参数对比 统计检验 IORT前 IORT后 统计量 P LA/cm 4.54±1.30 3.99±1.48 3.2 0.00a SA/cm 3.00(2.50,4.00) 2.80(1.98,3.68) - 0.12b A/mm2 841.40(480.90,1110.00) 775.80(416.10,901.90) - 0.12b 注:a-配对t检验;b-Wilcoxon符号秩检验,Graphpad prism无统计值;非正态分布计量资料用M(Q1,Q3)表示。 表 3 IORT肿瘤负荷3组间患者基本情况及影像参数比较
Table 3 Comparisons of patients' basic information and imaging parameters among the three IORT tumor burden groups
组别 IORT前 IORT后 统计量 P 缩小组(n=14) LA/cm 4.34±1.22 3.14±1.07 5.16 0.00d SA/cm 3.00±0.93 2.27±0.83 5.05 0.00d A/mm2 701.20±365.50 506.70±283.60 2.62 0.02d 稳定组(n=12) LA/cm 5.01±1.47 4.61±1.58 2.29 0.04d SA/cm 2.95(2.58,4.00) 3.10(2.53,4.00) - 0.69e A/mm2 952.60(644.10,1305.00) 811.70(576.6,1057) - 0.58d 增大组(n=6) LA/cm 4.08±0.99 4.75±1.23 5.82 0.00d SA/cm 3.38±1.10 3.97±1.48 1.48 0.20d A/mm2 927.40(517.40,1538.00) 1295.38(724.80,2135.00) - 0.44d 统计量 LA/cm 1.34a 5.32a SA/cm 0.35a 9.06c A/mm2 4.37c 7.60c P LA/cm 0.28 0.01 SA/cm 0.71 0.01 A/mm2 0.11 0.02 注:a-F值;b-$\chi^2 $值;c-Kruskal-Wallis检验;d-配对t检验;e-Wilcoxon符号秩检验,Graphpad prism无检验值。两两比较:缩小组LA与稳定组LA在IORT后同期比较,缩小组LA与增大组LA在IORT后同期比较,缩小组SA与增大组SA在IORT后同期比较,均P<0.05。 表 4 不可切除胰腺癌IORT后肿瘤负荷变化的应答时间(天)
Table 4 Response time to tumor burden changes after IORT for unresectable pancreatic cancer (day)
肿瘤负荷(LA) n(%) 时间范围
(Post-IORT)中位时间
(Post-IORT)最早时间
(Post-IORT)缩小 14(43.75) 15~53 39 15 稳定 12(37.50) 18~60 35 18 增大 6(18.75) 26~53 42 26 表 5 不可切除胰腺癌IORT后肿瘤负荷变化与应答时间相关性(天)
Table 5 Correlation of tumor burden changes and response time after IORT for unresectable pancreatic cancer (day)
组别 LA vs. 应答时间($ \bar{x}\pm s $)(范围) ΔLA($ \bar{x}\pm s $) 统计检验 r P 缩小组 (n=14) LA 39.57±11.77(15~53) -1.21±0.88 0.20 0.50 SA -0.73±0.54 0.16 0.59 A -194.54±277.91 0.27 0.34 稳定组 (n=12) LA 38.08±12.87(18~60) -0.40±0.60 -0.18 0.58 SA 0.07±0.36 -0.68 0.01 A -182.73±630.28 0.17 0.61 增大组(n=6) LA 41.17±10.42(26-53) 0.67±0.28 0.79 0.06 SA 0.58±0.96 0.40 0.43 A 217.32±453.19 -0.06 0.92 表 6 不同肿瘤负荷组影像参数变化
Table 6 Changes of imaging parameters in different tumor burden groups
组别 ΔLA/% ΔLA/cm ΔSA/% ΔSA/cm ΔA/% ΔA/mm2 缩小组(n=14) -27.53 -1.21 -5.05 -0.09 -0.68 373.33 稳定组(n=12) -8.51 -0.40 3.12 0.03 -13.67 383.87 增大组(n=6) 16.14 0.67 -25.02 -0.82 -22.01 806.57 表 7 32例胰腺肿瘤影像参数变化与IORT放射剂量(Dose)的相关性
Table 7 Correlation between the changes of imaging parameters and IORT radiation dose of 32 patients with pancreatic cancers
相关系数及其检验 剂量 vs.ΔA% 剂量 vs.ΔA 剂量 vs.ΔLA% 剂量 vs.ΔLA 剂量 vs.ΔSA% 剂量 vs.ΔSA r 0.13 0.06 0.40 0.39 -0.26 -0.21 P 0.47 0.75 0.02 0.03 0.15 0.25 表 8 肿瘤负荷3组内变化与IORT剂量(Dose)的相关性
Table 8 Correlation between the changes of imaging parameters and IORT dose within the tumor burden groups
组别 相关系数
及其检验剂量 vs.ΔLA/% 剂量 vs.ΔLA 剂量 vs.ΔSA/% 剂量 vs.ΔSA 剂量 vs.ΔA/% 剂量 vs.ΔA 缩小组
(n=14)r 0.45 0.36 -0.39 -0.29 0.06 -0.19 P 0.11 0.21 0.17 0.31 0.83 0.52 稳定组
(n=12)r 0.57 0.66 -0.31 -0.10 0.16 0.30 P 0.05 0.02 0.33 0.75 0.61 0.35 增大组
(n=6)r 0.20 0.26 0.14 -0.12 0.17 0.90 P 0.71 0.61 0.80 0.82 0.75 0.01 -
[1] ELASHWAH A, ALSUHAIBANI A, ALZAHRANI A, et al. The use of intraoperative radiation therapy (IORT) in multimodal management of cancer patients: A single-institution experience[J]. The Journal of Gastrointestinal Cancer, 2022. doi: 10.1007/s12029-021-00786-9
[2] World Health Organization. World health organization handbook for reporting results of cancer treatment[S]. Geneva: World Health Organization, 1979.
[3] CHALIAN H, TÖRE H G, HOROWITZ J M, et al. Radiologic assessment of response to therapy: Comparison of RECIST versions 1.1 and 1.0[J]. Radiographics, 2011, 31(7): 2093−2105. doi: 10.1148/rg.317115050
[4] JAGODA P, FLECKENSTEIN J, SONNHOFF M, et al. Diffusion-weighted MRI improves response assessment after definitive radiotherapy in patients with NSCLC[J]. Cancer Imaging, 2021, 21(1): 15.
[5] 闵旭红, 宋奇隆, 余永强, 等. 三维CT定量联合定性参数的logistic回归模型对纯磨玻璃结节侵袭程度的临床预测价值[J]. 中华放射学杂志, 2021,55(1): 34−39. doi: 10.3760/cma.j.cn112149-20200318-00416 MIN X H, SONG Q L, YU Y Q, et al. The clinical value of the logistic regression model with a combination of three-dimensional CT quantitative and qualitative parameters in predicting the invasiveness of pure ground glass nodules[J]. Chinese Journal of Radiology, 2021, 55(1): 34−39. (in Chinese). doi: 10.3760/cma.j.cn112149-20200318-00416
[6] NISHINO M, GIOBBIE‑HURDER A, GARGANO M, et al. Developing a common language for tumor response to immunotherapy: Immune‑related response criteria using unidimensional measurements[J]. Clinic Cancer Research, 2013, 19(14): 3936‑3943.
[7] CHUONG M D, HAYMAN T J, PATEL M R, et al. Comparison of 1-, 2-, and 3-dimensional tumor response assessment after neoadjuvant GTX-RT in borderline-resectable pancreatic cancer[J]. Gastrointestinal Cancer Research, 2011, 4(4): 128−134.
[8] WELSH J L, BODEKER K, FALLON E, et al. Comparison of response evaluation criteria in solid tumors with volumetric measurements for estimation of tumor burden in pancreatic adenocarcinoma and hepatocellular carcinoma[J]. American Journal of Surgery, 2012, 204(5): 580−585. doi: 10.1016/j.amjsurg.2012.07.007
[9] NISHIMURA A, OTSU H, ITOH I, et al. Response of pancreatic tumor to intraoperative radiotherapy: Medical imaging and pathologic system approach[J]. The Journal of Computed Tomography, 1987, 11(1): 5−15. doi: 10.1016/0149-936X(87)90026-9
[10] KANAMORI S, NISHIMURA Y, KOKUBO M, et al. Tumor response and patterns of failure following intraoperative radiotherapy for unresectable pancreatic cancer: Evaluation by computed tomography[J]. Acta Oncologica, 1999, 38(2): 215−220. doi: 10.1080/028418699431645
[11] 吴莉莉, 许耀麟, 楼文晖. 放射治疗在胰腺癌治疗中的应用现状和展望[J]. 外科理论与实践, 2022,27(1): 25−29. WU L L, XU Y L, LOU W H. Application and prospect of radiotherapy in pancreatic cancer[J]. Journal of Surgery Concepts & Practice, 2022, 27(1): 25−29. (in Chinese).
[12] LIERMANN J, MUNTER M, NAUMANN P, et al. Cetuximab, gemcitabine and radiotherapy in locally advanced pancreatic cancer: Long-term results of the randomized controlled phase II PARC trial[J]. Clinical and Translational Radiation Oncology, 2022, 34: 15−22. doi: 10.1016/j.ctro.2022.03.003
[13] HAMA Y, TATE E. High-dose planned adaptive intensity-modulated radiation therapy with simultaneous integrated boost for synchronous oligometastatic pancreatic cancer[J]. Cancer Investigation, 2022, 40(5): 437−441. doi: 10.1080/07357907.2022.2049287
[14] COMITO T, COZZI L, CLERICI E, et al. Can stereotactic body radiation therapy be a viable and efficient therapeutic option for unresectable locally advanced pancreatic adenocarcinoma? Results of a phase 2 study[J]. Technology in Cancer Research and Treatment, 2017, 16(3): 295−301. doi: 10.1177/1533034616650778
[15] WA K, KARASAWA K, ITO Y, et al. Intraoperative radiotherapy for resected pancreatic cancer: A multiinstitutional retrospective analysis of 210 patients[J]. International Journal of Radiation Oncology Biology Physics, 2010, 77: 734−742. doi: 10.1016/j.ijrobp.2009.09.010
[16] SINDELAR W F, KINSELLA T J. Normal tissue tolerance to intraoperative radiotherapy[J]. Surgical Oncology Clinics of North America, 2003, 12: 925−942. doi: 10.1016/S1055-3207(03)00087-5
[17] KIM J W, CHO Y, KIM H S, et al. A phase II study of intraoperative radiotherapy using a low-energy X-ray source for resectable pancreatic cancer: A study protocol[J]. BMC Surgery, 2019, 19(1): 31. doi: 10.1186/s12893-019-0492-x
[18] CHO Y, KIM J W, KIM H S, et al. Intraoperative radiotherapy for resectable pancreatic cancer using a low-energy X-ray source: Postoperative complications and early outcomes[J]. Yonsei Medical Journal, 2022, 63(5): 405−412. doi: 10.3349/ymj.2022.63.5.405
[19] MOHAPATRA D, DAS B, SURESH V, et al. Fluvastatin sensitizes pancreatic cancer cells toward radiation therapy and suppresses radiation- and/or TGF-β-induced tumor-associated fibrosis[J]. Laboratory Investigation, 2022, 102(3): 298−311. doi: 10.1038/s41374-021-00690-7
[20] ZHANG Z, ZHANG H, SHI L, et al. Heterogeneous cancer-associated fibroblasts: A new perspective for understanding immunosuppression in pancreatic cancer[J]. Immunology, 2022, 167(1): 1-14. DOI: 10.1111/imm.13496.



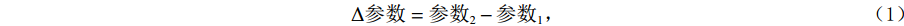



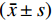
 下载:
下载:




