The Value of Radiomics Based on Spectral CT Iodine Map for Diagnosing Cervical Lymph Node Metastasis in Papillary Thyroid Carcinoma
-
摘要:
目的:探讨基于能谱CT碘图的影像组学特征对甲状腺乳头状癌患者颈部转移性淋巴结的诊断价值。方法:收集术前两周行颈部能谱CT检查的甲状腺乳头状癌患者,共纳入117枚转移性和176枚非转移性淋巴结,按照3︰1的比例随机分为训练集和验证集。从静脉期碘图中提取并筛选淋巴结的影像组学特征。采用Logistic回归分别建立影像组学模型、常规CT图像特征模型及联合模型,并绘制列线图将联合模型可视化。各模型的诊断效能、校准能力及临床实用性分别通过ROC曲线、校准曲线及决策曲线分析评估。结果:联合模型在训练集和验证集中均表现出最佳的诊断效能,其次是影像组学模型,且两者显著优于常规CT图像特征模型。所有模型均显示出良好的校准能力,决策曲线分析表明列线图的临床实用性优于其余两种模型。结论:能谱CT的影像组学特征在诊断甲状腺乳头状癌淋巴结转移方面表现出良好的性能,联合常规CT图像特征后诊断效能进一步提高。
Abstract:Objective: To investigate the value of radiomics features based on spectral CT iodine map for diagnosing metastatic cervical lymph nodes in patients with papillary thyroid carcinoma. Methods: Seventy-eight patients with papillary thyroid carcinoma who underwent cervical energy spectrum CT within two weeks before surgery were retrospectively analyzed. We included 117 metastatic, 176 non-metastatic lymph nodes, which were then randomly divided into a training set and a validation set in a 3:1 ratio. Radiomics features were extracted and screened from venous phase iodine maps. Logistic regression model was used to construct diagnostic models based on CT image features, radiomics signature, and a combination of the two, respectively; a nomogram was then drawn to visualize the combined model. The diagnostic performance, calibration ability and clinical practicability of each model were evaluated by ROC curve, calibration curve and decision curve analysis, respectively. Results: The combined model showed optimal diagnostic performance in both the training and validation sets, followed by radiomics model. These two models outperformed the CT image features model in both the training and validation sets. All models showed good calibration, and decision curve analysis demonstrated the superiority of the nomogram over the other two models in terms of clinical usefulness. Conclusion: The radiomics signature of spectral CT showed good performance in diagnosing lymph node metastasis of papillary thyroid carcinoma. The diagnostic performance was further improved when combined with CT image features, which can be a useful tool to assist in clinical decision-making.
-
Keywords:
- spectral CT /
- radiomics /
- thyroid neoplasms /
- papillary carcinoma /
- lymphatic metastasis
-
近年来由于医学影像诊断技术的不断迭代与人们对健康的日益重视,直径小于等于1 cm的甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)发病率逐年增加,而甲状腺乳头状癌病死率并未显著增加,因此PTMC的过度治疗受到日益重视[1]。2015年美国甲状腺癌治疗指南提出对低风险PTMC进行密切随访而非立即手术,其中淋巴结转移是划分低风险PTMC的重要指标之一,是肿瘤复发与预后不良的独立危险因素,是手术干预的重要指标[2-3]。PTMC淋巴转移多首先发生于颈部中央区,该区域转移淋巴结的评估具有重要意义。
鉴于目前国内尚无关于PTMC 中央区淋巴结转移(central lymph node metastasis,CLNM)的CT研究,本研究旨在通过CT及临床病理参数建立PTMC CLNM的二元Logistic回归模型,并以ROC曲线(receiver operating characteristic curve,ROC曲线)对该模型进行评价,从而为甲状腺外科医师治疗方案的选择提供依据。
1. 资料与方法
1.1 一般资料
本研究为回顾性研究,医院伦理委员会免除了患者的知情同意。回顾2019年1月至2021年6月,成都市第三人民医院病理证实为PTMC患者的临床病理及CT资料。
本研究共纳入157位患者,术前行CT平扫+增强扫描,患者年龄21~75(43.8±13.1)岁。36例患者行双侧中央区淋巴结清扫,121例行同侧中央区淋巴结清扫。
1.2 检查方法
使用128排Brilliance iCT扫描,患者术前行CT平扫+增强扫描。仰卧位,扫描范围自颅底至主动脉弓水平。
扫描参数:120 kV,200 mA,螺距0.800,重建层厚1.0 mm。增强扫描使用碘海醇注射液80 mL(含碘350 mg/mL),经右手背静脉注入,注射流量2.5~3.0 mL/s,注射对比剂后约50 s行单期扫描。
1.3 观测指标及统计方法
1.3.1 观测指标
两名10年CT诊断经验的医师对患者CT图像及临床病理资料进行如下分析并统计:①咬饼征:甲状腺低密度结节使甲状腺边缘高密度中断,无(图1)/有(图2~图4);咬饼征伴突出:甲状腺低密度结节使甲状腺边缘高密度中断,甲状腺边缘局限性突出,无(图1和图2)/有(图3和图4)。②增强后 PTMC边界模糊,是/否,若为多灶癌,以最大直径结节进行观察评估。③微钙化:钙化直径<2 mm,有/无。④PTMC长径≥6 mm,是/否,若为多灶癌,以最大直径结节为准。⑤PTMC位置,甲状腺上叶/下叶/峡部,若为多灶癌,以最大直径结节为准。⑥性别,男/女。⑦年龄<45岁,是/否。⑧PTMC多灶癌、CLNM情况查阅病理结果并记录。
1.3.2 统计方法
使用SPSS 22进行统计学分析,以ROC曲线得出PTMC长径预测CLNM的最佳截断值,通过χ2检验筛选出关于PTMC CLNM有统计学意义的自变量,进一步通过二元logistic回归分析,得出PTMC CLNM的独立危险因素、OR值及95% 置信区间。建立关于PTMC CLNM的二元Logistic回归模型,并以ROC曲线验证模型诊断PTMC CLNM的效能。当P值<0.05时认为有统计学差异。
2. 结果
2.1 PTMC CT及临床病理特征
157位患者共计226个PTMC,男性占22.3%(35/157),女性占77.7%(122/157);58.6%(92/157)患者<45岁,41.4%(65/157)患者≥45岁;CLNM患者占36.3%(57/157),无CLNM患者占63.7%(100/157);38.2%(60/157)患者咬饼征伴突出,44.6%(70/157)患者咬饼征不伴突出,17.2%(27/157)患者无咬饼征;77.7%(122/157)患者增强后边界模糊,22.3%(35/157)患者增强后边界清晰;38.9%(61/157)患者为多灶PTMC,61.1%(96/157)患者为单发;58.6%(92/157)患者PTMC长径≥6 mm,41.4%(65/157)患者长径<6 mm;28.7%(45/157)PTMC伴微钙化,71.3%(112/157)PTMC不伴微钙化;50.3%(79/157)患者PTMC或较大PTMC位于上叶,42.0%(66/157)患者PTMC或较大PTMC位于下叶,7.7%(12/157)患者PTMC或较大PTMC位于峡部。
2.2 PTMC CLNM统计结果
2.2.1 PTMC CLNM单因素分析结果
ROC曲线得出,当取PTMC长径≥6 mm时,约登指数最大为0.385,曲线下面积为0.732,标准误为0.061,显著性为0.002。
咬饼征、微钙化、多灶癌、PTMC长径≥6 mm、男性、年龄<45岁与PTMC CLNM的差异具有统计学意义。增强后边界模糊、PTMC位置与PTMC CLNM的差异无统计学意义。结果详见表1。
表 1 PTMC CLNM的单因素分析结果Table 1. The result of Univariate analysis in PTMC CLNM项目 特征 CLNM 统计检验 是 否 χ2 P 咬饼征 咬饼征伴突出 32 28 14.119 0.001 咬饼征不伴突出 21 49 无咬饼征 4 23 增强后边界模糊 是 43 79 0.266 0.606 否 14 21 微钙化 是 24 21 7.909 0.006 否 33 79 多灶癌 是 34 27 16.290 <0.001 否 23 73 长径≥6 mm 是 47 45 20.995 <0.001 否 10 55 PTMC位置 甲状腺上叶 28 51 0.175 0.916 甲状腺下叶 24 42 甲状腺峡部 5 7 性别 男 18 17 4.455 0.046 女 39 83 年龄<45岁 是 44 48 12.754 <0.001 否 13 52 2.2.2 PTMC CLNM二元Logistic回归分析结果
咬饼征伴突出(OR=5.159,95%CI=1.137~23.400)、多灶癌(OR=2.734,95%CI=1.215~6.154)、PTMC长径≥6 mm(OR=3.259,95% CI=1.326~8.008)、男性(OR=3.776,95% CI=1.339~10.653)、年龄<45岁(OR=3.222,95%CI=1.419~7.777)与 PTMC CLNM的差异具有统计学意义。微钙化(OR=1.952,95%CI=0.836~4.554)与PTMC CLNM的差异无显著统计学意义(表2)。
表 2 PTMC CLNM的二元Logistic回归分析结果Table 2. The result of binary Logistic regression analysis in PTMC CLNM项目 β P OR OR 95% CI 下限 上限 微钙化 0.669 0.122 1.952 0.836 4.554 多灶癌 1.006 0.015 2.734 1.215 6.154 长径≥6 mm 1.181 0.010 3.259 1.326 8.008 男性 1.329 0.012 3.776 1.339 10.653 年龄<45岁 1.201 0.006 3.322 1.419 7.777 咬饼征不伴突出 0.920 0.207 2.510 0.602 10.468 咬饼征伴突出 1.641 0.033 5.159 1.137 23.400 常数 -4.176 <0.000 0.015 — — 2.2.3 PTMC CLNM的二元Logisitc回归模型及诊断效能
根据PTMC CLNM的独立危险因素建立二元Logistic回归方程,Logit(PTMC CLNM)=-4.176+1.641×咬饼征伴突出(是)+1.006×多灶癌(是)+1.181×PTMC长径≥6 mm(是)+1.329×性别(男性)+1.201×年龄<45岁(是)。该模型Hosmer-Lemeshow检验的χ2=2.577,P=0.958,提示该模型与观测值拟合性好。
通过ROC曲线得出当截断值=0.331时,约登指数最大为0.502,曲线下面积为0.833,该模型诊断PTMC CLNM的敏感性、特异性分别为82.5%、68.0%。
3. 讨论
咬饼征是指甲状腺低密度结节使甲状腺边缘高密度中断的征象,在预测甲状腺乳头状癌CLNM中具有一定价值[4-5],其机制可能是咬饼征与肿瘤侵犯甲状腺包膜有一定联系,而甲状腺癌侵犯甲状腺包膜是CLNM的独立危险因素,文献报道伴该病理学特征的甲状腺乳头状癌CLNM的风险是无甲状腺包膜侵犯者的1.4~4.6倍[6-9]。
与既往关于甲状腺乳头状癌CLNM的研究不同[5,10-11],本研究将咬饼征进一步分层分析发现,咬饼征不伴突出是PTMC CLNM的危险因素而非独立危险因素,其CLNM的风险为无咬饼征患者的2.5倍;咬饼征伴突出是PTMC CLNM的独立危险因素,其CLNM的风险为无咬饼征患者的5.2倍。我们推测CT所观察到不伴突出咬饼征的PTMC与病理镜下所见的瘤体侵犯甲状腺包膜可能存在一致性不足,因此间接造成了该征象与CLNM数据的拟合性欠佳。而咬饼征伴突出的PTMC可能是肿瘤具有较高生物侵袭性的形态学表现,即肿瘤生长挤压甲状腺边缘使其形变,继而更易发生甲状腺包膜侵犯,从而出现淋巴结转移倾向。总的来说咬饼征伴突出较不伴突出的咬饼征可能是预测PTMC CLNM更可靠的形态学指标。
既往关于PTMC长径与CLNM的研究多基于病理或超声数据,所得出的PTMC 长径截断值也不尽相同,包括5、6 和7 mm[6-9,12],但总的来说较大的长径使得PTMC CLNM的风险增加。本研究基于增强CT得出长径≥6 mm是PTMC CLNM的独立危险因素,其CLNM的风险为长径<6 mm者的3.3倍,与既往文献研究结果基本相符。Sun等[9]通过对552例PTMC患者进行回顾性分析得出,多灶癌是PTMC CLNM的独立危险因素,该结论在本研究中也得到了印证,我们的数据显示,多灶PTMC CLNM的风险是单发者的2.7倍。
目前文献关于PTMC CLNM年龄预测节点的选择虽然存在差异,但报道结论多以45岁为主,且均提示较小的年龄存在较高的CLNM风险[9-11]。本研究经多因素分析,结果显示年龄<45岁是PTMC CLNM的独立危险因素,其CLNM的风险是≥45岁者的3.3倍。
男性是PTMC CLNM公认的预测指标,在既往报道中无争议存在,本研究也得出男性为PTMC CLNM的独立危险因素,其CLNM的风险是女性的3.8倍[2]。
微钙化是指在影像上所观察到直径<2 mm的钙化影,在既往报道中该征象在预测PTMC CLNM中尚存在一定争议,孙可敏等[12]研究并未得出微钙化与CLNM存在显著联系,而胡磊等[13]认为微钙化是PTMC的独立危险因素。本研究单因素分析结果提示微钙化与PTMC CLNM的关系存在显著性,而在多因素分析结果中差异并不显著,其CLNM的风险为无微钙化者的2.0倍。PTMC同为恶性肿瘤在生长过程中会对周围正常甲状腺组织造成一定浸润,因此我们猜想增强后PTMC边界模糊会提示肿瘤对周围正常甲状腺组织的浸润,并可能与CLNM存在一定联系。但在本研究的单因素分析结果中,PTMC增强后边界模糊与CLNM的差异无显著统计学意义,可能需要更大样本进一步明确该征象与CLNM之间的关系。
本研究中部分患者为多灶PTMC,肿瘤定位是基于较大者进行,单因素分析数据结果未提示PTC的位置分布与CLNM存在联系,但Zhang等[14]通过对1266例单发PTC的分布进行了分析,从而剔除了多灶癌可能存在的干扰,得出肿瘤位于中叶后侧、上叶前侧、上叶后侧及峡部具有较高CLNM的风险。
本研究基于上述PTMC CLNM的独立危险因素建立二元Logistic回归模型,并通过ROC曲线进行评价得出,当截断值=0.331时,约登指数最大为0.502,曲线下面积为0.833,该模型诊断PTMC CLNM的敏感性、特异性分别为82.5% 和68.0%。
本研究存在一定局限性:①本研究为回顾性研究,因此无法避免存在的选择偏倚;②受 CT软组织分辨率限制,本研究中增强CT观察最小PTMC直径为4 mm,因此无法对4 mm以下的肿瘤进行评估,同样存在一定选择偏倚;③本研究样本量可能存在不足,对部分与PTMC CLNM无明显统计学差异的征象可能存在评价不充分;④CT检查存在电离辐射,因此本研究方法可能更适合首诊而非随访。
综上所述,本研究回归模型有助于预测PTMC CLNM。咬饼征伴突出、PTMC长径≥6 mm、男性、年龄<45岁是PTMC CLNM的独立危险因素。对于上述类型患者,甲状腺外科医师应予以重视。
-
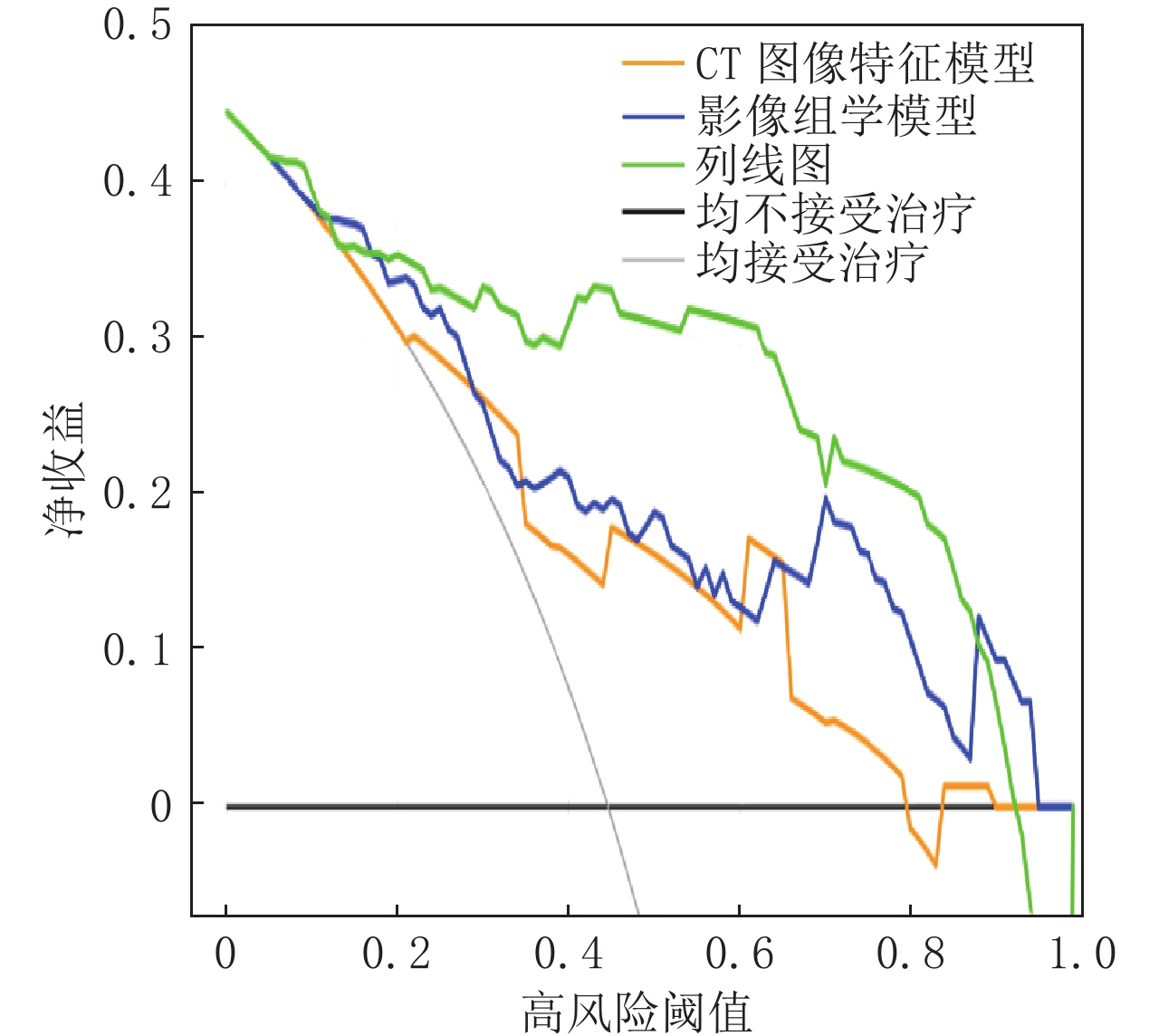
图 5 训练集(a)~(c)和验证集(d)~(f)中CT图像特征模型、影像组学模型和列线图的校准曲线,曲线越接近对角灰色虚线表示模型的预测能力越好
Figure 5. The calibration curves of the CT image feature model, radiomics model, and nomogram in the training set ((a)~(c)) and validation set ((d)~(f)). The closer the curve is to the diagonal gray dotted line, the better the predictive ability of the model
表 1 甲状腺乳头状癌患者颈部转移组与非转移组淋巴结的CT图像特征比较
Table 1 Comparison of CT image features of neck lymph nodes between metastatic and non-metastatic groups of patients with papillary thyroid carcinoma
组别 数量/枚 最大短径d/mm 形状 边缘 强化程度 5≤d<10 10≤d<35 规则 不规则 清楚 模糊 轻中度 明显 转移组 117 85 32 69 48 80 37 41 76 非转移组 176 134 42 144 32 142 34 115 61 统计检验 $\chi^2 $ 0.453 18.477 5.797 25.915 P 0.501 <0.001 <0.050 <0.001 组别 数量/枚 强化方式 钙化 囊变/坏死 结外侵犯 均匀 不均匀 有 无 有 无 有 无 转移组 117 54 63 14 103 16 101 8 109 非转移组 176 139 37 3 173 1 175 0 176 统计检验 $\chi^2 $ 33.680 13.540 22.091 Fisher P <0.001 <0.001 <0.001 <0.001 注:本研究中所测得淋巴结最大短径范围为5~35 mm。 表 2 三种模型诊断甲状腺乳头状癌颈部淋巴结转移纳入的logistic回归因素
Table 2 Logistic regression factors included in the diagnosis of cervical lymph node metastasis of papillary thyroid carcinoma by three models
模型 变量 P 回归系数 标准差 Wald值 OR值 95% CI CT图像特征模型 形状 0.013 0.746 0.302 6.113 2.108 1.167~3.806 强化程度 0.000 1.007 0.270 13.938 2.737 1.613~4.643 强化方式 <0.001 1.148 0.280 16.834 3.153 1.821~5.456 钙化 0.035 1.480 0.700 4.469 4.394 1.113~17.335 影像组学模型 firstorder_90 Percentile
_wavelet_HLH0.000 -0.994 0.273 13.281 0.370 0.216~0.631 glcm_Correlation_wavelet_LHL <0.001 -1.143 0.280 16.695 0.319 0.184~0.551 glcm_Idm_wavelet_HLH 0.518 -0.155 0.239 0.418 0.857 0.535~1.369 glcm_Imc1_wavelet_LHL 0.036 -0.638 0.305 4.388 0.528 0.290~0.959 gldm_DependenceVariance
_log_sigma_3_0_mm_3D0.094 0.335 0.200 2.812 1.398 0.945~2.068 gldm_Dependence
Variance_wavelet_HHH0.055 0.404 0.211 3.673 1.497 0.990~2.262 glrlm_GrayLevelNon
UniformityNormalized_square0.118 -0.623 0.399 2.441 0.537 0.245~1.171 glrlm_LowGrayLevel
RunEmphasis_square0.689 -0.146 0.364 0.161 0.864 0.423~1.763 shape_Elongation_original 0.005 0.525 0.187 7.889 1.690 1.171~2.436 联合模型 形状 0.000 1.408 0.384 13.465 4.086 1.926~8.666 强化程度 0.012 0.817 0.326 6.303 2.265 1.196~4.286 强化方式 0.016 0.820 0.341 5.788 2.270 1.164~4.426 钙化 0.061 1.434 0.765 3.509 4.195 0.935~18.805 Radscore <0.001 5.486 0.731 56.269 241.193 57.528~1011.227 表 3 训练集和验证集中CT图像特征模型、影像组学模型和列线图的诊断效能比较
Table 3 Comparison of diagnostic performance of the CT image feature model, radiomics model, and nomogram in training and validation sets
数据集 模型 AUC 95%CI P 灵敏度 特异度 PPV NPV 训练集 CT图像特征模型 0.746 0.682~0.802 <0.001 0.595 0.815 0.667 0.764 影像组学模型 0.832 0.776~0.879 0.061 0.857 0.689 0.632 0.886 列线图 0.870 0.818~0.912 ref 0.679 0.926 0.851 0.822 验证集 CT图像特征模型 0.751 0.637~0.844 0.005 0.576 0.902 0.826 0.725 影像组学模型 0.816 0.709~0.897 0.051 0.909 0.561 0.625 0.885 列线图 0.899 0.807~0.957 ref 0.788 0.927 0.900 0.864 -
[1] MCLEOD D S, SAWKA A M, COOPER D S. Controversies in primary treatment of low-risk papillary thyroid cancer[J]. Lancet, 2013, 381(9871): 1046−1057. DOI: 10.1016/S0140-6736(12)62205-3.
[2] PARK J H, YOON J H. Lobectomy in patients with differentiated thyroid cancer: Indications and follow-up[J]. Endocrine-Related Cancer, 2019, 26(7): R381−R393. DOI: 10.1530/ERC-19-0085.
[3] CHOI J S, KIM J, KWAK J Y, et al. Preoperative staging of papillary thyroid carcinoma: Comparison of ultrasound imaging and CT[J]. American Journal of Roentgenology, 2009, 193(3): 871−878. DOI: 10.2214/AJR.09.2386.
[4] ROH J L, PARK J Y, KIM J M, et al. Use of preoperative ultrasonography as guidance for neck dissection in patients with papillary thyroid carcinoma[J]. Journal of Surgical Oncology, 2009, 99(1): 28−31. DOI: 10.1002/jso.21164.
[5] KIM E, PARK J S, SON K R, et al. Preoperative diagnosis of cervical metastatic lymph nodes in papillary thyroid carcinoma: Comparison of ultrasound, computed tomography, and combined ultrasound with computed tomography[J]. Thyroid, 2008, 18(4): 411−418. DOI: 10.1089/thy.2007.0269.
[6] LAMBIN P, LEIJENAAR R T, DEIST T M, et al. Radiomics: The bridge between medical imaging and personalized medicine[J]. Nature Reviews Clinical Oncology, 2017, 14(12): 749−762. DOI: 10.1038/nrclinonc.2017.141.
[7] GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: Images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563−577. DOI: 10.1148/radiol.2015151169.
[8] ZHOU Y, SU G Y, HU H, et al. Radiomics analysis of dual-energy CT-derived iodine maps for diagnosing metastatic cervical lymph nodes in patients with papillary thyroid cancer[J]. European Radiology, 2020, 30(11): 6251−6262. DOI: 10.1007/s00330-020-06866-x.
[9] SCOTT G C, MEIER D A, DICKINSON C Z. Cervical lymph node metastasis of thyroid papillary carcinoma imaged with fluorine-18-FDG, technetium-99m-pertechnetate and iodine-131-sodium iodide[J]. Journal of Nuclear Medicine, 1995, 36(10): 1843−1845.
[10] CHOI B, KIM D H, SON S H, et al. Usefulness of SPECT/CT for equivocal findings on I-131 whole-body scan in a patient with differentiated papillary thyroid cancer[J]. Clinical Nuclear Medicine, 2014, 39(2): E160−E2. DOI: 10.1097/RLU.0b013e318286b9bb.
[11] 中国医师协会外科医师分会甲状腺外科医师委员会, 中国研究型医院学会甲状腺疾病专业委员会. 分化型甲状腺癌颈侧区淋巴结清扫专家共识(2017版)[J]. 中国实用外科杂志, 2017, 37(9): 985−991. DOI: 10.19538/j.cjps.issn1005-2208.2017.09.13. [12] PARK J E, LEE J H, RYU K H, et al. Improved diagnostic accuracy using arterial phase CT for lateral cervical lymph node metastasis from papillary thyroid cancer[J]. American Journal of Neuroradiology, 2017, 38(4): 782−788. DOI: 10.3174/ajnr.A5054.
[13] 许晓泉, 周燕, 苏国义, 等. 联合CT图像特征和双能CT定量参数对甲状腺乳头状癌颈部淋巴结转移的诊断价值[J]. 中华放射学杂志, 2021, 55(2): 137−142. DOI: 10.3760/cma.j.cn112149-20200222-00226. XU X Q, ZHOU Y, SU G Y, et al. Integrating CT image features and quantitative dual-energy CT parameters for diagnosing metastatic lymph nodes from papillary thyroid carcinoma[J]. Chinese Journal of Radiology, 2021, 55(2): 137−142. DOI: 10.3760/cma.j.cn112149-20200222-00226. (in Chinese).
[14] 中华医学会放射学分会头颈学组. 甲状腺结节影像检查流程专家共识[J]. 中华放射学杂志, 2016, 50(12): 911−915. DOI: 10.3760/cma.j.issn.1005-1201.2016.12.003. [15] 魏培英, 蒋念东, 韩志江, 等. CT强化程度对甲状腺乳头状癌颈部淋巴结转移的诊断价值[J]. 中华内分泌外科杂志, 2020, 14(2): 144−148. WEI P Y, JIANG N D, HAN Z J, et al. Value of CT enhancement degree in diagnosing cervical lymph node metastasis of papillary thyroid carcinoma[J]. Chinese Journal of Endocrine Surgery, 2020, 14(2): 144−148. (in Chinese).
[16] KING A D, TSE G M, YUEN E H. et al. Comparison of CT and MR imaging for the detection of extranodal neoplastic spread in metastatic neck nodes[J]. European Journal of Radiology, 2004, 52(3): 264−270. DOI: 10.1016/j.ejrad.2004.03.004.
[17] CHAI R L, RATH T J, JOHNSON J T, et al. Accuracy of computed tomography in the prediction of extracapsular spread of lymph node metastases in squamous cell carcinoma of the head and neck[J]. Jama Otolaryngology-Head & Neck Surgery, 2013, 139(11): 1187−1194.
[18] HUGHES D T, HAYMART M R, MILLER B S, et al. The most commonly occurring papillary thyroid cancer in the united states is now a microcarcinoma in a patient older than 45 years[J]. Thyroid, 2011, 21(3): 231−236. DOI: 10.1089/thy.2010.0137.
[19] WANG T S, DUBNER S, SZNYTER L A, et al. Incidence of metastatic well-differentiated thyroid cancer in cervical lymph nodes[J]. Archives of Otolaryngology-Head & Neck Surgery, 2004, 130(1): 110−113.
[20] 陈雨桐, 王燕. 超声诊断甲状腺乳头状癌颈部转移淋巴结的研究进展[J]. 肿瘤影像学, 2022, 31(2): 203−207. CHEN Y T, WANG Y. Advances in ultrasonographic diagnosis of cervical lymph node metastasis in papillary carcinoma of the thyroid[J]. Oncoradiology, 2022, 31(2): 203−207. (in Chinese).
[21] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1−133. DOI: 10.1089/thy.2015.0020.
[22] LIU Z M, XUN X Q, WANG Y Z, et al. MRI and ultrasonography detection of cervical lymph node metastases in differentiated thyroid carcinoma before reoperation[J]. American Journal of Translational Research, 2014, 6(2): 147−154.
[23] 周燕, 许晓泉, 苏国义, 等. 双能CT动静脉期加权融合图像影像组学对甲状腺乳头状癌颈部淋巴结转移的诊断价值[J]. 中华放射学杂志, 2021, 55(7): 703−709. ZHOU Y, XU X Q, SU G Y, et al. Radiomics based on arterial-venous mixed images derived from dual-energy CT data in diagnosis of lymph nodes metastasis of papillary thyroid cancer[J]. Chinese Journal of Radiology, 2021, 55(7): 703−709. (in Chinese).




 下载:
下载: