The Diagnosis of Cronkhite-Canada Syndrome with CT Enterography: A Clinical Case Analysis
-
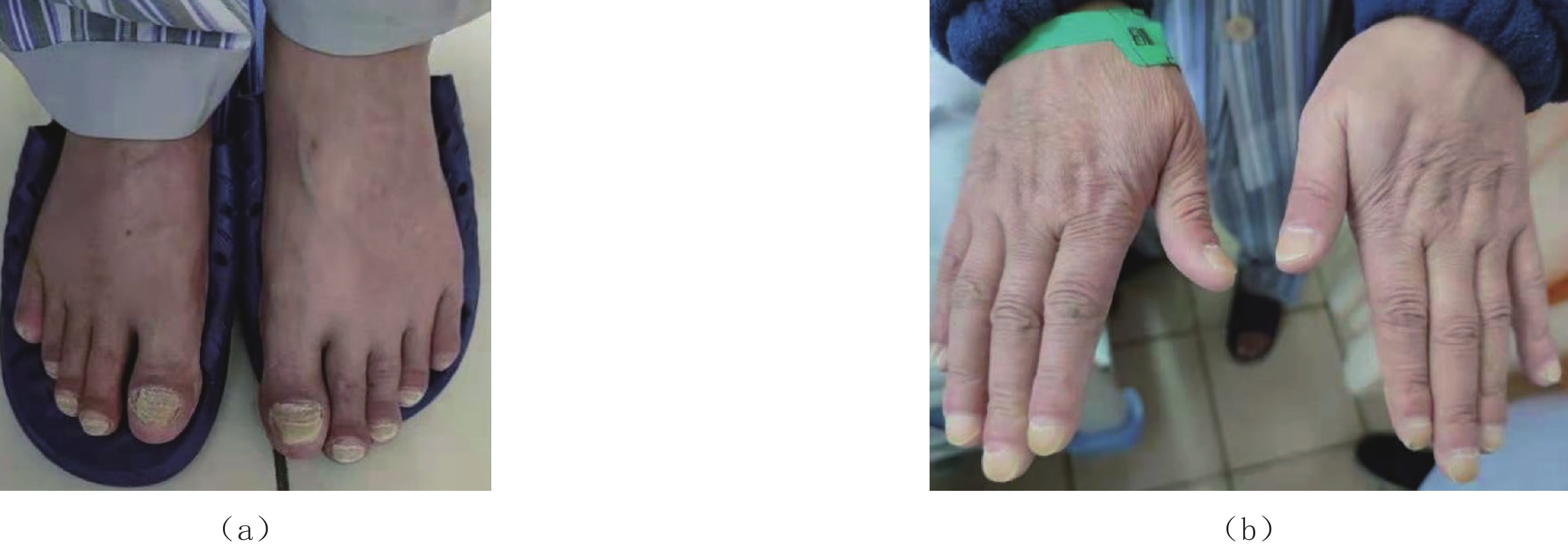
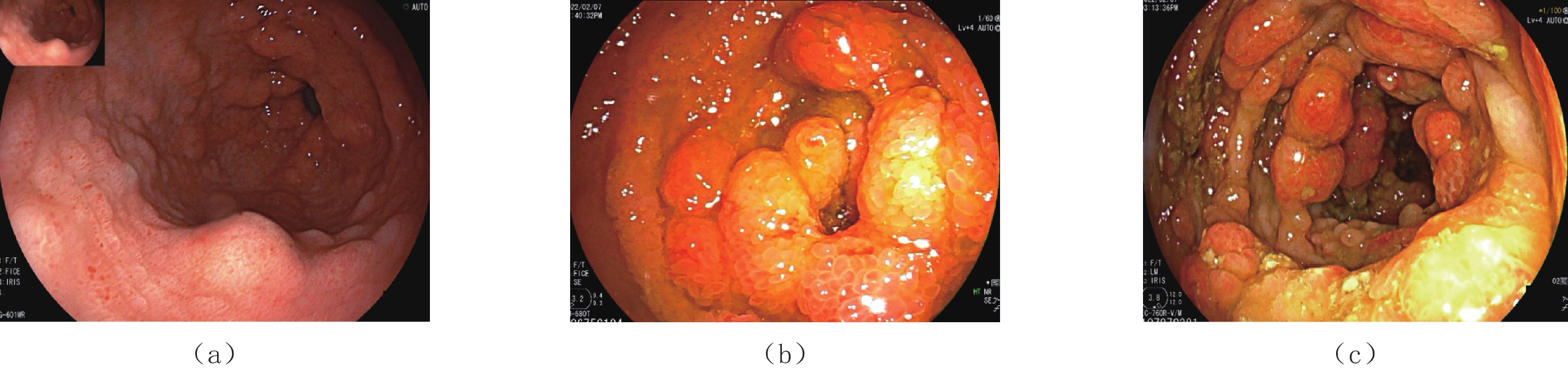
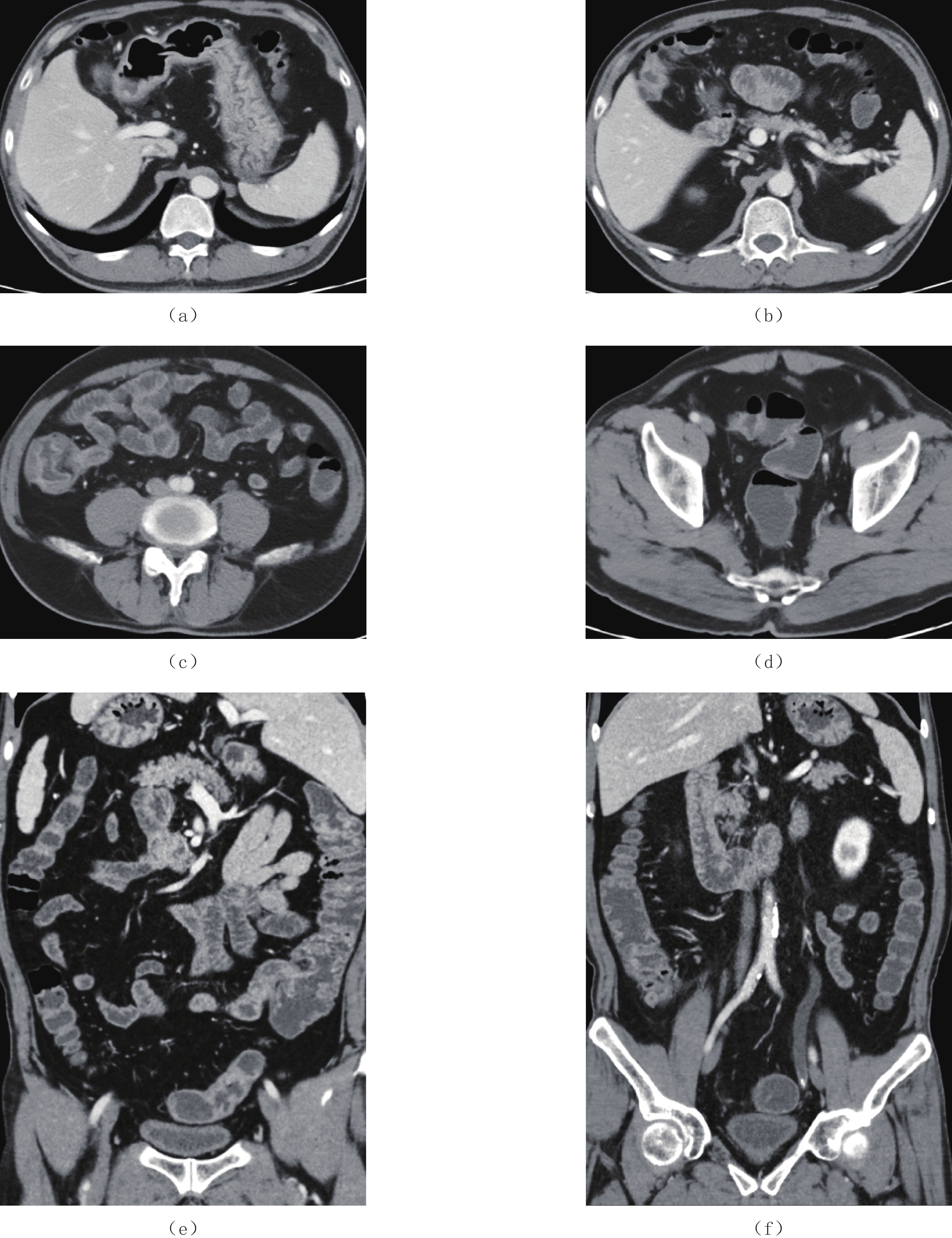
摘要: Cronkhite-Canada综合征(CCS)是一组以胃肠道弥漫性息肉和外胚层变化为特征的综合征,其临床表现主要为慢性腹泻和吸收不良,由于发病率罕见,早期发现和诊断对医生来说是一个挑战。本文报告1例CCS病例,58岁男性,临床表现为慢性水样腹泻、便血、体重减轻和皮肤变化,包括指甲营养不良和色素沉着;实验室检查结果提示贫血和低蛋白血症;CT小肠造影检查发现全消化道黏膜息肉样增生,高度怀疑CCS,随后行内镜检查证实了该诊断。患者经治疗后,症状明显好转,在近1年的随访中,CT小肠造影和内镜检查均提示明显缓解。本文对该疾病进行文献综述,旨在总结其CT小肠造影表现,以提高临床医生对本病的认识,为CCS的早期诊断提供一定的思路。
-
关键词:
- CT小肠造影 /
- 息肉-色素沉着-脱发-指(趾)甲营养不良综合征 /
- 诊断
Abstract: Cronkhite-Canada syndrome (CCS) is a rare cause of chronic diarrhea and malabsorption where patients develop multiple polyps throughout the gastrointestinal (GI) tract, accompanied by ectodermal changes. Due to its rarity, its early detection and diagnosis can be challenging for physicians. This case report described a 58-year-old male patient with CCS who presented with chronic watery diarrhea, hematochezia, weight loss, and skin changes including nail dystrophy and hyperpigmen-tation. Laboratory results showed anemia and hypoalbuminemia. He underwent CT enterography (CTE) which identified diffuse edematous polyposis in the GI tract. The CTE results were highly suspicious of CCS and a subsequent endoscopic examination confirmed the diagnosis. The patient received supportive treatment which improved his symptoms. Based on CTE and endoscopy at 1-year follow-up, the patient was deemed to be in remission. We included a literature review of CCS. The case report aimed to improve the understanding of CCS and explored the key CTE features relevant to its early diagnosis.-
Keywords:
- CT enterography /
- Cronkhite-Canada syndrome /
- diagnosis
-
类风湿关节炎(rheumatoidarthritis,RA)是一种以侵蚀性关节炎症为主要临床表现的自身免疫性疾病[1]。我国RA的患病率为0.42%,患者总数约为500万,男女比例约为1︰4[2]。肌肉减少症是RA的常见并发症,发病率约10.1%~45.1%[3]。肌肉减少症又称“肌少症”,1989年由Rosenberg首次定义为与年龄相关的肌肉量和功能的损失[4]。RA并发肌少症增加了患者骨质疏松、跌倒、骨折以及血管内皮功能障碍和心血管疾病的风险[5-7],因此早期诊断RA相关肌少症具有重要的临床意义。
目前,肌少症的影像学评估手段有双能X线吸收测定法(dual energy X-ray absorptiometry,DXA)、计算机断层扫描(coumputed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、超声(ultrasound,US)等。
本文将对类风湿关节炎并发肌少症的影像学研究进展进行综述。
1. RA相关肌少症的定义及评估意义
1.1 肌少症及RA相关肌少症
2019年,欧洲老年人肌肉减少症工作组将肌少症更新为与年龄相关的肌肉力量、肌肉量和肌肉质量以及功能3方面的减退[8]。目前对肌肉质量的定义存在争议,欧洲老年人肌肉减少症工作组对肌肉质量的评估主要包括骨骼肌脂肪浸润[8]。而美国国家老龄化研究所的跨学科研讨会认为这种骨骼肌脂肪浸润是骨骼肌缺陷中的一种独立疾病[9],并认为骨骼肌脂肪浸润包括3个组成部分:①肌细胞内脂质;②肌内脂肪组织;③肌间脂肪组织。
肌少症可继发于多种疾病,与营养不良、癌症等所导致的肌肉减少不同,RA患者常同时出现肌肉量的减少和肌肉脂肪组织的增加或稳定,而不伴有体重的明显减轻,一些研究将其定义为类风湿恶病质[10]。
1.2 RA相关肌少症的评估的意义
RA在早期阶段便可并发肌少症[11],RA并发肌少症可增加患者骨质疏松、跌倒、骨折以及血管内皮功能障碍和心血管疾病的风险[5-7],并使RA患者更容易合并其他疾病,如肥胖、血脂异常、糖尿病、慢性阻塞性肺病和乙型肝炎等[12]。
在最近的一项荟萃分析中,RA相关肌少症还可能与较高的疾病活动度有关[13]。因此对RA相关肌少症早期诊断及干涉可能有助于缓减RA疾病进展以改善患者的生活质量。与临床其他评估肌少症方法(如握力、4分钟步行速度、生物电阻抗等)相比,影像学检查技术具有客观性强、重复性高的优点,是临床定量评估肌肉量和肌肉质量的重要手段。
2. RA相关肌少症的影像学评估方法
2.1 双能X线吸收测定法
DXA因其快速、成本低以及辐射剂量低的优点成为评估肌少症最常用的影像学手段。DXA基于两束不同能量的X射线来定量评估全身或四肢的肌肉量,常用的测量指标为四肢瘦体重以及通过身高、体重或体重指数调整后的四肢瘦体重指数。
DXA能够评估RA相关的肌少症、肥胖症以及骨质疏松。在一项DXA评价RA身体成分的荟萃分析[11]中,RA患者瘦体重低于健康组,而肥胖发生率高于健康组。尽管RA合并肌少症与RA患者跌倒、骨折、骨质疏松等密切相关[5-6],但肌肉减少症定义和结果联盟[14]却认为DXA瘦体重的相关测量值不能很好地预测肌少症患者活动受限情况以及跌倒、髋部骨折和死亡的发生率。
DXA不能直接测得肌肉量,它只是对所有非脂肪及非骨组织的估计,因此其测量的准确性受患者体内水分变化的影响,此外,DXA难以对肌肉质量进行评估,并且难以准确测定躯干肌肉。
2.2 计算机断层扫描
CT被认为是无创评估肌肉量及肌肉质量的金标准[8]。CT定量评估肌肉量的常用指标包括骨骼肌横截面积以及经过身高、体重等调整得到的骨骼肌指数[15]。CT定量评估肌肉脂肪浸润主要包括两个方面:一是直接测量肌间脂肪组织,二是通过骨骼肌密度间接评估骨骼肌脂肪浸润,包括肌内脂肪组织和肌细胞内脂质[16]。然而,CT无法准确区分肌间脂肪组织和肌内脂肪组织[9]。
2.2.1 常规CT和双能CT
CT诊断肌少症的解剖部位尚未统一。腰3椎体层面骨骼肌指数是评估肌少症最常用的诊断指标[8]。腰大肌、竖脊肌等单块肌肉也可用于肌少症评估。在RA相关肌少症的研究中,腿部层面的应用更为广泛。Khoja等[16]对RA患者大腿中部层面的肌肉脂肪浸润进行了两项横断面研究:在第一项研究中,与成年对照组相比,RA患者骨骼肌密度更低,而肌间脂肪组织没有差异,结果表明骨骼肌密度比肌间脂肪组织对肌肉脂肪浸润的评估更有意义,这与其他疾病相关的肌少症得到的结果类似;在第二项研究中,RA患者的骨骼肌横截面积、骨骼肌密度、肌间脂肪组织与老年对照组没有差异,作者推测RA患者肌肉脂肪浸润模式可能类似于衰老过程。已有研究证实胸12椎体层面骨骼肌指数可代替腰3椎体层面骨骼肌指数来评估全身肌肉量的减少[17]。实际临床工作中RA患者常合并间质肺等肺部疾病,因此确定胸部层面的肌少症的诊断指标有望一站式评估RA患者肺部病变和肌少症。
双能CT(dual-energy CT,DECT)能够利用两种不同能量的X线对同一体素的不同物质进行分离。虚拟平扫技术是一种基于双能量CT成像系统的图像后处理技术,利用CT增强图像生成虚拟平扫图像,具有优化扫描流程、降低辐射剂量的优势。有研究[18]在腹部增强扫描中发现,DECT在腰3椎体层面测得的脂肪分数、虚拟平扫图像的CT值和MRI脂肪分数具有高度相关性(r=0.91)。因此通过DECT量化骨骼肌内脂肪浸润是一个新的研究方向。
2.2.2 外周定量CT
外周定量计算机断层扫描(peripheral quantitative CT,pQCT)运用较小的扫描仪器、较短的扫描时间及较低的辐射剂量来定量分析外周肢体的身体成分。在一项小样本研究中[19],pQCT测得的RA患者小腿上1/3层面的肌间脂肪组织与内脏脂肪(代谢活性脂肪)相关,即肌间脂肪组织可预测内脏脂肪导致的RA相关肌少症患者心血管疾病的发生。Roos等[20]对54例绝经后RA妇女大腿下1/3和前臂上1/3层面进行横断面研究,发现RA患者大腿骨质与肌肉面积之比增加,而前臂骨质与肌肉面积比没有差异,结果表明RA相关肌少症的肌肉萎缩存在部位差异,并且作者认为肌肉骨骼强度指数(即骨质肌肉面积比)是诊断肌少症的重要指标。
与pQCT相比,高分辨率pQCT具有高信噪比和空间分辨率、扫描速度更快、辐射剂量更低的优势。高分辨pQCT已用于老年相关肌少症肌肉脂肪浸润的研究中[21]。然而,两者均缺少统一的图像采集和分析的标准。
2.3 磁共振成像
与CT相同,MR也被认为是无创评估肌少症的金标准[8]。MRI具有无辐射、多参数和软组织分辨率高的优势,不仅可以评估肌肉量和肌肉脂肪浸润,还可以评估肌肉损伤、水肿、纤维化等。
2.3.1 磁共振波谱成像
磁共振波谱(MR spectroscopy,MRS)是目前能够进行活体组织内化学物质无创性检测的唯一方法。1H MRS可以通过测定活体脂峰及水峰下面积等参数对脂肪进行定量分析。31P MRS可评估高能磷酸盐代谢物间接反应肌细胞的能量代谢水平,有研究[22]表明衰老相关的肌少症患者肌肉中的主要磷脂成分(如磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰甘油)升高,并且与肌肉量成反比,这可能与肌细胞磷脂膜破坏有关。13C MRS已经用于测定健康人肌细胞内的糖原含量[23]。
常规使用的单体素MRS扫描范围有限,不足以代表其他肌肉变化情况,而多体素MRS可以改善这一不足,但其谱线质量容易受到磁场不均匀性的影响。
2.3.2 水-脂分离技术
MRI有多种技术对肌肉脂肪浸润进行评估,其中水-脂分离技术(即Dixon技术)是目前最常用的定量测定脂肪的方法。Friedberger等[24]使用Dixon技术对92例RA患者的手部肌肉进行研究,研究发现RA男性患者手部肌肉减少较其他疾病(如银屑病关节炎)更容易发生,而与年龄无关,并且初步表明手部相对肌肉脂肪含量(肌肉脂肪含量/肌肉体积)与相对肌肉体积(肌肉体积/手体积)呈负相关。
与 1H MRS扫描相比,Dixon技术可以提供较大扫描范围内的脂肪分布图,能够评估肌肉脂肪浸润的不均匀性。
2.3.3 扩散张量成像
扩散张量成像(diffusion tensor imaging,DTI)是扩散加权成像(diffusion-weighted imaging,DWI)最常用的高阶扩散模型。DTI可以对肌纤维进行示踪并评估肌纤维结构的微观变化,常用指标有分数各向异性和平均扩散率。Farrow等[10]对不同阶段RA患者(新发组、活动组、缓减组)的大腿肌肉进行评估,结果表明与健康组相比,3组RA患者大腿肌肉平均扩散率没有差异,平均扩散率的不敏感性可能是由水肿和脂肪对扩散的相反作用所导致的。
DTI缺点是只能识别高斯分布的水分子。近年来,其他DWI高阶扩散模型,如扩散峰度成像(diffusion kurtosis imaging,DKI)可以识别非高斯分布的水分子,能够提供更多的肌肉信息。有研究[25]使用DKI、DTI等序列评估了皮肌炎和肌肉营养不良的大腿肌肉,结果发现两组之间的平均峰度值比分数各向异性值具有更明显的差异。
2.3.4 磁共振弹性成像
磁共振弹性成像(magnetic resonance elastography,MRE)通过评估肌肉组织内的机械波传播特征(振动波长和振幅)间接反映肌肉中脂肪和纤维组织等非收缩性成分。Kennedy等[26]在老年相关肌少症中的研究表明大腿肌肉刚度与Dixon测得的脂肪分数呈负相关,即肌肉脂肪浸润可能会导致肌肉整体刚度的降低。MRE的缺点是易受肌张力和肌肉组织的各向异性的影响。
MRI虽存在成本高、禁忌症多、扫描和后处理时间长,且缺乏标准化的成像方案和测定指标的缺点,但其仍是评估肌少症最先进、最有前景的的技术。并且,与CT相比,MRI序列能更好的区分肌间脂肪组织和肌内脂肪组织。
最近,一些新兴的MRI技术已用于肌肉研究中,如 23Na MRI及 39K MRI成像技术、血氧水平依赖成像技术、化学交换饱和转移技术、超短回波时间序列技术等,然而,这些技术对软组织分辨率及空间分辨率较低,在临床中MRI诊断肌少症仍然依靠T1和T2加权序列来获得较为清晰的解剖图像来评估肌肉量、肌肉脂肪含量。
2.4 超声
超声因其便携、快速、禁忌症少、无辐射的优点常用于肌少症的初筛。欧洲老年医学会肌少症工作组在2018年确定了5个评估肌少症的超声指标,包括肌肉厚度、横截面积、肌束长度、羽状角及回声强度[27]。2021年提出了标准化的测量点,并且补充了另外4个潜在参数:肌肉体积、肌肉弹性、肌肉收缩潜力和肌肉微循环[28],其中,肌肉厚度、横截面积、肌肉体积用于评估肌肉量,其他参数用于评估肌肉质量。股直肌是目前超声评估肌少症最常用的解剖位点[29]。
Barbosa等[30]基于上臂下1/3和大腿中部的肌肉厚度等参数值,开发了与DXA测得的四肢瘦体重有良好的一致性(r2=0.90)的肌肉体积预测方程式。剪切波弹性成像技术可通过测量肌肉剪切波速度来评估肌肉弹性,即肌肉可变性和压缩之间的关系[31]。有研究[32]使用肌肉静息时横截面积与最大收缩时横截面积之比来代表肌肉收缩力。超声造影可用于评估骨骼肌微循环[33]。此外,部分研究使用声速超声来区分肌肉内的脂肪组织,Ruby等[34]分别对35名女性健康成人进行声速超声检查,研究发现测得的声速值与MRI Dixon测得的总脂肪呈高度相关,与肌内脂肪呈中度相关,因此该技术有望用于实际临床工作中。
超声的缺陷主要是测量值常受患者检查体位、肌肉收缩状态及操作者探头位置、压力、倾斜角等影响,而且部分指标的临界点尚不明确。
2.5 PET/CT及MRI/PET
正电子发射型断层扫描(positron emission tomography,PET)是一种代谢成像技术,MRI/PET、PET/CT成像结合了CT、MRI的结构、功能信息和PET分子信息,两者在癌性及炎性肌病中研究较多,但在RA相关肌少症中尚未应用。
有研究[35]使用18F-FDG-PET/CT对骨骼肌胰岛素抵抗的小鼠进行研究,结果发现运动刺激比胰岛素刺激更能促进骨骼肌葡萄糖的摄取。MRI/PET是一种更有前景的技术,Haddock等[36]发现在健康成人的骨骼肌激活时,18F-FDG摄取与肌肉T2值存在线性相关,肌肉T2值的变化可以作为葡萄糖摄取的替代指标。MRI/PET、PET/CT等多模态成像技术有望用于RA相关肌少症进一步研究,并为治疗RA肌少症提供更多思路,如运动等。
2.6 人工智能
随着人工智能的发展,身体成分的自动分割成为可能。有研究[37]使用深度神经网络的计算方法在PET-CT图像上对全身身体成分实现了自动分割,并且3D U-Net衍生的躯干体积与生物电阻抗测量的四肢瘦质量和脂肪量高度相关。Nachit等[38]使用3D U-Net算法,提取了腰部层面身体成分指标:肌肉面积以及肌间、皮下和内脏脂肪面积,结果发现肌肉脂肪浸润是无症状成人死亡风险的一个关键预测因素。此外,磁共振指纹(magnetic resonance fingerprinting,MRF)成像技术实现了短时间内同时量化组织的多种特征。
MRF已应用于动物实验中,Kim等[39]分别使用31P-MRSF和磁化特征转移技术对小鼠后肢进行扫描,两者测量的磷脂成分无统计学差异。未来,人工智能技术将为RA相关肌少症研究提供更为精准、更为便利的研究手段。
3. 总结与展望
肌少症是RA常见并发症,肌肉量减少是诊断RA相关肌少症的主要指标,近年来,肌肉脂肪浸润的评估也成为肌少症研究的热点之一。影像学技术是评估肌肉结构、功能以及分子信息的重要手段,每种检查手段都有其各自的优势(表1)。
表 1 RA相关肌少症的影像学评估方法Table 1. Comparison of imaging methods for sarcopenia assessment in rheumatoid arthritis影像学检
查技术常用检查部位
或测量点常用测量指标或参数 优点 缺点 DXA 四肢(双上肢+双下肢) ALM、ALMI 应用广,快速、成本低、辐射剂量低、有确定的临界值 受患者体内水分变化的影响,难以对肌肉质量评估、难以准确测定躯干肌肉 CT 测定部位不统一,大腿中部层面应用广泛 肌肉量:SMA、SMI
肌肉质量:IMAT、SMD金标准,定量测量不同层面或区域的肌肉和脂肪组织,扫描仪器较小、扫描时间较短及辐射剂量较低 临界值争议大,无法准确区分IMAT和IntraMAT,辐射量较大 MRI 测定部位不统一,大腿中部层面应用广泛 肌肉量:SMA、SMI
肌肉质量:Dixon技术为最常用的定量测定脂肪的方法、DTI及MRE可评估肌纤维结构的微观变化等金标准,无辐射、多参数和软组织分辨率高的优势,且更好的区分IMAT和IntraMAT 其成本高、禁忌症多、扫描和后处理时间,缺乏标准化的成像方案和测定指标 US 测定部位不统一,股四头肌(尤股直肌) 肌肉量:肌肉厚度、横截面积、肌肉体积
肌肉质量:肌束长度、羽状角;回声强度、肌肉弹性、肌肉收缩潜力初筛,便携、快速、禁忌症少、无辐射 受患者检查体位、肌肉收缩状态及操作者探头位置、压力、倾斜角等影响,指标的临界点不明确 注:DXA:双能X线吸收测定法;ALM:四肢瘦体重;ALMI:四肢瘦体重指数;CT:计算机断层扫描;SMA:骨骼肌横截面积;SMI:骨骼肌指数;IMAT:肌间脂肪组织;SMD:骨骼肌密度;IntraMAT:肌内脂肪组织;MRI:磁共振成像;Dixon技术:水-脂分离技术;DTI:扩散峰度成像;MRE:磁共振弹性成像;US:超声。 尽管CT、MRI被认为是诊断肌少症的金标准,但其检查部位及测量指标仍有争论,有待进一步研究。随着人工智能的发展,医学影像图像中的身体成分实现了较为精确自动分割,这将为临床大规模诊断肌少症提供重要基础。
近几年RA相关肌少症受到风湿科医生越来越多的关注,但目前影像学文献相对较少而临床文献较多,因此,本综述通过将当前临床研究文献中所采用的影像技术进行总结分析,希望能引起影像科医生对这一疾病的关注,未来在这个方向进行更深入的相关研究。
-
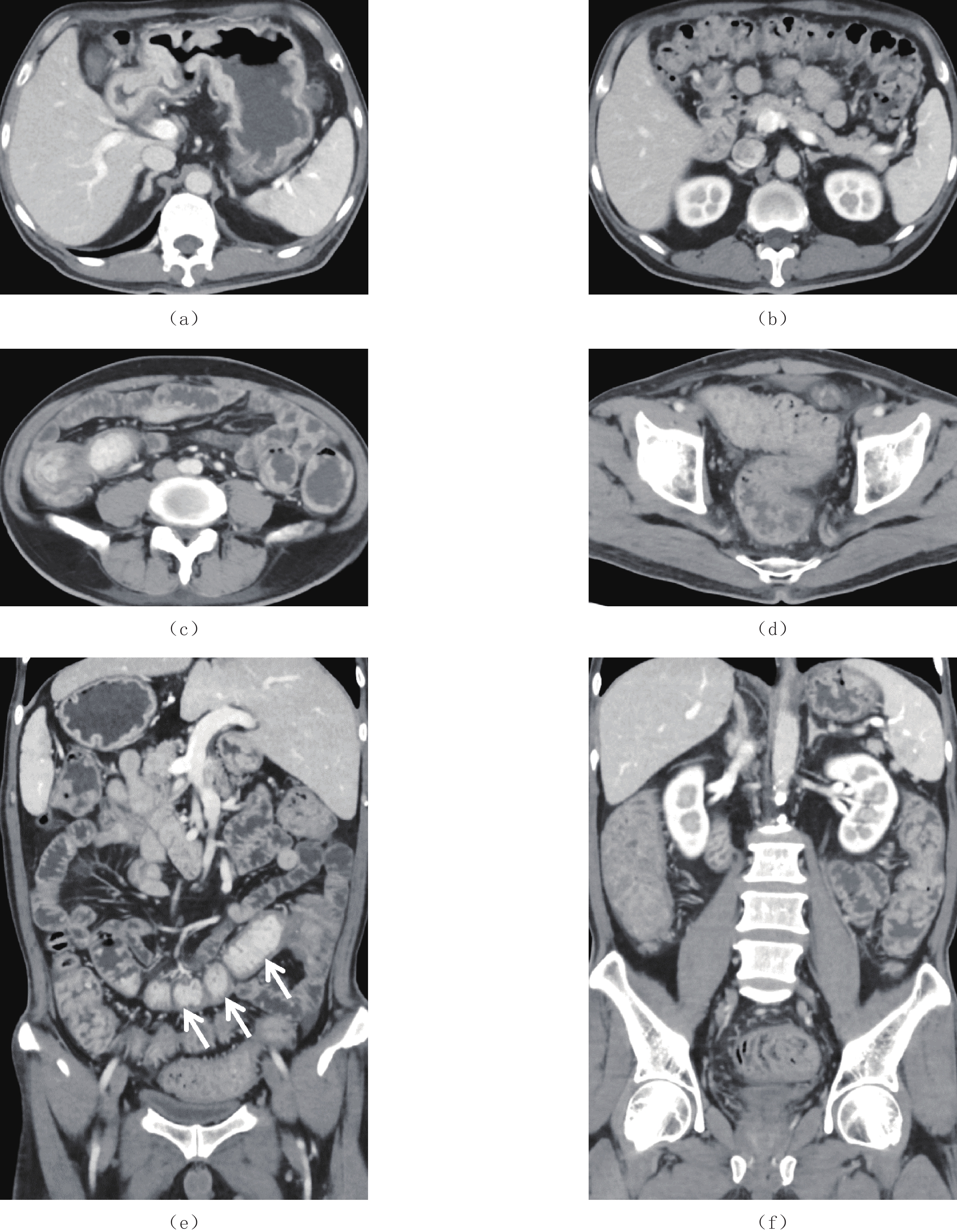
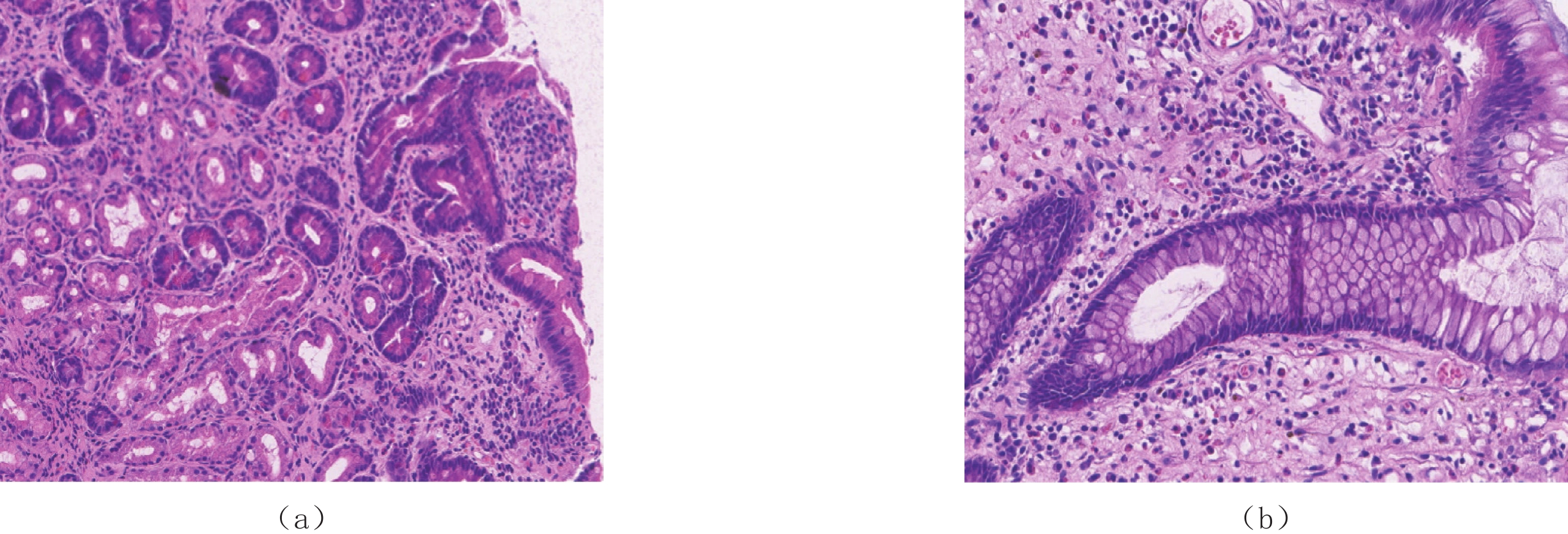
表 1 CCS CTE表现
Table 1 CT enterographic features of CCS
息肉 CTE特点 部位 胃底、胃体、胃角、胃窦、十二指肠球降段、空肠、回肠下段、末端回肠、回盲部、大肠 大小 大小不等,小者4 mm,大者2 cm,小肠中以末端回肠为著,大肠中以右半结肠为著 形态 椭圆形、指状,基底宽,蒂不明显 分布 弥漫性分布、地毯式覆盖 边界(与黏膜分界) 与黏膜分界不清,形成巨大息肉样黏膜皱襞 供血动脉 未见明显肠系膜供血动脉与其相连 强化方式 明显强化,尤以末端回肠强化更明显 并发症 末端回肠有套入右半结肠趋势,其他部位未见明显套叠;未见明显癌变征象;其他脏器未
见异常肠管周围及肠系膜淋巴结 肠管周围脂肪间隙清晰,未见肠系膜淋巴结增大 表 2 CCS患者实验室检查结果前后对照
Table 2 Laboratory results of the patient with CCS before and after treatment
实验室检查项目 第一次入院 随访 血红蛋白/(g/L) 128 141 总蛋白/(g/L) 45 65 白蛋白/(g/L) 29 39 -
[1] CRONKHITE L W, CANADA W J. Generalized gastrointestinal polyposis; An unusual syndrome of polyposis, pigmentation, alopecia and onychotrophia[J]. New England Journal of Medicine, 1955, 252(4): 1011−10152.
[2] WATANABE C, KOMOTO S, TOMITA K, et al. Endoscopic and clinical evaluation of treatment and prognosis of Cronkhite-Canada syndrome: A Japanese nationwide survey[J]. Journal of gastroenterology, 2016, 51(4): 327−336. doi: 10.1007/s00535-015-1107-7
[3] 陈鑫, 李变霞, 朱兰平, 等. 罕见的息肉病-Cronkhite-Canada综合征[J]. 世界华人消化杂志, 2019,27(16): 977−983. [4] IQBAL U, CHAUDHARY A, KARIM M A, et al. Cronkhite-Canada syndrome: A rare cause of chronic diarrhea[J]. Gastroenterology Research, 2017, 10(3): 196−198. doi: 10.14740/gr820w
[5] 晁帅恒, 李修岭, 张梦婷, 等. Cronkhite-Canada综合征83例临床分析[J]. 中国临床研究, 2018,31(3): 397−399. doi: 10.13429/j.cnki.cjcr.2018.03.028 [6] SWEETSER S, AHLQUIST D A, OSBORN N K, et al. Clinicopathologic features and treatment outcomes in Cronkhite-Canada syndrome: Support for autoimmunity[J]. Digestive Diseases and Sciences, 2012, (2): 496−502.
[7] TAYLOR S A, KELLY J, LOOMES D E. Cronkhite-Canada syndrome: Sustained clinical response with Anti-TNF therapy[J]. Case Reports in Medicine, 2018: 9409732. DOI: 10.1155/2018/9409732.
[8] TRIANTAFILLIDIS J K, KOUGIOUMTZIAN A, LEIVADITOU A. et al. Cronkhite-Canada syndrome associated with a giant cell bone tumor[J]. Journal of Gastrointestinal and Liver Diseases, 2012, 21(4): 345.
[9] WANG J, ZHAO L, MA N, et al. Cronkhite-Canada syndrome associated with colon cancer metastatic to liver: A case report[J]. Medicine, 2017, 96(38): e7466. doi: 10.1097/MD.0000000000007466
[10] PIRACCINI B M, RECH G, SISTI A, et al. Twenty nail onychomadesis: An unusual finding in Cronkhite-Canada syndrome[J]. Journal of the American Academy of Dermatology, 2010, 63(1): 172−174. doi: 10.1016/j.jaad.2009.04.036
[11] YASUDA T, UEDA T, MATSUMOTO I, et al. Cronkhite-Canada syndrome presenting as recurrent severe acute pancreatitis[J]. Gastrointestinal Endoscopy, 2008, 67(3): 570−572. doi: 10.1016/j.gie.2007.07.041
[12] GOTO A. Cronkhite-Canada syndrome: Epidemiological study of 110 cases reported in Japan[J]. Nippon Geka Hokan. Archiv Für Japanische Chirurgie, 1995, 64(1): 3−14.
[13] CHRISTIAN M, ANDREAS S, VAVRICKA S R, et al. ECCO-ESGAR guideline for diagnostic assessment in IBD part 1: Initial diagnosis, monitoring of known IBD, detection of complications[J]. Journal of Crohn's and Colitis, 2019, 13(2): 144−164. doi: 10.1093/ecco-jcc/jjy113
[14] UEYAMA H, FU K, OGURA K, et al. Successful treatment for Cronkhite-Canada syndrome with endoscopic mucosal resection and salazosulfapyridine[J]. Techniques in Coloproctology, 2014, 18(5): 503−507. doi: 10.1007/s10151-012-0863-0
[15] SLAVIK T, MONTGOMERY E A. Cronkhite-Canada syndrome six decades on: The many faces of an enigmatic disease[J]. Journal of Clinical Pathology, 2014, 67(10): 891−897. doi: 10.1136/jclinpath-2014-202488



 下载:
下载: