The Value of Chest Computed Tomography in the Review of Patients with Novel Coronavirus Pneumonia
-
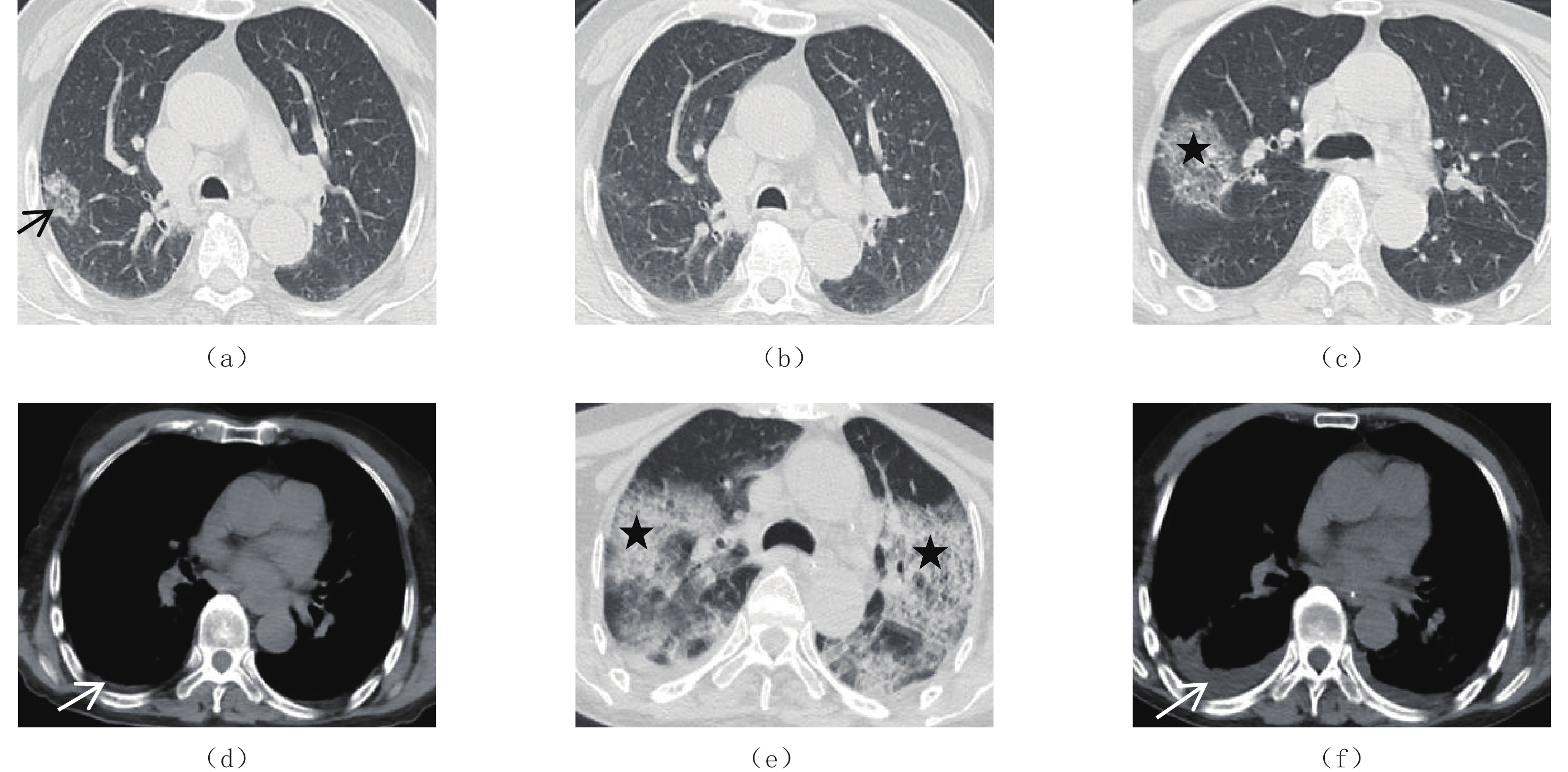
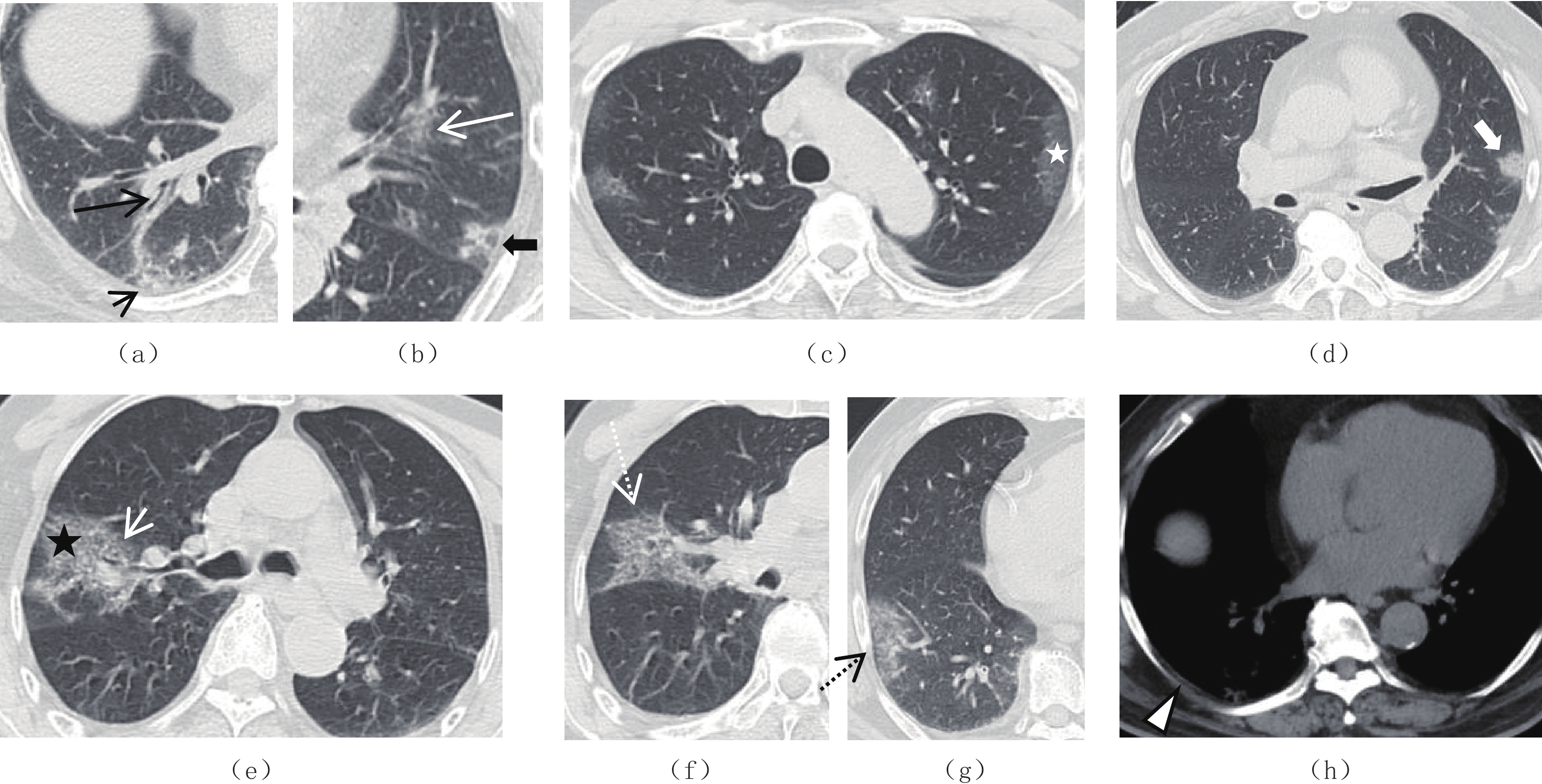
摘要: 目的:回顾性分析胸部平扫CT对不同年龄患者新型冠状病毒感染初次诊断及动态变化的临床价值。材料与方法:收集2022年11月12日至2023年1月6日确诊新冠肺炎并行胸部薄层CT检查患者52例,所有患者1个月内再次行胸部CT复查,并有较完整的临床资料。根据患者年龄(60岁和>60岁)将患者分为两组,比较两组患者的CT表现特征的差异性,同时观察所有患者CT复查的情况。结果:52例患者肺部病变中,24例累及气道(46.2%)、21例累及血道(40.4%)。年龄组间的对比显示病变部位(单/双肺、气道)、树芽、大片形态、纤维条索、间质性改变、胸膜增厚的差异有统计学意义。52例患者中,复查CT显示病变进展者18例,表现为范围增大者18例(100%)、实变加重者7例(38.9%)、GGO加重者14例(77.8%)、胸腔积液增多者6例(33.3%);复查CT显示病变缓解者34例,其中范围减小者31例(91.2%)、密度变淡者6例(17.6%)、纤维机化12例(35.3%)、完全吸收2例(5.9%)、胸腔积液减少4例(11.8%)。结论:新冠肺炎患者CT表现多种多样,不同年龄段患者的影像表现不同,60岁以上患者在累及双肺、气道,大片状GGO形态,合并纤维条索,间质性改变以及胸膜增厚上较60岁以下患者更多。治疗后肺部病变变化较快,多数患者可吸收缩小、密度变淡或纤维机化,少数患者范围增大、实变或GGO加重、并出现胸腔积液等。胸部平扫CT有助于临床医生早期诊断和动态评估新冠肺炎。Abstract: Objective: To retrospectively analyze the clinical value of chest plain computed tomography (CT) for the initial diagnosis and dynamic changes of early novel coronavirus pneumonia (2019 novel Coronavirus, 2019-nCoV, referred to as new coronavirus pneumonia). Materials and methods: Fifty-two patients with confirmed new coronavirus pneumonia diagnoses and positive chest CT manifestations from November 12, 2022, to January 6, 2023, in the infection department of our hospital were collected. All patients had two chest thin-section CT examinations within 1 month from the onset of the disease and had complete clinical data. Patients were divided into two groups according to their age (60 years and >60 years), and the differences in CT performance characteristics between the two groups were compared. The CT review of all patients was also observed. Results: Among the 52 patients, 52 involved the lungs (100%), 24 involved the airways (46.2%), and 21 involved the bloodways (40.4%). Comparison between age groups showed statistically significant differences in lesion location (single/both lungs, airways), tree-in-bud pattern, large morphology, fibrous striae, interstitial changes, and pleural thickening. Among the 52 patients, review CT showed lesion progression in 18 cases (34.6%), which showed an increase in extent in 18 cases (100%), aggravation of solid changes in 7 (38.9), aggravation of GGO in 14 (77.8%), and increase in pleural effusion in 6 (33.3%); review CT showed lesion remission in 18 cases (34.6%), which showed a decrease in extent in 31 (91.2%), 6 (17.6%) with reduced density, 12 (35.3%) with fibrosis, 2 (5.9%) with complete resorption, and 4 (11.8) with reduced pleural effusion. Conclusion: The CT scan of the chest in neocoronary pneumonia has certain characteristics, and for the first time, it mostly showed multiple patchy signs or large patchy ground glass opacity (GGO) with mainly subpleural distribution in the periphery of both lungs, mostly accompanied by "halo sign," "anti-halo sign," and "paving stone sign." The lung is more susceptible to change following treatment. After treatment, the lung lesions change rapidly, with most patients showing absorption and shrinkage, density fading, or fibrosis and a few patients showing increased extent, solidity or aggravation of GGO, and pleural effusion. Chest plain CT helps clinicians in the early diagnosis and dynamic evaluation of neocoronary pneumonia.
-
Keywords:
- CT /
- diagnosis /
- novel coronavirus /
- pneumonia
-
-
表 1 不同年龄患者组的CT表现
Table 1 CT performance of different patient age groups
项目 参数 总(n=52) ≥60(n=40) <60(n=12) $\chi^2$ P 累及部位 肺脏 52(100.0) 40(100.0) 12(100.0) - >0.999 单肺 10(19.3) 4(10.0) 6(50.0) 双肺 42(80.7) 36(90.0) 6(50.0) 7.108 0.008* 气道 24(46.2) 22(55.0) 2(16.7) 5.458 0.024* 血道 21(40.4) 15(37.5) 6(50.0) 0.192 0.661 形态优势 树芽 6(11.5) 2(5.0) 4(33.3) - 0.021* 斑片 17(32.7) 11(27.5) 6(50.0) 1.224 0.269 大片 19(36.5) 18(45.0) 1(8.3) 3.888 0.049* 密度优势 GGO 41(78.9) 33(82.5) 8(66.7) 0.601 0.438 实变 6(11.5) 4(10.0) 2(16.7) - 0.612 网格 4(7.69) 2(50.0) 2(16.7) - 0.224 相关征象 晕征 15(28.8) 8(20.0) 7(59.3) 4.873 0.027 反晕征 12(23.1) 9(22.5) 3(25.0) <0.001 0.999 铺路石征 7(13.5) 7(17.5) 0(0.0) 1.157 0.282 支气管充气征 5(9.6) 3(7.5) 2(16.7) - 0.325 拱廊征 9(17.3) 7(17.5) 2(16.7) <0.001 0.999 胸膜下黑线 20(38.5) 17(42.5) 3(25.0) 0.569 0.450 纤维索条 33(63.5) 32(80.0) 1(8.3) 17.472 0.001* 伴随病变 间质性改变 22(42.3) 21(52.5) 1(8.3) 7.377 0.008* 支气管扩张 10(19.2) 10(25.0) 0(0.0) - 0.092 胸腔积液 6(11.5) 5(12.5) 1(8.3) - 0.999 胸膜增厚 37(71.2) 36(90.0) 1(8.3) 26.148 0.001* 注:*-P<0.05。 表 2 胸部CT病灶变化特点
Table 2 Characteristics of lesion changes on chest CT
组别 病灶变化 病例数(N1/N2)* 百分比/% 进展(n=18) 范围增大 18/18 100.0 实变加重 7/18 38.9 GGO加重 14/18 77.8 胸水增多 6/18 33.3 缓解(n=34) 范围减小 31/34 91.2 密度变淡 6/34 17.6 纤维机化 12/34 35.3 完全吸收 2/34 5.9 胸水减少 4/34 11.8 注:*-数据用分子/分母表示,分子为影像学表现阳性的病例数,分母为该变化趋势(加重/减轻)总人数。 -
[1] SHI H, HAN X, JIANG N, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: A descriptive study[J]. Infectious Diseases, 2020, 20(4): 425−434.
[2] WANG H, LUO L, LV W, et al. Comparison of chest CT features between progressive and nonprogressive patients with COVID-19 pneumonia: A Meta-analysis[J]. Medicine (Baltimore), 2022, 101(39): e30744.
[3] LI Q, GUAN X, WU P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia[J]. New England Journal of Medicine, 2020, 382: 1199−207.
[4] CUI J, LI F, SHI Z L. Origin and evolution of pathogenic coronaviruses[J]. Nature Reviews. Microbiology, 2019: 181−92.
[5] PRADHAN M, SHAH K, ALEXANDER A, et al. COVID-19: Clinical presentation and detection methods[J]. Journal of Immunoassay & Immunochemistry, 2022, 43: 1951291. DOI: 10.1080/15321819.2021.1951291.
[6] 向容, 刘翔雏, 吴勇. 新型冠状病毒肺炎的CT表现[J]. 中国CT和MRI杂志, 2022,20(7): 70−72. DOI: 10.3969/j.issn.1672-5131.2022.07.023. XIANG R, LIU X C, WU Y. Application of chest CT in patients with novelcoronavirus pneumonia[J]. Chinese Journal of CT and MR, 2022, 20(7): 70−72. DOI: 10.3969/j.issn.1672-5131.2022.07.023. (in Chinese).
[7] 孙莹, 李玲, 刘晓燕, 等. 早期新型冠状病毒肺炎的胸部薄层平扫CT表现特征[J]. CT理论与应用研究, 2023,32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. SUN Y, LI L, LIU X Y, et al. Imaging features of early COVID-19 on chest thin-slice non-enhanced CT[J]. CT Theory and Applications, 2023, 32(1): 131−138. DOI: 10.15953/j.ctta.2023.006. (in Chinese).
[8] YANG S, LEE G W M, CHEN C M, et al. The size and concentration of droplets generated by coughing in human subjects[J]. Journal of Aerosol Medicine, 2007, 20(4): 484−494. doi: 10.1089/jam.2007.0610
[9] YE Z, ZHANG Y, WANG Y, et al. Chest CT manifestations of new coronavirus disease 2019 (COVID-19): A pictorial review[J]. European Radiology, 2020, 30(8): 4381−4389.
[10] LEE Y R, CHOI Y W, LEE K J, et al. CT halo sign: The spectrum of pulmonary diseases[J]. The British Journal of Radiology, 2005, 78(933): 862−865.
[11] 吴姗姗, 朱丽萍, 杜北珏, 等. 新型冠状病毒肺炎的临床表现及CT影像学特点[J]. 中国CT和MRI杂志, 2022,20(6): 71−73. DOI: 10.3969/j.issn.1672-5131.2022.06.023. WU S S, ZHU L P, DU B Y, et al. Analysis of the clinical manifestations and CT imaging features of COVID-19[J]. Chinese Journal of CT and MRI, 2022, 20(6): 71−73. DOI: 10.3969/j.issn.1672-5131.2022.06.023. (in Chinese).
[12] SHI H, HAN X, ZHENG C. Evolution of CT manifestations in a patient recovered from 2019 Novel coronavirus (2019-nCoV) pneumonia in Wuhan, China[J]. Radiology, 2020, 295(1): 200269.
[13] PAN Y, GUAN H, ZHOU S, et al. Initial CT findings and temporal changes in patients with the novel coronavirus pneumonia (2019-nCoV): A study of 63 patients in Wuhan, China[J]. European Radiology, 2020, 30(6): 3306−3309.
[14] WU J, WU X, ZENG W, et al. Chest CT findings in patients with coronavirus disease 2019 and its relationship with clinical features[J]. Investigative Radiology, 2020, 55(5): 257−261. doi: 10.1097/RLI.0000000000000670
[15] SONG F, SHI N, SHAN F, et al. Emerging 2019 novel coronavirus (2019-nCoV) pneumonia[J]. Radiology, 2020, 295(1): 210−217. doi: 10.1148/radiol.2020200274
[16] KOO H J, LIM S, CHOE J, et al. Radiographic and CT features of viral pneumonia[J]. Radiographics, 2018, 38(3): 719−739. doi: 10.1148/rg.2018170048
-
期刊类型引用(8)
1. 何诗韵,胡兴荣,梁宗辉. 多发恶性骨肿瘤的影像诊断思维. 影像诊断与介入放射学. 2024(05): 384-388 .  百度学术
百度学术
2. 邓琦,徐志锋,周涛,潘爱珍,杨冠英. 长骨骨巨细胞瘤影像学表现与病理分期的相关性分析. 中国CT和MRI杂志. 2022(08): 169-171+176 .  百度学术
百度学术
3. 董攀,许元智,尹帅,李金彪. 骨巨细胞瘤八例误诊原因分析. 临床误诊误治. 2021(01): 22-25 .  百度学术
百度学术
4. 谢倩云,唐卓芳. 1例桡骨近端骨巨细胞瘤的影像诊断及临床治疗. 骨科. 2021(01): 85-86 .  百度学术
百度学术
5. 文华林,蒋科,柳维才. 骨巨细胞瘤临床误诊分析. 临床误诊误治. 2021(12): 16-19 .  百度学术
百度学术
6. 张立云,沈丽荣,黄聪. 骨巨细胞瘤的X线、CT表现及临床意义. 影像研究与医学应用. 2020(14): 56-58 .  百度学术
百度学术
7. 马俊丽,王志军,段立娜. 颅骨骨巨细胞瘤1例. 肿瘤影像学. 2019(01): 63-64 .  百度学术
百度学术
8. 王艳艳,陈明,蒋小莉. 不典型恶性骨巨细胞瘤一例. 海南医学. 2018(20): 2952-2954 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: