Risk Factors of Vulnerable Coronary Plaque Formation in Type 2 Diabetes
-
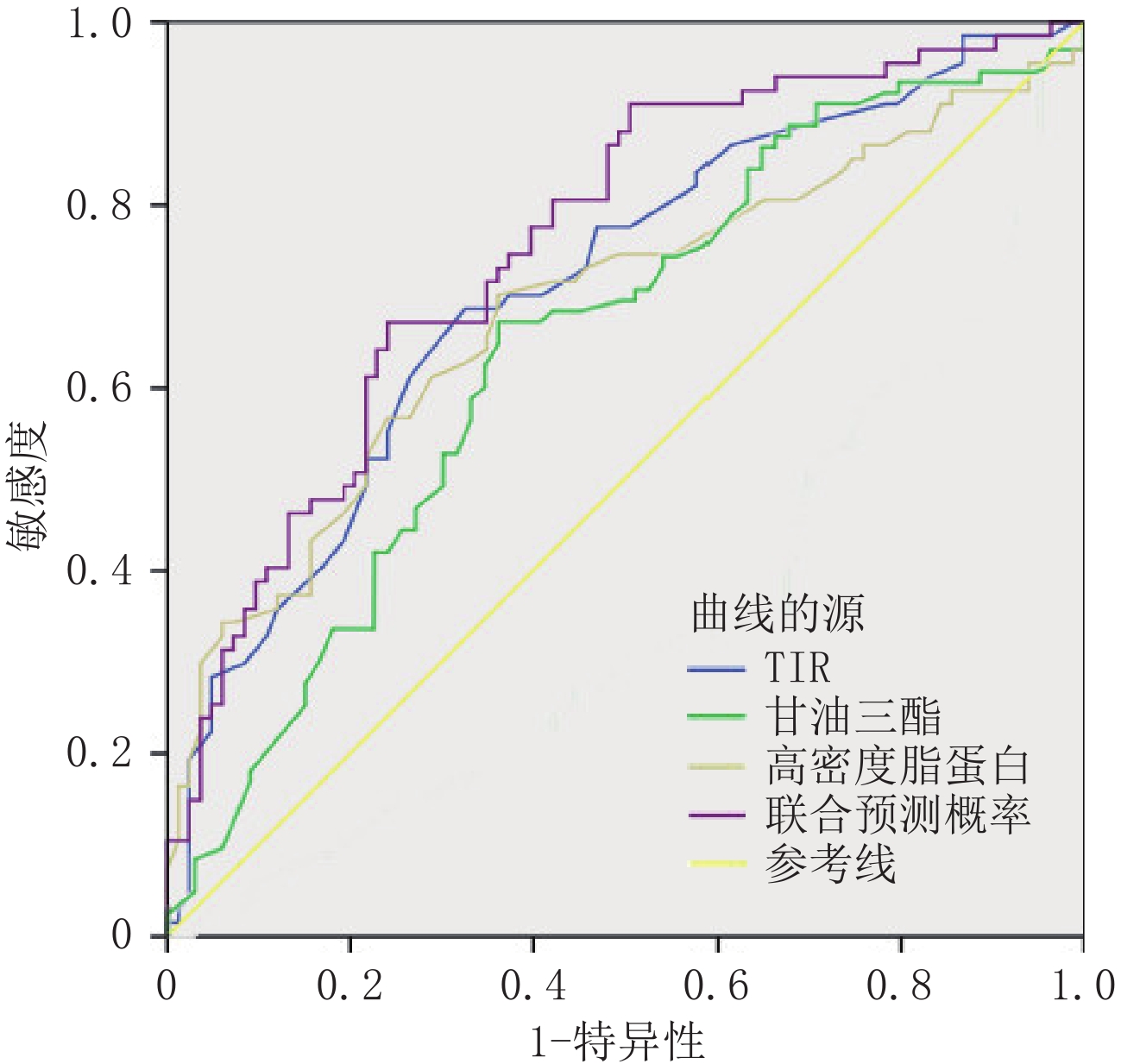
摘要: 目的:探讨2型糖尿病(T2DM)冠状动脉易损斑块的相关因素,为临床预测和管理T2DM患者冠脉易损斑块提供重要依据。方法:回顾性分析150例T2DM患者的相关临床指标及冠脉斑块的CT血管造影(CTA)数据,并以是否存在易损斑块分组,探讨T2DM患者冠脉易损斑块形成的独立危险因素,并对相关因素进行ROC曲线分析其诊断效能。结果:甘油三脂(TG)为T2DM患者出现易损斑块的独立危险因素(OR=1.49,95% CI 1.02~2.18);范围内时间(TIR)(OR=0.95,95% CI 0.92~0.97)和高密度脂蛋白(HDL)(OR=0.32,95% CI 0.13~0.78)为独立保护因素。TIR、TG、HDL的曲线下面积(AUC)分别是:0.71、0.69、0.65。联合预测的AUC为0.76,95% CI:0.68~0.83,灵敏度75%,特异度70%。结论:T2DM患者TIR及HDL减低、TG升高时,临床应警惕合并冠脉易损斑块的可能。Abstract: Objective: To explore the related factors of coronary vulnerable plaque in type 2 diabetes (T2DM) and to provide an important basis for clinical prediction and management of coronary vulnerable plaque in patients with T2DM. Methods: A retrospective analysis of 150 patients was performed using T2DM-related clinical indicators and coronary plaque CT angiography (CTA) data, and by the presence of vulnerable plaque groups, to explore the independent risk factors of coronary vulnerable plaque in patients with T2DM and related factors of the ROC curve analysis of its diagnostic efficacy. Results: TG was an independent risk factor for vulnerable plaque in T2DM cases (OR=1.49, 95% CI 1.02~2.18); TIR (OR=0.95, 95% CI 0.92~0.97) and HDL (OR=0.32, 95% CI 0.13~0.78) were independent protection factors. The AUC of TIR, TG, and HDL was 0.71, 0.69, and 0.65, respectively. The AUC for joint prediction was 0.76, 95% CI was 0.68~0.83, sensitivity was 75%, and specificity was 70%. Conclusions: When TIR and HDL decrease and TG increases in patients with T2DM, clinicians should be alert to the possibility of a coronary vulnerable plaque.
-
Keywords:
- Type 2 diabetes /
- vulnerable plaque /
- CT angiography
-
间质性肺异常(interstitial lung anomaly,ILA)是在轻度症状或轻微肺功能损害患者中偶然发现的,提示早期间质性肺疾病(interstitial lung disease,ILD)[1]。Fleischner协会提出,ILA是在无疑似ILD患者中发现与ILD相符的特异性CT表现,并建议对其进行评估[2]。研究表明,ILA很常见[3],且与死亡率增加、肺癌风险和癌症治疗相关并发症显著相关[4-5]。Cedars-Sinai等[6]通过对类风湿关节炎(rheumatoid arthritis,RA)患者进行纵向随访,发现基线时存在ILA的患者1年后出现影像学进展。因此,有必要对ILA进行早期诊断和适当管理。
ILD是结缔组织病(connective tissue disease,CTD)最常见的肺部并发症[7],通常与不良结局和早期死亡率有关[8]。结缔组织疾病相关间质性肺疾病(connective tissue disease-associated interstitial lung disease,CTD-ILD)常表现为咳嗽等非特异性症状[9],通常在病程晚期被诊断[10],且与其他疾病重叠,导致ILD诊断常被延迟和低估[11],使患者预后恶化[12]。而抗纤维化治疗已被证明可降低ILD患者的死亡率和急性加重的风险[13],延缓肺纤维化进展[14]。因此,保持对ILD的高度怀疑,并尽早识别和治疗有助于改善患者的临床结局[15-16]。
目前,高分辨率计算机断层扫描(high-resolution CT,HRCT)是诊断ILD的金标准[17],也是筛查ILA的重要工具[2]。然而,肉眼识别肺区5%异常具有挑战性[18],且早期ILA影像表现与其他肺部病变(如重力依赖型肺不张、局灶胸椎旁纤维化等[19])相似。而定量CT可克服这些局限性,在ILA评估中发挥着重要作用[20]。该技术不仅能量化不同影像表现(如磨玻璃影、纤维化等)的占比,还能评估肺部整体损伤(如平均肺密度等)情况,并能早期发现病变,为疾病评估和早期诊断提供重要依据。
然而,目前针对CTD患者的ILA的研究仍较少。本研究纳入CTD-ILA及CTD-ILD患者,通过定量CT评估患者肺损伤情况,探讨定量CT指标对于CTD-ILA、CTD-ILD的预测作用及诊断效能,建立基于定量CT的CTD患者筛查方法,为早期诊断与个性化管理提供参考依据。
1. 资料与方法
1.1 一般资料
选取延安大学附属医院2018年1月至2024年11月CTD-ILA患者33例、CTD-ILD患者140例,对照组109例。
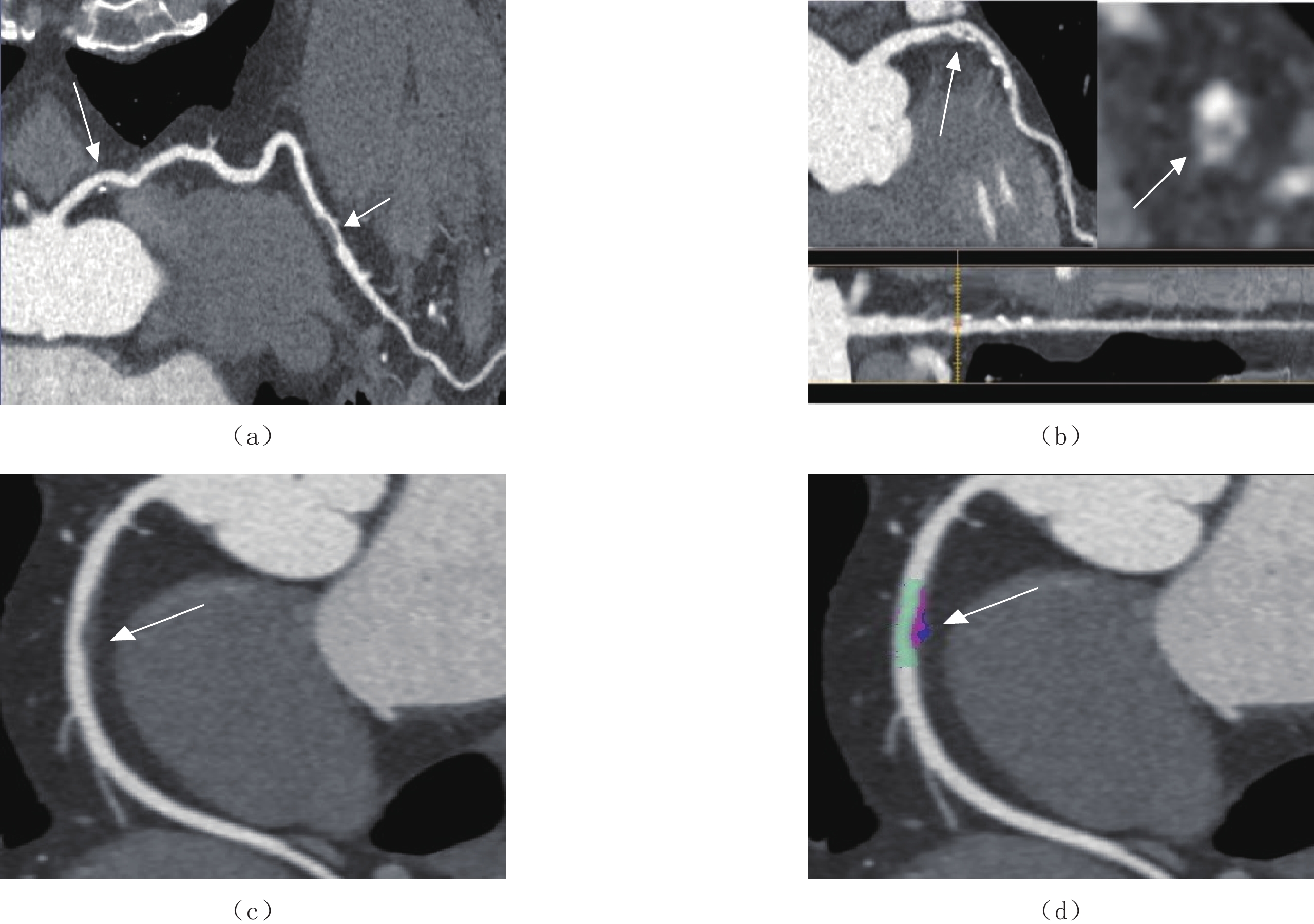
CTD-ILA/ILD纳入标准:类风湿关节炎(RA)、系统性硬化症(systemic sclerosis,SSc)、皮肌炎(dermatomyositis,DM)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关血管炎的诊断分别符合2010年[21]、2013年[22]、2017年[23]、2019年[24]、2022年[25]美国风湿病学会指南,干燥综合征(sjögren’s syndrome,SS)、弥漫性结缔组织病(mixed connective tissue disease,MCTD)诊断符合2016年[26]、2019年[27]美欧共识小组指南,ILA的定义符合2020年Fleischner协会指南[2],ILD的定义符合2013年英国胸科协会指南[28]。ILA和ILD示例图如图1所示。
CTD-ILA/ILD排除标准:无薄层高分辨率CT;胸部CT存在伪影;3D slicer无法分割;存在胸部肿瘤、感染[29-30]、肺气肿、胸腔积液;胸部手术史。对照组的纳入标准:符合CTD诊断但未患ILD的人群,其排除标准与CTD-ILD/ILD患者排除标准一致。
1.2 HRCT检查及定量分析
使用128层螺旋CT扫描仪(上海联影UCT-760)进行检查,受试者取仰卧位,于深吸气末扫描,扫描范围为肺尖至肺底膈面。扫描参数:管电压120 kV、管电流自动调节,扫描层厚5 mm,使用1 mm标准算法重建。
由两名经验丰富的放射科主任医生判断患者胸部CT质量并对其进行影像分型。定量CT指标使用3D-Slicer(5.6.2版本,http://www.slicer.org)获得。使用密度直方图和密度阈值法获得定量CT指标。具体步骤如图2所示。
密度阈值法的阈值设置:全肺像素阈值设定为 −
1024 HU至 − 200 HU,进一步细分为正常肺区(− 950 HU至 − 700 HU)、磨玻璃密度区(− 700 HU至 − 500 HU)和纤维化区(− 500 HU至 − 200 HU)。计算这些区域像素与全肺像素比例,得到正常肺区域(normal lung,NL)、磨玻璃密度区域(ground-glass opacity,GGO)和纤维化区域(fibrosis,F)百分比,以及异常病变区域(abnormal area,AA)的百分比(AA%为GGO%与F%之和),定量分割结果如图3所示。密度直方图法通过统计不同密度值出现的频率生成灰度直方图,得到高衰减区(high attenuation area,HAA)、平均肺密度(mean lung density,MLD)、标准差(standard deviation,SD)、峰度(Kurtosis)和偏度(Skewness)参数。
1.3 统计学方法
采用Shapiro-Wilk W进行正态检验。正态资料以(均数±标准差)表示,非正态资料以中位数(四分位数间距)表示,分类变量以频率(百分比(%))表示。组间差异用单因素方差分析或Kruskal-Wallis H检验分析,采用Bonferroni法进行事后比较。
应用受试者操作特征曲线(receiver operator characteristic curve,ROC)评估肺定量CT指标在区分对照组与CTD-ILA、对照组与CTD-ILD、CTD-ILA与CTD-ILD的诊断效能,使用多元逐步Logistic回归筛选预测CTD-ILA及CTD-ILD的定量CT指标。
使用SPSS 25.0进行统计分析,以P<0.05为差异具有统计学意义。
2. 结果
2.1 患者基线特征
本研究共纳入282名患者,包括对照组109例,CTD-ILD组140例,CTD-ILA组33例。3组患者在性别、年龄和CTD类型方面存在差异,而病程、BMI以及CT分型方面无显著差异(表1)。
表 1 患者临床资料表Table 1. Demographic and clinical characteristics of study participants项目 组别 统计检验 对照组(n=109) CTD-ILA(n=33) CTD-ILD(n=140) F/H P 性别(%) 14.52 0.001 男 19(17.3) 14(42.4) 53(37.9) 女 90(81.8) 19(57.6) 87(62.1) 年龄/岁 40(19) 64(11) 62.5(14) 104.52 <0.001 BMI/(kg/m2) 22.54(2.81) 21.89(3.08) 22.34(4.39) 0.29 0.864 病程 3(7) 5(11.25) 4(10.75) 3.25 0.187 CTD类型(%) 9.66 0.008 类风湿关节炎 63(57.3) 22(66.7) 67(47.9) 系统性红斑狼疮 24(21.8) 5(15.2) 10(7.1) 系统性硬化症 2(1.8) 2(6.1) 15(10.7) 干燥综合症 9(8.2) 2(6.1) 16(11.4) 皮肌炎 − 2(6.1) 8(5.7) 弥漫性结缔组织病 7(6.4) − 15(10.7) ANCA相关血管炎 4(3.6) 2(6.1) 9(6.4) CT分型(%) 1.12 0.291 普通型间质性肺炎 − 7(21.2) 41(29.3) 非特异性间质性肺炎 − 18(54.5) 71(50.7) 淋巴细胞性间质性肺炎 − 4(12.1) 22(15.7) 机化性肺炎 − 4(12.1) 6(4.3) 2.2 各组间定量指标差异
定量CT指标分析显示(表2),组间定量CT指标均存在统计学差异(P<0.05)。在密度阈值法中,从无ILD、ILA到ILD,NL%逐渐下降,而GGO%、F%、AA% 则逐渐上升。
表 2 各组间定量CT指标差异Table 2. Intergroup differences in quantitative CT metrics among controls, CTD-ILA, and CTD-ILD cohorts项目 组别 统计检验 对照组(n=109) CTD-ILA(n=33) CTD-ILD(n=140) F/H P NL% 74(7) 68.0(7.5)* 65.5(9)* 89.82 <0.001 GGO% 5.7(3.7) 11.3(8.75)* 12.65(9.1)* 76.00 <0.001 F% 2.9(1.25) 5.2(3.4)* 6.6(4.98)* 113.72 <0.001 AA% 8.8(4.9) 16.40(11.80)* 19.35(12.67)* 89.51 <0.001 HAA 4.04(2.18) 9.25±5.26* 9.44(6.92)* 114.05 <0.001 MLD −830.16(49.19) −777.08(59.02)* −768.19(93.69)* 70.18 <0.001 SD 179.94(16.38) 205.52(25.83)* 220.19(41.43)* 139.60 <0.001 Kurtosis 13.62±4.20 6.77(4.91)* 5.28(5.64)* 122.59 <0.001 Skewness 3.27(0.71) 2.34(0.74)* 2.19±0.60* 115.41 <0.001 注:*表示与对照组相比P<0.05。NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差;Kurtosis为峰值;Skewness为偏度。 密度直方图法中,MLD、HAA、SD呈上升趋势,而Kurtosis和Skewness则逐渐减小。
2.3 定量CT指标区分ILA与ILD ROC曲线
ROC曲线分析结果显示,SD、HAA、Kurtosis和F%在区分对照组与CTD-ILA(表3和图4)、对照组与CTD-ILD(表4和图5)方面表现优异。其中,SD的曲线下面积(AUC)最大,在区分对照组与CTD-ILA(AUC=0.862)和对照组与CTD-ILD(AUC=0.923)时均表现出较高的诊断效能。在密度阈值法中,F%区分两者AUC值最大。
表 3 定量CT指标区分对照组与CTD-ILA的ROC曲线分析结果Table 3. ROC curve analysis of quantitative CT metrics for discriminating control groups from CTD-ILA patients项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.770 <0.001 < 71.50 0.758 0.743 0.501 GGO% 0.774 <0.001 > 8.000 0.788 0.734 0.522 F% 0.814 <0.001 > 4.050 0.758 0.807 0.565 AA% 0.785 <0.001 > 12.20 0.788 0.762 0.549 HAA 0.830 <0.001 > 6.121 0.788 0.835 0.623 MLD 0.763 <0.001 > −800.9 0.697 0.798 0.495 SD 0.862 <0.001 > 191.2 0.849 0.817 0.665 Kurtosis 0.821 <0.001 < 9.615 0.727 0.844 0.571 Skewness 0.816 <0.001 < 2.795 0.788 0.817 0.604 注:NL% 为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 在区分CTD-ILA与CTD-ILD的ROC曲线分析(表5和图6),SD的诊断价值最佳(AUC=0.649),其次为Kurtosis(AUC=0.638),密度阈值法中F%的AUC最大为0.617。
表 4 定量CT指标区分对照组与CTD-ILD的ROC曲线分析结果Table 4. ROC curve analysis of quantitative CT metrics for differentiating control groups from CTD-ILD patients项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.844 <0.001 < 71.50 0.829 0.743 0.572 GGO% 0.815 < 0.001 > 8.350 0.771 0.752 0.524 F% 0.886 < 0.001 > 4.050 0.727 0.807 0.535 AA% 0.843 < 0.001 > 11.30 0.857 0.716 0.573 HAA 0.885 < 0.001 > 6.205 0.727 0.844 0.571 MLD 0.801 < 0.001 > −798.2 0.636 0.826 0.462 SD 0.923 < 0.001 > 191.2 0.864 0.817 0.680 Kurtosis 0.896 < 0.001 < 11.74 0.818 0.706 0.525 Skewness 0.889 < 0.001 < 2.795 0.727 0.817 0.544 注:NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 表 5 定量CT指标区分CTD-ILA与CTD-ILD的ROC曲线分析结果Table 5. ROC curve analysis of quantitative CT metrics for differentiating CTD-ILA from CTD-ILD项目 AUC P 最佳截断值 灵敏度 特异度 约登指数 NL% 0.600 0.074 < 63.50 0.379 0.788 0.167 GGO% 0.544 0.435 > 12.10 0.536 0.576 0.112 F% 0.617 0.037 > 5.450 0.650 0.576 0.226 AA% 0.574 0.187 > 16.85 0.600 0.576 0.176 HAA 0.585 0.128 > 10.06 0.486 0.727 0.213 MLD 0.568 0.224 > −758.5 0.429 0.758 0.186 SD 0.649 0.008 > 219.1 0.529 0.758 0.286 Kurtosis 0.638 0.014 < 5.095 0.479 0.849 0.327 Skewness 0.614 0.042 < 1.932 0.364 0.879 0.243 注:NL%为正常肺区域百分比;GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;AA%为异常病变区域百分比;HAA为高衰减区;MLD为平均肺密度;SD为标准差; Kurtosis为峰值; Skewness为偏度。 2.4 定量CT指标预测ILA与ILD 多元Logistic回归分析
将NL%、GGO%、F%、AA%、HAA、MLD、SD、Kurtosis、Skewness作为自变量,分组结果(ILA/ILD)为因变量,进行多元逐步logistic回归。
结果显示(表6),在区分对照组与ILD及ILA时,F%(β=0.620,P=0.006,OR=1.895;β=0.854,P=0.000,OR=2.349)、GGO%(β=−0.302,P=0.002,OR=0.739;β=−0.454,P=0.000,OR=0.635)、SD(β=0.026,P=0.009,OR=1.016;β=0.016,P=0.000,OR=1.026)、Kurtosis(β=−0.370,P=0.000,OR=0.691;β=−0.439,P=0.000,OR=0.645)具有统计学差异。
表 6 定量CT指标预测ILA与ILD多因素多元logistic回归结果Table 6. Multivariate logistic regression analysis of quantitative CT metrics in predicting ILA vs. ILD项目 β BE wald P OR 95% CI 下限 上限 ILA F% 0.620 0.225 7.629 0.006 1.859 1.197 2.887 GGO% −0.302 0.098 9.546 0.002 0.739 0.610 0.895 SD 0.015 0.006 6.784 0.009 1.016 1.004 1.027 Kurtosis −0.370 0.069 28.727 0.000 0.691 0.603 0.791 ILD F% 0.854 0.209 16.666 0.000 2.349 1.559 3.540 GGO% −0.454 0.092 24.385 0.000 0.635 0.530 0.760 SD 0.026 0.005 23.855 0.000 1.026 1.016 1.037 Kurtosis −0.439 0.062 50.962 0.000 0.645 0.571 0.727 注:GGO%为磨玻璃密度区域百分比;F%为纤维化区域百分比;SD为标准差; Kurtosis为峰值。 3. 讨论
ILA及ILD均与CTD患者不良预后和早期死亡率密切相关,早期识别和管理对改善患者结局至关重要。但目前临床筛查仍依赖视觉评估,易导致早期病变漏诊。与既往研究相比,本研究系统量化了正常肺组织、到ILA、再到ILD的连续演变规律,为疾病发展提供客观证据;其次,构建基于定量CT的CTD患者筛查方法,为建立风险分层提供依据;最后,使用开源分析软件,免费、省时,有利于技术推广与普及。
从无ILD的CTD对照组、CTD-ILA到CTD-ILD,NL%、峰度(Kurtosis)和偏度(Skewness)逐渐下降,而GGO%、F%、AA%、MLD、HAA以及SD则逐渐上升,与Ahn等[31]及杨凯等[32]的研究一致,表明ILA是ILD的早期阶段。
定量CT指标的ROC曲线和Logistic回归分析表明,F%、GGO%、SD和Kurtosis是区分对照组与CTD-ILA/ILD的敏感指标。在密度阈值法,F%在区分对照组与CTD-ILA(AUC=0.814)和CTD-ILD(AUC=0.886)时表现最佳,提示其在早期诊断ILA和ILD方面具有重要意义。与Zhang等[33]研究结果一致,F%同样被证实为识别健康对照与特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)的最佳指标(AUC=0.962)。但本研究F%的AUC值低于其在IPF中的表现,这提示炎症主导的CTD-ILD与纤维化驱动的IPF存在差异[34],表明定量指标筛查应结合患者病因。
此外,磨玻璃密度区域百分比(GGO%)在诊断ILA及ILD方面同样具有重要价值(β1=−0.302,P=0.002,OR=0.739;β2=−0.454,P=0.000,OR=0.635)。这与马震忠等[35]发现皮肌炎/多发性肌炎相关ILD(DM/PM-ILD)患者HRCT表现以磨玻璃影为主(87.2%,123/141)一致,徐光兴等[36]证实GGO%在鉴别DM/PM-ILD与健康对照组时具有较高的诊断效能(AUC=0.91),但DM/PM-ILD患者的影像表现以非特异性间质性肺炎(NSIP)为主[9],而本研究还纳入了约30%以普通型间质性肺炎(usual interstitial pneumonia,UIP)表现为主的患者,这表明GGO%在鉴别不同亚型ILD时具有广泛适用性。
密度直方图法中,标准差(SD)和峰度(Kurtosis)是区分正常组和CTD-ILA/ILD有意义的指标。SD的曲线下面积最大(AUC=0.862,AUC=0.923),Kurtosis区分ILD(AUC=0.896)仅次于SD(AUC=0.923),与Guisado-Vasco等[37]研究一致。研究表明SD还是区分局限性和弥漫性SSc-ILD和SS-ILD的最佳鉴别参数[38-39],进一步证明SD对于判断疾病严重程度也具有重要价值。
而区分ILA与ILD的ROC曲线显示SD的AUC最大(AUC=0.649),SD>219.1为区分ILA和ILD的最佳截断值。在密度阈值法,F%的AUC最大(AUC=0.617),F%>5.450为区分ILA和ILD的最佳截断值。然而,基于定量CT区分ILD和ILA的结果仅供参考,实际应用还需结合患者临床症状、肺功能检查及随访结果进行综合评估。
基于当前证据,我们提出CTD肺部评估的大致路径:初筛阶段采用SD、F%、GGO%、和Kurtosis排除高危人群;对于异常患者采用SD和F%判断患者是否患ILA或ILD。针对ILA患者,定期随访监测病情变化;而ILD患者则评估病情程度,尽早治疗改善预后。
尽管高衰减区(HAA)未被纳入回归模型,但其在区分对照组与ILA患者时表现较好(AUC=0.830)。既往研究也表明,HAA在无症状类风湿关节炎(RA)识别ILD风险的能力最强[40],不同肺区域HAA与肺重塑的生物标志物、ILA的风险和全因死亡率相关[41],呼气HAA被认为是所有直方图分析指标中ILD严重程度的最佳预测因子[42],均提示HAA对于早期诊断的价值。此外,Shiraishi等[43]纵向评估COPD患者ILA,发现ILDvol%(磨玻璃影、网状影和蜂窝影的体积之和)与ILA 的发生相关,是识别和监测COPD患者ILA的可重复方法。这与我们的AA%指标类似,但AA%区分对照组与CTD-ILA/ILD AUC值较小,可能是3D slicer无法区分蜂窝影与肺气肿的局限性,未来需通过深度学习算法优化分割精度。
本研究的局限性。①样本量较小,尤其是CTD-ILA组。由于前期研究重点是CTD-ILD,对ILA人群关注较少,但本研究仍为该领域提供了有价值的依据,未来将增加样本量,优化研究结果。②基线资料年龄和性别存在差异,但将其纳入回归分析后模型参数并未显著优化,因此未将其纳入最终分析。③3D slicer目前无法区分肺气肿与蜂窝影,因此纳入人群时已排除合并肺气肿的患者,可能存在一定的选择偏移。④研究主要聚焦于定量CT诊断价值,忽略了血清学指标、肺功能等的诊断意义,后续研究将纳入临床指标进行分析。
综上所述,本研究不仅验证了定量CT在CTD-ILD/ILA早期诊断中的价值,还提出基于定量CT的CTD患者筛查方式,为患者精准管理提供有力支持。未来需在大样本中验证其适用性,并探索其与临床指标的协同作用。
-
表 1 T2DM冠脉斑块类型与狭窄程度分析
Table 1 Analysis of T2DM coronary plaque types and stenosis degree
斑块类型 狭窄程度 $\chi^2 $ P 轻度 中度 重度 闭塞 非易损斑块(n=83) 50(60.24) 29(34.94) 2(2.41) 2(2.41) 3.95 0.27 易损斑块(n=67) 34(50.75) 26(38.80) 6(8.96) 1(1.49) 总计(n=150) 84(56.00) 55(36.67) 8(5.33) 3(2.00) 表 2 T2DM冠脉易损斑块相关临床指标分析
Table 2 Analysis of clinical indicators related to vulnerable coronary plaque in T2DM
临床因素 总人数(n=150) 非易损斑块(n=83) 易损斑块(n=67) P 男性/% 89(59.33) 49(59.05) 40(59.70) 0.93 年龄/岁 69.5(43,84) 69(43,84) 71(45,82) 0.79 病程/年 9(0.5,23) 10(0.5,20) 8(2,23) 0.27 吸烟/(>20年) 68(45.33) 33 35 0.13 BMI/(kg/m2) 24.8(18.3,28.7) 24.8(18.4,28.3) 25.6(19.5,28.7) 0.87 收缩压/mmHg 137(105.165) 137(105,165) 136±12 0.83 舒张压/mmHg 85(60,101) 83(62,101) 87(60,98) 0.68 HbA1c/% 7.0(4.8,13.8) 6.5(4.8,13.6) 7.8(5.3,13.8) <0.001 TIR/% 59(21,82) 66(23,82) 51±15 <0.001 TBR/% 0(0,33) 0(0,23) 0(0,33) 0.39 TAR/% 39(6,78) 32(13,78) 45(6,77) 0.001 SIRI 0.99(0.12,3.02) 0.99(0.23,2.96) 1.05(0.12,3.02) 0.02 CPR/(mg/L) 7.96(0.22,21.09) 6.9(0.22,17.65) 9.41(0.33,21.09) 0.04 TC/(mmol/L) 4.86±1.24 4.80±1.18 4.93±1.30 0.54 TG/(mmol/L) 2.20(1.23,6.56) 1.91(1.23,6.32) 2.60(1.33,6.56) 0.001 LDL/(mmol/L) 3.00±0.66 3.02±0.68 2.93±0.77 0.37 HDL/(mmol/L) 1.19(0.45,3.65) 1.48±0.27 1.06(0.45,3.65) <0.001 注:BMI-体重指数;HbA1c-糖化血红蛋白;TIR-目标葡萄糖范围内时间;TBR-低于目标葡萄糖范围内时间;TAR-高于目标葡萄糖范围内时间;SIRI-全身炎症反应指数;CPR-C反应蛋白;TC-总胆固醇;TG-甘油三酯;LDL-低密度脂蛋白;HDL-高密度脂蛋白。 表 3 T2 DM易损斑块相关因素的Logistic回归分析
Table 3 Logistic regression analysis of related factors of vulnerable plaque of T2 DM
独立危险因素 B SE Wald P OR值 95% CI TIR -0.05 0.01 16.31 <0.001 0.95 0.92~0.97 TG 0.40 0.19 4.34 0.040 1.49 1.02~2.18 HDL -1.13 0.45 6.28 0.010 0.32 0.13~0.78 常量 3.18 1.10 8.41 0.004 24.05 − -
[1] 中华医学会糖尿病学会. 中国2型糖尿病防治指南(2020年版)[J]. 中华内分泌代谢杂志, 2021,37(4): 311−398. doi: 10.3760/cma.j.cn115791-20210221-00095 [2] SHAH A D, LANGENBERG C, RAPSOMANIKI E, et al. Type 2 diabetes and incidence of cardiovascular diseases: A cohort study in 1.9 million people[J]. Lancet Diabetes & Endocrinology, 2015, 3(2): 105−113. DOI: 10.1016/S2213-8587(14)70219-0.
[3] DAGHEM M, BING R, FAYAD Z A, et al. Noninvasive imaging to assess atherosclerotic plaque composition and disease activity: Coronary and carotid applications[J]. JACC-Cardiovascular Imaging, 2020, 13(4): 1055−1068. DOI: 10.1016/j.jcmg.2019.03.033.
[4] HOFFMANN U, FERENCIK M, UDELSON J E, et al. Prognostic value of noninvasive cardiovascular testing in patients with stable chest pain: Insights from the PROMISE trial (prospective multicenter imaging study for evaluation of chest pain)[J]. Circulation, 2017, 135(24): 2320−2332. DOI: 10.1161/CIRCULATIONAHA.116.024360.
[5] MADDOX T M, STANISLAWSKI M A, GRUNWALD G K, et al. Nonobstructive coronary artery disease and risk of myocardial infarction[J]. JAMA-Journal of the American Medical Association, 2014, 312(17): 1754−1763. DOI: 10.1001/jama.2014.14681.
[6] TERASHIMA M, KANEDA H, SUZUKI T. The role of optical coherence tomography in coronary intervention[J]. The Korean Journal of Internal Medicine, 2012, 27(1): 1−12. DOI: 10.3904/kjim.2012.27.1.1.
[7] de GRAAF M A, BROERSEN A, KITSLAAR P H, et al. Automatic quantification and characterization of coronary atherosclerosis with computed tomography coronary angiography: Cross-correlation with intravascular ultrasound virtual histology[J]. The International Journal of Cardiovascular Imaging, 2013, 29(5): 1177−1190. DOI: 10.1007/s10554-013-0194-x.
[8] HALON D A, LAVI I, BARNETT-GRINESS O, et al. Plaque morphology as predictor of late plaque events in patients with asymptomatic type 2 diabetes: A long-term observational study[J]. JACC-Cardiovascular Imaging, 2019, 12(7 Pt 2): 1353-1363. DOI: 10.1016/j.jcmg.2018.02.025.
[9] LU J, WANG C, SHEN Y, et al. Time in range in relation to all-cause and cardiovascular mortality in patients with type 2 diabetes: A prospective cohort study[J]. Diabetes Care, 2020, 44(2): 549−555. DOI: 10.2337/dc20-1862.
[10] 中国医师协会放射医师分会. 冠状动脉CT血管成像斑块分析和应用中国专家建议[J]. 中华放射学杂志, 2022,56(6): 595−607. doi: 10.3760/cma.j.cn112149-20211129-01055 [11] 赖添福, 邓君良, 陈湘光, 等. 糖尿病患者冠状动脉粥样硬化的CTA特征分析[J]. CT理论与应用研究, 2020,29(3): 347−353. DOI: 10.15953/j.1004-4140.2020.29.03.11. LAI T F, DENG J L, CHEN X G, et al. Analysis of CTA characterisation of coronary atherosclerosis with diabetes mellitus[J]. CT Theory and Applications, 2020, 29(3): 347−353. DOI: 10.15953/j.1004-4140.2020.29.03.11. (in Chinese).
[12] ABDELRAHMAN K M, CHEN M Y, DEY A K, et al. Coronary computed tomography angiography from clinical uses to emerging technologies: JACC state-of-the-art review[J]. American College of Cardiology Foundation Washington D. C., 2020, 76(10): 1226−1243. DOI: 10.1016/J.JACC.2020.06.076.
[13] 曾智, 谭维萍, 吴霞, 等. Ⅱ型糖尿病患者合并冠心病的冠状动脉造影特点分析[J]. 西部医学, 2011,23(9): 1692−1694. DOI: 10.3969/j.issn.1672-3511.2011.09.027. ZENG Z, TAN W P, WU X, et al. AnaIysis of coronary angiography characters among patients with type 2 diabetes and coronary heart disease[J]. Medical Journal of West China, 2011, 23(9): 1692−1694. DOI: 10.3969/j.issn.1672-3511.2011.09.027. (in Chinese).
[14] YAHAGI K, KOLODGIE F D, OTSUKA F, et al. Pathophysiology of native coronary, vein graft, and in-stent atherosclerosis[J]. Nature Reviews Cardiology, 2016, 13(2): 79−98. DOI: 10.1038/nrcardio.2015.164.
[15] BURKE, A P, KOLODGIE, F D, ZIESKE, A, et al. Morphologic findings of coronary atherosclerotic plaques in diabetics: A postmortem study[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2004, 24(7): 1266−1271. DOI: org/10.1161/01.ATV.0000131783.74034.97.
[16] 李雯, 陈海冰. 葡萄糖在目标范围内时间的研究进展[J]. 中国糖尿病杂志, 2021,29(2): 141−144. DOI: 10.3969/j.issn.1006-6187.2021.02.013. LI W, CHEN H B. The research progress of glucose time in range[J]. Chinese Journal of Diabetes, 2021, 29(2): 141−144. DOI: 10.3969/j.issn.1006-6187.2021.02.013. (in Chinese).
[17] RODBARD D. Glucose time in range, time above range, and time below range depend on mean or median glucose or hba1c, glucose coefficient of variation, and shape of the glucose distribution[J]. Diabetes Technology & Therapeutics, 2020, 22(7): 492−500. DOI: 10.1089/dia.2019.0440.
[18] 李佳, 鄢华, 苏晞. 糖尿病血脂异常的药物治疗新进展[J]. 中国循证心血管医学杂志, 2022,14(2): 247−249. doi: 10.3969/j.issn.1674-4055.2022.02.32 [19] RIDKER P M, EVERETT B M, THUREN T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J]. New England Journal of Medicine, 2017, 377(12): 1119−1131. DOI: 10.1056/NEJMoa1707914.
[20] 王涛, 浦艳华, 殷洁, 等. 易损斑块与急性冠脉综合征[J]. 心血管病学进展, 2007,28(2): 246−248. DOI: 10.3969/j.issn.1004-3934.2007.02.039. WANG T, PU Y H, YING J, et al. Vulnerable plaque and acute coronary syndrome[J]. Advances in Cardiovascular Diseases, 2007, 28(2): 246−248. DOI: 10.3969/j.issn.1004-3934.2007.02.039. (in Chinese).
[21] 刘锼, 李阳, 樊泽元, 等. 冠心病患者血清MMP-8和MMP-9水平与冠脉易损斑块关系的研究[J]. 心血管康复医学杂志, 2016,25(5): 483−487. DOI: 10.3969/j.issn.1008-0074.2016.05.09. LIU T, LI Y, FAN Z Y, et al. Relationship among serum MMP-8, MMP-9 levels and coronary vulnerable plaques in patients with coronary heart disease[J]. Chinese Journal of Cardiovascular Rehabilitation Medicine, 2016, 25(5): 483−487. DOI: 10.3969/j.issn.1008-0074.2016.05.09. (in Chinese).
[22] JIANG, Y, PANG, T, SHI, R, et al. Effect of smoking on coronary artery plaques in type 2 diabetes mellitus: Evaluation with coronary computed tomography angiography[J]. Frontiers in Endocrinology, 2021, 12(11): 750−773. DOI: 10.3389/fendo.2021.750773.




 下载:
下载: