The Application of Radiomics in the Prognosis of Non-small Cell Lung Cancer
-
摘要:
肺癌是全球癌症相关死亡的主要原因之一,非小细胞肺癌(NSCLC)是肺癌最常见的类型,非小细胞肺癌早期的预后预测对提高患者生存率至关重要。传统评估手段无法全面准确反映非小细胞肺癌预后,近年来不断有学者探索影像组学技术在非小细胞肺癌预后预测中的应用价值,以改善非小细胞肺癌患者预后。本文对影像组学技术的基本研究流程及其在非小细胞肺癌预后预测中的应用研究现状进行综述。
Abstract:Lung cancer remains a leading cause of cancer-related mortality worldwide, with non-small cell lung cancer (NSCLC) as the most prevalent type. Accurately predicting NSCLC prognosis is crucial for optimizing patient survival. However, traditional assessment tools often lack the comprehensive and precise capability to effectively stratify patient risk. Recent research has focused on exploring the potential of imaging histology technology for NSCLC prognosis. This article delves into the core principles of imaging histology and reviews the current state of research on its application in predicting NSCLC outcomes.
-
Keywords:
- machine learning /
- radiomics /
- non-small cell lung cancer
-
肺癌(lung cancer)是全球癌症相关死亡的主要原因之一,也是中国最常见的恶性肿瘤之一,其死亡率约18.0%[1],居恶性肿瘤首位,5年总生存率仅约15%[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)为肺癌最常见的类型[3]。NSCLC早期的预后预测有助于提供额外治疗、密切随访,实现精准个体化治疗,以改善NSCLC患者的预后。
目前,NSCLC预后的评估主要依靠肿瘤淋巴结转移(tumor node metastasis,TNM)分期系统,但肿瘤具有时空异质性,传统TNM分期系统以及组织病理学等有创检测并不能全面准确预测非小细胞肺癌患者的预后[4]。影像组学(radiomics)技术通过从医学图像中提取并分析高通量影像组学特征,能够将图像信息转换为反映肿瘤内部异质性的信息并进行深层预测,具有安全、无创、全面等优点[5]。近年来,不断有学者探索影像组学技术在非小细胞肺癌预后预测中的应用价值,且取得了长足的进展。
本文就影像组学技术的基本研究流程及其在预测NSCLC预后应用方面的研究现状作综述。
1. 影像组学概述
影像组学是指从医学影像图像中高通量提取大量特征并进行筛选降维,利用数据分析方法将数字图像信息转化为可挖掘的高维信息,构建预测模型,对肿瘤的深层信息进行描述,分析临床问题并提供决策指导[6]。影像组学的概念由荷兰学者Lambin等[7]在2012年提出,影像组学技术的出现使肺癌患者的早期诊断和个体化治疗成为可能,因此越来越受到科学家及临床工作者的重视。
影像组学的研究流程主要分为图像采集、图像分割、特征提取、特征选择及模型建立5步[8]。目前NSCLC影像组学研究多回顾性收集图像数据,由于不同平台和不同参数下采集的图像存在差异,一般需预先对图像进行标准化及归一化处理[9-10]。由于尚无十分理想的全自动分割工具,目前多采用人工分割或半自动分割方法[11]。通过特定的计算机算法从图像感兴趣区域中自动提取大量的定量化影像组学特征,主要包括强度特征、纹理特征、形状特征及小波特征等[12]。对提取出的影像组学特征进行选择,以筛选出稳定且有效的特征。最后基于最终选择的特征建立影像组学模型对病灶进行预测。
2. 影像组学技术在非小细胞肺癌预后中的应用
肺癌的预后与患者年龄、性别、吸烟状况、TNM分期、病理亚型等许多因素相关[13],但其大多属于定性因素,具有评估不准确等局限性。影像组学技术可以运用影像组学特征及临床信息对NSCLC预后进行量化分析以及预测。
2.1 预测生存期
NSCLC的总生存期(overall survival,OS)、无病生存期(disease-free survival,DFS)、无进展生存期(progression-free survival,PFS)都反映了患者预后,但目前难以实现对NSCLC患者DFS、OS、PFS的准确预测。
因此研究者试图寻找一种新的预测工具以更加准确全面地预测NSCLC的预后。
2.1.1 总生存期(OS)
Yang等[14]通过从239例NSCLC患者的CT图像中提取二维及三维影像组学特征并与临床预测指标相结合,构建影像组学列线图评估NSCLC患者的总生存期,研究显示影像组学特征与NSCLC患者总生存期具有明显的相关性,二维和三维联合影像组学特征比单一特征预测预后的效能更好,且影像组学特征与临床预测指标联合能更好地评估NSCLC患者的预后。Wang等[15]提取并分析局部晚期NSCLC患者的CT影像组学特征以及临床特征,建立联合影像组学、临床特征的预后预测模型以及多模态列线图,研究显示联合模型对总生存期的预测效能较单一模型更优,预测值与实际值的一致性更高。Yang等[16]从 315名NSCLC患者的CT和正电子发射计算机断层显像(positionemission tomography,PET)图像中提取影像组学特征,基于CT、PET和PET/CT影像组学特征,使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)Cox回归算法计算影像组学评分,联合影像组学评分及临床病理因素进行多变量Cox回归分析确定独立的危险因素,并构建列线图,结果表明影像组学评分及临床联合模型具有最佳的一致性指数(concordance index,C-index),该研究认为基于18F-FDG PET/CT影像组学列线图能较好地预测NSCLC患者的预后。Yoo等[17]纳入了300例 Ⅲ期NSCLC患者,分别提取原发肿瘤初始检查和新辅助同步放化疗后的影像组学特征,通过LASSO回归分析筛选有用特征,通过Cox比例风险回归分析评估LASSO评分和常规PET参数预后预测价值,研究表明LASSO评分显示出更好的OS预测效能。PET/CT的影像组学特征是评估 Ⅲ期 NSCLC总生存期的独立预后因素,基于影像组学特征建立的LASSO评分显示了比传统PET参数更好的个体化OS估计预后能力。
前述研究显示影像组学在预测NSCLC患者总生存期中具有良好的效能,但均为回顾性研究,可能存在选择偏倚,且均未考虑基因组特征,而肿瘤的基因表型有可能影响患者的生存预后,相关研究有待进一步探索。
2.1.2 无病生存期(DFS)
Choe等[18]回顾性分析接受肺腺癌根治手术的患者,通过单变量和多变量Cox比例风险回归分析评估基于增强CT影像组学特征与患者无病生存期(DFS)和总生存期(OS)之间的相关性,结果显示影像组学特征与患者DFS和OS独立相关,影像组学与临床病理因素联合建立的模型对预后预测的效能更优,该研究表明CT影像组学可有效预测肺腺癌患者的预后,并能提供除临床病理危险因素之外的额外信息。Liu等[19]探索了基于不同感兴趣体积(region of volume,VOI)的影像组学对肺腺癌患者DFS预测准确性的影响,该研究分别基于大体肿瘤体积(gross tumor volume,GTV)、肿瘤边界外3 mm、跨越肿瘤边界6 mm、肿瘤边界外6 mm提取影像组学特征构建模型并比较模型的效能,研究发现基于跨越肿瘤边界6 mm VOI的影像组学模型预测肺腺癌患者DFS的效能最优。Park等[4]通过在不同层厚的CT图像中提取影像组学特征分别建立模型预测非小细胞肺癌患者DFS,模型训练集的一致性指数分别为0.68、0.70和0.68,其研究结果显示基于不同层厚建立的模型效能并没有明显差异,因此认为CT层厚对肺腺癌患者DFS的预测没有显著影响。Xiu等[20]分析146例非小细胞肺癌患者的CT影像组学、临床及肿瘤免疫特征分别构建模型,并联合组织病理学及免疫组化特征构建多模态列线图,比较各模型的准确性和差异。列线图模型在训练集和验证集的C-index分别为0.8766和0.8426,优于临床病理-影像组学模型、影像组学模型和临床病理模型。
这些研究探索了影像组学在预测NSCLC患者无病生存期中的应用价值,但仍存在随访间隔及扫描参数不统一等问题,一定程度上影响了研究的可靠性和可重复性。
2.1.3 无进展生存期(PFS)
He等[21]联合CT影像组学特征、临床病理风险因素构建个体化预后评分系统,预测接受铂类化疗的 Ⅳ期非小细胞肺癌患者的无进展生存期(PFS),研究发现该模型对患者PFS具有良好的预测效能,在95% 置信区间内其C-index为0.772,内部及外部验证集的C-index分别为0.738和0.750,且该联合模型在临床实用性方面显著优于基于临床病理学建立的模型,该研究显示基于CT影像组学特征和临床病理学风险因素的预后模型可用于IV期NSCLC铂类化疗患者PFS的个体化预测,以指导IV期NSCLC个体化预治疗。Li等[22]回顾性分析368例治疗前接受18F-FDG PET/CT检查的NSCLC患者,利用LIFEx软件提取PET和CT图像影像组学特征构建临床及联合模型,预测PFS临床模型训练集C-index为0.748、AUC值为0.758,联合模型C-index及AUC值分别为0.775和0.780,验证集临床模型C-index及AUC值分别为0.729和0.776,联合模型分别为0.755和0.791。该研究显示基于治疗前 18F-FDG PET/CT影像组学模型能够较好地预测NSCLC患者PFS,在结合临床因素后预测效能进一步提高。
目前关于影像组学在预测NSCLC患者无进展生存期中的应用研究相对较少,前述研究的样本量都相对较小,仍需进行大样本研究证实。
2.2 预测淋巴结转移
淋巴结转移是影响患者预后及治疗决策选择的重要因素之一。Cong等[23]回顾性研究 649例IA期非小细胞肺癌患者,通过随机森林(random forest,RF)方法建立临床模型、增强CT影像组学模型和联合模型预测早期NSCLC癌患者淋巴结转移,影像组学模型和联合模型对淋巴结转移的预测效能较佳,均优于临床模型,研究表明基于增强CT影像组学模型可以术前预测IA期NSCLC患者的淋巴结转移。Ran等[24]提取300名肺腺癌患者的CT影像组学特征以及深度学习特征,使用多变量逻辑回归分析构建淋巴结转移预测模型以及列线图,多变量逻辑回归分析显示影像组学特征、深度学习特征是淋巴结转移的独立预测因子。预测模型训练集一致性指数为0.820,外部验证集一致性指数为0.861,均具有较好的预测效能,可用于预测肺腺癌患者淋巴结转移。Wang等[25]探究基于肿瘤内和肿瘤周围肺实质CT影像组学模型在术前预测临床T1期周围型肺腺癌患者淋巴结转移的价值,分别提取T1期周围型肺腺癌患者大体肿瘤体积(GTV)和肿瘤周围体积((peritumoral volume,PTV),肿瘤周围1.5 cm)的影像组学特征,通过逻辑回归分析构建包含影像组学特征和临床参数的影像组学模型并建立列线图,结果显示基于GTV和PTV的影像组学特征具有良好的预测效能,其接受者操作特性曲线下面积(area under curve,AUC)分别为0.829和0.825,基于大体肿瘤体积和肿瘤周围体积的联合影像组学特征的AUC为0.843,影像组学列线图的AUC为0.869,该研究表明基于大体肿瘤体积和肿瘤周围体积的影像组学特征均可以较好地预测淋巴结转移。
研究显示影像组学对于NSCLC患者淋巴结转移具有良好的预测效能,但目前相关研究的样本量相对较小且涉及临床因素较为有限,仍需进一步探究及完善。
2.3 预测远处转移
晚期NSCLC患者常出现远处转移,远处转移多提示预后不佳。NSCLC远处转移常见于脑转移及骨转移。
Chen等[26]从89例T1期肺腺癌患者的平扫CT图像中提取共影像组学特征建立模型,联合模型和影像组学模型的预测效能显著优于临床模型,该研究显示基于CT影像组学对T1期肺腺癌患者脑转移具有良好的预测性能和巨大潜力。Ding等[27]基于平扫CT图像影像组学特征构建影像组学、临床和联合模型预测同步脑转移(synchronous brain metastasis,SBM),比较不同模型的预测效能,并研究3种模型对SBM、异时脑转移(metachronous brain metastasis,MBM)和全部脑转移中寡转移(1~3个病灶)或多发(>3个病灶)转移的预测效能。影像组学模型和联合模型对同步脑转移的预测能力较临床模型更优,此外影像组学模型还可预测同步脑转移、异时脑转移和全部脑转移中寡转移或多发转移。该研究表明影像组学模型及联合模型可作为预测肺癌同步脑转移高危患者的有效影像标志物,且影像组学模型还可以识别寡转移或多发脑转移。Chen等[28]回顾性分析195例NSCLC患者,采用t检验、秩和检验、
$\chi^2 $ 检验分析患者临床影像学特征与骨转移的关系,同时提取影像组学特征构建模型,并根据最佳预测模型提取的影像组学参数结合临床影像特征建立多因素logistic回归预测模型,模型训练集和验证集的AUC为0.82和0.73,研究显示性别、细胞角蛋白19的可溶性片段(Cyfra21-1)升高、血铁含量、CT征象(如病灶同质性、胸膜凹陷征)及影像组学特征Glszm_Small Area高灰度强调是骨转移的独立危险因素,该研究认为基于影像组学和临床影像特征建立的预测模型对NSCLC患者骨转移具有较好的预测能力。上述研究表明影像组学能够预测NSCLC的远处转移,但目前现有相关研究相对较少,且上述研究具有样本量小、单中心等局限,仍需进一步大样本、多中心研究。
3. 小结与展望
影像组学技术在预测NSCLC预后方面展现出较大的潜力,但其作为影像学领域中的新兴交叉学科,仍存在研究多为回顾性、小样本、单中心等不足,缺乏前瞻性、大样本、多中心的研究验证及综合评估,缺乏标准化数据库的建立、标准化研究流程、图像重建算法、预处理方式以及特征提取算法,研究的稳定性及可重复性尚待进一步提高,从而导致临床广泛应用受到一定限制。
目前影像组学技术仍在不断快速发展,相信在日益发展的人工智能技术的推动下,影像组学技术能够在NSCLC预后预测方面中发挥更大的价值,并在指导NSCLC精准个性化治疗中发挥更大优势及作用。
-
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209−249. DOI: 10.3322/caac.21660.
[2] YOSHIDA Y, MURAYAMA T, SATO Y, et al. Gender differences in long-term survival after surgery for non-small cell lung cancer[J]. The Thoracic and Cardiovascular Surgeon, 2016, 64(6): 507−514. DOI:10.1055/ s-0035-1558995.
[3] ETTINGER D S, WOOD D E, AISNER D L, et al. Non-small cell lung cancer, version 5.2017, NCCN clinical practice guidelines in oncology[J]. Journal of the National Comprehensive Cancer Network, 2017, 15(4): 504−535. DOI: 10.6004/jnccn.2017.0050.
[4] PARK S, LEE S M, KIM S, et al. Performance of radiomics models for survival prediction in non-small-cell lung cancer: Influence of CT slice thickness[J]. European Radiology, 2021, 31(5): 2856−2865. DOI: 10.1007/s00330-020-07423-2.
[5] ZHAO J, SUN L, SUN K, et al. Development and validation of a radiomics nomogram for differentiating pulmonary cryptococcosis and lung adenocarcinoma in solitary pulmonary solid nodule[J]. Frontiers in Oncology, 2021, 11: 759840. DOI: 10.3389/fonc.2021.759840.
[6] LAMBIN P, LEIJENAAR R T H, DEIST T M, et al. Radiomics: The bridge between medical imaging and personalized medicine[J]. Nature Reviews. Clinical Oncology, 2017, 14(12): 749−762. DOI: 10.1038/nrclinonc.2017.141.
[7] LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: Extracting more information from medical images using advanced feature analysis[J]. European Journal of Cancer, 2012, 48(4): 441−446. DOI: 10.1016/j.ejca.2011.11.036.
[8] MAYERHOEFER M E, MATERKA A, LANGS G, et al. Introduction to radiomics[J]. Journal of Nuclear Medicine, 2020, 61(4): 488−495. DOI: 10.2967/jnumed.118.222893.
[9] GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: Images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563−577. DOI: 10.1148/radiol.2015151169.
[10] YIP S S, AERTS H J. Applications and limitations of radiomics[J]. Physics in Medicine and Biology, 2016, 61(13): R150−R166. DOI: 10.1088/0031-9155/61/13/R150.
[11] LIMKIN E J, SUN R, DERCLE L, et al. Promises and challenges for the implementation of computational medical imaging (radiomics) in oncology[J]. Annals of Oncology, 2017, 28(6): 1191−1206. DOI: 10.1093/annonc/mdx034.
[12] DHARA A K, MUKHOPADHYAY S, DUTTA A, et al. Content-based image retrieval system for pulmonary nodules: Assisting radiologists in self-learning and diagnosis of lung cancer[J]. Journal of Digital Imaging, 2017, 30(1): 63−77. DOI: 10.1007/s10278-016-9904-y.
[13] MIZUNO T, ARIMURA T, KURODA H, et al. Current outcomes of postrecurrence survival in patients after resection of non-small cell lung cancer[J]. Journal of Thoracic Disease, 2018, 10(3): 1788−1796. DOI: 10.21037/jtd.2018.01.148.
[14] YANG L, YANG J, ZHOU X, et al. Development of a radiomics nomogram based on the 2D and 3D CT features to predict the survival of non-small cell lung cancer patients[J]. European Radiology, 2019, 29(5): 2196−2206. DOI: 10.1007/s00330-018-5770-y.
[15] WANG L, DONG T, XIN B, et al. Integrative nomogram of CT imaging, clinical, and hematological features for survival prediction of patients with locally advanced non-small cell lung cancer[J]. European Radiology, 2019, 29(6): 2958−2967. DOI: 10.1007/s00330-018-5949-2.
[16] YANG B, ZHONG J, ZHONG J, et al. Development and validation of a radiomics nomogram based on 18F-fluorodeoxyglucose positron emission tomography/computed tomography and clinicopathological factors to predict the survival outcomes of patients with non-small cell lung cancer[J]. Frontiers in Oncology, 2020, 10: 1042. DOI: 10.3389/fonc.2020.01042.
[17] YOO J, LEE J, CHEON M, et al. Radiomics analysis of 18F-FDG PET/CT for prognosis prediction in patients with stage III non-small cell lung cancer undergoing neoadjuvant chemoradiation therapy followed by surgery[J]. Cancers, 2023, 15(7): 2012. DOI: 10.3390/cancers15072012.
[18] CHOE J, LEE S M, DO K H, et al. Outcome prediction in resectable lung adenocarcinoma patients: Value of CT radiomics[J]. European Radiology, 2020, 30(9): 4952−4963. DOI: 10.1007/s00330-020-06872-z.
[19] LIU K, LI K, WU T, et al. Improving the accuracy of prognosis for clinical stage I solid lung adenocarcinoma by radiomics models covering tumor per se and peritumoral changes on CT[J]. European Radiology, 2022, 32(2): 1065−1077. DOI: 10.1007/s00330-021-08194-0.
[20] XIU D, MO Y, LIU C, et al. Integrative nomogram of computed tomography radiomics, clinical, and tumor immune features for analysis of disease-free survival of NSCLC patients with surgery[J]. Journal of Oncology, 2023, 2023: 8607062. DOI: 10.1155/2023/8607062.
[21] HE L, LI Z, CHEN X, et al. A radiomics prognostic scoring system for predicting progression-free survival in patients with stage IV non-small cell lung cancer treated with platinum-based chemotherapy[J]. Chinese Journal of Cancer Research, 2021, 33(5): 592−605. DOI: 10.21147/j.issn.1000-9604.2021.05.06.
[22] LI J, ZHANG B, GE S, et al. Prognostic value of 18F-FDG PET/CT radiomic model based on primary tumor in patients with non-small cell lung cancer: A large single-center cohort study[J]. Frontiers in Oncology, 2022, 12: 1047905. DOI: 10.3389/fonc.2022.1047905.
[23] CONG M, FENG H, REN J L, et al. Development of a predictive radiomics model for lymph node metastases in pre-surgical CT-based stage IA non-small cell lung cancer[J]. Lung Cancer, 2020, 139: 73−79. DOI:10. 1016/j.lungcan.2019.11.003.
[24] RAN J, CAO R, CAI J, et al. Development and validation of a nomogram for preoperative prediction of lymph node metastasis in lung adenocarcinoma based on radiomics signature and deep learning signature[J]. Frontiers in Oncology, 2021, 11: 585942. DOI: 10.3389/fonc.2021.585942.
[25] WANG X, ZHAO X, LI Q, et al. Can peritumoral radiomics increase the efficiency of the prediction for lymph node metastasis in clinical stage T1 lung adenocarcinoma on CT?[J]. European Radiology, 2019, 29(11): 6049−6058. DOI: 10.1007/s00330-019-06084-0.
[26] CHEN A, LU L, PU X, et al. CT-based radiomics model for predicting brain metastasis in category T1 lung adenocarcinoma[J]. American Journal of Roentgenology, 2019, 213(1): 134−139. DOI: 10.2214/AJR.18.20591.
[27] DING Z, WANG Y, XIA C, et al. Thoracic CT radiomics analysis for predicting synchronous brain metastasis in patients with lung cancer[J]. Diagnostic and Interventional Radiology, 2022, 28(1): 39−49. DOI: 10.5152/dir.2021.21677.
[28] CHEN L, YU L, LI X, et al. Value of CT radiomics and clinical features in predicting bone metastases in patients with NSCLC[J]. Contrast Media & Molecular Imaging, 2022, 2022: 7642511. DOI: 10.1155/2022/7642511.
-
期刊类型引用(1)
1. 洪静静,文戈,张飞,郭嘉亮,冯艳芳,黄伟康. 预测肺腺癌浸润性:基于临床特征和普通CT平扫影像学特征的联合模型. 分子影像学杂志. 2024(11): 1225-1230 .  百度学术
百度学术
其他类型引用(1)
计量
- 文章访问数: 193
- HTML全文浏览量: 43
- PDF下载量: 48
- 被引次数: 2



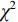
 下载:
下载:


