Diagnosis of Tuberous Sclerosis Complex with Multiple Organ Involvement using Computer Tomography: A Clinical Case Analysis
-
摘要:
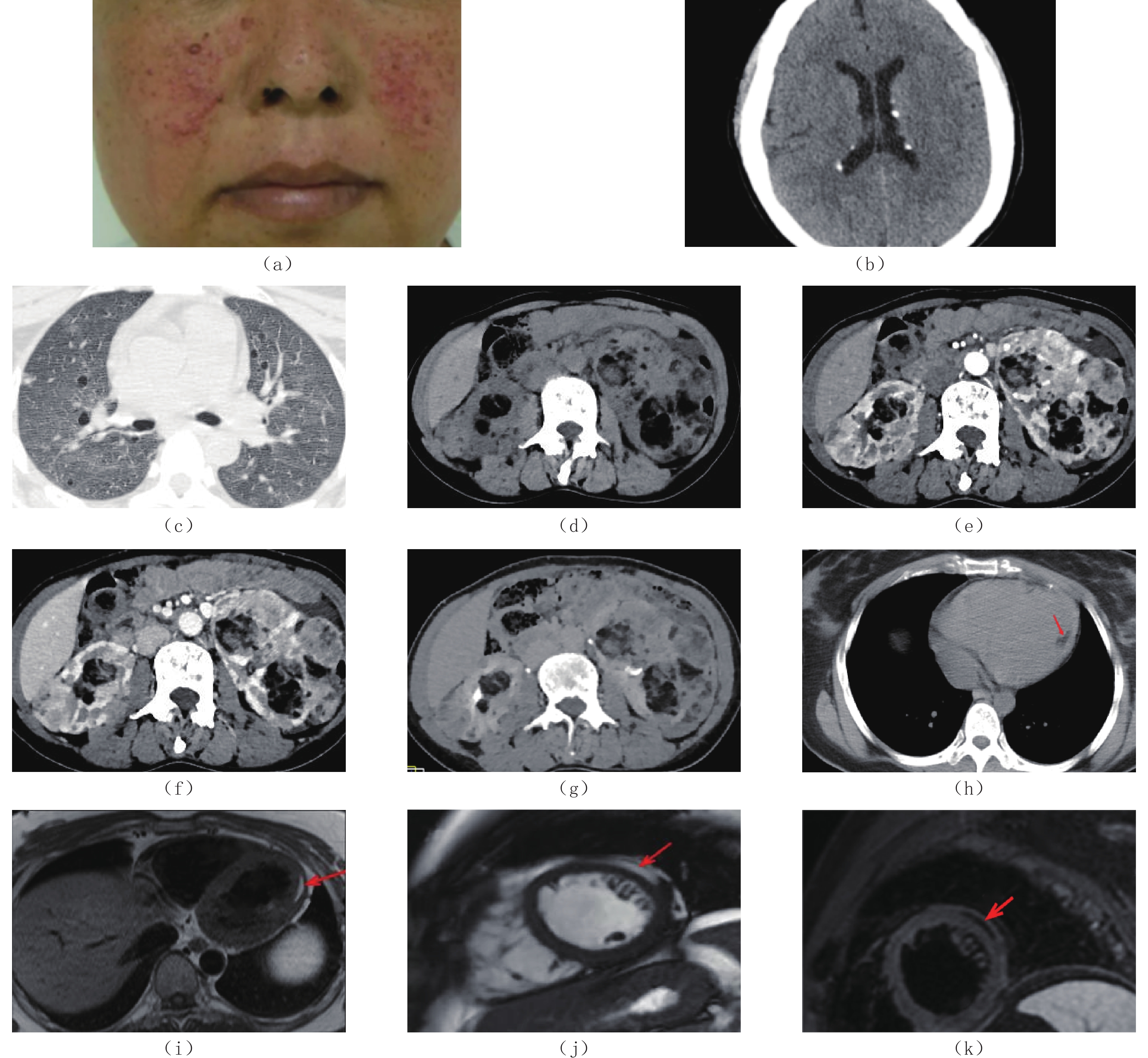
结节性硬化症(TSC)是一种由于抑癌基因TSC1和/或TSC2突变引起的常染色体显性遗传病,其临床表现主要为反复癫痫发作、智力低下及面部血管纤维瘤等。本文报道1例TSC多器官受累病例,自幼年反复癫痫发作,右枕部皮肤鲨鱼革斑,双颊部多发紫红色小结节;CT平扫发现双侧侧脑室周围多发小钙化灶,肺淋巴管肌瘤病,双肾多发血管平滑肌脂肪瘤,左心室后壁心肌内存在多发脂肪灶。本文旨在提高对该病的认识。
Abstract:Tuberous sclerosis complex (TSC) is an autosomal dominant genetic disease caused by mutations in the tumor suppressor genes TSC1 and/or TSC2. Its clinical manifestations include recurrent seizures, intellectual disability, and facial angiofibromas. Herein, we report the case of a patient with TSC who had recurrent seizures since childhood, shark skin nevus on the right occipital region, and multiple purple-red nodules on both cheeks. Computer tomography (CT) revealed multiple small calcifications around the lateral ventricles, pulmonary lymphangioleiomyomatosis, multiple renal angiomyolipomas, and multiple lipomatous lesions on the left ventricular wall. Through this case report, we aimed to improve the understanding of TSC.
-
Keywords:
- CT diagnosis /
- tuberous sclerosis complex /
- multiple organ involvement
-
目前新型冠状病毒感染(COVID-19)变异毒株—奥密克戎(Omicron)已成为优势流行株[1],国内外证据显示奥密克戎变异株肺部致病力明显减弱,临床表现已由肺炎为主衍变为以上呼吸道感染为主,即轻型,而且轻型、中型患者预后良好,重型及危重型患者临床预后差[2],尤其是老年重型患者的死亡率较高[3],因此影响重型患者预后的因素值得关注。张炜宗等[4]的Meta分析显示影响COVID-19患者院内死亡因素有很多因素,而且COVID-19患者肺部病变体积被确定为危重症的独立预测因子[5]。人工智能(AI)不仅可以帮助放射科医生检测COVID-19患者肺部病变[6-7],还可以自动检测肺炎病变的数量、体积与病变体积占百分比[8]。
本研究通过AI定量重型COVID-19全肺病变体积(total lung lesion volume,TLLV)及全肺病变体积占比(percentage of total lung lesion volume,PTLLV),分析肺部病变体积及伴发基础疾病对重型COVID-19预后的影响。
1. 1对象与方法
1.1 一般资料
回顾性分析2022年12月8日至2023年1月31日内蒙古自治区人民医院确诊重型COVID-19患者147例,排除11例入院时在外院行CT检查或住院期间均行胸部普通X线检查进行诊断、复查患者及呼吸伪影较重无法准确测量患者。最终纳入136例住院且入院时行多层螺旋CT检查患者,男88例,年龄40~95岁,平均年龄(74.39±11.826)岁;女48例,年龄35~91岁,平均年龄(76.19±12.471)岁。诊断标准:新型冠状病毒感染诊疗方案(试行第十版)[1]发布重型诊断标准。
1.2 方法
1.2.1 临床资料
包括年龄、性别、吸烟史、心血管疾病、低蛋白血症、2型糖尿病、脑卒中、恶性肿瘤、慢性肺部疾病、慢性肾脏疾病、慢性肝脏疾病。
1.2.2 实验室检查
血常规:白细胞、中性粒细胞比值、淋巴细胞比值、血红蛋白、C反应蛋白。生化指标:白蛋白、丙氨酸转移酶、天门冬氨酸转移酶、乳酸脱氢酶、BUN、肌酐、总胆红素。凝血指标:凝血酶原时间、D-二聚体;降钙素原、N-端脑钠肽前体。检验指标的正常值源自《全国临床检验操作规程第4版》[9],核酸检测采集咽拭子或鼻拭子。
1.2.3 胸部CT检查
采用64排及其以上多排螺旋CT(MSCT)扫描,仰卧位,从肺尖至肺底扫描,扫描时屏气。扫描条件:120 kV、80~100 mA、层厚5 mm、间隔5 mm,扫描完成后以层厚1.5 mm、间隔1.5 mm进行重建。肺窗:窗宽1500 HU、窗位 -600 HU,纵隔窗:窗宽400 HU、窗位40 HU。
将数据传输到人工智能软件,由两位高年主治以上医生进行评估COVID-19肺部病变,即COVID-19肺部受累的特征性CT表现包括实变或胸膜下磨玻璃密度影,外周和下肺分布为主、铺路石症、晕症等[10],通过人工智能软件逐层测量得出全肺及各叶病灶体积(LV)及其占比等CT定量参数(图1),测量过程中如AI软件识别不准时,进行人工手动校正。
1.2.4 预后判断
将所有患者分为两类:好转、预后不良。预后不良:重型转为危重型放弃治疗或死亡;好转:根据新型冠状病毒感染诊疗方案(试行第十版)[1]住院患者达到出院标准及危重型诊断标准。
1.3 统计学方法
所有数据采用SPSS 17.0软件进行处理,计量数据以
$\, \bar{x}\pm s$ 表示,计量资料组间比较,采用独立样本t检验;计数资料以百分比表示,计数资料组间比较采用$\chi^{2}$ 检验,相关性分析采用logistic回归分析,P<0.05为差异有统计学意义。ROC曲线分析计算曲线下面积、最佳截止点、敏感性和特异性。2. 结果
2.1 所有纳入重症COVID-19患者各观察指标及两组对比结果
所有纳入重症COVID-19患者各观察指标及不同预后两组研究对象观察指标的比较(表1和表2),肺部病灶AI测量指标(图2和图3)。
表 1 重症COVID-19患者不同预后两组肺部病灶AI测量指标的比较($\bar{x}\pm s$ )Table 1. Comparison of various indicators of lung lesions between two groups with patients with severe COVID-19 and different prognoses measured using AIAI测量指标 所有纳入人群(n=136) 预后好转(n=94) 预后不良(n=42) t P 右肺上叶LV/cm3 99.26±115.784 82.30±102.082 137.21±135.534 2.345 0.022* 右肺上叶PLV/% 14.22±17.011 11.79±15.551 19.65±18.989 2.351 0.022* 右肺中叶LV/cm3 48.44±60.167 38.57±70.516 70.52±72.137 2.591 0.012* 右肺中叶PLV/% 16.22±18.504 13.65±17.238 21.97±20.109 2.468 0.015* 右肺下叶LV/cm3 187.30±139.077 172.75±133.610 219.87±147.050 -0.338 0.736 右肺下叶PLV/% 42.76±163.245 45.93±195.969 35.66±23.665 1.842 0.068 左肺上叶LV/cm3 84.79±99.048 76.72±96.225 102.84±104.005 1.427 0.156 左肺上叶PLV/% 11.86±15.076 10.45±14.354 15.02±16.315 1.645 0.102 左肺下叶LV/cm3 139.30±112.473 123.59±104.904 174.48±121.889 2.485 0.014* 左肺下叶PTLV/% 24.26±20.080 21.36±19.277 30.75±20.552 2.571 0.011* TLLV/cm3 554.24±393.127 486.90±359.175 704.94±427.312 3.081 0.003* PTLLV/% 18.11±14.442 15.90±13.844 23.04±14.700 2.724 0.007* 注:*-P<0.05,统计学有显著性差异;LV为病灶体积,PLV为病灶体积占比。 表 2 重症COVID-19患者不同预后两组基础疾病及实验室检查的比较($\bar{x}\pm s$ )Table 2. Comparison of observation indicators between two groups with patients with severe COVID-19 and different prognoses临床及实验室资料 所有纳入人群(n=136) 预后好转(n=94) 预后不良(n=42) $t/\chi^{2}$ P 年龄/岁 74.91±12.006 73.66±11.441 78.07±12.915 1.996 0.039* 男性/例(%) 88(64.71) 60(63.83) 28(66.67) 0.102 0.749 吸烟/例(%) 27(19.85) 20(21.28) 7(16.67) 0.388 0.534 心血管疾病/例(%) 98(72.06) 66(70.21) 32(76.19) 0.515 0.473 低蛋白血症/例(%) 78(57.35) 48(51.06) 30(71.43) 4.922 0.027* 2型糖尿病/例(%) 43(31.62) 34(36.17) 9(21.43) 2.918 0.088 脑卒中/例(%) 6(4.41) 1(1.06) 5(11.90) 8.090 0.004* 恶性肿瘤/例(%) 11(8.09) 8(8.51) 3(7.14) 0.073 0.787 慢性肺部疾病/例(%) 36(26.47) 23(24.47) 13(30.95) 0.672 0.428 慢性肾脏疾病/例(%) 22(16.18) 12(12.77) 10(23.81) 2.611 0.106 慢性肝脏疾病/例(%) 15(11.03) 9(9.57) 6(14.29) 0.657 0.418 总胆红素/(µmol/L) 11.87±9.40 11.79±10.579 12.03±6.076 0.137 0.891 丙氨酸转移酶/(U/L) 36.24±47.173 34.36±43.254 40.45±55.290 0.695 0.488 天门冬氨酸转移酶/(U/L) 40.18±42.563 38.55±48.102 43.84±26.402 0.823 0.412 乳酸脱氢酶/(U/L) 323.54±159.911 305.05±149.402 364.92±176.154 2.041 0.043* BUN/(mmol/L) 8.47±6.653 7.67±6.487 10.25±6.750 2.117 0.036* 肌酐/(µmol/L) 99.10±136.866 103.81±160.405 88.57±56.150 -0.599 0.550 凝血酶原时间/s 13.23±2.601 12.84±2.088 14.09±3.358 2.640 0.009* 白蛋白/(g/L) 34.27±5.787 35.32±5.464 31.93±5.866 -3.269 0.001* 降钙素原/(ng/mL) 2.07±12.058 1.65±10.312 3.00±15.370 0.600 0.549 血红蛋白/(mmol/L) 131.99±23.442 132.16±22.76 131.62±25.193 -0.119 0.906 白细胞/(109/L) 7.40±4.336 6.88±3.839 8.58±5.140 2.149 0.033* 淋巴细胞比值% 15.33±9.413 16.41±9.331 12.90±9.249 -2.031 0.044* 中性粒细胞比值% 77.28±12.397 75.55±11.688 81.14±13.192 2.476 0.015* C反应蛋白/(mg/L) 79.07±64.282 71.59±64.539 95.81±61.173 2.098 0.039* D-二聚体/(µg/mL) 1.32±3.062 0.96±1.974 2.13±4.590 2.083 0.039* N-端脑钠肽前体/(pg/mL) 3239.55±7118.443 2797.38±7253.059 4229.14±6787.372 1.112 0.269 注:*-P<0.05,统计学有显著性差异。 本组136例重型COVID-19患者中,94例好转出院,42例预后不良,年龄、低蛋白血症、脑卒中、乳酸脱氢酶、BUN、凝血酶原时间、白蛋白、白细胞、淋巴细胞比值、中性粒细胞比值、C反应蛋白、D-二聚体、右肺上叶LV、右肺上叶PLV、右肺中叶LV、右肺中叶PLV、左肺下叶LV、左肺下叶PLV、TLLV、PTLLV两组之间差异有显著意义。
2.2 两组重型COVID-19患者预后的危险因素分析
重型COVID-19患者不同预后两组肺病变体积及其占比、伴发疾病及其实验室检查相关性分析(表3)。本组重型COVID-19患者中,Logistic回归分析显示:年龄、PTLLV、TLLV、BUN、白蛋白、白细胞进入方程,与重型COVID-19患者预后显著相关;年龄、PTLLV、TLLV、BUN、白细胞OR>1,呈正相关,白蛋白OR<1,呈负相关。
表 3 Logistic回归分析重型COVID-19患者预后与进入方程中的自变量及其参数的估计值Table 3. Logistic regression analysis of prognosis and estimated values of independent variables and parameters in the entry equation for patients with severe COVID-19选入变量 B S.E. Wald P 0R 年龄/岁 0.052 0.020 6.739 0.009* 1.053** PTLLV/% 0.034 0.015 5.081 0.024* 1.034** TLLV/cm3 0.001 0.001 6.431 0.011* 1.001** BUN/(mmol/L) 0.069 0.031 4.902 0.027* 1.072** 白蛋白/(g/L) -0.082 0.039 4.475 0.034* 0.922# 白细胞/(109/L) 0.116 0.048 5.713 0.017* 1.123** 注:*-P<0.05,统计学有显著性差异。**-OR>1,呈正相关;# -OR<1,呈负相关。 2.3 PTLLV、TLLV评估重型COVID-19患者预后的诊断效能
ROC曲线分析显示:PTLLV、TLLV评估重型COVID-19患者预后有诊断意义(图4)。PTLLV、TLLV曲线下面积(AUC)分别为0.651和0.650,诊断敏感性分别为59.5% 和54.8%,特异性分别为76.6% 和76.6%,最佳截止点分别为19.38% 和647.93 cm3(表4)。PTLLV、TLLV两者评估重型COVID-19患者预后的特异性相同,而PTLLV评估重型COVID-19患者预后的敏感性相对更高。
表 4 PTLLV和TLLV评估重型COVID-19患者预后的ROC分析结果Table 4. ROC analysis results of PTLLV and TLLV in the prognosis of patients with severe COVID-19预测值 AUC 最佳截止点 敏感性/% 特异性/% p PTLLV/% 0.651 19.38 59.50 76.60 0.005 TLLV/cm3 0.650 647.93 54.80 76.60 0.005 2.4 不同年龄段重型COVID-19患者预后对比
重型COVID-19患者预后在不同年龄段中差异对比(表5)。两组预后有差别,说明年龄在重型新型冠状病毒感染患者预后中有差异。≥80岁重型COVID-19患者中,预后不良患者占43.86%。预后不良患者中59.52% 是≥80岁患者。
表 5 重型COVID-19患者预后在不同年龄段中的卡方检验Table 5. Chi-square test for the prognosis of patients with severe COVID-19 in different age groups年龄 所有纳入人群(n=136) 合计 预后好转/例 预后不良/例 <60岁 10 4 14 ≥60且<70岁 20 2 22 ≥70岁且<80岁 32 11 43 ≥80岁 32 25 57 合计 94 42 136 3. 讨论
3.1 AI定量分析肺部病变体积与重型COVID-19患者预后的关系
胸部CT是检测肺病变的有效成像方法[5],不仅可以诊断COVID-19肺炎还可以评估肺部病变的范围[11]。为了规范急性COVID-19肺部受累程度的主观评估,已有学者提出了一些不同的定量和半定量CT严重程度评分系统,他们的研究显示肺损伤比例较高与重症COVID-19相关[12-13]。也有研究者通过CT定量检测技术对COVID-19患者肺内病灶的总体容积、最大径、密度、分布范围,发现患者进展期、重症期病灶体积、最大密度和最大径均显著升高[14],在危重COVID-19患者中,观察到具有较大肺病灶体积者炎症反应生物标志物水平更高。肺病灶体积是危重症的独立预测因子,肺病灶体积等于或大于60% 的患者患危重症的风险增加了19.4倍[10]。
目前AI可以自动检测肺炎LV与PLV(图1),AI定量分析肺部病变体积方便快捷,本研究通过AI定量重型COVID-19患者TLLV及PTLLV,分析了其与重型COVID-19预后的关系。研究结果显示重型COVID-19不同预后两组比较PTLLV、TLLV差异有统计学意义,PTLLV、TLLV与重型COVID-19预后不良呈正相关,PTLLV、TLLV是重型COVID-19预后不良危险因素;ROC曲线分析显示:TLLV在647.93 cm3时,重型COVID-19预后不良的敏感性、特异性分别为54.8% 和76.6%,PTLLV在19.38%时,重型COVID-19预后不良的敏感性、特异性分别为59.5% 和76.6%。有研究显示在危重COVID-19患者中PTLLV为60%时,预后不良的敏感性、特异性分别为82.1% 和70.2%[10],可能他们的研究为危重型患者,肺部病变更重,而本研究为重型COVID-19患者肺部病变相对较危重型轻、PTLLV相对较小,而且病灶实性成分占比可能对重型COVID-19患者的预后也存在一定的影响。本研究没有阐述病灶实性成分占比对重型COVID-19预后的影响,有待于我们进一步研究。
3.2 重型COVID-19伴发疾病及实验室指标与其预后的关系
本研究中重型COVID-19患者都具有基础疾病,基础疾病可能使COVID-19患者更容易成为重型,但是不同预后两组之间对比除脑卒中以外,其余均没有统计学意义,COVID-19患者并发缺血性脑卒中的比例为1.6%~4.6%。与未感染者相比,COVID-19患者患缺血性脑卒中的风险增加3.6倍[15],重症COVID-19伴发脑卒中可能更易出现预后不良。
本组研究对象中低蛋白血症患者57.35%,重症COVID-19不同预后两组比较显示:白蛋白、低蛋白血症差异有统计学意义,白蛋白与重型COVID-19预后不良呈负相关,白蛋白水平减低可以影响重型COVID-19预后,是重型COVID-19预后不良的危险因素。感染新冠病毒后的患者能量消耗增加,蛋白质分解加快,可以导致低蛋白血症,白蛋白水平的下降可以有效评估重型COVID-19患者病情[2]。
本研究重型COVID-19不同预后两组比较炎性指标中的白细胞计数、淋巴细胞比值、中性粒细胞比值、C反应蛋白等,肝功能指标中的乳酸脱氢酶,凝血功能异常中的凝血酶原时间延长、D-二聚体水平升高等指标,差异有统计学意义。重型COVID-19预后不良患者可能炎症爆发、肝功损伤、凝血系统的激活较预后良好者更明显。BUN是肾功能损伤的标志物,多见于各种类型肾功能衰竭,其水平升高多提示不良预后[16]。本研究显示BUN与重症COVID-19预后不良呈正相关,是预后不良的危险因素。
3.3 年龄、性别对重型COVID-19预后的关系
老年患者大多数有基础疾病,当感染COVID-19时,容易导致病情加重,死亡率增加[17],本研究显示重症COVID-19不同预后两组比较年龄差异有统计学意义,而且年龄是重症COVID-19预后不良的危险因素。有研究认为新冠肺炎主要影响男性(58.1%),经常发生在中老年男性中,80岁以上人群的死亡率最高(8%~15%)[18],特别是重型COVID-19患者80岁以上死亡率更高。本组研究对象均为重型COVID-19患者,其中男性64.71%,≥80岁重型COVID-19患者中,预后不良患者占43.86%,而且预后不良患者中近一半以上都是≥80岁患者。重型COVID-19患者中男性占比更大原因可能与性激素有关[19-20],从免疫学角度来看,雌性比雄性更强,导致病原体清除速度更快[21]。
4. 结论
年龄越大、TLLV及PTLLV越大,重型COVID-19患者越容易出现预后不良,BUN、白细胞指标增加以及白蛋白减少是重型COVID-19患者预后不良的危险因素。
-
[1] NORTHRUP H, KRUEGER D A. Tuberous sclerosis complex diagnostic criteria update: Recommendations of the 2012 international tuberous sclerosis complex consensus conference[J]. Pediatric Neurology, 2013, 49(4): 243−254.
[2] PORTOCARRERO L K L, QUENTAL K N, SAMORANO L P, et al. Tuberous sclerosis complex: Review based on new diagnostic criteria[J]. Anais Brasileiros de Dermatologia, 2018, 93(3): 323−331.
[3] Von RANKE F M, FARIA I M, ZANETTI G, et al. Imaging of tuberous sclerosis complex: A pictorial review[J]. Radiologia Brasileira, 2017, 50(1): 48−54. DOI: 10.1590/0100-3984.2016.0020.
[4] RODRIGUES D A, GOMES C M, COSTA I M. Tuberous sclerosis complex[J]. Anais Brasileiros de Dermatologia, 2012, 87(2): 184−196. DOI: 10.1590/S0365-05962012000200001.
[5] CURATOLO P, MOAVERO R, de VRIES P J. Neurological and neuropsychiatric aspects of tuberous sclerosis complex[J]. Lancet Neurology, 2015, 14(7): 733−745. DOI: 10.1016/S1474-4422(15)00069-1.
[6] RITTER D M, FESSLER B K, EBRAHIMI-FAKHARI D, et al. Prevalence of thoracoabdominal imaging findings in tuberous sclerosis complex[J]. Orphanet Journal of Rare Diseases, 2022, 17(1): 124−134.
[7] MIZUGUCHI M, OHSAWA M, KASHII H, et al. Brain symptoms of tuberous sclerosis complex: Pathogenesis and treatment[J]. International Journal of Molecular Sciences, 2021, 22(13): 6677−6692.
[8] LIN Y, WU W, GAO L, et al. Multimodality imaging of benign primary cardiac tumor[J]. Diagnostics (Basel), 2022, 12(10): 2543−2562.
[9] HOEY E T, MANKAD K, PUPPALA S, et al. MRI and CT appearances of cardiac tumours in adults[J]. Clinical Radiology, 2009, 64(12): 1214−1230. DOI: 10.1016/j.crad.2009.09.002.
[10] ALSHOABI S A, HAMID A M, ALHAZMI F H, et al. Diagnostic features of tuberous sclerosis complex: Case report and literature review[J]. Quantitative Imaging in Medicine and Surgery, 2022, 12(1): 846−861.
[11] 王乐, 秦娜, 郝美美, 等. 中国结节性硬化症患者的临床特点及诊断现状分析[J]. 现代生物医学进展, 2019, 19(8): 1567−1572. WANG L, QIN N, HAO M M, et al. Clinical features and diagnosis of patients with tuberous sclerosis complex, a current evaluation in China[J]. Progress in Modern Biomedicine, 2019, 19(8): 1567−1572. (in Chinese).
[12] ILYAS M, QUEZADA J, OPFER E K. Lipomatous infiltration in tuberous sclerosis complex: A case series and literature review[J]. Child Neurology Open, 2021, 20(8): 48−65.
[13] LUO C, YE W R, SHI W, et al. Perfect match: mTOR inhibitors and tuberous sclerosis complex[J]. Orphanet Journal of Rare Diseases, 2022, 17(1): 106−109. DOI: 10.1186/s13023-022-02266-0.
[14] PENG J H, TU H P, HONG C H. A population-based study to estimate survival and standardized mortality of tuberous sclerosis complex (TSC) in Taiwan[J]. Orphanet Journal of Rare Diseases, 2021, 16(1): 335−348.
[15] 李林, 赵建设. MRI是儿童先天性TORCH综合征治疗的首选影像学检查方式[J]. 分子影像学杂志, 2019, 42(4): 430−433. LI L, ZHAO J S. Application and clinical analysis of MRI in the TORCH of children[J]. Journal of Molecular Imaging, 2019, 42(4): 430−433. (in Chinese).
[16] CIPRIANI A, MATTESI G, BARIANI R, et al. Cardiac magnetic resonance imaging of arrhythmogenic cardiomyopathy: Evolving diagnostic perspectives[J]. European Radiology, 2023, 33(1): 270−282.




 下载:
下载: