Analysis of Influencing Factors on Pulmonary Nodule Detection by Computed Tomography with Artificial Intelligence: A Phantom Study
-
摘要:
目的:基于胸部仿真体模实验,对人工智能(AI)诊断系统CT肺结节检出的影响因素进行分析。方法:使用东芝Aquilion CXL 64排CT,设定不同扫描参数(扫描剂量、重建算法及重建层厚)和非扫描参数(结节的大小、密度及胸部位置),对体模扫描并图像重建,运用AI诊断系统检出肺结节。结果:①不同剂量扫描时,肺结节检出真阳性率无统计学差异,低剂量模式时检出假阳性数较高。②3种迭代重建算法比较,检出的肺结节真阳性率无统计学差异,Strong组的真阳性率及假阳性数均较高。③薄层图像的肺结节检出真阳性率明显高于厚层图像。④纵隔旁肺结节真阳性率明显高于胸膜下和肺实质。⑤直径≥8 mm组肺结节检出真阳性率明显高于直径≤5 mm组。⑥3种密度肺结节检出时,真阳性率均无明显差异。结论:CT扫描因素(扫描剂量、重建算法及重建层厚)和非扫描因素(结节的大小、密度及胸部位置)可影响AI肺结节的检出。
Abstract:Objective: This study aimed to analyze the factors influencing artificial intelligence (AI) diagnostic system detection of pulmonary nodules on computed tomography (CT) scans, using a chest simulation phantom experiment with simulated lung nodules. Methods: A Toshiba (Canon) 64-slice spiral CT scanner was used. The phantom was scanned and images were reconstructed under varying scanning parameters (dose, reconstruction algorithm, and layer thickness) and non-scanning parameters (nodule size, density, and chest location). Subsequently, the AI diagnostic system performed pulmonary nodule detection on the images. Results: (1) No statistically significant difference was observed in the true positive rate of pulmonary nodules detected at different scanning doses. However, the low-dose mode produced a higher number of false positives. (2) Comparisons across the three iterative reconstruction algorithms revealed no statistically significant difference in the true positive rate of detected pulmonary nodules. However, the Strong group exhibited a higher true positive rate and a higher number of false positives. (3) The true positive rate of lung nodules detected in thin images was significantly higher than in thick images. (4) The true positive rate of pulmonary nodules located in the paramediastinum was significantly higher in the subpleural and lung parenchyma. (5) The true positive rate of nodules ≥8 mm was significantly higher than that of nodules ≤5 mm. (6) No statistically significant difference was observed in the true positive rate when detecting nodules with differing densities. Conclusion: Both CT scanning parameters (dose, reconstruction algorithm, and layer thickness) and non-scanning parameters (nodule size, density, and chest location) can influence the detection of pulmonary nodules by AI systems.
-
Keywords:
- artificial intelligence /
- X-ray computed tomography /
- pulmonary nodules /
- phantom
-
随着人工智能(artificial intelligence,AI)技术的兴起,AI在医疗领域有着广泛的应用前景和发展空间,已成为影响医疗健康产业发展的重要科技手段[1]。肺癌的早期精准检出对患者的治疗、生存期的提高有重要意义。早期肺癌在CT上常表现为具有或不具有恶性征象的肺结节,因此肺结节的检出是肺癌早诊第一步。
近年来,AI技术在肺结节检出中广泛应用,提升了肺结节的检出能力[2],提高了肺癌、转移瘤和良性病变的预测准确性[3],体现出较高的临床应用价值。与医师肉眼判断肺结节一样,AI在结节检出过程中也受到许多因素的影响,如肺结节的类型、位置、大小、形状、扫描及重建参数等,但基于AI技术辅助诊断系统的CT肺结节检出影响因素的分析报道较少。因此,本文利用胸部仿真体模和置入模拟肺结节模型实验,就不同CT成像因素对AI肺结节检出的影响进行定量研究。
1. 材料与方法
1.1 材料
实验对象为“Lungman N1”型男性胸部体模,大小约43 cm×40 cm×48 cm,胸围约94 cm,重约18 kg,包括仿真的胸壁、横膈膜、纵隔、心脏、肺及肺血管,均与实际人体组织的衰减性相同,胸腔内的肺血管之间的空间内包含空气。
该体模双臂向上举起,体位与患者实际扫描时一致。模拟球形结节表面光滑,将5种不同直径(3、5、8、10和12 mm)、标称CT值分别为100、-650和
$-{\text{800}}$ HU的肺结节,分3次分别置入胸部双肺不同叶段的肺实质、胸膜下和纵隔旁区域。1.2 方法
1.2.1 CT成像与图像重建
使用佳能(东芝)Aquilion CXL 64排CT对置入模拟肺结节的仿真体模进行扫描。扫描参数:管电压120 kV,螺距因子0.993,矩阵768×768,层厚及间隔5 mm,扫描时间0.5 s/r,准直0.5×64;采用自动管电流调制技术(3D CARE),按照预制的由高到低3个辐射剂量等级(High、Quality和Low dose)进行扫描。
重建算法采用三维自适应迭代剂量降低(adaptive iterative dose reduction three dimensional,AIDR 3D)技术,3D AIDR技术后置使用可降低噪声并优化图像,降噪权重由高到低3个模式(Strong>Standard>Mild)。图像重建层厚/层间距分别为1 mm/0.8 mm和7 mm/7 mm。
1.2.2 AI辅助诊断系统的图像分析
由两位资深经验放射科医生分析CT扫描结果。将所有纳入实验的图像导入深睿Dr.wise肺结节辅助诊断系统(版本号:220531),利用图像识别技术对体模实验影像中的肺结节进行图像识别,并标注结节。AI辅助诊断系统的肺结节检出截止尺寸设置为3 mm,以减少假阳性(图1)。
1.2.3 AI肺结节检出
本实验设计6种情况下,由AI辅助诊断系统行肺结节检出。①不同扫描剂量:选用1 mm层厚、Standard重建算法图像,每种3D CARE自动管电流调制技术(automatic tube current modulation,ATCM)等级有结节靶病灶135个。②不同权重降噪模式 AIDR 3D重建算法:选用Quality剂量等级扫描、1 mm层厚重建图像,每种模式AIDR 3D重建算法有结节靶病灶45个。③不同重建层厚:选用Quality等级剂量扫描、3种模式AIDR 3D重建算法,每种层厚图像有结节靶病灶135个。④不同胸部位置:选用Quality剂量等级扫描、1 mm层厚重建图像,3种模式AIDR 3D重建算法,每一位置计有结节靶病灶45个。⑤不同大小肺结节:选用Quality剂量等级扫描、3种模式AIDR 3D重建算法,将实验模拟结节分成2组,即≤5 mm组和≥8 mm组;≤5 mm组有结节靶病灶45个,≥8 mm组共有结节靶病灶81个。⑥不同密度肺结节:选用Quality剂量等级扫描,3种模式AIDR 3D重建算法,每种密度肺结节有结节靶病灶45个。
1.3 统计学方法
采用SPSS 26.0进行统计学分析处理。采用Kang等[4]的方法,用3个因子来评价AI检出结果每个数据的检测准确性,即真阳性结节(true positive nodules,TPN)数、真阳性率(true positive rate,TPR)和假阳性结节(false positive nodules,FPN)数。
每次检查结果的真阳性率(TPR)定义为使用每个参数检查时AI识别的结节总数除以每个参数检查时实际置入结节总数的百分比,即TPR=(AI识别的结节总数÷实际置入结节总数)×100%;假阳性结节(FPN)数定义为每个参数每次检查发现的假阳性结节之和,计数资料以(n(%))表示。其中,涉及肺结节自身物理属性(大小、密度)的两组实验,没有统计假阳性结节数。对真阳性率(TPR)进行单因素方差分析。检验水准α=0.05,P<0.05表示差异有统计学意义。
2. 结果
2.1 扫描剂量
采用3种ATCM模式扫描后AI肺结节检出情况见表1。真阳性率总体比较和配对比较,其差异均无统计学意义,但低剂量模式时假阳性结节数多。
表 1 AI对不同剂量扫描时肺结节的检出结果(n=135)Table 1. Results of pulmonary nodules detected by artificial intellgence at different doses3D自动管电流调制(ATCM) 真阳性结节数/个 真阳性率/% 假阳性结节数/个 高剂量 107 79.26 10 常规剂量 108 80.00 12 低剂量 111 82.22 21 P 0.90 高剂量vs.常规剂量 0.88 高剂量vs.低剂量 0.76 常规剂量vs.低剂量 0.64 2.2 迭代重建算法
3种AIDR 3D重建算法扫描后AI肺结节检出情况见表2。真阳性率总体比较和配对比较,其差异均无统计学意义,但降噪权重最大的Strong组真阳性率和假阳性结节数均较高。
表 2 AI对不同降噪权重AIDR 3D算法肺结节的检出结果(n=135)Table 2. Results of lung nodules detected by AIDR three-dimensional algorithm with different noise reduction weights by artificial intelligenceAIDR 3D算法 真阳性结节数/个 真阳性率/% 假阳性结节数/个 Mild 108 78.26 9 Standard 107 79.26 12 Strong 114 84.44 22 P 0.67 Mild vs. Standard 1.00 Mild vs. Strong 0.43 Standard vs. Strong 0.43 2.3 重建层厚
不同重建层厚图像AI肺结节检出情况见表3。薄层图像AI检出肺结节的真阳性率明显高于厚层图像,同时假阳性结节数也明显高于厚层图像。
表 3 AI对不同重建层厚图像肺结节的检出结果(n=135)Table 3. Results of lung nodules detected by AI in images with different reconstructed layers重建层厚/mm 真阳性结节数/个 真阳性率/% 假阳性结节数/个 1(薄层) 108 80.00 12 7(厚层) 83 61.48 4 P 0.00 2.4 胸部位置
胸部不同位置AI肺结节检出情况见表4。纵隔旁位置肺结节的真阳性率高于胸膜下和肺实质两个位置,差异有统计学意义。
表 4 AI对不同胸部位置肺结节的检出结果(n=45)Table 4. Results of artificial intelligence detection of pulmonary nodules at different chest locations肺结节所在胸部位置 真阳性结节数/个 真阳性率/% 假阳性结节数/个 胸膜下 40 88.89 2 纵隔旁 30 66.67 1 肺实质 38 84.44 9 P 0.02 胸膜下 vs. 纵隔旁 0.01 胸膜下 vs. 肺实质 0.59 纵隔旁 vs.肺实质 0.03 2.5 肺结节大小
直径≤5 mm和直径≥8 mm两组肺结节AI检出情况见表5。直径≥8 mm组真阳性率明显高于直径≤5 mm组。
表 5 AI对不同大小肺结节的检出结果Table 5. Results of AI detection of pulmonary nodules with different sizes肺结节直径/mm 真阳性结节数/个 真阳性率/% ≤5(n=54) 32 59.26 ≥8(n=81) 76 94.83 P 0.00 2.6 肺结节密度
3种密度肺结节AI检出情况见表6。真阳性率总体比较和配对比较,3种密度肺结节AI检出均无明显差异。
表 6 AI对不同密度肺结节的检出结果(n=45)Table 6. Results of artificial intelligence detection of pulmonary nodules with different densities肺结节密度/HU 真阳性结节数/个 真阳性率/% 100(实性结节) 35 77.78 -650(磨玻璃结节) 40 88.89 -800(磨玻璃结节) 33 73.33 P 0.17 100 HU vs. -650 HU 0.19 100 HU vs. -800 HU 0.60 -650 HU vs. -800 HU 0.07 3. 讨论
本文借助仿真胸部体模实验,分析影响AI辅助诊断系统检出肺结节的6个相关因素,以期指导AI辅助诊断系统在临床的合理应用。
本实验采用自动管电流调制(ATCM)技术,3种扫描剂量时AI肺结节检出结果见表1,总体比较和两两配对比较,真阳性率的差异性均无统计学意义。随着管电流的增加,噪声有显著降低的趋势[5],但低剂量扫描时AI肺结节检出真阳性率差异没有显著性。Jin等[6]对比研究了低剂量和常规剂量CT对实性结节检出的影响,结果显示降低放射剂量对实性结节检出的敏感度无影响。对于磨玻璃结节,低剂量下单独采用AI的检出效能较医师独立阅片时诊断效能高(88.4% vs 34.2%)[7]。因此,低剂量CT扫描结合AI筛查肺结节是合理的选择。
与标准FBP重建相比,迭代重建时胸部CT上的噪声降低。本实验设置3种降噪权重AIDR 3D算法的AI肺结节检出结果,总体检出比较和两两配对比较,真阳性率的差异性均无统计学意义,但最大降噪权重组(Strong组)真阳性肺结节检出数最高,同时假阳性结节检出也最高(表2)。实验结果与Kang等[4]的研究结果相同,即提高迭代重建的降噪权重可以提升AI肺结节检出能力。但要注意过高的降噪可能导致图像失真,引起假阳性结节检出增加。
在薄层图像上,AI对真阳性结节检出增加,同时对假阳性结节检出也增加(表3)。关于层厚与AI肺结节检出的相关性,许多文献有相同或相似的报道。Narayanan等[8]比较了不同层厚图像的AI检出,大于3 mm结节的差异,结果显示,1.25 mm和2.50 mm层厚表现相当,明显优于5 mm及10 mm。Messerli等[9]发现1.5 mm层厚检出率高于3.0 mm。Godoy等[10]则发现对于薄层(0.67~1.00 mm)的实性、混合磨玻璃、纯磨玻璃结节,在AI辅助后,敏感度分别提高了25%、16% 和13%;而对于厚层(5 mm)上述3种结节,AI辅助后敏感度分别提高了18%、1% 和5%。不同厚度图像肺结节检测率的差异可以用空间分辨率来解释,总体来说,薄层图像AI肺结节检出率优于厚层图像。
研究表明,在胸部CT扫描时不同区域的噪声分布存在一定的差异性[11]。本研究在胸部不同位置上布放结节,不同位置肺结节AI检出真阳性率的差异性有统计学意义(表4),其中纵隔旁结节检出率明显较低,可能与胸部纵隔区域噪声相对较高有关。Ban等[12]研究发现与血管相连的结节检出敏感度为94.1%,胸膜下结节为92.3%,而肺内孤立性结节则为97.4%。Han等[13]采用经典机器学习AI系统,对胸膜下结节检出的敏感度可以达到89.2%,假阳性率为4.14 FPs/Scan。对于肺结节位置来说,不与血管、支气管或胸膜相连的结节,检出率要高。
本实验中,直径≥8 mm结节组的AI检出真阳性率明显高于直径≤5 mm结节组(表5)。Brown等[14]采用图像处理法得出结果,>8 mm和4 mm的结节检出敏感度分别为79.3% 和75.0%,假阳性率为1.01、2.05 FPs/Scan。Setio等[15]采用的深度学习模型中,对于3 ~10 mm实性结节和>10 mm实性结节,检出敏感度分别为85.7% 和31.8%。总体上,肺结节体积越小,AI的检出敏感性越低、检出率越低。
本研究的3种密度(CT值)结节AI检出,真阳性率的差异性无统计学意义(表6)。较早的研究与本研究结果有一定程度的偏差,Godoy等[10]设计了针对混合磨玻璃结节与纯磨玻璃结节的经典机器学习模型,发现对前者检出的敏感度为95%,后者则为71%。Setio等[15]采用的CNN深度学习模型,对实性结节的检出敏感度为85.7%,但对于磨玻璃结节的检出敏感度只有36.1%。Han等[16]专门针对磨玻璃结节采用CNN方法构建模型,结果显示肺结节检出敏感度为96.64%,特异度为71.43%。说明AI的不同构建模型,对不同密度肺结节检出效果有差异性,随着AI技术的不断成熟,对磨玻璃结节的检出能力逐渐提升。
本研究存在一些局限性。①研究是基于仿真胸部体模,与患者胸部背景影像表现有一定差异;实验置入的模拟圆形肺结节趋于理想化(形状规整、边界清楚),在临床实践中,病理性肺结节常常形状不规则、边缘不清楚,而结节形态多样性和不规则是造成AI检出假阳性的主要原因之一[13],因此,研究结果可能与临床实际情况下肺结节检测有偏差。②只采用一种AI辅助诊断系统进行实验,研究表明[17],不同人工智能软件系统的肺结节检出效果存在差异性。这些局限性有待于我们进行下一步研究。
4. 结论
AI技术仍然存在不可忽视的问题,影响结节检出的因素很多,如非扫描相关因素(结节大小、位置、性质等)和扫描相关因素(扫描层厚、重建算法、曝光剂量等),CT肺结节检出AI临床应用时,对AI检出能力的影响因素要有足够的认识,需要做好CT图像的质量控制。
-
表 1 AI对不同剂量扫描时肺结节的检出结果(n=135)
Table 1 Results of pulmonary nodules detected by artificial intellgence at different doses
3D自动管电流调制(ATCM) 真阳性结节数/个 真阳性率/% 假阳性结节数/个 高剂量 107 79.26 10 常规剂量 108 80.00 12 低剂量 111 82.22 21 P 0.90 高剂量vs.常规剂量 0.88 高剂量vs.低剂量 0.76 常规剂量vs.低剂量 0.64 表 2 AI对不同降噪权重AIDR 3D算法肺结节的检出结果(n=135)
Table 2 Results of lung nodules detected by AIDR three-dimensional algorithm with different noise reduction weights by artificial intelligence
AIDR 3D算法 真阳性结节数/个 真阳性率/% 假阳性结节数/个 Mild 108 78.26 9 Standard 107 79.26 12 Strong 114 84.44 22 P 0.67 Mild vs. Standard 1.00 Mild vs. Strong 0.43 Standard vs. Strong 0.43 表 3 AI对不同重建层厚图像肺结节的检出结果(n=135)
Table 3 Results of lung nodules detected by AI in images with different reconstructed layers
重建层厚/mm 真阳性结节数/个 真阳性率/% 假阳性结节数/个 1(薄层) 108 80.00 12 7(厚层) 83 61.48 4 P 0.00 表 4 AI对不同胸部位置肺结节的检出结果(n=45)
Table 4 Results of artificial intelligence detection of pulmonary nodules at different chest locations
肺结节所在胸部位置 真阳性结节数/个 真阳性率/% 假阳性结节数/个 胸膜下 40 88.89 2 纵隔旁 30 66.67 1 肺实质 38 84.44 9 P 0.02 胸膜下 vs. 纵隔旁 0.01 胸膜下 vs. 肺实质 0.59 纵隔旁 vs.肺实质 0.03 表 5 AI对不同大小肺结节的检出结果
Table 5 Results of AI detection of pulmonary nodules with different sizes
肺结节直径/mm 真阳性结节数/个 真阳性率/% ≤5(n=54) 32 59.26 ≥8(n=81) 76 94.83 P 0.00 表 6 AI对不同密度肺结节的检出结果(n=45)
Table 6 Results of artificial intelligence detection of pulmonary nodules with different densities
肺结节密度/HU 真阳性结节数/个 真阳性率/% 100(实性结节) 35 77.78 -650(磨玻璃结节) 40 88.89 -800(磨玻璃结节) 33 73.33 P 0.17 100 HU vs. -650 HU 0.19 100 HU vs. -800 HU 0.60 -650 HU vs. -800 HU 0.07 -
[1] 庹敏, 侯梦婷, 鲍娟. 人工智能在医疗领域的应用现状和思考[J]. 中国现代医生, 2022, 60(22): 72−75. DOI: 10.3969/j.issn.1673-9701.2022.22.zwkjzlml-yyws202222017. TUO M, HOU M T, BAO J. Application status and thinking of artificial intelligence in medical field[J]. Chinese Modern Doctor, 2022, 60(22): 72−75. DOI: 10.3969/j.issn.1673-9701.2022.22.zwkjzlml-yyws202222017. (in Chinese).
[2] 明佳蕾, 方向明. 基于人工智能的CT肺结节检出临床应用及研究进展[J]. 中华放射学杂志, 2019, 53(6): 522−525. DOI: 10.3760/cma.j.issn.1005-1201.2019.06.017. MING J L, FANG X M. Clinical application and research progress of lung nodule detection using artificial intelligence CT[J]. Chinese Journal of Radiology, 2019, 53(6): 522−525. DOI: 10.3760/cma.j.issn.1005-1201.2019.06.017. (in Chinese).
[3] LI K, LIU K F, ZHONG Y H, et al. Assessing the predictive accuracy of lung cancer, metastases, and benign lesions using an artificial intelligence-driven computer aided diagnosis system[J]. Quantitative Imaging in Medicine and Surgery, 2021, 11(8): 3629−3642. DOI: 10.21037/qims-20-1314.
[4] KANG S M, KIM T H, SHIN J M, et al. Optimization of a chest computed tomography protocol for detecting pure ground glass opacity nodules: A feasibility study with a computer-assisted detection system and a lung cancer screening phantom[J]. PLOS ONE, 2020, E15(5): e0232688.
[5] SOLOMON J, MARIN D, ROY CHOUDHURY K, et al. Effect of radiation dose reduction and reconstruction algorithm on image noise, contrast, resolution, and detectability of subtle hypoattenuating liver lesions at multidetector CT: Filtered back projection versus a commercial model-based iterative reconstruction algorithm[J]. Radiology, 2017, 284: 777−787. DOI: 10.1148/radiol.2017161736.
[6] JIN H, LI Z, TONG R, et al. A deep 3D residual CNN for false-positine in pulmonary nodule detection[J]. Medical Physics, 2018, 45(5): 2097−2107. DOI: 10.1002/mp.12846.
[7] SILVA M, SCHAEFER-PROKOP C M, JACOBS C, et al. Detection of subsolid nodules in lung cancer screening: Complementary sensitivity of visual reading and computer-aided diagnosis[J]. Investigative Radiology, 2018, 53(8): 441−449. DOI: 10.1097/RLI.0000000000000464.
[8] NARAYANAN B N, HARDIE R G, KEBEDE T M, et al. Performence analysis of a computer-aided detection system for lung nodules in CT at different slice thickness[J]. Journal of Medical Imaging, 2018, 5(1): 014504.
[9] MESSERLI M, KLUCKERT T, KNITEL M, et al. Computer-aided detection (CAD) of solid pulmonary nodules in chest X-ray equivalent ultralow dose chest CT-first in-vivo result at dose level of 0.13 mSv[J]. European Journal of Radiology, 2016, 85(12): 2217−2224. DOI: 10.1016/j.ejrad.2016.10.006.
[10] GODOY M C, KIM T J, WHITE C S, et al. Benefit of computer-aided detection analysis for the detection of subsolid and solid lung nodules on thin and thick-section CT[J]. American Journal of Roentgenology, 2013, 200(1): 74−83. DOI: 10.2214/AJR.11.7532.
[11] 赵峰, 曾勇明, 彭刚, 等. 胸部低剂量CT扫描管电流与噪声分布相关性研究[J]. 中华放射医学与防护杂志, 2012, 32(1): 100−103. DOI: 10.3760/cma.j.issn.0254-5098.2012.01.030. ZHAO F, ZENG Y M, PENG G, et al. Correlation between the tube current and image noise in low-dose chest CT scean[J]. Chinese Journal of Radiological Medicine and Protection, 2012, 32(1): 100−103. DOI: 10.3760/cma.j.issn.0254-5098.2012.01.030. (in Chinese).
[12] BAN K T, KIM J S, NA Y H, et al. Pulmonary nodules: Automated detection on CT image with morphologic matching algorithm-preliminary results[J]. Radiology, 2005, 236(1): 286−293. DOI: 10.1148/radiol.2361041286.
[13] HAN H, LI L, HAN F, et al. Fast and adaptive detection of pulmonary nodules in thoracic CT images using a hierarchical vecter quantization scheme[J]. IEEE Journal of Biomedical and Health Informatics, 2015, 19(2): 648−659.
[14] BROWN M S, LO P, GOLDIN J C, et al. Toward clinically usable CAD for lung cancer screening with computed tomography[J]. European Radiology, 2014, 24(11): 2719−2728. DOI: 10.1007/s00330-014-3329-0.
[15] SETIO A A, CIOMPI F, LATJENS G et al. Pulmonary nodules detection in CT image: False positive redution using multi-view convolutional networks[J]. IEEE Transactions on Medical Imaging, 2016, 35(5): 1160−1169. DOI: 10.1109/TMI.2016.2536809.
[16] HAN G, LIU X, ZHENG G, et al. Automatic recognition of 3D GGO CT imaging signs through the fusion of hybird resampling and layer-wise finetining CNNs[J]. Medical & Biological Engineering & Computing, 2018, 56(12): 2201−2212.
[17] FU B J, WANG G S, WU M Y, et al. Influence of CT effffective dose and convolution kernel on the detection of pulmonary nodules in difffferent artifificial intelligence software systems: A phantom study[J]. European Journal of Radiology, 2020, 126: 108928. DOI: 10.1016/j.ejrad.2020.108928.
-
期刊类型引用(3)
1. 杨文杰,梁烨,杨柯. 双流法肺动脉技术在肺动脉扫描中的应用评价. 影像诊断与介入放射学. 2024(04): 278-282 .  百度学术
百度学术
2. 胡嘉诚,刘云福,王新艳,王倩,马梓轩,张永县,李伟,刘荣,牛延涛. 对比剂分次团注联合能量成像获得CTU和CTA联合成像的应用研究. CT理论与应用研究. 2024(06): 692-700 .  本站查看
本站查看
3. 肖爱兰. 基于肺动脉CTA对肺栓塞检出流程优化的探讨. 现代医用影像学. 2024(09): 1644-1646+1656 .  百度学术
百度学术
其他类型引用(0)



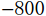

 下载:
下载:


