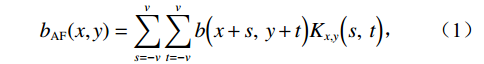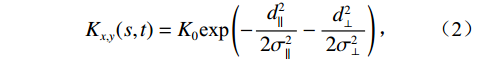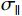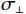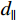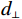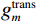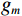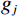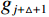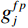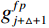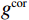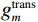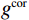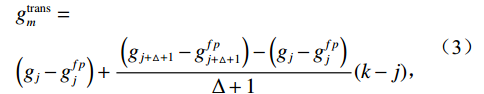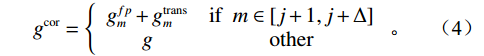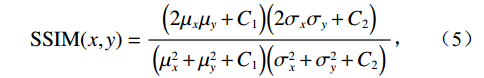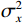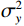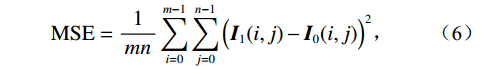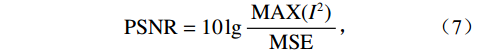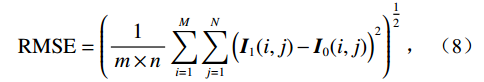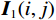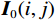Methods Research on Correction for Intracranial Metal Artifacts Based on Prior Image Utilization
-
摘要:
目的:为了有效抑制颅内金属伪影对术后复查的影响,提出一种基于先验图像的金属伪影校正算法。方法:首先对颅内金属伪影的CT图像进行自适应滤波、阈值分割和K均值聚类获得只含金属物质的图像和先验图像;以先验图像为参照,在金属物质的投影轨迹中,对原始图像的投影数据进行插值校正得到修复后的图像,并将其与只含金属物质图像融合,获得最终校正图像。为了验证该算法抑制CT金属伪影的有效性,利用仿真单金属伪影和颅内金属伪影的CT图像进行伪影校正。结果:与线性插值算法和ADN算法相比,该算法校正后的图像结构相似性和峰值信噪比最大,而均方根误差最小。由两位高年资医生对该算法去除CT金属伪影的主观评价得分高于线性插值算法和ADN算法的主观评价得分。结论:该算法在有效保留图像边缘信息的同时,可有效地抑制CT金属伪影。
Abstract:Objective: A metal artifact correction algorithm based on prior image is proposed to suppress the effect of intracranial metal artifacts on postoperative review. Method: The computed tomography (CT) image compensating for the intracranial metal artifact is obtained by adaptive filtering, threshold segmentation, and K mean clustering. In projecting the trajectory of metallic matter, the interpolation correction of the original image’s projection data is obtained using the prior image as a reference, and the image is fused with the metal-containing material only image to produce the final corrected image. To verify the efficacy of this algorithm in suppressing CT metal artifacts, artifact correction was performed using CT images of simulated isolated metal artifacts and intracranial metal artifacts. Results: Compared with linear interpolation and the ADN algorithms, this algorithm achieves the highest structure similarity and peak signal-to-noise ratio and lowest root mean square error in corrected images. Two senior doctors subjectively scored this algorithm higher than the linear interpolation and ADN algorithms for removing CT metal artifacts. Conclusion: This algorithm effectively suppresses metal artifacts while preserving image edge information.
-
Keywords:
- CT metal artifact simulation /
- prior image /
- metal artifact /
- adaptive filter
-
颅内动脉瘤是一种严重的脑血管疾病,其治疗通常需要依赖介入性手术方法,如血管内弹簧圈栓塞术,以实现病变的栓塞和治愈[1-2]。血管内弹簧圈栓塞术具有罕见的并发症、较小的外科创伤以及显著的治愈率已经成为治疗颅内动脉瘤的一种非常安全、有效的方法。近年来被广泛应用治疗颅内动脉瘤。计算机断层扫描(computed tomograhy,CT)作为一种无创影像检查技术,已经广泛用于评估术后置入弹簧圈的血管结构及周围脑实质情况[3]。然而,在常规CT检查中,光子饥饿效应和X光子硬化效应等因素会导致弹簧圈周围出现大量的条带状伪影,降低脑组织和颅内血管的显示,进而影响CT图像的质量。这些伪影不利于术后评估动脉瘤周围结构以及对疗效评估。随着CT技术的不断发展,双源CT单能量成像技术可有效去除体内金属伪影对图像质量的影响[4-6]。双源CT通常需要更高的辐射剂量和多次扫描,以获取无伪影的CT图像,这无疑增加了患者的辐射剂量。
在过去的研究中,已经有一些关于金属伪影校正方法的相关报道[7-8]。线性插值算法是一种常见的金属伪影校正方法[9],它通过对金属投影区域的灰度值进行插值来减轻金属伪影。然而,这种方法存在一些不足之处。首先,线性插值会引入次级伪影,因为它将金属区域的灰度值替换为两边正常组织的平均灰度值,这可能导致图像细节的丢失;其次,线性插值难以应对金属伪影的非均匀性,因为线性插值是假设周围的灰度变化是均匀。在实际应用中,金属伪影的强度和形状可能会因金属物质形状和大小的不同而异,这使线性插值方法不够灵活,难以应对复杂的解剖情况。
归一化去除金属伪影(normalized metal artifact reduction,NMAR)算法是一种基于先验图像的归一化插值算法,它是通过获取一张无伪影的图像来校正受金属伪影污染的数据[10]。NMAR算法对于单金属伪影的抑制效果较为理想,但是对于复杂结构中金属植入物的校正效果不理想,特别是在金属周围存在骨组织结构的情况下,如果金属周围的组织具有高密度,则NMAR方法可能无法有效地校正金属伪影。其次,NMAR方法通常需要复杂的计算,这增加了计算机的处理时间。
迭代去除金属伪影算法(iterative metal artifact reduction,IMAR)是通过迭代计算金属投影区来减轻金属伪影[11-12]。然而,这种方法也存在一些不足之处。首先,迭代去除金属伪影算法需要更多的运行时间,因为它涉及多次迭代和优化步骤,这导致临床实践中CT图像后处理速度较慢,不适用于紧急情况;其次,迭代算法对初始参数的依赖性较高,可能需要精细地参数调整,这对操作者的经验和技能要求较高。此外,IMAR算法不利于图像细节信息的显示,因为它旨在最小化金属伪影而忽略了图像的细微特征。
为此,本研究提出基于先验图像对脑血管内弹簧圈产生金属伪影的校正研究(fusion prior-based metal artifact reduction, FP-MAR)。通过临床影像数据验证和虚拟仿真验证探讨FP-MAR算法是否可以有效抑制。CT金属伪影以提高图像的清晰度,以期为医学影像学领域提供一种新的解决方案,改善颅内动脉瘤的诊断水平,从而更好地服务于临床。
1. 原理与方法
1.1 原理
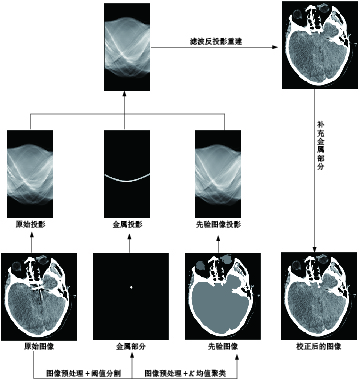
先验图像是一张近似无伪影的图像。以先验图像为参照,对原始投影图像的金属投影轨迹进行插值修复,修复后图像上金属区域与正常组织之间过渡更平滑且插值不容易产生次级伪影。校正CT金属伪影的关键是获取先验图像。
本研究采用各向异性高斯滤波器对原始CT图像进行预处理,该滤波器的卷积核会根据CT金属伪影的严重程度做动态调整,这样不仅可以有效去除CT图像中金属伪影,同时保留图像特征结构的完整。对预处理后的图像采用K均值聚类得到由空气、脑组织、骨组织3类填充组成的先验图像,然后正向投影得到先验投影图。以先验图像上的信息为参照,对原始投影图中金属投影区内的数据进行插值校正,对校正后正弦图采用滤波反投影重建得到去伪影图像。本文提出颅内金属伪影的抑制算法流程(图1)。
1.2 方法
1.2.1 预处理
金属伪影是由于金属物体在CT扫描中吸收和散射X射线,导致X射线束透过金属时产生伪影,这些伪影降低了图像分辨率干扰了医生对患者解剖结构的观察。自适应滤波是一种基于图像特征的技术,通过分析CT图像中不同组织类型的特性,根据这些特性自动调整滤波参数,以抑制金属伪影。这种方法能够在不损失重要组织细节的情况下有效抑制金属伪影,同时保持周围组织结构的清晰度。不同类型的组织在CT图像中具有不同的吸收特性,金属物体也有其特定的吸收率。
本研究将高斯滤波器和各向异性滤波器相结合,根据不同组织的吸收率来调整滤波器响应,以有效去除图像中的伪影。这种方法使得金属物体周围的软组织结构能够更清晰地显示在图像中,不再受到金属伪影的影响。
本研究采用公式(1)对含有金属伪影的CT图像进行预处理,
$$ b_{\mathrm{A}\mathrm{F}}(x,y)=\sum\limits_{s=-v}^v\sum\limits_{t=-v}^vb\Big(x+s,\;y+t\Big)K_{x,y}\Big(s,\;t\Big)\text{,} $$ (1) 其中,bAF是对校正后的 CT图像;b是含有金属伪影的CT图像,Kx,y(s, t)是各向异性高斯滤波器。以金属区域为原点,选择金属伪影的最长直径为横坐标,过金属区域做垂线为纵坐标构建二维坐标系,向量(s, t)是二维直角坐标系中相对于金属伪影点的空间位置。滤波器中卷积核的大小与向量(s, t)的取值有关系,它决定了滤波器对图像的平滑性。每一个向量(s, t)对应的二维自适应滤波器是Kx,y(s, t),见公式(2)。
$$ {{{K}}_{x,y}}(s,t) = {K_0}{\text{exp}}\left( - \frac{d_{||}^2}{2\sigma _{||}^2} - \frac{d_ \bot ^2}{2\sigma _ \bot ^2}\right) \text{,} $$ (2) 其中,
$\sigma _{||} $ 和$\sigma _ \bot $ 是金属伪影在平行和垂直方向的强度;$d_{||} $ 和$d_ \bot $ 是向量(s, t)到金属物质距离在垂直和平行方向的投影。1.2.2 先验图像
由于先验图像的优点在于可以提供一个清晰、准确的基准,用于对比和校正带有金属伪影的CT图像,所以基于先验图像校正CT金属伪影的关键是获取无“伪影”的图像。一幅良好的先验图像对于最终校正结果的影响至关重要,错误的分割结果会产生新的伪影。当存在很多很大的金属植入物,尤其这些植入物又靠近骨骼时,传统金属伪影校正算法对存在于复杂组织内的金属伪影抑制效果不彻底。
本研究根据相同组织结构具有相同的空间信息,利用K均值聚类算法将CT图像中的像素点划分为3个类别,分别代表空气、脑组织和骨组织。将K均值聚类的结果映射到对应的组织类型,形成先验图像。在这个过程中,每个类别组织的像素值为原图像上对应区域的CT平均值。根据先验图像中各组织类型的位置和分布,对金属伪影进行修正,提高CT图像的质量和可信度,从而得到更准确的CT图像。
1.2.3 插值校正
由于金属伪影会使原图出现高低不同的密度影像,若将先验图像的区域替换CT金属伪影的区域,则会导致图像不连续。本研究采用Jacobs等[13]提出的数据融合方式,以先验图像为参照,在金属轨迹区,按照融合权重将原图的正向投影与先验图像的正向投影进行融合得到校正后的CT图像,融合权重会根据伪影密度情况适当调整。
在本研究中,
$g_m^{{\mathrm{trans}}} $ 是原始图像投影和先验图像投影在金属投影区进行插值得到的过渡性投影;$g_m $ 为原始投影中的金属投影区;$g_j $ 和$g_{j + \vartriangle + 1} $ 为原始图像在金属投影区内的邻域像素;$g_j^{fp} $ 和$g_{j+\vartriangle + 1}^{fp} $ 为先验图像在金属投影区内的邻域像素;Δ+1为金属投影区域内邻域像素的位置;${g^{{\mathrm{cor}}}} $ 为校正后的图像。根据公式(3)和(4)对金属投影区进行插值可得到平滑过渡性投影$g_m^{{\mathrm{trans}}} $ ,将它与先验图像在金属投影区进行融合得到校正后投影${g^{{\mathrm{cor}}}} $ ,这个过程有助于更准确地还原金属植入物周边组织结构的几何特征,为进一步分析和应用提供了可靠的数据基础。$$ \begin{aligned}&g_m^{{\mathrm{trans}}} =\\ &\Big({g_j} - g_j^{fp}\Big) + \frac{{\Big({g_{j + \vartriangle + 1}} - g_{j + \vartriangle + 1}^{fp}\Big)-\Big({g_j} - g_j^{fp}\Big)}}{{\Delta + 1}}(k - j) \text{,}\end{aligned} $$ (3) $$ {g^{{\mathrm{cor}}}} = \left\{ \begin{array}{*{20}{c}} g_m^{fp} + g_m^{{\mathrm{trans}}}&{\mathrm{if}}\;\;{m \in [j + 1,j + \Delta ]}\\ g&{{\mathrm{other}}} \end{array} \right. 。 $$ (4) 1.2.4 图像重建与金属补偿
利用滤波反投影算法,对修正后正弦数据进行图像重建,生成一张不包含金属植入物的CT图像。为了准确呈现组织结构以及金属植入物的空间位置,将金属植入物从原始图像中提取并融合到修正后的图像中,从而产生一张消除了金属伪影的CT图像。
2. 实验与结果
2.1 仿真实验验证
为了进一步验证FP-MAR算法对CT金属伪影的抑制效果,本研究对比了线性插值算法(linear interpolation based MAR,LI-MAR)[9]、ADN算法[14]和FP-MAR算法,本文采用文献[15]中的仿真平台进行仿真实验,给出单金属伪影CT图像。实验中分别采用LI-MAR算法、ADN算法和FP-MAR算法对CT金属伪影进行校正,并比较3种算法对金属伪影校正的优劣性。
图2(a)是理想的含单金属物质层面。图2(b)是重建后含金属伪影的CT图像。图2(c)是LI-MAR处理结果,虽然伪影程度得到了改善,但是图中组织信息模糊,而且引入了许多次级伪影。图2(d)和图2(f)是ADN和FP-MAR校正后的结果,组织结构中的明暗条纹得到了有效抑制,金属间残留伪影去除干净,效果优于LI-MAR。
为了定量评价FP-MAR算法的优劣,采用SSIM值,PSNR值和RMSE值评价这3种不同算法校正后图像。结构相似性(SSIM)是衡量两幅图像在空间结构上的相似性,它是基于图像的亮度、对比度和结构信息的综合判断[16]。结构相似性的取值范围从0到1,其中1表示两幅图像完全相同,0表示两幅图像完全不同,SSIM值较高表示两幅图像在细节和结构信息上极其相似。表达式为:
$$ {\mathrm{SSIM}}(x,y) = \frac{{\Big(2{\mu _x}{\mu _y} + {C_1}\Big)\Big(2{\sigma _x}{\sigma _y} + {C_2}\Big)}}{{\Big(\mu _x^2 + \mu _y^2 + {C_1}\Big)\Big(\sigma _x^2 + \sigma _y^2 + {C_2}\Big)}} \text{,} $$ (5) 其中,ux、uy分别表示图像X和图像Y的灰度均值;σx、σy分别表示图像X和图像Y的标准差;
$\sigma _x^2 $ 、$\sigma _y^2 $ 分别表示图像X和图像Y的方差。常数C1和C2是为了防止分母可能等于零时分式出现不稳定现象。本研究采用SSIM比较3种算法重建后图像的结构相似性以评价其优缺点。峰值信噪比(PSNR)是一种用于衡量图像质量的指标,常用于评估重建后图像的失真程度。它通过比较原始图像与重建图像之间的差异来确定图像的保真度[17]。若重建后图像的PSNR值越高,说明校正后图像与理想图像之间的均方误差越小,即校正后图像的质量越接近理想图像。表达式为:
$$ {\mathrm{MSE}} = \frac{1}{{mn}}\sum\limits_{i = 0}^{m - 1} {\sum\limits_{j = 0}^{n - 1} {{{\Big({\boldsymbol I_1}(i,j) - {{\boldsymbol{I}}_0}(i,j)\Big)}^2}} } \text{,} $$ (6) $$ {\mathrm{PSNR}} = 10\lg \frac{{{\mathrm{MAX}}({I^2})}}{{{\mathrm{MSE}}}}, $$ (7) 其中,MSE是均方误差,反映理想图像与校正后图像之间差异的指标[18];m×n是图像I0的矩阵;PSNR是校正后图像的峰值信噪比。
均方根值(RMSE)是衡量校正后图像与理想图像的离散程度。RMSE值较低表示校正后图像与理想图像之间的差异较小,RMSE值越小,说明两幅图像相似性越高,CT金属伪影抑制效果越理想。反之两幅图像之间差异越大,CT金属伪影抑制效果欠佳,表达式为:
$$ {\mathrm{RMSE }}= \left( {\frac{1}{{m \times n}}\sum\limits_{i = 1}^M {\sum\limits_{j = 1}^N {{{\Big({\boldsymbol I_1}(i,j) - {\boldsymbol I_0}(i,j)\Big)}^2}} } }\right)^{\tfrac{1}{2}} \text{,} $$ (8) 其中,
${\boldsymbol I_1}(i,j) $ 和${\boldsymbol I_0}(i,j) $ 分别表示理想的CT图像和校正后的CT图像,m×n表示CT图像的像素个数。采用以上3个指标评价本算法抑制CT金属伪影的有效性,结果见表1。从表1可知FP-MAR算法对应的SSIM值和RMSE值最大;FP-MAR算法在单金属校正中SSIM和RMSE分别为0.994和0.024,比LI-MAR和ADN算法分别增加37.86%、0.2% 和减少87.56%、9.1%,表明FP-MAR算法校正后图像的纹理结构信息与理想图像的纹理结构信息具有较高的相似性。FP-MAR算法在单金属校正中PSNR为0.452,比LI-MAR算法和ADN算法分别增加了36.14%和1.3%。这表明FP-MAR算法校正后图像的失真小,与原始图像之间的差异程度低,抑制CT金属伪影的能力强。ADN算法校正后得到的图像与FP-MAR算法相比差异不大。
表 1 比较LI-MAR和FP-MAR校正后,单金属图像上SSIM值、PSNR值和RMSE值Table 1. Comparison between SSIM, PSNR, and RMSE values for isolated metal artifact images after LI-MAR and FP-MAR correction评价指标 LI-MAR ADN FP-MAR SSIM 0.721 0.992 0.994 PSNR 33.200 44.640 45.200 RMSE 0.193 0.022 0.024 2.2 临床实验验证
为了进一步验证FP-MAR算法的有效性,在MATLAB平台上进行CT图像验证。本文以带有金属伪影的DICOM格式的CT图像作为测试图。48例DICOM颅内动脉瘤CT影像数据均来自湖南医药学院总医院。实验测试的是颅脑血管内弹簧圈栓塞产生的金属伪影(图3)。
图中的伪影主要是金属和颅骨之间和金属周围的射线状伪影。经过LI-MAR算法校正后,弹簧圈周围的伪影得到了有效抑制。但是引入次级伪影,并且颅骨与弹簧圈之间的金属伪影去除不彻底(图3(b))。这是由于线性插值只对插值区间内部数据进行校正而忽略区间两端灰阶连续性导致校正后组织与金属物质之间的过渡不平滑。经过ADN算法校正后,弹簧圈周围的伪影得到有效抑制,但是弹簧圈与颅骨之间又引入新的次级伪影导致弹簧圈与颅骨之间的脑组织分辨率降低(图3(c))。经过FP-MAR算法处理后,金属部分和正常软组织之间过渡平滑,弹簧圈边缘显示清晰,伪影也得到最有效抑制(图3(d))。但是,在临床数据验证中,校正后图像的分辨率比初始图像低,这可能原因是本文算法是从含有金属伪影的CT图像出发,采用K均值聚类得到先验图像作为CT金属伪影校正的参考。由于K均值聚类算法中是以每一个组织的CT均值表示每一个组织的CT值。虽然K均值聚类得到的图像噪声减小,但是CT图像的分辨率也降低了。因此,FP-MAR算法校正后CT图像分辨率会有所下降,这与Anhaus等[19]的研究结果一致。
为了更好地评价LI-MAR算法、ADN算法和FP-MAR算法对含金属伪影图像的校正效果,由两名高职称医生分别对两种算法校正后的CT图像进行质量评估。根据Gondim等[20]公布的评分标准:伪影重,不能辨认正常结构,1分;辨认结构较为困难,2分;可以辨认结构,但缺乏信心,3分;可以辨认结构,自信心中等,4分;可以辨认结构,有较高的信心,5分。
图像质量主观评价结果如表2,原始图像的主观评价是3.15,LI-MAR图像的主观评价是3.8,FP-MAR图像的主观评价是4.4,这说明LI-MAR算法和FP-MAR算法均能在一定程度上消除金属伪影提升图像质量。其中,FP-MAR算法校正结果最优,图像中的伪影最少,金属边缘细节显示清楚,具有更好的临床应用前景。
表 2 比较LI-MAR、ADN和FP-MAR校正后,单金属图像的主观评分Table 2. Comparison of subjective scores on isolated metal images after LI-MAR and FP-MAR corrections评价指标 常规CT图像 LI-MAR FP-MAR ADN 评价者1 3.20 3.9 4.5 4.2 评价者2 3.10 3.7 4.3 4.4 评价者得分取均值 3.15 3.8 4.4 4.3 T检验 P < 0.05 LI-MAR算法在减轻CT金属伪影方面表现出一定的效果,但它并不能完全消除伪影,而且在处理金属植入物紧邻骨组织的情况下,可能会引入次级伪影。这种现象的根本原因在于LI-MAR算法是以金属植入物周围的像素值作为参考,对金属投影区间进行插值来修复原始数据。若弹簧圈紧挨骨组织必然会导致像素值估算错误,插值错误会导致模糊或不清晰的骨组织边缘,因为它无法准确估算金属与组织之间的复杂差异。所以LI-MAR算法校正后的CT图像评分不是很高。采用独立样本t检验比较LI-MAR算法和FP-MAR算法校正后图像质量的主观评价是否存在差异,结果两两评价间存在统计学差异(P < 0.05)。
3. 结论
本文提出FP-MAR算法解决了传统算法得到数据不连续,容易引入次级伪影等问题。FP-MAR算法校正后的CT图像保证了修复后数据的平滑过渡,提高了校正图像清晰度和准确性,有助于病灶检测、定位和评估等临床应用。因此,本研究提出FP-MAR算法对于抑制颅内金属植入物产生的伪影,提高诊疗水平和推进医学影像的发展具有重要的意义。
-
表 1 比较LI-MAR和FP-MAR校正后,单金属图像上SSIM值、PSNR值和RMSE值
Table 1 Comparison between SSIM, PSNR, and RMSE values for isolated metal artifact images after LI-MAR and FP-MAR correction
评价指标 LI-MAR ADN FP-MAR SSIM 0.721 0.992 0.994 PSNR 33.200 44.640 45.200 RMSE 0.193 0.022 0.024 表 2 比较LI-MAR、ADN和FP-MAR校正后,单金属图像的主观评分
Table 2 Comparison of subjective scores on isolated metal images after LI-MAR and FP-MAR corrections
评价指标 常规CT图像 LI-MAR FP-MAR ADN 评价者1 3.20 3.9 4.5 4.2 评价者2 3.10 3.7 4.3 4.4 评价者得分取均值 3.15 3.8 4.4 4.3 T检验 P < 0.05 -
[1] DING Y H, GHOZY S, DAI D, et al. Rabbit elastase aneurysm model mimics the recurrence rate of human intracranial aneurysms following platinum coil embolization[J]. American Journal of Neuroradiology. 2022, 43(5): 741-747.
[2] 刘远来, 孙异春, 何永超, 等. Solitaire支架与lvis支架辅助弹簧圈栓塞对颅内宽颈动脉瘤的疗效对比[J]. 南方医科大学学报, 2020, 40(3): 423-426. DOI: 10.12122/j.issn.1673-4254.2020.03.23. LIU Y L, SUN Y C, HE Y C, et al. Treatment efficacy of Solitaire stent- and Lvis stent-assisted coil embolization for intracranial wide-neck carotid aneurysm[J]. Journal of Southern Medical University, 2020, 40(3): 423-426. DOI:10.12122/j.issn.1673-4254.2020.03.23. (in Chinese).
[3] DAI W, LING H, SUN Y, et al. The comparison of neuronavigation combined with CT three-dimensional angiography vs. CT angiography in the guidance of clipping treatment in distal intracranial aneurysm surgery: A retrospective clinical study[J]. Annals of Translational Medicine, 2022, 10(10): 572-578.
[4] KANANI A, YAZDI M, OWRANGI A M, et al. Metal artifact reduction in cervix brachytherapy with titanium applicators using dual-energy CT through virtual monoenergetic images and an iterative algorithm: A phantom study[J]. Brachytherapy, 2022, 21(6): 933-942.
[5] 陈宗桂, 陆思璇, 管海辰, 等. IMAR技术在去除腰椎内固定金属伪影中的应用价值[J]. 中国CT和MRI杂志, 2023, 21(11): 167-169. DOI: 10.3969/j.issn.1672-5131.2023.11.051. CHEN Z G, LU S X, GUAN H C, et al. Value of IMAR Iterative algorithm in removing metal artifacts of lumbarInternal fixation[J]. Chinese Journal of CT and MRI, 2023, 21(11): 167-169. DOI:10.3969/j.issn.1672-5131.2023.11.051. (in Chinese).
[6] SCHWARZ G M, HUBER S, WASSIPAUL C, et al. Influence of scan parameters of single and dual-energy CT protocols in combination with metal artifact suppression algorithms for THA: An EX Vivo study[J]. Journal of Bone and Joint Surgery-american Volume, 2023, 105(8): 620-629.
[7] 于佳弘, 张昆鹏, 靳爽, 等. 弦图插值结合UNIT网络图像转换的CT金属伪影校正[J]. 南方医科大学学报, 2023, 43(7): 1214-1223. DOI: 10.12122/j.issn.1673-4254.2023.07.18. YU J H, ZHANG K P, JIN S, et al. CT metal artifact correction using chord graph interpolation combined with UNIT network image conversion[J]. Journal of Southern Medical University, 2023, 43(7): 1214-1223. DOI: 10.12122/j.issn.1673-4254.2023.07.18. (in Chinese).
[8] ZHANG Z, YANG M, XU L, et al. An innovative metal artifact reduction algorithm based on Res-U-Net GANs[J]. Current Medical Imaging, 2023, 19(13): 1549-1560.
[9] YOON H, LEE K Y, BECHWATI I. CLIMAR: Classified linear interpolation based metal artifact reduction for severe metal artifact reduction in X-ray CT imaging[J]. Physics in Medicine&Biology, 2021, 66(7): 1-13.
[10] 齐宏亮, 凌庆, 李翰威, 等. 基于先验图像的CT图像金属伪影校正算法[J]. 北京生物医学工程, 2023, 42(4): 384-389, 413. DOI: 10.3969/j.issn.1002-3208.2023.04.008. QI H L, LING Q, LI H W, et al. Metal artifact correction algorithm for CT images based on prior images[J]. Befjing Blomedical Engineering, 2023, 42(4): 384-389, 413. DOI: 10.3969/j.issn.1002-3208.2023.04.008. (in Chinese).
[11] SCHMIDT A M A, GRUNZ J P, PETRITSCH B, et al. Combination of iterative metal artifact reduction and virtual monoenergetic reconstruction using split-filter dual-energy CT in patients with dental artifact on head and neck CT[J]. American Journal of Roentgenology, 2022, 218(4): 716-727.
[12] TRABZONLU T A, TERRAZAS M, MOZAFFARY A, et al. Application of iterative metal artifact reduction algorithm to CT urography for patients with hip prostheses[J]. American Journal of Roentgenology, 2020, 214(1): 137-143.
[13] JACOBS F, SUNDERMANN E, de Sutter B, et al. A fast algorithm to calculate the exact radiological path through a pixel or voxel space[J]. Journal of Computing and Information Technology, 1998, 6(1): 89-94.
[14] LIAO H F, LIN W A, ZHOU S K, et al. ADN: Artifact disentanglementnetwork for unsupervised metal artifact reduction[J]. IEEE TransMed Imaging, 2020, 39(3): 634-643. DOI: 10.1109/TMI.2019.2933425.
[15] 王军. 基于投影数据修正的CT金属伪影消除方法研究[D]. 南京: 东南大学, 2013. DOI: 10.7666/d.Y2438396. WANG J. Research on CT metal artifact elimination method based on projection data correction[D]. Nanjing: Southeast University, 2013. DOI:10.7666/d.Y2438396.(in Chinese).
[16] SARA U, AKTER M, UDDIN M S. Image quality assessment through FSIM, SSIM, MSE and PSNR-A comparative study[J]. Journal of Computer and Communications, 2019, 7(3): 8-18. DOI: 10.4236/jcc.2019.73002.
[17] MATTHIEU B, LOTHAR S. Metal artifact reduction in CT using tissue-class modeling and adaptive prefiltering[J]. Medical Physics, 2006, 33(8): 2852-2859. DOI: 10.1118/1.2218062.
[18] 郑艳梅, 岳向江, 李翠, 等. 基于均方误差的变形图像的质量评价[J]. 测控技术, 2018, 37(8): 117-120. DOI: 10.19708/j.ckjs.2018.08.027. ZHENG Y M, YUE X J, LI C, et al. Quality evaluation of deformed images based on mean square error[J]. Measurement and Control Technology, 2018, 37(8): 117-120. DOI: 10.19708/j.ckjs.2018.08.027. (in Chinese).
[19] ANHAUS J A, KILLERMANN P, SEDLMAIR M, et al. Nonlinearly scaled prior image-controlled frequency split for high-frequency metal artifact reduction in computed tomography[J]. Medical Physics, 2022, 49(9): 5870-5885.
[20] GONDIM T P, MEYER J B, BAUMANN C, et al. Total hip prosthesis CT with single-energy projection based metallic artifact reduction: Impact on the visualization of specific periprosthetic soft tissue structures[J]. Skeletal Radiology, 2014, 43(9): 1237-1246. DOI: 10.1007/s00256-014-1923-5.



 下载:
下载: