Predicting Cervical Lymph Node Metastasis Using Preoperative Multiparameter Data Based on Imaging, Serology, and Clinical Features in Unifocal Papillary Thyroid Carcinoma
-
摘要:
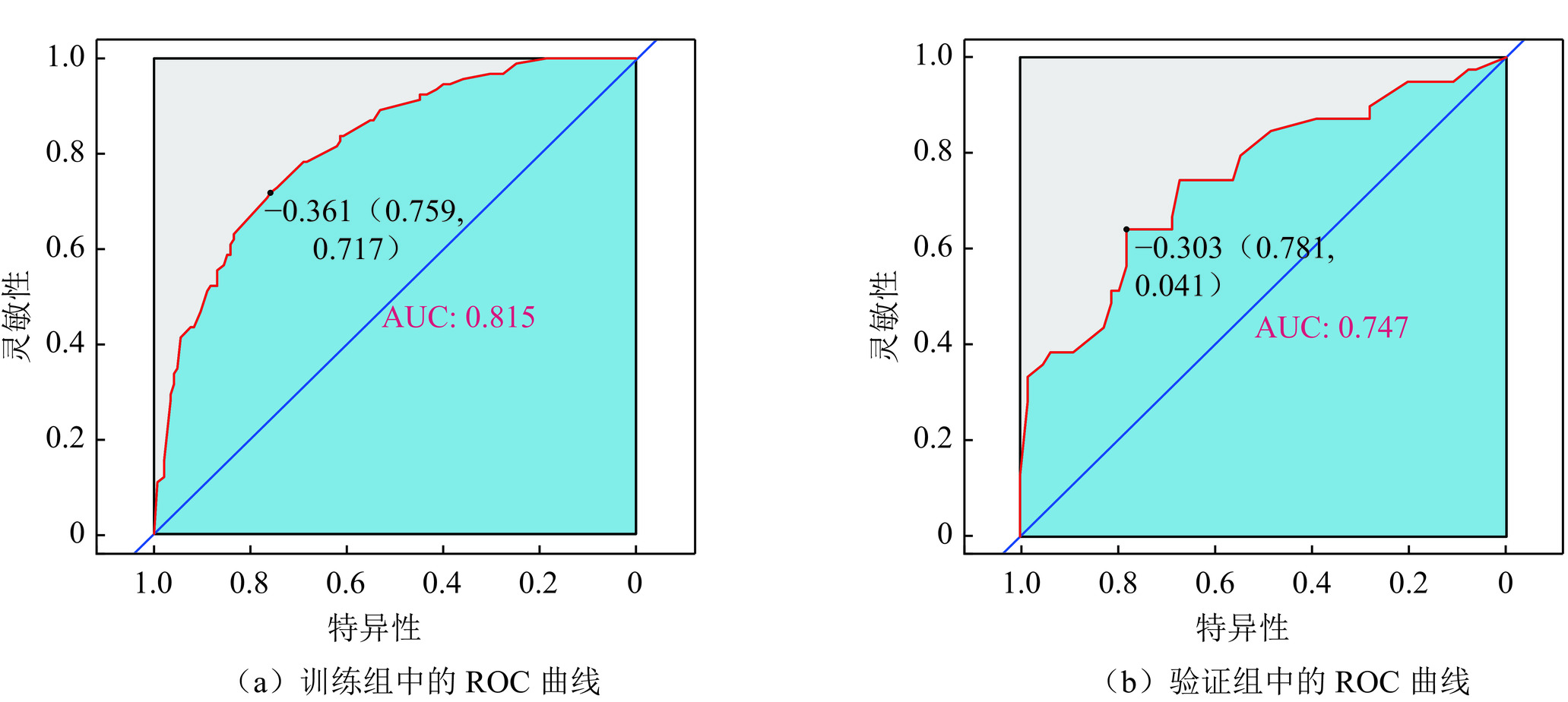
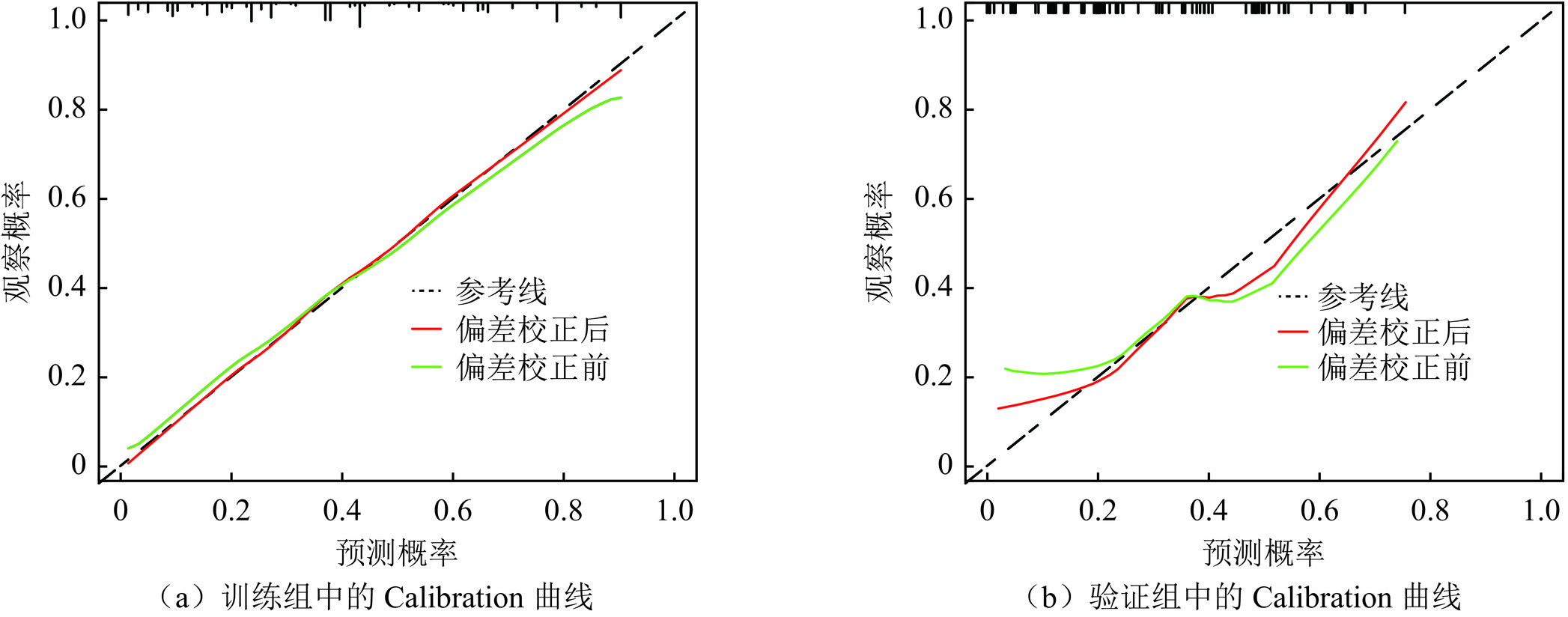
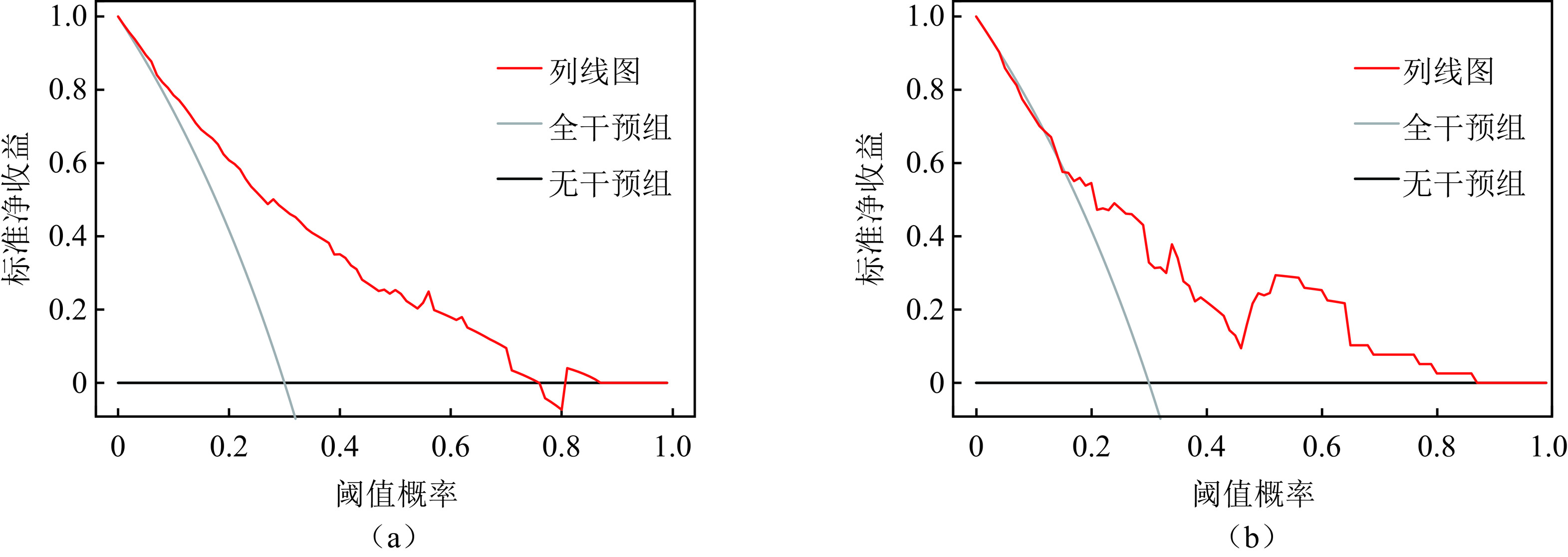
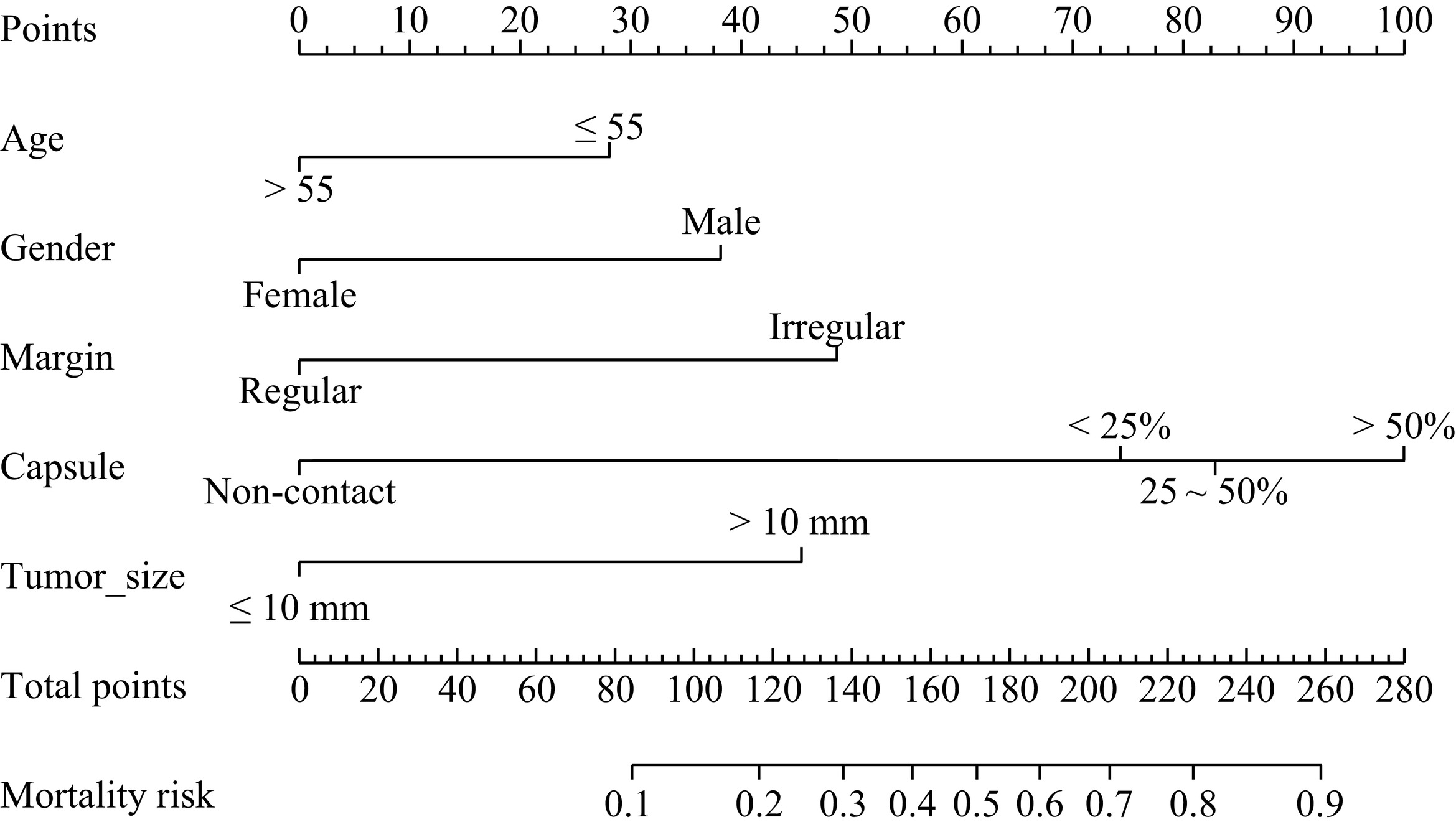
目的:评价超声、CT、临床、血清学多参数术前预测单灶性甲状腺乳头状癌(PTC)颈部中央区淋巴结转移(CLNM)的价值,开发一个列线图用于术前预测CLNM。方法:连续收集2019年1月至2023年12月在我院经手术病理证实的340例单灶性PTC患者的超声、CT、临床、甲状腺功能检查的术前多参数资料。相关专业不同年资的医师评价和记录各个参数的特征后,单因素分析各个特征与CLNM的相关性,多因素Logistic回归分析(向前法)筛选CLNM的独立危险因素(IRF)。340例患者以7∶3随机分成训练组(n=237)和验证组(n=103),预测列线图由IRFs在训练组构建,并在验证组中验证。评价列线图预测性能的指标包括受试者工作特性曲线(ROC)、校准曲线(calibration)以及决策曲线分析(DCA)。结果:单灶性PTC的多参数特征中,2个临床特征、4个CT影像特征、7个超声影像特征以及甲状腺功能检查的7项指标被纳入研究。年龄 ≤ 55岁、男性性别、肿瘤最大径 > 10 mm、被膜接触 > 0和肿瘤边缘不规则是CLNM的IRFs。列线图的预测性能在训练组和验证组的ROC曲线下面积分别是0.815(95% CI:0.761~0.870)和0.747(95% CI:0.646~0.848),calibration曲线和DCA显示了列线图的预测准确性和临床实用性。结论:单灶性PTC的术前多参数特征能够有效地预测CLNM,构建的预测列线图能够辅助临床决策,提升患者受益。
Abstract:Objective: To evaluate the predictive performance of preoperative multiparameter data, including computed tomography (CT), ultrasound, clinical features, and serology, for central cervical lymph node metastasis (CLNM) in unifocal papillary thyroid carcinoma (PTC) and to develop a nomogram model for predicting CLNM preoperatively. Methods: Data were collected from 340 consecutive patients with pathologically confirmed unifocal PTC who underwent radical thyroidectomy between January 2019 and December 2023. Radiologists with varying levels of experience analyzed the multiparameter data, including clinical features, CT, ultrasound, and thyroid function tests. The correlation between these characteristics and CLNM was assessed using univariate analysis, and independent risk factors (IRFs) were identified via forward selection in multivariate logistic regression analysis. The patients were randomly divided into training and validation cohorts at a 7∶3 ratio. A nomogram model for predicting CLNM was established using IRFs from the training cohort and tested on the validation cohort. The predictive performance of the nomogram was evaluated using receiver operating characteristic (ROC) curve, calibration curve, and decision curve analysis (DCA). Results: A total of 20 characteristics, including two clinical features, four CT features, seven ultrasound features, and seven thyroid hormone levels, were recorded and analyzed. Age ≤55 years, male sex, maximum lesion diameter >10 mm (ultrasound), capsular contact >0 (CT), and irregular tumor margin (ultrasound) were identified as IRFs for CLNM. The area under the curve of the nomogram ROCs in the training and validation cohorts was 0.815 (95% CI: 0.761–0.870) and 0.747 (95% CI: 0.646–0.848), respectively. The calibration curve and DCA showed excellent utility of the nomogram for predicting CLNM. Conclusions: The multiparameter characteristics of unifocal PTC can effectively predict CLNM. The constructed nomogram can assist in clinical decision-making and benefit patients with PTC.
-
新型冠状病毒感染(COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2,简称新冠病毒)入侵机体引起的一种特殊类型的病毒性感染性疾病(Viral infectious disease,VID)。因其发病机制、累及部位和范围、病理改变及损伤程度等差异而呈现明显多样化或异质性的临床症征及影像学表现,所以早期发现和精准评判及风险预警对于COVID-19患者的诊断、治疗和预后极为重要[1-2]。目前国内外有关COVID-19的研究和文献多有报道,但尚有诸多诊断及治疗等相关问题亟待研究。本文对其流行病学、病理改变、临床表现和CT特征等进行总结分析,旨在提高临床和影像医师对该病的认知和诊治水平。
1. 病原学和流行病学特征
COVID-19人群普遍易感,传染源主要是新型冠状病毒感染者;主要传播途径为经呼吸道飞沫和密切接触传播,在相对封闭的环境中经气溶胶传播,接触被病毒污染的物品后也可能造成感染。疫情的传播与新冠病毒自身的基因突变密切相关,研究显示目前在全球范围内新冠病毒的变异毒株达几百余种,其中重要的毒株有5种[3-4],即2020年9月出现的阿尔法株(Alpha/α)、贝塔株(Beta/β)和伽马株(Gamma/γ),2021年2月的德尔塔株(Delta/δ)和2021年11月发现的奥密克戎(Omicron/ο)。目前流行优势毒株Omicron是从D614G株演化而来,并出现了5个亚型:BA.1、BA.2、BA.3、BA.4和BA.5。
2. 发病机制和病理学改变
COVID-19的发病机制尚不完全清楚,与新冠病毒的基因组结构和宿主的免疫功能密切相关。SARS-CoV-2属于有薄膜的β属单正链 RNA冠状病毒,基本结构包括核衣壳(蛋白质+RNA)、包膜(蛋白质+脂质)和包膜周的棘突蛋白(spike protein,即S蛋白)。其基因组有29891个核苷酸,基因组序列为5′UTR-ORF1 a/b(多聚蛋白Pp1 a或Pplab)-结构蛋白(S蛋白)-包膜蛋白(envelope protein,E蛋白)-膜蛋白(membrane protein,M蛋白)-核衣壳蛋白(nucleocapsid protein,N蛋白)-3′UTR[3-6]。基因序列比对提示COVID-19为动物源性疾病。SARS-CoV-2通过其表面的S蛋白识别靶细胞上的受体人血管紧张素转换酶Ⅱ(human angiotensin-converting enzyme 2,ACE2)进入细胞,遗传物质RNA利用细胞内的翻译系统完成相应蛋白质的复制和转录获得子代病毒并胞吐出细胞。Harmer等[7]和Ceraolo等[8]研究发现ACE2在人体组织内均有表达,尤其在肺脏、鼻咽、消化道、肝脏、肾脏和心血管组织中呈高表达,在中枢神经、淋巴组织和骨肌中表达中等,且以Ⅱ型肺泡细胞中表达量最高,所以SARS-CoV-2极易感染人呼吸道黏膜上皮细胞、Ⅱ型肺泡上皮细胞和肺间质以及微血管血栓形成和多系统脏器受累等。
COVID-19的组织病理学改变多种多样,可累及全身多个脏器,其中肺脏最好发,其他部位依次为心脏、肝脏、胃肠道、神经和脑组织以及骨肌组织等。肺脏病理改变主要包括对肺泡上皮、脉管内皮和气道结构的损伤[4,9-12]。
(1)肺泡上皮的损伤,SARS-CoV-2传播给宿主时,首先感染肺泡壁中的Ⅱ型肺泡上皮细胞,随后是单核细胞募集、细胞因子释放、肺细胞凋亡和巨噬细胞募集;如果肺泡-血管基底膜完整则损伤的肺组织经历再上皮化和再内皮化,同时去除成纤维细胞,最终返回到正常的肺结构。如基底膜被破坏则持续的成纤维细胞活化继续形成具有累积的细胞外基质的组织化成纤维细胞组织,导致纤维化形成。所以轻度和可逆性病变表现为非特异性间质肺炎和机化性肺炎模式;重度或不可逆病变呈现急性纤维蛋白性机化性肺炎和弥漫性肺泡损伤模式。
(2)脉管内皮损伤,包括微血管内透明血栓形成、血管充血、灶性出血或出血性梗死、外周血管减少、血管树芽模式和灌注异常等,可能与病毒血症导致的全身性血管内凝血障碍或血管损伤有关。
(3)气道损伤,表现为小气道或细支气管非特异性炎,管壁增厚和管腔狭窄,管腔内脱落的上皮细胞与坏死物、渗出物、黏液混杂形成细支气管黏液栓,部分或完全阻塞小气道而引起的闭塞性细支气管炎并伴不同程度的通气障碍。新冠感染后肺纤维化是其重要的病理特征,其致病机制为SARS-CoV-2感染导致肺泡上皮细胞损伤,诱导巨噬细胞衍生的炎症和免疫细胞因子的产生,在TGFB、PDGF、IL-6的作用下,激活的炎性细胞和受损的上皮细胞参与基底膜的剥蚀,导致肺泡间质内成纤维细胞的迁移和增值;感染损伤内皮细胞导致出血和血浆漏入肺泡,由于尿激酶和PAI-1的释放激活凝血通路和纤维蛋白沉积,最终导致成纤维细胞大量增殖和纤维化形成。其他脏器受累的病理性改变均以非特异性炎性改变为主,肝脏表现为不同程度的微泡性脂肪变性和肝小叶及门脉周围非特异性炎改变;心脏以心肌不同程度的间质性单核炎性浸润为主等。
3. 临床表现
COVID-19的临床表现与受累部位、损伤程度和患者免疫功能等相关,多见于儿童和老年人,男女无差异。肺部感染的临床分期主要依据症征和CT表现分为轻型、普通型、重型和危重型等4种类型[10,13-15],其中轻型为临床症状轻微和影像学未见肺炎表现;普通型具有发热、咳嗽、胸闷、声嘶等呼吸道症状,影像学可见肺炎表现;重型表现为下列情况之一,气促且RR≥30 r/min、静息状态下指氧饱和度≤93%、动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg和肺部影像学显示24~48 h内病灶明显进展>50% 者;危重型为如下情况之一者,呼吸衰竭、休克及合并其他器官功能衰竭等。
肝脏感染表现为肝脏增大、肝功能异常、厌食或消化不良等;心血管感染呈现心率紊乱、胸闷、乏力或凝血功能障碍等;消化道感染以腹泻、腹痛、腹胀、厌食或恶心等为主;中枢神经系统受累表现为味觉减退、吞咽障碍、全身无力、头痛失眠、焦虑症或精神障碍等。
实验室检查多呈非典型或非特异性改变,如早期外周血白细胞总数正常或减少和淋巴细胞计数减少,部分伴肝酶、乳酸脱氢酶(LDH)、肌酶和肌红蛋白、C反应蛋白(CRP)和血沉增高,危重者可有肌钙蛋白、D-二聚体和炎症因子等升高以及外周血淋巴细胞进行性减少等。
4. 胸部CT表现
COVID-19的胸部CT表现在近3年疫情期间国内外文献报道较多,尤其以肺脏间质和/或实质受累为主,兼有气道、血管、胸膜和心包病变等。其中肺内病变在CT图像上的分布特征、影像表型、伴随改变、特殊征象和动态演变等CT表现以及与病变来源、病理改变和鉴别诊断等相关性等均进行了精准的研究和分析[9-22]。影响CT表现的相关因素包括发病时间、临床分期、合并症、患者年龄、伴随基础病(如合并糖尿病、高血压、COPD或免疫功能异常等)和不同的治疗方法等[10,23-25]。
4.1 病变分布
研究证实多数病变呈双肺(83.8%~90%)、多灶性(96%)、非叶段性(98.1%)或对称性(52.6%)病变,以周围性(65%~96.1%)胸膜内(92.2%)或兼有胸膜下(71.4%)、中央性支气管血管束周围(83.8%)和弥漫性(79.9%)为主。
病变的分布在病理机制上提示COVID-19为气道吸入性来源和累及肺泡壁间质的特征,部分提示血管源性或继发性间质性病变的可能。此分布特征有助于与特发性间质性肺炎(IIP)、淋巴增生性疾病和叶段性肺泡充盈性病变的鉴别。
4.2 影像表型
COVID-19肺部病变的CT表型以多样性、混合性、异质性和易变性为特征,认为与疾病的进程和发展相关。早期病变类型主要以腺泡状、斑片状或大片状的磨玻璃影(58.5%~91.6%)、铺路石样改变(79.2%)和实变影(20.7%~45.5%)等为主。随病情进展或好转常伴有不同程度的机化或间质纤维化改变,而呈现网格影(79.2%)、结节或机化或肉芽肿样改变(57.1%~64.3%)、蜂窝影(7.1%)、白肺(12.3%)或混合型病变(89%)。病变边缘多呈现模糊(53.9%)、不规则(47.4%)、毛刺(20.1%)和分叶(5.1%),反映了病变的渗出或增殖、机化或纤维化和急慢性等病理改变。
研究证实COVID-19肺部病变的表型和边缘改变与发病时间相关而与患者年龄或基础病等无统计学差异。鉴别诊断主要包括IIPs的NSIP、UIP、OP、AIP和Rb-ild以及细菌或真菌性感染、癌性淋巴管炎、EAA、肺水肿样病变和肺泡蛋白沉积症等。
4.3 伴随改变或合并症
特指COVID-19肺部病变的继发性改变或伴随其他部位的异常。
(1)COVID-19肺部病变继发性改变主要包括COVID-19后肺纤维化(post COVID-19 pulmonary fibrosis,PCPF)和真菌感染等。PCPF表现以网格影、实质条带、牵拉性支气管扩张、小叶间隔增厚和蜂窝影等为主。我们认为PCPF存在概念模糊和影像学特征不严谨等需商榷的问题,更名为COVID-19相关性机化和纤维化(COVID-19 related organization and fibrosis,COVID-19-ROF)更为确切和精准。因机化(organization)和纤维化(fibrosis)在影像学和病理学上是两个概念且疗效不同,所以二者在CT图像上的直接征象和间接征象也不尽相同。真菌感染多表现为单发或多发的结节状或肉芽肿样病变伴有或不伴有空洞,确诊需要穿刺获取组织病理学。
(2)伴随其他部位的异常包括气道(73.4%)、血管(93.5%)、胸膜(70%)、心包(2%)和纵隔淋巴结肿大(1.4%)等异常改变。其中气道异常主要为小气道壁增厚或轨道征、牵拉支气管扩张和小气道黏液栓,病理改变为病毒性支气管细支气管炎,是导致患者反复咳嗽、少痰、气憋和胸痛的主要原因。胸膜改变以局限性线样增厚、胸膜下线或胸膜下栅栏、叶间裂增厚等为主,而胸水相对少见(胸水(3%~5.6%)。血管相关异常包括血管增厚、血管束周模糊或磨玻璃影,而血管内血栓较罕见。心包积液不常见,但与胸腔积液均提示预后不良的指标。纵隔淋巴结肿大可为陈旧表现,是否与COVID-19相关有待进一步证实。
4.4 特殊征象
COVID-19相关的特殊征象与病变累及的部位和病理改变等密切相关,如病变表型相关的铺路石样征、低密度实变、晕征和反晕征、支气管充气征、空泡征、蜂窝影、空气潴留征、马赛克灌注或胸膜下黑带等;机化或纤维化相关的不规则煎蛋征、拱廊征、实变皱缩征、纵行索条征、胸膜下栅栏或胸膜下线;气道增厚相关的树芽征、双轨征、印戒征、牵拉性支气管扩张等;结节样病变的毛刺征、分叶征、空泡征、胸膜尾征或胸膜凹陷。
4.5 动态演变
COVID-19相关病变以发展迅速和变化多样为特征,尤其在病程早期表现为最为典型,即多样性、混合性、异质性和易变性。这与病毒的致病性、毒力大小、侵及方式以及机体的免疫反应等密切相关。
4.6 基于胸部CT图像AI的临床价值
有关AI在COVID-19肺内病变的应用已有诸多文献,主要集中在以下几个方面:①早期发现,尤其显示微小的磨玻璃影或结节性病变具有极高的阳性率和敏感性;②精准的定量诊断,根据肺内病变密度(CT值)的不同(磨玻璃影和实变影),将其占受累肺叶或单肺或双肺体积的比例精确表达,同时可与临床分期或预后等进行回顾性对照分析或前瞻性研究等,为临床提供精确的影像学依据。③定性诊断和鉴别诊断,事实上这是AI临床应用的最大价值,目前临床上这方面的研究尚有待进一步探讨和完善,主要涉及“异病同影”的诊断和鉴别,譬如肺部炎性病变与非炎性病变、病毒性肺炎与非病毒性肺炎、COVID-19与其他病毒性肺炎、不同来源磨玻璃影或实变影的诊断与鉴别等[26-27]。需要收集大量的病例资料和CT数据进行研究。
5. 结论
COVID-19是一种由SARS-CoV-2引起的以肺部受累为主的一种特殊类型的病毒性传染性疾病,可广泛累及气道、肺间质、肺实质、血管和胸膜等部位,其影像表型以多样化或异质性、肺泡为单元的间质性病变、早期呈急性或慢性炎症且常伴机化和纤维化、病变演变较迅速等为特征。胸部CT是早期发现和精准诊断及鉴别诊断的最佳影像学方法,对明确临床分型、选择治疗方法、动态观察病变进展、评判风险因素和患者预后具有重要意义。对怀疑肺血管栓塞或微小血管内血栓形成的患者可行胸部增强CT或CTPA或CTPV检查。基于CT图像或多模态数据的AI对于早期发现、精准的定位和定量诊断以及定性或鉴别诊断具有重要的临床意义。
-
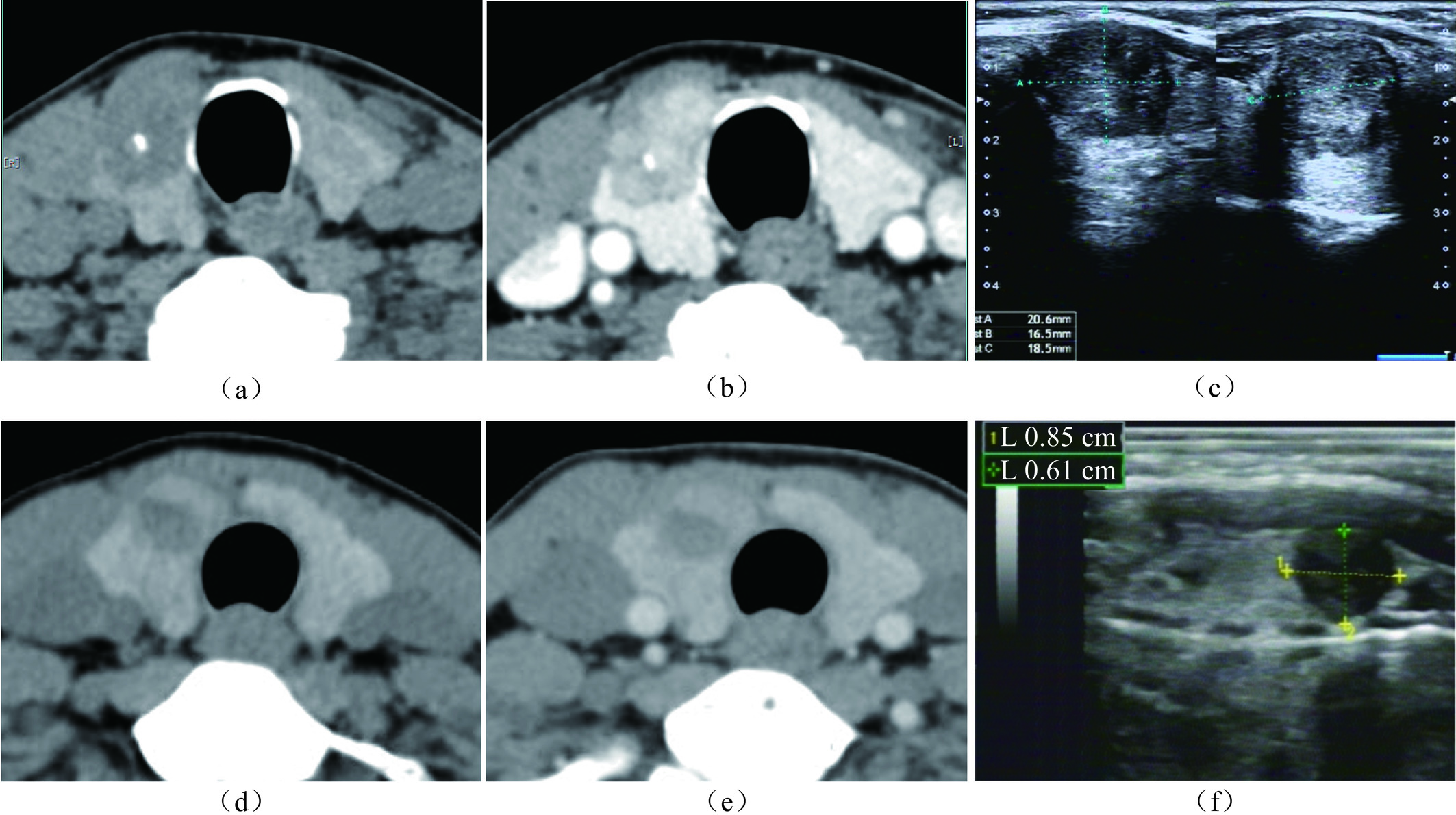
图 3 Nomogram预测CLNM的性能演示(界值为0.303)
注:患者1,男性,44岁,PTC病例,CLNM阳性。CT平扫示右叶中下部类圆形病灶,内见钙化,与甲状腺被膜接触约75%(a),增强后不均匀强化(b),超声显示低回声区,境界清晰,边缘光整,约20.6×16.5×18.5 mm(c),对照Nomogram:男性(38分)+年龄 < 55岁(28分)+被膜接触 > 50%(100分)+最大径 > 10 mm(45分)=211分,对应的CLNM预测概率0.73。患者2,女性,37岁,PTC病例,CLNM阴性。右叶内不规则低密度结节,边缘与被膜无接触(d),增强后轻度强化(e),超声显示境界清晰,边缘不光整的低回声区,最大径约8.5 mm(f),对照Nomogram:年龄 < 55岁(28分)+边缘不规则(48分)=76分,对应的CLNM预测概率0.10。
Figure 3. Performance of the nomogram for CLNM (cutoff=0.303)
表 1 CLNM分组的临床和实验室特征单因素分析
Table 1 Univariate analysis of clinical and laboratory characteristics in the CLNM group
特征 组别 统计检验 CLNM(n=131) Non-CLNM(n=209) T P 年龄/岁 46.27±13.68 53.32±12.23 −4.933 0.000 年龄分组/例(%) ≤55 93(71.0) 110(52.6) 11.284 0.001 >55 38(29.0) 99(47.4) 性别/例(%) 男 50(38.2) 38(18.2) 16.768 0.000 女 81(61.8) 171(81.8) TSH 1.933±1.117 2.086±1.173 −1.130 0.259 fT3 5.101±0.781 4.975±0.663 1.584 0.114 fT4 17.414±3.682 17.382±2.955 0.086 0.932 T3 1.768±0.322 1.755±0.316 0.345 0.730 T4 111.3±25.346 113.0±24.016 1.233 0.218 TG-Ab 22701 35269 −0.423 0.673 TPO-Ab 22332.5 35673.5 −0.004 0.997 表 2 CLNM分组的影像特征单因素分析
Table 2 Univariate analysis of imaging characteristics in the CLNM group
特征 组别 统计检验 CLNM(n=131) Non-CLNM(n=209) T P 边缘/例(%) 规则 23(17.6) 81(38.8) 17.044 0.000 不规则 108(82.4) 128(61.2) 边界/例(%) 清晰 92(70.2) 143(68.4) 0.123 0.725 模糊 39(29.8) 66(31.6) 位置1/例(%) 右叶 59(45.0) 103(49.3) 1.861 0.394 峡部 14(10.7) 14(6.7) 左叶 39(29.8) 92(44.0) 位置2/例(%) 上 32(24.4) 45(21.5) 0.395 0.821 中 64(48.9) 107(51.2) 下 35(26.7) 57(27.3) 实质构成/例(%) 实性 93(71.0) 175(83.7) 7.830 0.005 囊实性 38(29.0) 34(16.3) 被膜接触/例(%) 0 8(6.1) 51(24.4) 34.526 0.000 < 25% 34(26.0) 62(29.7) 25%~50% 35(26.7) 61(29.2) > 50% 54(41.2) 35(16.7) 最大径/例(%) ≤10 mm 66(50.4) 167(79.9) 32.544 0.000 >10 mm 65(49.6) 42(20.1) A/T 比/例(%) ≤1 83(63.4) 133(63.6) 0.003 0.959 > 1 48(36.6) 76(36.4) 钙化/例(%) 无 44(33.6) 105(50.2) 9.201 0.010 ≤3 mm 72(55.0) 84(40.2) > 3 mm 15(11.5) 20(9.6) CDFI/例(%) 无 60(45.8) 118(56.5) 5.073 0.167 周围 24(18.3) 38(18.2) 中央 40(30.5) 47(22.5) 周围+中央 7(5.3) 6(2.9) 差值* 33.09±16.459 34.37±16.754 −0.693 0.489 注:*甲状腺实质与同侧胸锁乳突肌CT值之差。 表 3 340例PTC患者CLNM的多因素logistics回归分析
Table 3 Multivariate logistic regression analysis for CLNM in 340 patients with PTC
变量 估计值 标准误 统计检验 Z P 截距 −2.596 0.688 −3.773 0.000 年龄(> 55) −0.755 0.332 −2.272 0.023 性别(女) −0.993 0.362 −2.739 0.006 边缘(不规则) 1.153 0.390 2.856 0.003 最大径(>10 mm) 1.051 0.362 2.898 0.003 构成(囊实性) 0.343 0.397 0.863 0.388 被膜接触 < 25% 1.791 0.622 2.879 0.004 25%~50% 2.005 0.623 3.217 0.001 > 50% 2.520 0.632 3.984 0.000 钙化 ≤3 mm 0.003 0.350 0.008 0.993 > 3 mm 0.515 0.591 0.871 0.384 表 4 340例PTC患者7∶3比例随机分组中IRF的比较
Table 4 Comparison of IRFs in the training and validation cohorts where 340 PTC patients were randomly divided into at a 7∶3 ratio
特征 组别 统计检验 训练组(n=237) 验证组(n=103) T P 年龄分组/例(%) ≤55 141(59.5) 62(60.2) 0.015 0.904 >55 96(40.5) 41(39.8) 性别/例(%) 男 63(26.6) 25(24.3) 0.200 0.655 女 174(73.4) 78(75.7) 边缘/例(%) 规则 68(28.7) 36(35,0) 1.325 0.250 不规则 169(71.3) 67(65.0) 被膜接触/例(%) 0 45(19.0) 14(13.6) 1.903 0.593 < 25% 68(28.7) 28(27.2) 25%~50% 64(27.0) 32(31.1) > 50% 60(25.3) 29(28.2) 最大径/例(%) ≤10 mm 164(69.2) 69(67.0) 0.162 0.687 >10 mm 73(30.8) 34(33.0) -
[1] LAHA D, NILUBOL N, BOUFRAQECH M. New therapies for advanced thyroid cancer[J]. Frontiers in Endocrinology, 2020, 11: 82. DOI: 10.3389/fendo.2020.00082.
[2] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer the american thyroid association guidelines task force on thyroid nodules and differen-tiated thyroid cancer[J]. Thyroid: Official Journal of the American Thyroid Association, 2016, 26(1): 1-133. DOI: 10.1089/thy.2015.0020.
[3] SORRENTI S, CARBOTTA G, di MATTEO F M, et al. Evaluation of clinicopathological and molecular parameters on disease recurrence of papillary thyroid cancer patient: A retrospective observational study[J]. Cancers (Basel), 2020, 12(12): 3637.
[4] 中国抗癌协会甲状腺癌专业委员会. 甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)[J]. 中国肿瘤临床, 2016, 43(10): 405-411. DOI: 10.3969/j.issn.1000-8179.2016.10.001. [5] ZHUO X, YU J, CHEN Z, et al. Dynamic nomogram for predicting lateral cervical lymph node metastasis in papillary thyroid carcinoma[J]. Otolaryngol Head Neck Surg, 2022, 166(3): 444-453. DOI: 10.1177/01945998211009858.
[6] Al-HILLI Z, STRAJINA V, MCKENZIE T J, et al. The role of lateral neck ultrasound in detecting single or multiple lymph nodes in papillary thyroid cancer[J]. American Journal of Surgery, 2016, 212(6): 1147-1153. DOI: 10.1016/j.amjsurg.2016.09.014.
[7] SUH C H, BAEK J H, CHOI Y J, et al. Performance of CT in the preoperative diagnosis of cervical lymph node metastasis in patients with papillary thyroid cancer: A systematic review and meta-analysis[J]. American Journal of Neuroradiology, 2017, 38(1): 154-161. DOI: 10.3174/ajnr.A4967.
[8] PAEK S H, YI K H, KIM S J, et al. Feasibility of sentinel lymph node dissection using Tc-99m phytate in papillary thyroid carcinoma[J]. Annals of Surgical Treatment and Research, 2017, 93(5): 240-245. DOI: 10.4174/astr.2017.93.5.240.
[9] KARATZAS T, VASILEIADIS I, ZAPANTI E, et al. Thyroglobulin antibodies as a potential predictive marker of papillary thyroid carcinoma in patients with indeterminate cytology[J]. The American Journal of Surgery, 2016, 212(5): 946-952 DOI: 10.1016/j.amjsurg.2015.12.030.
[10] MIN Y, HUANG Y, WEI M, et al. Preoperatively predicting the central lymph node metastasis for papillary thyroid cancer patients with hashimoto's thyroiditis[J]. Frontiers in Endocrinology, 2021, 12: 713475. DOI: 10.3389/fendo.2021.713475.
[11] 岳潇潇. 血清TSH、超声与增强CT对甲状腺乳头状癌及淋巴结转移的诊断价值[D]. 沈阳: 中国医科大学, 2021. YUE X X. Diagnostic value of serum TSH, ultrasound and enhanced CT for testing papillary thyroid cancer and lymph node metastasis[D]. Shengyang: China Medical University, 2021. (in Chinese).
[12] LUISA GARO M, DEANDREIS D, CAMPENNI A, et al. Accuracy of papillary thyroid cancer prognostic nomograms: A systematic review[J]. Endocrine Connections, 2023, 12(4): e220457.
[13] HU Q, ZHANG W J, LIANG L, et al. Establishing a predictive nomogram for cervical lymph node metastasis in patients with papillary thyroid carcinoma[J]. Frontiers in Oncology, 2021, 11: 766650.
[14] KIM S K, CHAI Y J, PARK I, et al. Nomogram for predicting central node metastasis in papillary thyroid carcinoma[J]. Journal of Surgical Oncology, 2017, 115(3): 266-272. DOI: 10.1002/jso.24512.
[15] ZAHEDI A, BONDAZ L, RAJARAMAN M, et al. Risk for thyroid cancer recurrence is higher in men than in women independent of disease stage at presentation[J]. Thyroid, 2020, 30(6): 871-877. DOI: 10.1089/thy.2018.0775.
[16] HUANG J, SONG M, SHI H, et al. Predictive factor of large-volume central lymph node metastasis in clinical n0 papillary thyroid carcinoma patients underwent total thyroidectomy[J]. Frontiers in Oncology, 2021, 11: 574774. DOI: 10.3389/fonc.2021.574774.
[17] DING Y, MAO Z, RUAN J, et al. Nomogram-based new recurrence predicting system in early-stage papillary thyroid cancer[J]. International Journal of Endocrinology, 2019: 1029092.
[18] 孔繁亮, 杨敬春, 常莹, 等. 甲状腺乳头状癌术前超声特征及术后复发的危险因素[J]. 中华医学超声杂志(电子版) ,2020, 17(9): 848-853. KONG F L, YANG J C, CHANG Y, et al. Preoperative ultrasonographic characteristics and risk factors for postoperative recurrence of thyroid papillary carcinoma[J]. Chinese Journal of Medical Ultrasound (Electronic Edition), 2020; 17(9): 848-853. (in Chinese).
[19] 郝儒田, 张筱骅, 潘贻飞. 甲状腺乳头状癌与甲状腺结节钙化的关系探讨[J]. 中国肿瘤临床, 2007, 34(20): 1178-1180. DOI: 10.3969/j.issn.1000-8179.2007.20.011. HAO R T, ZHANG X H, PAN Y F. The correlation between calcified thyroid nodules and papillary thyroid carcinoma[J]. Chinese Journal of Clinical Oncology, 2007, 34(20): 1178-1180. DOI: 10.3969/j.issn.1000-8179.2007.20.011. (in Chinese).
-
期刊类型引用(1)
1. 崔晓燕,葛平. 新型冠状病毒感染可能导致糖尿病的机制探讨. 中国医药生物技术. 2024(02): 169-173 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: