Computer Tomography Features of Antineutrophil Cytoplasm Antibody-associated Vasculitis-interstitial Lung Disease and Its Correlation with Antineutrophil Cytoplasmic Antibody Concentration
-
摘要:
本研究旨在系统分析抗中性粒细胞胞浆抗体相关性血管炎(AAV)−间质性肺病(ILD)患者首次诊断时的CT影像学特征,探讨病变类型、分布特点及其与实验室检查结果的相关性。回顾性纳入92例首次确诊为AAV-ILD的患者,收集患者的临床及CT影像数据,对CT影像资料进行主观定量分析,评估病变类型(如磨玻璃影、网格影、蜂窝样改变、实变影及牵拉性支气管扩张)及其分布特征。采用肺纤维化评分系统量化病变严重程度,分析影像学特征ANCA浓度之间的相关性。结果发现AAV-ILD在老年男性中更为常见,蜂窝样改变和网格影是最常见的影像学表现,病变主要分布于双肺下叶及外周区域,主要表现为寻常型间质性肺炎(UIP)模式。另外还发现肺纤维化评分与髓过氧化物酶(MPO)浓度呈显著正相关,蜂窝样改变评分与MPO浓度也存在正相关。AAV-ILD的CT表现具有独特的特点,而且MPO-ANCA与肺纤维化的相关性提示MPO可能成为肺纤维化进展的潜在生物标志物,这为深入理解AAV-ILD的影像学特征及其病理机制提供了重要依据。
-
关键词:
- 抗中性粒细胞胞浆抗体 /
- 间质性肺病 /
- 高分辨率CT /
- 磨玻璃影 /
- 蜂窝样改变
Abstract:This study systematically analyzed the CT imaging features of patients diagnosed with ANCA-associated vasculitis (AAV)-related interstitial lung disease (ILD) at the time of their first diagnosis. The types and distribution characteristics of the lesions and their correlation with laboratory findings were investigated. A retrospective study was conducted on 92 patients with newly diagnosed AAV-ILD. Clinical and CT imaging data were collected. CT imaging data were analyzed qualitatively and quantitatively to evaluate lesion types (e.g., ground-glass opacities, reticulations, honeycombing, consolidation, and traction bronchiectasis) and their distribution patterns. The severity of the lesions was quantified using a pulmonary fibrosis scoring system, and the correlation between imaging features and laboratory indices was analyzed. AAV-ILD was more commonly observed in elderly male patients. Honeycombing and reticulations were the most common CT-imaging findings, with lesions primarily distributed in the bilateral lower lungs and peripheral regions. AAV-ILD predominantly exhibited a usual interstitial pneumonia (UIP) pattern. A significant positive correlation was also observed between the pulmonary fibrosis score and myeloperoxidase (MPO) concentration and between honeycombing scores and MPO concentration. The CT features of AAV-ILD are unique. The correlation between MPO and pulmonary fibrosis suggests that MPO may serve as a potential biomarker for the progression of pulmonary fibrosis. These findings provide important insights into the imaging characteristics and pathological mechanisms of AAV-ILD.
-
抗中性粒细胞胞浆抗体相关性血管炎(ANCA-associated vasculitis,AAV)是一组以小血管炎症为特征的自身免疫性疾病,常累及肺部和肾脏。间质性肺病(interstitial lung disease,ILD)是AAV累及肺部常见且严重表现,近些年来越来越受到关注,有研究报道高达45%的显微镜下多血管炎(microscopic polyangiitis,MPA)患者和23%的肉芽肿性多血管炎患者存在ILD,ILD会增加患者的死亡率[1-2]。ILD的出现通常很隐匿,准确诊断AAV-ILD对于监测患者病情进展、制定合适的治疗方案以及改善预后具有重要意义。
高分辨率CT(high-resolution computed tomography,HRCT)是评估间质性肺病的首选影像学工具,其能够清晰显示肺实质和间质的细微病变。已有研究表明,AAV-ILD影像学表现具有一定特征性,包括磨玻璃影、蜂窝样改变和牵拉性支气管扩张等[2]。
目前对于AAV-ILD的肺部表现尚缺乏系统分析,尽管已有研究指出AAV继发的ILD在CT上的表现及影像分布模式[3-4],但仍未明确ILD病变的分布特点及其与纤维化程度的关系。
本研究通过分析首次确诊为AAV-ILD患者的HRCT影像资料,总结其病变类型、分布特征及相关影像学特征,分析影像学特征与实验室检查指标的相关性,以揭示疾病的主要影像学规律,并为临床早期诊断和疾病评估提供依据。
1. 研究对象与方法
1.1 研究对象
本研究纳入2018年1月至2024年12月期间,在内蒙古自治区人民医院风湿免疫科和呼吸科确诊为ANCA相关血管炎,其诊断符合2012年《ANCA相关血管炎分类标准》。同时,经HRCT检查证实存在ILD。
纳入标准:①年龄在18至75岁之间,具有完整的临床、实验室和影像学数据;②HRCT图像完整、清晰,上至肺尖,下至肺底层面。排除标准:①肺部肿瘤等占位病变;②具有环境和职业暴露史;③胸廓畸形、胸腔积液、严重肺结核;③合并有其他可能引起肺间质性病变的疾病。
按照纳入和排除标准最终共纳入AAV-ILD患者的CT结果92例。
1.2 数据收集
一般信息包括性别、年龄、吸烟史、病程、症状(咳嗽、气促等)。实验室检查包括抗肾小球基底膜抗体,蛋白酶3、髓过氧化物酶(myeloperoxidase,MPO)、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)。
1.3 CT扫描方法
使用64排及以上螺旋CT机(LightSpeed GE 750、东软NeuViz128及DISVOVERY GSI 200 CHN)。
扫描参数:管电压120 kVp,矩阵512×512,螺距1.3~1.5,管电流为自动调节(100~200 mAs),扫描范围从肺尖到肺底,覆盖全肺。
数据后处理采用高分辨率算法重建,重建层厚1 mm,层间隔1 mm。
1.4 CT影像学评估
由两名具有10年以上经验的影像科医生独立评估影像学特征(磨玻璃密度影、蜂窝样改变、实变影、牵拉性支气管扩张及间质增厚)及间质性肺病的分布模式。采用盲法阅片,并且不知晓临床及实验室数据,若存在分歧,则由第3位专家仲裁。
记录病变的分布特点(上叶、下叶、外周、弥漫性)及累及程度。上叶分布通常包括肺尖和肺门以上的部分;下叶包括肺门以下的区域;外周区域定义为肺的边缘区域,靠近胸膜的部分。而弥漫则指病变广泛分布于肺部,涉及多个肺叶或整个肺部[5]。
采用肺纤维化评分系统(Modified Kazerooni Score),1分:病变占肺叶体积的 < 5%;2分:病变占肺叶体积的5%~25%;3分:病变占肺叶体积的26%~50%;4分:病变占肺叶体积的51%~75%;5分:病变占肺叶体积的 > 75%。计算磨玻璃影、蜂窝样改变和实变影的总评分,分析病变严重程度。
此外,还需要两位专家进一步评估患者的CT影像学征象,以确定其属于哪种模式的间质性肺病。例如,评估是否符合寻常型间质性肺炎(usual interstitial pneumonia,UIP)、非特异性间质性肺炎(non-specific interstitial pneumonia,NSIP)、机化性肺炎(organizing pneumonia,OP)或弥漫性肺泡损伤(diffuse alveolar damage,DAD)等其他类型的间质性肺病模式。
UIP的影像学特点是双肺基底部和外周部为主的斑片状分布的网格影及蜂窝影,常伴有牵拉性支气管扩张。NSIP的影像学特点是双肺下叶和胸膜下为主的对称性磨玻璃影或网格影,常伴有牵拉性支气管扩张,但蜂窝肺少见,胸膜下有不受累区[6-7]。
1.5 统计分析
使用Shapiro-Wilk检验评估每个单独变量是否符合正态分布。针对实验室检查结果和纤维化评分等变量,分别进行Shapiro-Wilk检验。若Shapiro-Wilk检验的P<0.05,则认为该变量的数据不符合正态分布;若P>0.05,则认为数据符合正态分布。对于不符合正态分布的变量,后续分析将采用Spearman相关分析。
使用SPSS 26.0软件进行数据分析,P<0.05为差异有统计学意义。
2. 结果
2.1 患者基本信息
共纳入92例患者,其中男性54例(58.7%),女性38例(41.3%),男女比例约为1.42∶1。患者年龄分布为44~86岁,平均年龄(69.66±9.58)岁。
有吸烟史的患者30例(32.6%),其中长期吸烟者(≥10年)12例(13%)。50例(54.35%)出现咳嗽症状,以干咳为主。40例(43.48%)伴有气促,多表现为劳力性呼吸困难。少数患者伴胸痛(8例,8.7%)或咯血(5例,5.4%)(表1)。
表 1 AAV-ILD患者临床特征Table 1. Clinical characteristics of patients with AAV-ILD项目 临床特征 例数 占比/% 总例数 92 100 性别 男 54 58.7 女 38 41.3 吸烟史 有长期吸烟者≥10年12例 30 32.6 无 62 67.4 症状 咳嗽(干咳) 50 54.4 气促(劳力性呼吸困难) 40 43.5 胸痛 8 8.7 咯血 5 5.4 2.2 CT影像学表现
蜂窝肺样改变见于78例患者(84.78%),为最常见的影像学表现,主要集中于双肺下叶,部分病情严重的患者累及中叶和外周区域。磨玻璃密度影见于72例患者(78.27%),主要出现在胸膜下。实变影见于6例患者(6.52%),多为局灶性病变。网格影见于85例患者(92.39%),主要分布于下叶及胸膜下。牵拉性支气管扩张见于72例患者(78.26%),常伴随蜂窝样改变,主要分布于下叶及胸膜下。70例(76.09%)呈外周分布,病变主要集中于胸膜下区域。弥漫性分布22例(23.91%)呈弥漫分布,累及所有肺叶且分布均匀。
62例(67.39%)呈现UIP分布模式(图1(a)),15例(16.3%)呈NSIP模式分布(图1(b)),10例(10.87%)呈OP模式分布,4例(4.35%)表现为DAD,1例表现为NSIP叠加DAD(表2)。
表 2 AAV-ILD患者肺部HRCT特征Table 2. HRCT characteristics of lungs in patients with AAV-ILD项目 HRCT特征 例数 占比/% 总例数 92 100 影像学表现 蜂窝样改变(下叶分布为主) 78 84.8 磨玻璃密度影 72 78.3 实变影 6 6.5 网格影 85 92.4 牵拉性支气管扩张 72 78.3 分布特点 外周分布 70 76.1 弥漫性分布 22 23.9 分布模式 UIP 62 67.4 NSIP 15 16.3 OP 10 10.9 DAD 4 4.4 NSIP叠加DAD 1 1.1 2.3 病变评分
按照肺纤维化评分系统(Modified Kazerooni Score),磨玻璃影评分为(1.05±0.89),实变评分(0.12±0.33),蜂窝样改变评分为(2.18±1.38),总平均纤维化评分为(3.12±1.69),表明大部分患者轻度纤维化。
2.4 实验室检查
2例(2.12%)出现抗肾小球基底膜抗体升高,正常参考范围为0~16 AU/mL。89例(96.73%)MPO阳性,正常参考范围为0~16 AU/mL。7例(7.6%)蛋白酶3浓度阳性,正常参考范围0~16 AU/mL。
2.5 相关性分析
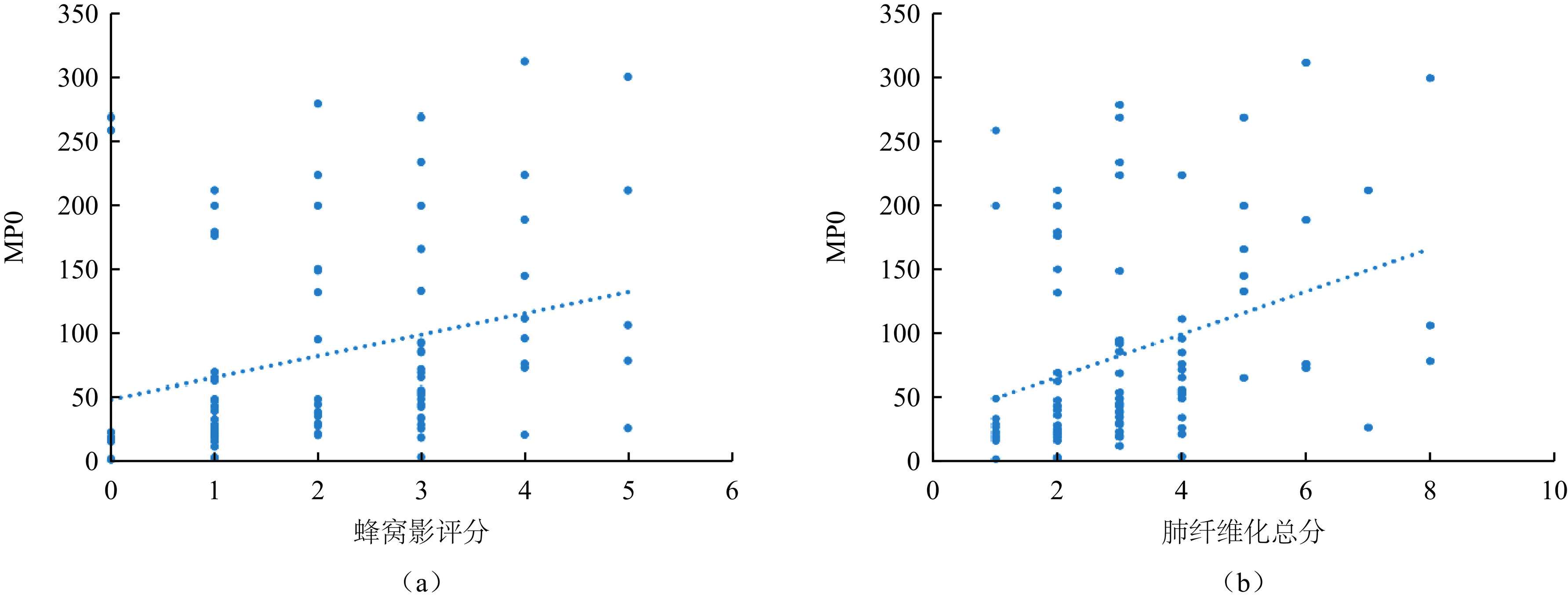
实验室检查结果和纤维化评分不符合正态分布。使用Spearman分析来评估两者的相关性。结果发现纤维化总分与MPO存在正相关(r=0.441,P<0.05,图2(a))。蜂窝样改变的评分与MPO存在正相关(r=0.437,P<0.05,图2(b))。
3. 讨论
近些年来,学者们逐渐意识到AAV也可继发ILD,2022年ILD已被列入美国风湿病学会/欧洲风湿病协会联盟MPA分类标准的关键项目,突出了其作为AAV表现形式的重要性[8]。本研究深入分析AAV-ILD患者的HRCT影像学表现及其纤维化评分,旨在探讨影像学特征在评估疾病严重程度、指导治疗和预测临床预后中的潜力。通过对磨玻璃影、实变影和蜂窝样改变等影像学表现的主观量化,能够更清晰地了解疾病的进展及其与临床症状之间的关联。
在本研究中,共纳入92例患者,男女比例约为1.42∶1,提示男性在该组患者中略为占优。平均年龄为(69.66±9.58)岁,表明研究中的患者主要为老年人群体,说明间质性肺病的发生还存在一定的性别和年龄差异。
从流行病学角度分析,男性老年人更容易受到间质性肺病的侵袭。一方面,老年人的肺部组织结构相对脆弱,肺泡毛细血管基底膜的通透性增加,更容易在炎症刺激下出现间质纤维化等病理改变,既往的研究指出临床发现AAV并发ILD的患者比无ILD的AAV患者年龄更大,支持本研究的结论,进一步证实了年龄越大,越容易继发ILD[9];另一方面,男性在生活方式上可能更多地暴露于吸烟等危险因素,长期吸烟会加重肺部的炎症反应[10],进一步促进间质性肺病的发生,既往针对AAV-ILD的研究,未明确提出AAV男性容易患ILD,但是系统性硬化症相关ILD的研究中明确指出男性较女性更加容易患上ILD[11],而且还有研究指出吸烟男性比女性更容易发生肺间质纤维化[10]。烟草烟雾暴露和吸烟状况之间存在强相关性[12],吸烟可能通过加剧肺部炎症反应、增加氧化应激、激活成纤维细胞等过程促进纤维化,进而对ILD的发展起到一定的作用[13]。
因此,在AAV的临床管理中,对于男性老年患者,应更加警惕间质性肺病的发生,通过早期监测肺功能、影像学检查等手段及时发现病变。
本研究还发现AAV-ILD患者的MPO阳性率达96.73%,提示MPO与AAV-ILD的发生关系密切,与既往研究一致[3,14]。MPO是一种由中性粒细胞释放的氧化酶,在炎症和氧化应激过程中具有重要作用。
据文献报道AAV发病率存在地理差异,亚洲人群中MPO-ANCA阳性患者的百分比高于欧洲人群[1]。MPO不仅与AAV-ILD的发生密切相关,还与肺纤维化的进展紧密相连。MPO通过激活中性粒细胞释放炎性介质和活性氧,具有肺部靶向性。由于肺部小血管丰富,MPO引发的炎症反应导致肺毛细血管损伤,从而增加了ILD的发生风险[8]。此外,MPO阳性患者的肺部微环境易引发慢性炎症,表现为IL-6、TNF-α等炎性细胞因子水平的升高。免疫异常及小血管炎的慢性损伤导致成纤维细胞过度激活,分泌大量胶原蛋白和细胞外基质成分,进而促进肺泡壁增厚和纤维化,进一步加剧肺间质的炎症和纤维化[15-16]。
本研究中发现AAV-ILD的网格影及蜂窝样改变最为常见,双肺下叶及胸膜下分布为主,如此的区域分布与文献报道一致,主要由于下肺区域较大的血流量、外周肺间质组织易受损以及低灌注和低氧环境的共同作用,导致血管损伤、局部纤维化和胶原沉积[17]。AAV-ILD影像学特征可呈现出5种主要的表现形式,磨玻璃影、实变、蜂窝样改变、网格影及牵拉性支气管扩张,这些影像学表现揭示了AAV-ILD从早期炎症反应到晚期肺纤维化的病理进程。磨玻璃影通常是肺泡内出血或炎症细胞浸润的早期表现,提示肺泡内有轻度的液体或细胞成分积聚,但肺泡结构尚未完全破坏[5]。
孤立性磨玻璃密度影且不伴有网状影,罕见于UIP中,磨玻璃密度影常见于存在纤维化的肺区(如网状影、牵拉性支气管扩张及蜂窝样改变),因此在UIP中,GGO常反映存在微纤维化,而不止是单纯的肺泡内出血或者炎症细胞浸润[18]。随着炎症的加重,肺泡腔内可能被渗出物填充,进而形成实变影,提示肺泡结构受损和纤维组织增生。网格影提示肺组织结构紊乱,肺泡间隔的增厚和纤维组织沉积,通常伴随肺小血管和气道受累,常提示病变进入了较为严重阶段[19],同时纤维化使支气管周围的支持结构减弱,支气管壁变薄,从而导致支气管扩张,纤维组织还会牵拉周围的支气管壁,从而出现牵拉性支气管扩张,此征象的存在表明纤维化已经发展到牵拉和扭曲气道的程度,表明更严重的肺损伤。研究表明,牵拉性支气管扩张与肺纤维化患者的预后较差相关[20]。
在随访过程中,发现牵拉性支气管扩张的发展是进行性纤维化的标志。蜂窝样改变则是不可逆性纤维化的特征表现,代表肺组织塌陷和不可修复的纤维化过程,当牵拉性支气管扩张与如蜂窝样改变同时出现时,说明疾病已经进入晚期[20-21]。既往有研究分析了AAV-ILD的影像征象,显示磨玻璃影是AAV-ILD中最常见CT征象,同时还伴有网状影、实变影以及蜂窝样改变[22],不同影像征象出现的比例与本研究结果不太一致,分析其中的原因有两点:一是本研究分析的病例包含了所有种类的AAV,既往研究分析仅是MPA相关ILD;二是样本量不一样。今后的研究还需扩大样本量并详细分析每一种类型的AAV所引起的ILD表现。
在AAV-ILD患者的HRCT影像学评估中,本研究发现UIP模式最为常见,其次是NSIP模式,少数患者表现为其他类型的ILD,这一发现与文献报告一致[3]。然而,既往研究表明OP是第2常见的类型,这与本研究的结果有所不同。这可能是由于样本量的差异以及患者个体特征的不同所导致的[4]。UIP模式主要表现为下肺外周的蜂窝样改变和牵拉性支气管扩张,这种影像特征通常指示着不可逆的肺纤维化,尽管UIP模式在AAV-ILD中较为常见,但也有相当一部分患者表现为NSIP模式。NSIP通常呈现弥漫性肺泡浑浊,通常伴有轻度的磨玻璃影,这提示着活动性肺泡炎症和较早期的间质性损伤。NSIP模式的出现通常意味着病情可能仍处于相对可逆的阶段,而UIP则代表着更为晚期、不可逆的纤维化进程。此外,少数AAV-ILD患者呈现出其他类型的ILD影像学表现,这可能与疾病的不同免疫反应、血管炎的急性或慢性阶段以及治疗干预的不同有关。
本研究中,UIP和NSIP模式的比例存在显著差异。UIP通常表现为不可逆的纤维化,而NSIP则代表较为早期的间质损伤。这一差异表明,本研究中大多数AAV-ILD患者在疾病发现时肺部就已经存在不可逆的肺纤维化。这一发现强调了早期发现AAV患者发生ILD的重要性,因为早发现、早干预有助于延缓疾病进展,改善患者预后。
另外,相关性分析结果发现MPO浓度与肺部纤维化评分及蜂窝样改变评分之间呈现中等相关性,说明MPO与肺纤维化的严重程度存在一定程度的关系。MPO浓度似乎可以作为肺纤维化进展的潜在生物标志物,已有研究也证实了MPO与肺纤维化之间存在密切的关系[16]。MPO可能通过增强氧化应激反应、促进炎症细胞因子释放、加速成纤维细胞的活化及胶原沉积等共同导致肺泡结构的不可逆破坏,使肺组织纤维化加重,最终形成蜂窝样改变[23-24]。虽然当前结果仅能显示MPO与肺纤维化的相关性,但这为MPO在肺纤维化早期筛查及预后评估中的潜在应用提供了重要依据。
本研究存在一定的局限性。首先,样本量相对较小,因此目前的研究结果仅能揭示MPO与肺纤维化之间的相关性,尚未能明确两者之间的因果关系。其次,由于本研究基于横截面数据,无法追踪MPO水平随肺纤维化进展的动态变化。因此,未来的研究应结合纵向随访数据,进一步评估MPO水平是否能够预测肺纤维化的进展速度。最后,本研究主要依赖于肺纤维化的主观评估,这可能受到病例选择标准和分类标准的影响。为了提高主观评价的准确性,我们排除了那些可能对ILD观察结果产生显著影响的胸廓畸形及胸腔积液病例,同时也排除了影响ILD观察的双肺结核较重的病例,但这些做法也可能导致一定的偏倚。此外,AAV患者中较高的MPO阳性率可能与筛选标准相关。未来的研究拟采用定量的方法,以进一步验证本研究的结果,并减少潜在的偏倚。
4. 结论
本研究回顾性分析AAV-ILD患者的临床表现和影像学特征。研究结果表明,AAV-ILD的发生与一些高危因素密切相关,特别是男性老年患者以及MPO-ANCA阳性的患者更易患病。在影像学特征方面,网格影和蜂窝样改变是最为常见的表现,而UIP分布模式则是最为典型的。
此外,研究还发现AAV-ILD患者肺纤维化的发生与MPO浓度之间存在密切的相关性,这一发现为深入了解AAV-ILD的影像学表现提供了宝贵的临床价值。通过这些结果,能够更好地识别和诊断AAV-ILD,进而为其早期干预和治疗提供依据。
-
表 1 AAV-ILD患者临床特征
Table 1 Clinical characteristics of patients with AAV-ILD
项目 临床特征 例数 占比/% 总例数 92 100 性别 男 54 58.7 女 38 41.3 吸烟史 有长期吸烟者≥10年12例 30 32.6 无 62 67.4 症状 咳嗽(干咳) 50 54.4 气促(劳力性呼吸困难) 40 43.5 胸痛 8 8.7 咯血 5 5.4 表 2 AAV-ILD患者肺部HRCT特征
Table 2 HRCT characteristics of lungs in patients with AAV-ILD
项目 HRCT特征 例数 占比/% 总例数 92 100 影像学表现 蜂窝样改变(下叶分布为主) 78 84.8 磨玻璃密度影 72 78.3 实变影 6 6.5 网格影 85 92.4 牵拉性支气管扩张 72 78.3 分布特点 外周分布 70 76.1 弥漫性分布 22 23.9 分布模式 UIP 62 67.4 NSIP 15 16.3 OP 10 10.9 DAD 4 4.4 NSIP叠加DAD 1 1.1 -
[1] SEBASTIANI M, MANFREDI A, VACCHI C, et al. Epidemiology and management of interstitial lung disease in ANCA-associated vasculitis[J]. Clinical and Experimental Rheumatology, 2020, 124(2): 221-231.
[2] SACOTO G, BOUKHLAL S, SPECKS U, et al. Lung involvement in ANCA-associated vasculitis[J]. Presse Médicale, 2020, 49(3): 104039. DOI: 10.1016/j.lpm.2020.104039.
[3] 刘泠钰, 田新平. 原发性系统性血管炎的肺部表现[J]. 中华医学杂志, 2021, 101(24): 1938-1941. LIU L Y, TIAN X P. Pulmonary manifestations of primary systemic vasculitis. Chinese Medical Journal, 2021, 101(24): 1938-1941. (in Chinese).
[4] DOLINER B, RODRIGUEZ K, MONTESI S B, et al. Interstitial lung disease in ANCA-associated vasculitis: Associated factors, radiographic features and mortality[J]. Rheumatology (Oxford), 2023, 62(2): 716-725. DOI: 10.1093/rheumatology/keac339.
[5] 马震忠, 盛亚丹, 杨凯, 等. 皮肌炎/多发性肌炎相关间质性肺病高分辨率CT特征[J]. CT理论与应用研究(中英文), 2024, 33(4): 497-502. DOI: 10.15953/j.ctta.2023.131. MA Z Z, SHENG Y D, YANG K, et al. HRCT features of dermatomyositis-/polymyositis- associated interstitial lung disease[J]. CT Theory and Applications, 2024, 33(4): 497-502. DOI: 10.15953/j.ctta.2023.131. (in Chinese).
[6] HINO T, LEE KS, YOO H, et al. Interstitial lung abnormality (ILA) and nonspecific interstitial pneumonia (NSIP)[J]. European Journal of Radiology Open, 2021, 8: 100336. DOI: 10.1016/j.ejro.2021.100336.
[7] DELANEY L, ALABED S, MAITER A, et al. Meta-analysis of interobserver agreement in assessment of interstitial lung disease using high-resolution CT[J]. Radiology, 2024, 313(1): e240016. DOI: 10.1148/radiol.240016.
[8] TURGEON D, BALTER M S, PAGNOUX C. Interstitial lung disease in patients with anti-neutrophil cytoplasm antibody-associated vasculitis: An update on pathogenesis and treatment[J]. Current Opinion in Pulmonary Medicine, 2023, 29(5): 436-442. DOI: 10.1097/mcp.0000000000000979.
[9] ALBA M A, FLORES-SUÁREZ L F, HENDERSON A G, et al. Interstitial lung disease in ANCA vasculitis[J]. Autoimmunity Reviews, 2017, 16(7): 722-729. DOI: 10.1016/j.autrev.2017.05.008.
[10] MCDERMOTT G, FU X, STONE J H, et al. Association of cigarette smoking with antineutrophil cytoplasmic antibody-associated vasculitis[J]. JAMA Internal Medicine, 2020, 180(6): 870-876. DOI: 10.1001/jamainternmed.2020.0675.
[11] CERRO-CHIANG G, AYRES M, RIVAS A, et al. An exploratory analysis of differences in serum protein expression by sex in patients with systemic sclerosis associated interstitial lung disease[J]. BMC Pulmonary Medicine, 2025, 25(1): 16. DOI: 10.1186/s12890-024-03474-z.
[12] HUNNINGHAKE G M, HATABU H, OKAJIMA Y, et al. MUC5B promoter polymorphism and interstitial lung abnormalities[J]. New England Journal of Medicine, 2013, 368(23): 2192-2200. DOI: 10.1056/NEJMoa1216076.
[13] CHOI W I, DAUTI S, KIM H J, et al. Risk factors for interstitial lung disease: A 9-year nationwide population-based study[J]. BMC Pulmonary Medicine, 2018, 18(1): 96. DOI: 10.1186/s12890-018-0660-2.
[14] KADURA S, RAGHU G. Antineutrophil cytoplasmic antibody-associated interstitial lung disease: A review[J]. European Respiratory Review, 2021, 30(162). DOI: 10.1183/16000617.0123-2021.
[15] OIWA H, OOI K, OYAMA T, et al. Idiopathic interstitial pneumonia as a possible cause of antineutrophil cytoplasmic antibody-associated vasculitis: A case report[J]. Archives of Rheumatology, 2018, 33(1): 89-92. DOI: 10.5606/ArchRheumatol.2018.6532.
[16] NEGREROS M, FLORES-SUÁREZ L F. A proposed role of neutrophil extracellular traps and their interplay with fibroblasts in ANCA-associated vasculitis lung fibrosis[J]. Autoimmunity Reviews, 2021, 20(4): 102781. DOI: 10.1016/j.autrev.2021.102781.
[17] LEE KS, HAN J, WADA N, et al. Imaging of pulmonary fibrosis: An update, from the AJR special series on imaging of fibrosis[J]. American Journal of Roentgenology, 2024, 222(2): e2329119. DOI: 10.2214/ajr.23.29119.
[18] WIJSENBEEK M, SUZUKI A, MAHER T M. Interstitial lung diseases[J]. Lancet, 2022, 400(10354): 769-786. DOI: 10.1016/s0140-6736(22)01052-2.
[19] BANKIER A A, MACMAHON H, COLBY T, et al. Fleischner society: Glossary of terms for thoracic imaging[J]. Radiology, 2024, 310(2): e232558. DOI: 10.1148/radiol.232558.
[20] HATA A, HINO T, PUTMAN R K, et al. Traction bronchiectasis/bronchiolectasis on CT scans in relationship to clinical outcomes and mortality: The COPD Gene study[J]. Radiology, 2022, 304(3): 694-701. DOI: 10.1148/radiol.212584.
[21] SMITH M L. The histologic diagnosis of usual interstitial pneumonia of idiopathic pulmonary fibrosis: Where we are and where we need to go[J]. Modern Pathology, 2022, 35(S1): 8-14. DOI: 10.1038/s41379-021-00889-5.
[22] 张笑雨, 于文成, 冯爱然, 等. ANCA血管炎相关间质性肺病的研究进展[J]. 青岛大学学报(医学版), 2018, 54(1): 115-118,126. ZHANG X Y, YU W C, FENG A R, et al. Research progress of ANCA vasculitis-related interstitial lung disease[J]. Journal of Qingdao University (Med Edition), 2018, 54(1): 115-118,126. (in Chinese).
[23] SALVATI L, PALTERER B, LAZZERI E, et al. Presentation and progression of MPO-ANCA interstitial lung disease[J]. Journal of Translational Autoimmunity, 2024, 8: 100235. DOI: 10.1016/j.jtauto.2024.100235.
[24] HOSODA C, BABA T, HAGIWARA E, et al. Clinical features of usual interstitial pneumonia with anti-neutrophil cytoplasmic antibody in comparison with idiopathic pulmonary fibrosis[J]. Respirology, 2016, 21(5): 920-926. DOI: 10.1111/resp.12763.



 下载:
下载: